
|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |

|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |
Физические основы термодинамики ⇐ ПредыдущаяСтр 3 из 3
Основные формулы
1. Связь между молярной (Сm) и удельной (с) теплоемкостями газа
где m – молярная масса газа.
2. Молярные теплоемкости при постоянном объеме и постоянном давлении соответственно равны
где i – число степеней свободы; R – универсальная газовая постоянная.
3. Удельные теплоемкости при постоянном объеме и постоянном давлении соответственно равны:
4. Уравнение Р. Майера
5. Показатель адиабаты
6. Внутренняя энергия идеального газа
где áeñ – средняя кинетическая энергия молекулы; N – число молекул газа; n – количество вещества.
7. Работа, связанная с изменением объема газа, в общем случае вычисляется по формуле
где V1 – начальный объем газа; V2 – его конечный объем. Работа газа при изобарическом процессе (р = const):
при изотермическом процессе (Т = const):
при адиабатическом процессе:
где Т1 – начальная температура газа; Т2 – его конечная температура.
8. Уравнение Пуассона (уравнение газового состояния при адиабатическом процессе)
9. Связь между начальным и конечным значениями параметров состояний газа при адиабатическом процессе:
10. Первое начало термодинамики в общем случае записывается в виде
где Q – количество теплоты, сообщенное газу; DU – изменение его внутренней энергии; A – работа, совершаемая газом против внешних сил. Первое начало термодинамики при изобарическом процессе:
при изохорическом процессе (А = 0):
при адиабатическом процессе (Q = 0):
11. Термический коэффициент полезного действия (КПД) цикла в общем случае
где Q1 – количество теплоты, полученное рабочим телом (газом) от нагревателя; Q2 – количество теплоты, переданное рабочим телом охладителю.
КПД цикла Карно
где Т1 – температура нагревателя; Т2 – температура охладителя.
12. Изменение энтропии
где А и В – пределы интегрирования, соответствующие начальному и конечному состояниям системы. Так как процесс равновесный, то интегрирование проводится по любому пути.
13. Формула Больцмана
где S – энтропия системы; W – термодинамическая вероятность ее состояния; k – постоянная Больцмана.
Примеры решения задач
Задача 1. В вертикальном цилиндре под тяжелым поршнем находится кислород массой т = 1 кг. Для повышения температуры кислорода на DТ = 10 °К ему было сообщено количество теплоты Q = 9,1 кДж. Найти удельную теплоемкость кислорода, работу, совершаемую им при расширении, и увеличение его внутренней энергии.
Решение
Так как поршень в любой момент находится в равновесии, то во время нагревания кислорода его давление р остается также постоянным. Тогда удельная теплоемкость при постоянном давлении
| |||||||
| c р = ? А = ? DU = ? |
Работа расширения при постоянном давлении
 ,
,
где V1 и V2 – начальный и конечный объем газа.
Уравнение состояния газа до и после нагревания
 (1)
(1)
и
 (2)
(2)
Вычитая из выражения (2) выражение (1), найдем

следовательно,
 кДж.
кДж.
Подводимое к газу количество теплоты идет на увеличение его внутренней энергии DU и на совершение работы А:

отсюда
 кДж.
кДж.
Задача 2. В цилиндре с площадью основания 100 см2 находится воздух при температуре 17° С. На высоте 50 см от основания цилиндра расположен легкий поршень, на котором лежит гиря весом 50 кГ. Какую работу совершит газ при расширении, если его нагреть на 50 °С? Атмосферное давление 760 мм рт. ст.
| Дано: S = 100 см2 = 0,01 м2 Т1 = 290 °К h = 0,5 м Р0 = 150 кГ = 1470 Н рА = 760 мм рт. ст. = 1·105 Па DТ = 50 °К |
Решение
В процессе нагревания газ расширяется и совершает работу по преодолению веса груза и силы атмосферного давления, действующих на поршень. Так как эти силы постоянны, то при достаточно медленном нагревании газ будет расширятся изобарически и его работу можно вычислить: |
| А = ? |

При равновесии поршня давление р уравновешивается атмосферным давлением рА и давлением, создаваемым гирей весом Р0:

По закону Гей-Люссака  ,
,
следовательно,
 Дж.
Дж.
Задача 3. Азот, занимавший при давлении р1 = 2 ·105 Па объем
V1 = 5 л, расширяют до объема 8 л, при этом давление падает до значения
р2 = 105 Па. Процесс происходит сначала по изотерме, затем – по изохоре. Определить работу сил давления газа, изменение внутренней энергии и количество поглощенной теплоты при этом переходе.
| Дано: p1 = 2·105 Па V1 = 5 л = 5·10–3 м3 V2 = 8 л = 8·10–3 м3 m = 28·10–3 кг/моль р2 = 105 Па i = 5 |
Решение
|
| Q12 = ? DU12 = ? А12 = ? |
При переходе из состояния 1 в состояние 2 надо рассмотреть каждый из указанных процессов отдельно, тогда
 (1)
(1)
Изменение внутренней энергии не зависит от процесса и в любом случае
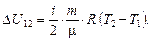 (2)
(2)
Используя уравнение Менделеева–Клапейрона для состояний 1 и 2, получим
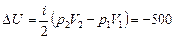 Дж.
Дж.
Работа газа при изотермическом расширении
 Дж.
Дж.
Учитывая, что Аа 2 = 0, находим А12 = А1а = 470 Дж.
Для изотермического процесса (участок 1–а)
 Дж;
Дж;  .
.
Для изохорического процесса (участок а–2)
 Дж.
Дж.
Общее количество теплоты
 Дж.
Дж.
Знак минус показывает, что газ отдавал теплоту окружающим телам.
Задача 4. Некоторая масса азота при давлении 1 атм имела объем 5 л, а при давлении 3 атм – объем 2 л. Переход от начального к конечному состоянию был сделан в два этапа: сначала по изохоре, а затем по изобаре. Определить изменение внутренней энергии, количество теплоты и произведенную работу.
| Дано: i = 5 р1 = 1 атм = 105 Па V1 = 5 л = 5·10–3 м3 р2 = 3 атм = 3·105 Па V2 = 2 л = 2·10–3 м3 m = 32·10–3 кг/моль |
Решение
Покажем графически, как происходил переход газа от первого состояния ко второму:
|
| 1) DU = ? 2) Q = ? 3) A = ? |
1) При изохорном процессе вся теплота идет только на изменение внутренней энергии, работа при изохорном процессе не совершается, т. е.


2) При изобарном процессе на основе I начала термодинамики теплота идет как на изменение внутренней энергии, так и на работу:
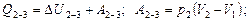

За оба процесса:
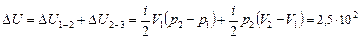 Дж,
Дж,
 Дж,
Дж,
 Дж.
Дж.
Задача 5. Определить отношение  для смеси 3 молей аргона и 5 молей кислорода.
для смеси 3 молей аргона и 5 молей кислорода.
| Дано: n1 = 3 моля n2 = 5 молей m1 = 40·10–3 кг/моль m2 = 32·10–3 кг/моль i1 = 3 i2 = 5 |
Решение
По определению молярные теплоемкости
|
| g = ? |
Общее количество теплоты, затраченное на нагревание смеси из аргона и кислорода, найдем как сумму теплоты, затраченной на нагревание каждого газа в отдельности, а число молей смеси – как сумму молей аргона и кислорода, тогда

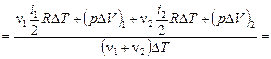




Ответ: 1,47.
Задача 6. Температура пара, поступающего в паровую машину,
t1 = 130 °С; температура в конденсаторе t2 = 25 °С. Определить теоретически максимальную работу при затрате количества теплоты Q = 5,1 кДж.
| Дано: T1 = 403 °К Т2 = 298 °К Q1 = 5,1·103 Дж |
Решение
Коэффициент полезного действия цикла Карно
КПД любого теплового двигателя
|
| А = ? |
 , (2)
, (2)
где А – полезная работа, совершаемая двигателем;
Q1 – количество теплоты, полученное рабочим телом от нагревателя.
Приравнивая правые части равенств (1) и (2), получим

откуда
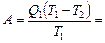 1,3 кДж.
1,3 кДж.
Задача 7. Кислород, масса которого т = 160 г при температуре
t1 = 27 °С расширяется изотермически, а затем изохорно нагревается до
t2 = 127 °С. Найти изменение энтропии, если известно, что начальное и конечное давления одинаковы.
| Дано: т = 1,16 кг m = 32·10–3 кг/моль i = 5 Т1 = 300 °К Т2 = 400 °К |
Решение
|
| S3 – S1 = ? |
Для процессов 1–2–3 изменение энтропии
 (1)
(1)
где 

Подставляя выражения dQT и dQV в выражение (1) и учитывая, что при изотермическом процессе  получим:
получим:

Учитывая, что р1 / р2 = V2 / V1 (для процесса 1–2) и р1 / р2 = T2 / T1 (для процесса 2–3), получим V2 / V1 = T2 / T1, тогда

Задача 8 . 14 г азота адиабатически расширяются так, что давление уменьшается в 5 раз, а затем изотермически сжимаются до первоначального давления. Найти приращение энтропии при этих процессах.
| Дано: d Q1 = 0 т = 1,4·10–4 кг m = 28·10–3 кг/моль р1/р2 = 5 Т2 = соnst |
Решение
Приращение энтропии можно найти по формулам
|
| DS = ? |


где ΔS1 – приращение энтропии при адиабатическом процессе;
ΔS2 – приращение энтропии при изотермическом процессе.
Так как dQ1 = 0 по условию задачи, то и ΔS1 = 0. Чтобы найти ΔS2 запишем, чему равно количество теплоты dQ2, которое при изотермическом процессе полностью расходуется на работу, т. е. dQ2 = pdV. Отсюда  Используя уравнение Менделеева-Клапейрона выразим давление через температуру и объем и подставим вместо р под интеграл. Тогда
Используя уравнение Менделеева-Клапейрона выразим давление через температуру и объем и подставим вместо р под интеграл. Тогда


Задача 9. Найти приращение энтропии DS при расширении 2 г водорода от V1 = 1,5 л до V2 = 4,5 л, если процесс расширения происходит: 1) при постоянном давлении; 2) при постоянной температуре.
| Дано: i = 5 т = 2·10–3 кг m = 2·10-3 кг/моль V1 = 1,5·10–3 м3 V2 = 4,5·10–3 м3 1) р = соnst 2) Т = соnst |
Решение
Используя формулу для приращения энтропии
|
| DS1 = ? DS2 = ? |
1) 

Отношение  при изобарическом процессе равно отношению
при изобарическом процессе равно отношению  поэтому
поэтому


2) 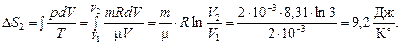
 |
РЕАЛЬНЫЕ ГАЗЫ. ЖИДКОСТИ
Основные формулы
1. Уравнение Ван-дер-Ваальса для одного моля газа
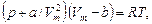
для произвольного количества вещества n газа

где a и b – постоянные Ван-дер-Ваальса (рассчитанные на один моль газа);
V – объем, занимаемый газом; Vm – молярный объем;
р – давление газа на стенки сосуда;
 или
или  – внутренне давление, обусловленное силами взаимодействия молекул.
– внутренне давление, обусловленное силами взаимодействия молекул.
2. Связь критических параметров – объема, давления и температуры газа – с постоянными а и b Ван-дер-Ваальса:

3. Внутренняя энергия реального газа

где С V – молярная теплоемкость газа при постоянном объеме.
4. Поверхностное натяжение

где F – сила поверхностного натяжения, действующая на контур l, ограничивающий поверхность жидкости, или

где DЕ – изменение свободной энергии поверхностной пленки жидкости, связанное с изменением площади DS поверхности этой пленки.
5. Формула Лапласа в общем случае записывается в виде

где р – давление, создаваемое изогнутой поверхностью жидкости;
s – поверхностное натяжение;
R1 и R2 – радиусы кривизны двух взаимно перпендикулярных сечений поверхности жидкости, а в случае сферической поверхности

6. Высота подъема жидкости в капиллярной трубке

где q – краевой угол;
R – радиус канала трубки;
r – плотность жидкости;
g – ускорение свободного падения.
7. Высота подъема жидкости между двумя близкими и параллельными плоскостями

где d – расстояние между плоскостями.
8. Расход жидкости в трубке тока:
а) объемный расход QV = vS;
б) массовый расход Qm = rvS, где S – площадь поперечного сечения трубки тока; v – скорость жидкости; r – ее плотность.
9. Уравнение неразрывности струи


где S1 и S2 – площади поперечного сечения трубки тока в двух местах;
v1 и v2 – соответствующие скорости течений.
10. Уравнение Бернулли для идеальной несжимаемой жидкости в общем случае

где р1 и р2 – статические давления жидкости в двух сечениях трубки тока;
v1 и v2 – скорости жидкости в этих сечениях;
 и
и  – динамические давления жидкости в этих же сечениях;
– динамические давления жидкости в этих же сечениях;
h1 и h2 – высоты сечений над некоторым уровнем;
rgh1 и rgh2 – гидростатические давления.
Уравнения Бернулли в случае, когда оба сечения находятся на одной высоте (h1 = h2),

11. Скорость течения жидкости из малого отверстия в открытом широком сосуде

где h – глубина, на которой находится отверстие относительно уровня жидкости в сосуде.
Примеры решения задач
Задача 1. Бак, имеющий форму куба, длина ребра которого l, наполнен водой. определить силу давления на стенку бака со стороны воды, если атмосферное давление равно р0.
| Дано: l, r, p0 |
Решение

На рисунке показан график зависимости давления от глубины погружения h. Давление на боковую стенку линейно зависит от h, следовательно,
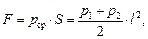
где р1 = р0; р2 = р0 + rgl.
Таким образом, 
Ясно, что сила давления не будет приложена в центре грани куба, а будет несколько смещена вниз.
Задача 2. Полный медный шар, наружный объем которого V, плавает в воде так, что половина его погружена в воду. Найти объем полости шара, если плотность меди r1, а воды – r2.
| Дано:
r1; r2; V | Решение | |
|
| ||
| V0 = ? |
Так как шар находится в равновесии, то 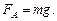
Масса шара m = r1 (V – V0).
По закону Архимеда 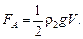
Получим уравнение

откуда

Задача 3. Найти добавочное давление, обусловленное поверхностным натяжением, внутри шаровой капли радиусом R. Коэффициент поверхностного натяжения жидкости равен s.
| Дано: s; R |
Решение
Рассечем мысленно каплю диаметральной плоскостью на две половинки. Вследствие поверхностного натяжения обе половинки притягиваются друг к другу с силой | |
|
Dр = ? | ||

Задача 4. Найти массу воды, поднявшейся по стеклянной капиллярной трубке диаметром 0,5 мм, если коэффициент поверхностного натяжения воды 7,2 ·10–2 Н/м.
| Дано: s = 7,2 ·10–2 Н/м d = 0,5 ·10–3 м |
Решение
Сила поверхностного натяжения, действующая по краю мениска жидкости, направлена вверх и уравновешивает силу тяжести столбика жидкости.
|
| т = ? |
откуда
 кг.
кг.
Задача 5. Из трубы сечением S1 бьет вертикально вверх струя воды. Найти сечение струи на высоте h над отверстием трубы. Расход воды из трубы равен Q.
| Дано: S1; h; Q |
Решение
Уравнение Бернулли для данного случая:
|
| S2 = ? |
где v1 – скорость воды в сечении S1;
v2 – скорость в сечении струи S2 на высоте h.
Уравнение неразрывности

Отсюда находим v1 и v2 и подставляем в уравнение Бернулли:

откуда

 |
КОНТРОЛЬНАЯ РАБОТА № 2
Студент-заочник должен решить семь задач того варианта, номер которого совпадает с третьей цифрой справа его шифра.
Пример. Номер шифра (номер зачетной книжки) 13799. Студент решает седьмой вариант.
| Вариант | Номера задач | ||||||
| 0 | 3 | 15 | 21 | 34 | 42 | 53 | 62 |
| 1 | 7 | 12 | 27 | 40 | 44 | 58 | 65 |
| 2 | 5 | 19 | 30 | 33 | 48 | 51 | 67 |
| 3 | 10 | 16 | 22 | 35 | 46 | 59 | 61 |
| 4 | 6 | 11 | 26 | 38 | 43 | 54 | 64 |
| 5 | 8 | 20 | 29 | 31 | 49 | 56 | 68 |
| 6 | 1 | 14 | 23 | 36 | 47 | 60 | 69 |
| 7 | 9 | 17 | 25 | 37 | 45 | 52 | 63 |
| 8 | 4 | 13 | 24 | 32 | 50 | 57 | 66 |
| 9 | 2 | 18 | 28 | 39 | 41 | 55 | 70 |
1. Открытую стеклянную трубку длиной l = 1 м наполовину погружают в ртуть. Затем трубку закрывают пальцем и вынимают. Какой длины останется в трубке столбик ртути? Атмосферное давление равно
750 мм рт. ст.
2. Посередине откачанной и запаянной с обоих концов горизонтальной трубки длиной L = 1 м находится столбик ртути высотой h = 20 см. если трубку поставить вертикально, столбик ртути сместится на l = 10 см. до какого давления была откачана трубка? Плотность ртути r = 1,36 ·104 кг/м3.
3. Два баллона соединены трубкой с краном. В первом находится газ при давлении 105 Па, во втором – при давлении 0,6 ·105 Па. Объем первого баллона V1 = 1 л, второго – V2 = 3 л. какое давление установится в баллонах, если открыть кран? Температура постоянная. Объемом трубки можно пренебречь.
4. Три баллона емкостью V1 = 3 л, V2 = 7 л и V3 = 5 л наполнены соответственно кислородом (р1 = 2 ·105 Па), азотом (р2 = 3 ·105 Па) и углекислым газом (р3 = 0,6 ·105 Па) при одной и той же температуре. Баллоны соединяют между собой, причем образуется смесь той же температуры. Каково давление смеси?
 5. Дан график изменения состояния идеального газа в координатах р, V. Представить этот цикл в координатах р, T и V, Т.
5. Дан график изменения состояния идеального газа в координатах р, V. Представить этот цикл в координатах р, T и V, Т.
6. В цилиндре, площадь основания которого равна S = 100 см2, находится воздух при температуре 12 °С. атмосферное давление 105 Па. На высоте h = 60 см от основания цилиндра расположен поршень. На сколько опустится поршень, если на него поставить гирю массой т = 100 кг, а воздух в цилиндре при этом нагреть до 27 °С? трение поршня о стенки цилиндра и вес самого поршня не учитывать.
7. Из баллона со сжатым водородом емкостью V = 10 л вследствие неисправности вентиля утекает газ. При температуре t1 = 7 °С манометр показывал р = 5 ·106 па. Через некоторое время при температуре t2 = 17 °С манометр показал такое же давление. Сколько утекло газа?
8. Сколько молекул воздуха выходит из комнаты объемом V0 = 120 м3 при повышении температуры от t1 = 15 °С до t2 = 25 °С? Атмосферное давление р0 = 105 Па.
9. При какой температуре кислород (О2), находясь под давлением 0,2 ·106 па, имеет плотность 1,2 кг/м3?
10. В сосуде при температуре t = 100 °С и давлении р = 4 ·105 Па находится 2 м3 смеси кислорода О2 и сернистого газа SO2. Определить парциальное давление компонентов, если масса сернистого газа 8 кг.
11. В баллоне емкостью 0,05 м3 находятся 0,12 кмоль газа при давлении 0,6 ·107 Па. Определить среднюю кинетическую энергию теплового движения молекул газа.
12. Найти средние квадратичные скорости молекул азота и кислорода при температуре 27 °С.
13. Найти импульс молекулы водорода при температуре 20 °С. скорость молекулы считать равной средней квадратичной скорости.
14. В сосуде объемом 5 л находится 20 г кислорода под давлением 105 Па. Найти: 1) среднюю квадратичную скорость молекул газа; 2) число молекул, находящихся в сосуде; 3) плотность газа.
15. Средняя квадратичная скорость молекул некоторого газа равна
500 м/с. Давление газа равно 5 ·104 Па. Найти плотность газа при этих условиях.
16. Средняя квадратичная скорость молекул некоторого газа при нормальных условиях равна 461 м/с. Какое количество молекул содержится в 1 г этого газа?
17. Чему равна энергия вращательного движения молекул, содержащихся в 1 кг азота при температуре 7 °С?
18. Чему равна энергия теплового движения молекул двухатомного газа, заключенного в сосуд объемом 2 л и находящегося под давлением в 1,5 ·105 Па?
19. 1 кг двухатомного газа находится под давлением 8·104 па и имеет плотность 4 кг/м3. Найти энергию теплового движения молекул газа при этих условиях.
20. Какое число молекул двухатомного газа занимает объем V = 10 см3 при давлении 40 мм рт. ст. и при температуре 27 °С? Какой энергией теплового движения обладают эти молекулы?
21. Кинетическая энергия поступательного движения молекул азота, находящегося в баллоне объемом 0,02 м3, равна 5 ·103 Дж, а средняя квадратичная скорость его молекул равна 2 ·103 м/с. Найти: 1) количество азота в баллоне; 2) давление, под которым находится азот.
22. Смесь состоит из двух молей одноатомного газа и одного моля двухатомного газа. Определить мольные теплоемкости  и
и 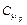 смеси.
смеси.
23. Вычислить теплоемкость при постоянном объеме двухатомного газа, заключенного в сосуд V = 10 л при нормальных условиях.
24. Разность удельных теплоемкостей некоторого двухатомного газа ср – с V = 2,08 кДж/кг ·К. Определить молярную массу m газа и его удельные теплоемкости ср и с V.
25. Каковы удельные теплоемкости ср и с V смеси газов, содержащей кислород массой т1 = 10 г и азот массой т2 = 20 г?
26. Определить удельную теплоемкость с V смеси газов, содержащей V1 = 5 л водорода и V2 = 3 л гелия. Газы находятся при одинаковых условиях.
27. В баллоне находятся аргон и азот. Определить удельную теплоемкость с V смеси газов, если массовые доли аргона и азота одинаковы и равны 0,5.
28. Вычислить удельные теплоемкости ср и сV газов: 1) гелия; 2) углекислого газа.
29. Для некоторого двухатомного газа удельная теплоемкость при постоянном давлении равна 840 Дж/кг · К. чему равна масса одного моля этого газа?
30. Чему равны удельные теплоемкости ср и сV некоторого двухатомного газа, если плотность этого газа при нормальных условиях равна 1,43 кг/м3?
31. Найти среднюю длину свободного пробега молекул азота при температуре 17 °С и давлении 104 Па.
32. Найти среднюю длину свободного пробега атомов гелия в условиях, когда плотность гелия 2,1 ·10–2 кг/м3.
33. Найти среднее число столкновений в 1 с молекул азота при
t = 27 °С и давлении р = 0,5 ·105 Па.
34. Найти среднюю длину свободного пробега молекул воздуха при нормальных условиях. Диаметр молекул воздуха условно принять равным 3 ·10–10 м.
35. В колбе объемом 100 см3 находится 0,5 г азота. Найти среднюю длину свободного пробега молекул азота при этих условиях.
36. Найти коэффициент внутреннего трения азота при нормальных условиях, если коэффициент диффузии для него при этих условиях равен 0,142 см2/с.
37. Найти диаметр молекулы кислорода, если известно, что для кислорода коэффициент внутреннего трения при 0 °С равен 18,8 ·10–6 Н·с/м2?
38. Найти коэффициент диффузии и коэффициент внутреннего трения воздуха при давлении 105 Па и температуре 10 °С. диаметр молекулы воздуха принять равным 3 ·10–10 м.
39. Найти коэффициент диффузии гелия при нормальных условиях.
40. Какая часть молекул водорода при температуре 0 °С обладает скоростями от 2000 м/с до 2100 м/с.
41. Один киломоль воздуха при давлении р1 = 106 Па и температуре Т1 = 390 °К изохорически изменяет давление так, что его внутренняя энергия изменяется на DU = –71,7 кДж, затем изобарически расширяется и совершает работу А = 745 кДж. Определить параметры воздуха (считать
сV = 721 Дж/кг ·К = const).
42. При изобарическом сжатии азота была совершена работа, равная 12 кДж. Определить затраченное количество теплоты и изменение внутренней энергии газа.
43. Определить работу расширения 7 кг водорода при постоянном давлении и количество теплоты, переданное водороду, если в процессе нагревания температура газа повысилась на 200 °С.
44. В цилиндре диаметром 20 см и высотой 42 см с подвижным поршнем находится газ под давлением 12 ·105 Па при температуре 300 °С. определить работу, совершаемую газом при снижении температуры до
10 °С при постоянном давлении.
45. При изотермическом сжатии 2,8 кг окиси углерода объем его уменьшился в четыре раза. Определить работу сжатия, если температура газа 7 °С.
46. Азот, адиабатически расширяясь, совершает работу, равную
480 кДж. Определить конечную температуру газа, если до расширения он имел температуру Т1 = 362 К. масса азота т = 12 кг. Теплоемкость считать постоянной.
47. 28 г азота, находящегося при температуре 40 °С и давлении 105 Па, сжимается до объема в 13 л. Найти температуру и давление азота после сжатия, если: 1) азот сжимается изотермически; 2) азот сжимается адиабатически. Найти работу сжатия в каждом из этих случаев.
48. При изотермическом расширении 2 кг водорода, взятых при давлении 6 ·105 Па и объеме 8,31 м3, была совершена работа 547 ·103 Дж. Определить конечные параметры водорода, если после изотермического расширения газ был адиабатически сжат, причем была совершена такая же работа, что и при расширении.
49. Сероводород (Н2S) массой 6 кг, занимающий объем 3 м3 при температуре 27 °С, сжали адиабатически так, что давление его увеличилось в два раза. Определить конечные объем, температуру и изменение внутренней энергии газа.
50. Азот массой 2 кг при температуре 7 °С занимает объем 830 дм3. В конце адиабатического сжатия температура возросла до 227 °С, а давление увеличилось до 15,2 ·105 Па. Определить отношение ср /сV.
51. Найти изменение энтропии при превращении 20 г льда при
t = –10 °С в пар при t = 100 °С.
52. Найти изменение энтропии при плавлении 1 кг льда, находящегося при температуре 0 °С.
53. Смешали воду массой 4 кг при температуре Т1 = 280 К с водой массой 10 кг при температуре Т2 = 350 К. Найти: 1) температуру смеси;
2) изменение энтропии, происходящее при смешивании.
54. Лед массой 2 кг при температуре 0 °С был превращен в воду той же температуры с помощью пара, имеющего температуру 100 °С. определить массу т2 израсходованного пара. Каково изменение энтропии системы лед – пар?
55. 7 г водорода расширяются изобарически до удвоения объема. Найти изменение энтропии при этом расширении.
56. Найти изменение энтропии при изотермическом расширении 10 г водорода от 105 до 0,5 ·105 Па.
57. 650 г расплавленного свинца при температуре плавления вылили на лед при t = 0 °С. найти изменение энтропии при этом процессе.
58. Найти изменение энтропии при изобарическом расширении 15 г гелия от объема V1 = 10 л до V2 = 30 л.
59. Совершая цикл Карно, газ получил от нагревателя теплоту
Q1 = 1 кДж и совершил работу А = 200 Дж. Температура нагревателя
Т1 = 375 К. Определить температуру охладителя.
60. Совершая цикл Карно, газ отдал охладителю 2/3 теплоты, полученной от нагревателя. Определить температуру охладителя, если температура нагревателя Т1 = 425 °К.
61. Какую работу А нужно совершить, чтобы, выдувая мыльный пузырь, увеличить его диаметр от d1 = 1 см до d2 = 11 см.
62. В воду опущена на очень малую глубину стеклянная трубка с диаметром внутреннего канала d = 1 мм. Найти массу вошедшей в трубку воды. Считать смачивание полным.
63. Определить работу А, которую необходимо совершить при выдувании мыльного пузыря, чтобы увеличить его объем от V1 = 10 см3 до
V2 = 20 см3.
64. Две капли ртути радиусом R = 1 мм каждая слились в одну большую каплю без изменения температуры. Какая энергия выделится при этом слиянии?
65. Найти добавочное давление внутри мыльного пузыря диаметром 5 см. Определить также работу, которую нужно совершить, чтобы выдуть этот пузырь.
66. На сколько давление р воздуха внутри мыльного пузыря больше атмосферного давления р0, если диаметр пузыря d = 5 мм?
67. Глицерин поднялся в капиллярной трубке на высоту h = 20 мм. Определить коэффициент поверхностного натяжения глицерина, если диаметр канала равен 1 мм.
68. Найти скорость течения по трубке углекислого газа, если известно, что за полчаса через поперечное сечение трубы протекает 0,51 кг газа. Плотность газа принять равной 7,5 кг/м3. Диаметр трубы равен 2 см.
69. Тонкое алюминиевое кольцо радиусом 8,0 см соприкасается с мыльным раствором. Каким усилием можно оторвать кольцо от раствора? Температуру раствора считать комнатной. Масса кольца 10 г.
70. Под каким давлением находится воздух внутри пузырька радиусом 5 ·10–3 мм, расположенного под поверхностью воды?
 |
Литература
1. Зисман Г. А., Тодес О. М. Курс физики. – М.: Наука, 1970. –
Т. 1. – §§ 10, 11.
2. Савельев И. В. Курс общей физики. М.: Наука, 1977. – Т. 1. –
§§ 34–42.
3. Детлаф А. А., Яворский Б. М., Милковская Л. Б. Курс физики. – М.: Высш. шк., 1973. – Т. 1. – §§ 4.1–4.3.
4. Чертов А. Г., Воробьев А. А. Задачник по физике. – М.: Высш. шк., 1981.
5. Новодворская Е. М., Дмитриев Э. М. Методика проведения упражнений по физике во втузе. – М.: Высш. шк., 1981.
6. Беликов С. Б. Решение задач по физике. – М.: Высш. шк., 1986.
7. Савельев И. В. Сборник вопросов и задач по общей физике. – М.: Наука, 1987.
8. Трофимова Т. И. Курс физики. – М.: Высш. шк., 1994.
9. Трофимова Т. И., Павлова З. Г. Сборник задач по курсу физики с решениями. – М.: Высш. шк., 1999.
10. Айзенцон А. Е. Курс физики. – М.: Высш. шк., 1996.
 |
Справочные таблицы
Последнее изменение этой страницы: 2019-03-22; Просмотров: 352; Нарушение авторского права страницы