
|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |

|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |
Строение комплексных соединенийСтр 1 из 6Следующая ⇒
КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
С о д е р ж а н и е
§1. Строение комплексных соединений.............. 2 §2. Номенклатура комплексных соединений........... 4 §3. Классификация комплексных соединений.......... 6 §4. Природа химической связи и в комплексных соединениях.................... 7 §5. Оптические свойства комплексных соединений ..... 13 §6. Устойчивость комплексных соединений........... 14 §7. Теория «жестких» и «мягких» реакционных центров........................... 17 §8. Изомерия комплексных соединений .............. 18 §9. Примеры решения задач........................ 21
Классификация комплексных соединений Комплексные соединения очень разнообразны по строению и свойствам. Пока не найдено единого признака, по которому можно провести их полную классификацию. Применяющиеся системы классификации КС основываются на различных принципах: 1. По принадлежности к определённому классу химических соединений различают: а) комплексные кислоты – Н[AuCl4] тетрахлорозолотая (III) кислота; б) комплексные основания – [Cu(NH3)4](OH)2 гидроксид тетраамминмеди (II); в) комплексные соли – K4[Fe(CN)6] гексацианоферрат (II) калия. 2. По природе лигандов: а) аквакомплексы (лиганды – молекулы воды) [Co(Н2О)4](NO3)2; б) аммиакаты (лиганды – молекулы аммиака) [Ag(NH3)2]Cl; в) ацидокомплексы (лиганды – анионы кислот) Na3[AlF6]; г) гидроксокомплексы (лиганды – гидроксогруппы) K3[Al(OH)6]; д) смешанного типа (содержатся лиганды нескольких видов) [Co(NH3)4Cl2]. 3. По знаку заряда комплекса: а) катионные [Zn(NH3)4]2+Cl б) анионные Li+[AlH4]– ; в) нейтральные (без внешней сферы) [Pt(NH3)2Cl2]0; г) бикомплексы [Co(NH3)6][Fe(CN)6]. 4. По внутренней структуре комплексного соединения: а) циклические или хелатные (клешневидные) – содержат би- и полидентатные лиганды:
б) одноядерные комплексы – внутренняя сфера имеет один центральный атом и некоторое число лигандов, например, [SbF6]–; в) многоядерные комплексы – содержат несколько центральных атомов, например, [Os3(CO)12] – трёхядерный комплекс. Многоядерные комплексы также делят на комплексы с мостиковыми лигандами, связывающие одновременно два комплексообразователя, как, например, в соединении К4[(C2O4)2Co(OH)2Co(C2O4)2]), и кластеры, в которых центральные атомы связаны между собой непосредственно – K4[Cl4Re – ReCl4] (иначе K4[Re2Cl8]).
§4. Природа химической связи в комплексных соединениях.
Механизм образования комплексных соединений, то есть природа связи между комплексообразователем и лигандами, описывается с помощью различных квантовомеханических методов, из которых самыми распространенными являются метод валентных связей (МВС) и теория поля лигандов (ТПЛ). Метод валентных связей Взаимодействие между комплексообразователем и лигандами осуществляется согласно следующим положениям: 1. Комплексообразователь и лиганды образуют ковалентные связи по донорно-акцепторному механизму. Лиганды являются донорами, а центральный атом акцептором электронов. Возникающие таким образом связи относятся к s–типу и называются координационными; 2. Атомные орбитали (АО) центрального атома гибридизируются в зависимости от его электронной структуры, а также числа и природы лигандов. Тип гидридизации определяет геометрическое строение комплекса. Наиболее распространенные типы гибридизаций приведены в табл.1. Собственные электронные пары комплексообразователя изображены сплошными стрелками, а донорные электронные пары лигандов - пунктирными; 3. Магнитные свойства комплекса связаны с наличием (парамагнетизм) или отсутствием (диамагнетизм) неспаренных электронов во внутренней сфере КС; 4. Кроме s–связей между комплексообразователем и лигандами могут возникать p–связи, в которых центральный атом – донор, а лиганды – акцепторы. Таблица 1 Теория поля лигандов ТПЛ дополняет МВС, успешно объясняя электрические, магнитные и химические свойства большинства КС. В основе данной теории лежит положение, что связь между комплексообразователем и лигандами обусловлена только электростатическими эффектами, то есть является ионной или ион-дипольной. При этом не учитывается ковалентная природа связывания, возможность образования π –связей и строение лиганда. Согласно ТПЛ лиганды – заряженные точки, а комплексообразователь рассматривается с детальным учетом его электронной структуры. В свободном атоме или ионе АО любого d–подуровня пятикратно вырождены, т.е. все пять АО имеют одинаковую энергию. Если такую частицу поместить в центре ориентированных особым образом лигандов, то под действием их электростатического поля энергия АО d–подуровня комплексообразователя изменится. Вне зависимости от числа и расположения лигандов вокруг центрального иона АО d–подуровня расщепляются на две группы новых орбиталей: 1) de серию, образованную dxy, dxz, dyz электронными облаками; 2) dg серию, содержащую d В октаэдрическом поле лигандов (КЧ = 6) электроны dg серии испытывают более сильное отталкивание со стороны лигандов, чем электроны dε серии, поэтому энергия dg серии более высокая (см. рис. 1).
Рис.1. Расщепление d –АО в октаэдрическом поле лигандов
В тетраэдрическом поле лигандов (КЧ = 4) d–подуровень расщепляется по отношению к октаэдрическому полю в обратном порядке (см. рис.2).
Рис.2. Расщепление d –АО в тераэдрическом поле лигандов
Сумма энергий АО dg и dε серий согласно закону сохранения энергии равна начальному значению энергии Е0 вырожденных орбиталей. Разность между энергиями новых подуровней Величина энергии расщепления для данного комплексообразователя определяется природой лиганда. Для 3d–элементов экспериментально установлен так называемый спектрохимический ряд, в котором слева направо численное значение Δ монотонно возрастает: I– < Br– < –SCN– < Cl– < NO < –NCS– < gly < py < H– < NH3 < Еn < –NC– < NO (подчеркнут атом, непосредственно связанный с комплексообразователем)
Лиганды левой части ряда называются лигандами слабого поля, так как вызывают малое расщепление энергии d‑ подуровня. В этом случае величина Δ не превышает энергию взаимного отталкивания спаренных электронов, что приводит к заполнению АО электронами в соответствии с правилом Гунда (см. рис. 3).
Рис.3. Распределение электронов d –подуровня в ионе Co3+ при октаэдрическом расположении лигандов слабого поля
Лиганды правой части ряда – лиганды сильного поля – приводят к значительному расщеплению энергии d–подуровня, при этом величина Δ превышает энергию межэлектронного отталкивания спаренных электронов. Это означает, что энергетически более выгодно заполнять электронами АО с нарушением правила Гунда. Например, в случае октаэдрического расположения лигандов сильного поля электроны будут заполнять сначала по одному, а затем по второму АО dε серии, а затем в таком же порядке АО dγ серии (см. рис.4). Для тетраэдрического поля порядок будет обратный.
Рис.4. Распределение электронов d –подуровня в ионе Co3+ при октаэдрическом расположении лигандов сильного поля
ТПЛ также как и МВС позволяет объяснять магнитные свойства комплексов: при наличии неспаренных электронов – комплекс парамагнитен, а при их отсутствии – диамагнитен. Однако, в слабом октаэдрическом поле лигандов число неспаренных электронов всегда больше, чем в сильном. Поэтому комплексы с лигандами, создающими слабое октаэдрическое поле, называют высокоспиновыми, а с лигандами сильного поля – низкоспиновыми.
Р е ш е н и е Внешняя сфера комплексного соединения состоит из одного аниона NO +1 = 1× х + 0·4 + 2·(–1). Отсюда х = +1. Таким образом, КС является комплексным катионом. Название соединения: нитрит дихлоротетрааммин кобальта (+1).
П р и м е р 2. Почему комплексный ион [Cu(NH3)2]+ имеет линейное строение? Р е ш е н и е Определяем заряд комплексообразователя в данном комплексном ионе +1 = 1× х + 0·2. Отсюда х = +1. Электронное строение валентных подуровней иона Cu+ отвечает конфигурации 3d104s04р0. Так как 3d – подуровень не содержит вакансий, то в образовании связей по донорно-акцепторному механизму (в качестве акцептора) со стороны Cu+ участвуют одна 4s и одна 4p орбитали, которые гибридизируются по типу sp. Такому типу гибридизации соответствует линейное строение комплекса.
П р и м е р 3. Определите тип гибридизации АО центрального иона и геометрическое строение комплекса [HgCl4]2–. Р е ш е н и е Электронная конфигурация иона комплексообразователя Hg2+ соответствует записи: 5d106s06р0, а электронно-графическая схема может быть представлена следующим образом
Таким образом, в данном комплексном ионе имеет место sp3 гибридизация АО, в результате которой связи направлены к вершинам тетраэдра и ион [HgCl4]2– имеет тетраэдрическую структуру.
П р и м е р 4. Составьте энергетическую диаграмму образования связей в комплексе [Fe(CN)6]3– и укажите тип гибридизации орбиталей центрального атома. Какими магнитными свойствами обладает комплекс? Р е ш е н и е Электронная конфигурация центрального иона Fe3+: …3d54s04p04d0. Шесть монодентатных лигандов CN– создают сильное октаэдрическое поле и образуют шесть σ –связей, предоставляя неподеленные пары электронов атома углерода на свободные АО комплексообразователя Fe3+, при этом происходит снятие вырождения АО 3d подуровня комплексообразователя. Энергетическая диаграмма комплекса имеет вид
   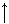   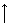      

Пять 3d-электронов полностью распределяются на орбиталях 3dε серии, так как энергия расщепления, которая возникает при взаимодействии с лигандами сильного поля, оказывается достаточной для максимального спаривания электронов. Свободные 3d, 4s и 4р–орбитали подвергаются d2sp3–гибридизации и обуславливают октаэдрическую структуру комплекса
Комплекс находится в низкоспиновом состоянии и является парамагнетиком, т.к. имеется один неспаренный электрон.
П р и м е р 5. Составьте энергетическую диаграмму образования связей в комплексе [CrF4]– и укажите тип гибридизации. Р е ш е н и е Электронная формула Cr3+: …3d34s04p04d0. Монодентатные лиганды F– образуют четыре σ –связи, являются лигандами слабого поля и создают тетраэдрическое поле
Свободные две 3d, одна 4s и одна 4р АО комплексообразователя гибридизируются по типу d2sp, в результате образуется комплекс тетраэдрической конфигурации, высокоспиновый, парамагнитный.
П р и м е р 6. Объясните, почему ион [CoF6]3– парамагнитный, а ион [Co(CN)6]3– диамагнитный. Р е ш е н и е Электронная формула комплексообразователя Со3+: …3d6. В октаэдрическом поле лигандов F– (лиганд слабого поля) происходит незначительное расщепление d–подуровня, поэтому электроны заполняют АО в соответствии с правилом Гунда (см. рис.3). В этом случае имеется четыре непарных электрона, поэтому ион [CoF6]3– парамагнитный. При образовании иона [Co(CN)6]3– с участием лиганда сильного поля (ион CN–) энергия расщепления d–подуровня будет столь значительна, что превысит энергию межэлектронного отталкивания спаренных электронов. Электроны будут заполнять АО иона Со3+ с нарушением правила Гунда (см. рис.4). Все электроны спарены, сам ион – диамагнитный.
П р и м е р 7. Для иона [Cr(H2O)6]3+ энергия расщепления равна 167, 2 кДж·моль–1. Какова окраска соединений хрома (III) в водных растворах? Р е ш е н и е Для определения окраски вещества определим длину волны, при которой происходит поглощение света. Используем формулу (2)
отсюда выразим λ
Таким образом, ион [Cr(H2O)6]3+ поглощает свет в красной части спектра, что в соответствии с табл. 1 приложения соответствует окраске соединения хрома (III) зелёного цвета.
П р и м е р 8. Максимум поглощения видимого света ионом [Cu(NH3)4]2+ соответствует длине волны λ = 304 нм. Вычислите энергию расщепления d–подуровня. Р е ш е н и е По формуле (2) определяем энергию расщепления
П р и м е р 9. Изобразите распределение электронов по АО в октаэдрическом ионе [Ti(H2O)6]3+. Определите энергию электронного перехода, если ион титана поглощает свет с длиной волны 4930 Å (1 Å = 1× 10–10 м). Р е ш е н и е Определим заряд комплексообразователя в данном ионе (х + 6·0) = +3, х = +3.
Молекулы воды являются лигандами слабого поля. Ион Ti3+ имеет электронную конфигурацию 3d14s0. Тогда распределение электронов в октаэдрическом поле лигандов
Ион титана имеет один неспаренный электрон на dε –орбитали, следовательно, комплексный ион парамагнитен. При поглощении ионом света возможен переход этого электрона с dε серии на dγ . Энергия этого электронного перехода может быть вычислена по формуле
П р и м е р 10. Установите, выпадет ли осадок сульфида серебра (I) при температуре 25°С, если смешать равные объёмы 0, 001 М раствора [Ag(CN)2]–, содержащего одноимённый лиганд CN– с концентрацией 0, 12 моль/дм3, и раствора иона-осадителя S2– с концентрацией 3, 5·10–3 М. Р е ш е н и е Процесс диссоциации для данного иона можно представить схемой [Ag(CN)2]– ↔ Ag+ + 2CN– Процесс осаждения можно записать так 2Ag+ + S2– ↔ Ag2S¯ Для того чтобы определить будет ли образовываться осадок необходимо рассчитать ПР(Ag2S) по формуле
Найдём концентрацию ионов серебра, для этого запишем выражение для константы нестойкости комплексного иона
Из табл. 2 приложения выбираем значение константы нестойкости комплекса [Ag(CN)2]– Кнест = 1·10-21. Тогда Рассчитаем произведение растворимости образующегося осадка
По табл. 3 приложения выбираем табличное значение произведения растворимости сульфида серебра ( ПР(Ag2S)табл = 5, 7·10–51) и сравниваем его с расчетным. Поскольку ПРтабл < ПРрасчет, то из данного раствора осадок выпадает, так как соблюдается условие выпадения осадка.
П р и м е р 11. Сколько моль хлорида бария необходимо взять, чтобы осадить ионы SO Р е ш е н и е К[Al(SO4)2] – двойная соль имеет малоустойчивую внутреннюю сферу, поэтому при диссоциации полностью распадается на ионы К[Al(SO4)2] ↔ К+ + Al3+ + 2SO В растворе находится 2 моль ионов SO 2Ва2+ + 2SO требуется 2 моль ионов Ва2+ или 2 моль молекул BaCl2.
П р и м е р 12. Вычислите концентрацию ионов цинка в растворе тетрацианоцинката натрия с концентрацией 0, 3 моль/дм3 при избытке цианид–ионов в растворе равном 0, 01 моль/дм3. Р е ш е н и е Ионы цинка в свободном виде в растворе могут находиться только при полной диссоциации комплекса. Первичная диссоциация протекает практически полностью по схеме Na2[Zn(CN)4] → 2Na2+ + [Zn(CN)4]2– Вторичная диссоциация протекает по уравнению [Zn(CN)4]2– ↔ Zn2+ + 4CN– Запишем для данного процесса выражение константы нестойкости
Из табл. 2 приложения находим значение константы нестойкости данного иона (Кнест = 1, 3·10-17). Поскольку концентрация цианид–ионов, образующихся в результате диссоциации комплекса, гораздо меньше концентрации введенного избытка, можно полагать, что [CN–] » 0, 01 моль/дм3, то есть концентрацией ионов CN–, образующихся в результате диссоциации, можно пренебречь. Тогда
КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ
С о д е р ж а н и е
§1. Строение комплексных соединений.............. 2 §2. Номенклатура комплексных соединений........... 4 §3. Классификация комплексных соединений.......... 6 §4. Природа химической связи и в комплексных соединениях.................... 7 §5. Оптические свойства комплексных соединений ..... 13 §6. Устойчивость комплексных соединений........... 14 §7. Теория «жестких» и «мягких» реакционных центров........................... 17 §8. Изомерия комплексных соединений .............. 18 §9. Примеры решения задач........................ 21
Строение комплексных соединений Комплексные соединения иначе называют координационными соединениями или соединениями высшего порядка. Они образуются при взаимодействии друг с другом простых соединений или соединений первого порядка (Н2О, NH3, CuCl2 и др.). Например, CuCl2 + 4NH3 = [Cu(NH3)4]Cl2.
Согласно координационной теории швейцарского химика Альфреда Вернера (1893 г.) комплексными называются наиболее устойчивые соединения высшего порядка, которые в водном растворе или расплаве способны к самостоятельному существованию. В молекулу комплексного соединения входит центральный атом (ион) - комплексообразователь (М). Частицы (ионы или молекулы), располагающиеся вокруг комплексообразователя, называются лигандами (L). Комплексообразователь и лиганды образуют внутреннюю сферу КС. Ионы, нейтрализующие суммарный заряд ионов внутренней сферы и располагающиеся более отдаленно от комплексообразователя, образуют внешнюю сферу. При написании формул КС комплексообразователь с лигандами, т.е. внутреннюю сферу, заключают в квадратные скобки [MLn]. Этим подчеркивается, что в растворах комплексный ион почти не диссоциирует на составляющие его ионы или молекулы. Например,
В большинстве соединений связь между комплексообразователем и лигандом имеет донорно-акцепторную природу. Число связей (число мест) между лигандами и комплексообразователем определяет координационное число (к.ч.) или координационную дентантность (ёмкость) последнего. Если лиганды (Н2О, NH3, CO, Cl-, CN-) занимают в координационной сфере одно место, т.е. связаны с комплексообразователем через один атом лиганда (к.ч. совпадает с числом лигандов) их называют монодентатными. Например, координационные числа центральных ионов в [Fe(CN)6]3- и [Cu(NH3)4]2+ равны 6 и 4, а лиганды CN- и NH3 – монодентатные. Лиганд, образующий с комплексообразователем две связи, называется бидентатным. Например, оксалат-ион С2О42- - бидентатный и образует с Cu2+ соединение K2[Cu(C2O4)2]. Такие лиганды, как SO42- или CO32- в зависимости от условий могут быть моно- и бидентатными. Лиганды, которые занимают в координационной сфере два или более мест, т.е. соединены с комплексообразователем через два или большее число атомов, называют полидентатными. Координационное число комплексообразователя зависит от многих факторов: электронного строения, природы лигандов, соотношения радиусов ионов комплексообразователя и лигандов, а иногда от температуры и других условий проведения реакции, но самым значительным фактором можно считать степень окисления комплексообразователя. Значения к.ч. варьируются от 1 до 12, но наиболее часто встречаются 6 и 4. Приближенно можно считать, что характерное к.ч. определяется зарядом (степенью окисления) центрального иона и равно: к.ч. ≈ 2 · Zк
К.ч. 6 встречается в комплексных соединениях с участием Pt4+, Cr3+, Co3+, Fe3+, координационное число 4 – в комплексах Cu2+, Zn2+, Pd2+, Pt2+, - координационное число 2 – в комплексах Аg+, Cu+. Приведённые координационные числа соответствуют максимальному насыщению координационной сферы и относятся к координационно-насыщенным соединениям. Не всегда в растворах соблюдаются условия, необходимые для этого, и тогда образуются координационно-ненасыщеные комплексы с меньшими к.ч.. К.ч. не является неизменной величиной для данного комплексообразователя, а обусловлено также природой лиганда, его электронными свойствами. Даже для одних и тех же комплексообразователей и лигандов координационное число зависит от агрегатного состояния, от концентрации компонентов и температуры раствора. Характерными комплексообразователями являются катионы: Fe2+, Fe3+, Co2+, Co3+, Cu2+, Ag+, Cr3+, Al3+, Ni2+. Характерными лигандами являются анионы: F-, Cl-, Br-, CN-, SO42- и полярные молекулы: NH3, H2O, CO, NO. Если лигандами являются только нейтральные молекулы, то заряд комплексного иона равен заряду комплексообразователя; если во внутреннюю сферу входят ионы и молекулы, то заряд комплексного иона равен заряду комплексообразователя; если во внутреннюю сферу входят ионы и молекулы, то заряд комплексного иона равен алгебраической сумме зарядов комплексообразователя и лигандов. Например, заряд иона [Cr(H2O)5Cl]x слагается из зарядов Cr3+ и Cl- и равен + 3 + 0·5 + (-1) = +2. Итак, объединив все выше сказанное можно сделать следующий вывод: Комплексным соединением называется вещество, в узлах кристаллической решетки которого находятся сложные частицы, построенные за счет координации одним атомом (или несколькими атомами) обычных молекул или ионов и способные к существованию при переходе вещества в расплавленное или растворенное состояние.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Последнее изменение этой страницы: 2019-03-29; Просмотров: 422; Нарушение авторского права страницы