
|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |

|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |
Сравнительная характеристика внехромосомных факторов наследственности
Сравнительная характеристика внехромосомных факторов наследственности
Геном (генотип) бактерий (от греч. genos — рождение и typos — отпечаток, образ) — совокупность всех генов бактерий. До 1956 г. все бактериальные хромосомы считались линейными. В 1956 г. Жакоб и Вольман предложили кольцевую модель бактериальной хромосомы, которая была общепринятой до появления новых методов исследования ДНК. Затем с помощью электрофореза в пульсирующем поле (метод прямого анализа физической структуры хромосом) было показано, что у некоторых бактерий хромосомы являются линейными. В середине 90-х гг., когда были начаты расшифровки полных нуклеотидных последовательностей геномов методом секвенирования, было выявлено, что ряд бактерий имеют сложные геномы, состоящие из двух или нескольких репликонов. Например, геномы V. cholerae и B. melitensis представлены 2 кольцевыми хромосомами, а геномы L. interrogans и B. cereus — 1 кольцевой хромосомой и 1 мегаплазмидой. Анализ полных нуклеотидных последовательностей геномов бактерий позволил получить информацию об организации геномов бактерий — их размерах, линейности или циркулярности, ГЦ-составе, количестве открытых рамок считывания (ORF), наличии дупликаций и амплификации некоторых из них, выявить родственные и уникальные гены у различных бактерий (табл. 37). Таблица 37 Характеристики геномов некоторых бактерий
Оказалось, что многие бактерии, относящиеся к различным таксономическим группам, обладают генами, имеющими общее происхождение. Их распространение осуществлялось путем горизонтального переноса генов — механизма, признанного сейчас одним из основных «двигателей» в эволюции бактерий. В составе геномов бактерий были обнаружены гены эукариот, а в геноме человека и других эукариот — гены бактерий. Это подтвердило сложившееся после открытия мобильных генетических элементов представление о существовании общего генофонда всего живого мира, обмена генами не только между разными видами и родами бактерий, но и между совершенно неродственными организмами — бактериями и высшими животными и растениями. ИЗМЕНЧИВОСТЬ БАКТЕРИЙ Изменчивость бактерий — способность приобретать новые признаки, закреплять их в потомстве и сохранять. Изменчивость — один из главных факторов эволюции. Она служит источником для отбора форм, наиболее приспособленных к условиям существования. Изменчивость может быть генотипической и фенотипической (табл. 38). Таблица 38 Частота изменений | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Низкая | Высокая | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Реверсия в исходную форму | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Редкая | Частая | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Характер сдвигов | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Случайный | Адаптивный к среде | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Передача по наследству | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| + | – | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Изменчивость бактерий имеет большое прикладное значение в диагностике, лечении и профилактике инфекционных заболеваний. Так, образование L-форм бактерий приводит к ложноотрицательным результатам культурального метода исследования. Возникновение антибиотикорезистентности является чрезвычайно актуальной проблемой в лечении инфекционных заболеваний. Наконец, формирование типоспецифического иммунитета делает возможным повторные случаи инфекционных заболеваний.
Генотипическая изменчивость
Генотипическая (наследственная) изменчивость — наследуемые изменения генетического аппарата бактерий, возникающие в результате мутаций или генетических рекомбинаций.
Мутации (лат. mutatio — изменение) — скачкообразные стойкие изменения наследственного признака (признаков), возникающие в результате изменения первичной структуры ДНК (последовательности одной или нескольких пар нуклеотидов). Мутации у бактерий носят ненаправленный характер, в их основе лежат ошибки копирования наследственной информации, возникающие при репликации.
Мутации проявляются в фенотипе в виде утраты или изменения признаков: морфологических (жгутиков, пилей, капсулы, КС), биохимических (способности ферментировать углеводы, синтезировать аминокислоты, витамины), возникновения резистентности к лекарственным или дезинфицирующим веществам, изменения чувствительности к температуре, снижения вирулентности (аттенуации). Мутанты, нуждающиеся в определенных аминокислотах, азотистых основаниях, ростовых факторах, называются ауксотрофными. Они могут сохранять способность к росту лишь в том случае, если утрата фермента компенсируется наличием в среде готового продукта, образуемого при его непосредственном участии.
Классификации мутаций:
А. По происхождению:
I. Спонтанные — возникающие самопроизвольно, без преднамеренного экспериментального воздействия, под влиянием природных факторов или в результате физиологических изменений в клетке.
Спонтанные мутации составляют естественный (спонтанный) фон, величина которого колеблется в зависимости от типа мутации и вида микробной популяции в пределах 10–7–10–10. При высоких скоростях роста частота мутирования постоянна, и ее обычно определяют для клеток в экспоненциальной фазе роста при оптимальных условиях среды. Спонтанные мутации могут обусловливать благоприятные и неблагоприятные генетические изменения.
Причины спонтанных мутаций:
Ошибки в работе ДНК-полимеразы во время репликации ДНК и неправильного формирования комплементарных пар оснований. Мутации происходят в результате ошибочного включения в синтезируемую дочернюю цепь вместо одного азотистого основания другого, некомплементарного, имеющегося в родительской цепи, например, вместо аденина, комплементарного тимину, гуанина или цитозина.
Инсертационные мутации, возникающие при встраивании в нуклеоид внехромосомных факторов наследственности (IS-последовательностей, транспозонов, плазмид). Фенотип мутации зависит от места их интеграции: если она происходит вблизи промотора, то нарушается функция регуляторного гена, если вблизи структурного гена — синтез закодированного в нем продукта. При наличии у бактерий генов-мутаторов частота мутаций увеличивается в 100 и более раз.
Ошибки в работе репарирующих ферментов.
II. Индуцированные — возникают под влиянием мутагенов — внешних факторов физической, химической или биологической природы, повреждающих ДНК. Общее число мутагенов в настоящее время измеряется несколькими
сотнями.
Мутагены (мутагенные факторы) — (лат. mutatio — изменение и греч. genesis — развитие) — химические вещества или физические факторы, вызывающие предмутационные изменения в ДНК или РНК (в случае РНК-вирусов), которые в результате ошибок в работе репарирующих ферментов или в процессе репарации переходят в мутацию.
Классификация мутагенов по природе:
1. Физические (УФ-излучение, g-излучение, температура) — оказывают прямое и опосредованное (окислительные и деструктивные процессы под действием свободных радикалов) повреждающее действие на основания ДНК.
2. Химические:
а) ингибиторы предшественников нуклеиновых кислот;
б) аналоги азотистых оснований (5-бромурацил, 2-аминопурин);
в) алкилирующие соединения (гидроксиламин, азотистая кислота);
г) окислители;
д) восстановители;
е) свободные радикалы;
ж) акридиновые красители;
з) производные нитрофуранового ряда.
Часть химических мутагенов действует лишь при синтезе ДНК, другие способны вызывать мутации, действуя на покоящуюся ДНК.
3. Биологические (вирусы, транспозоны).
Классификация мутагенов по механизму действия:
1. Аналоги азотистых оснований Þ замена пар оснований.
Азотистая кислота дезаминирует азотистые основания, в результате чего после нескольких актов редупликации ДНК в ней происходит замена пар оснований гуанин–цитозин (ГЦ) на аденин–тимин (AT). Гидроксиламин во внеклеточных вирусах действует только на цитозин, что приводит к замене ГЦ на AT.
Аналог тимина, 5-бромурацил, замещает тимин у фагов и бактерий в процессе редупликации их ДНК, что может привести к замене пары AT на ГЦ.
2. Акридиновые красители Þ выпадения или вставки оснований.
Этилэтансульфонат и этилметансульфонат вызывают алкилирование гуанина и его отщепление от рибозофосфатного скелета и другие повреждения в ДНК.
3. УФ-излучение, некоторые продукты микробного метаболизма (формальдегид) Þ нарушение работы ДНК-полимеразы Þ образование тиминовых димеров — «сшивок» между соседними молекулами тимина.
4. Нитрозосоединения Þ множественный эффект («супермутагены»). Нитрозонитрометилгуанидин и нитрозопроизводные мочевины алкилируют цитозин, вызывая его замену тимином. Они характеризуются чрезвычайно высокой эффективностью при незначительном летальном действии, извращают синтез предшественников ДНК, дезаминируют некоторые основания.
Б. По проявлению мутации в фенотипе:
I. Проявленные (доминантные).
II. Непроявленные (молчащие, рецессивные). Первичный эффект мутагенного фактора не обязательно ведет к истинной мутации. Новый фенотип проявляется только тогда, когда измененный ген начнет функционировать.
В. По направленности действия:
I. Прямые — первичные мутации от дикого типа к мутантному фенотипу (потеря или изменение признака).
II. Обратные (реверсии) — мутации, обусловившие возврат к дикому фенотипу (восстановление признака):
Истинные реверсии — вторичная мутация в этом же гене точно восстанавливает исходный генотип, как следствие — восстанавливается и фенотип. Это может произойти, если прямое мутационное изменение состоит в простой замене пары оснований в первично мутировавшем гене. Так, если прямая мутация — результат замены пары AT на ГЦ, то обратная мутация — результат замены пары ГЦ на AT.
Супрессорные вторичные реверсии — подавление мутантного фенотипа, которое выражается в исправлении мутационного изменения, т. е. восстанавливается только фенотип, но не генотип. Различают супрессорные мутации:
а) внутригенные — в исходном гене: если при первой мутации произошла вставка или выпадение пары нуклеотидов в одном из участков ДНК одного и того же гена, а в другом — мутация противоположного рода (выпадение или вставка), то правильность считывания информации восстанавливается.
б) внегенные — в других участках хромосомы в генах-супрессорах, кодирующих синтез транспортных РНК, в результате чего в синтезируемый полипептид доставляется нужная аминокислота.
Для точечных мутаций частота реверсий довольно высока, в то время как для аберраций реверсии не характерны.
Г. По фенотипическим последствиям для мутировавшей клетки:
I. Нейтральные — безразличны для популяции, фенотипически не проявляются изменениями признаков, т. к. заметно не отражаются на функциональной активности синтезируемого фермента.
II. Условно-летальные (полулетальные) — приводят к изменению, но не к утрате функциональной активности фермента. В зависимости от условий окружающей среды микроорганизмы могут сохранять или утрачивать свою жизнеспособность. Так, например, ts-мутанты (температурочувствительные) бактерий сохраняют способность к синтезу ферментов, функционирующих при 37 º С, но утрачивают этот признак при 42 º С. В то же время у бактерий дикого типа соответствующие ферменты активны при обеих температурах.
III. Летальные — характеризуются полной утратой способности синтезировать жизненно важный для бактериальной клетки фермент. Чаще всего это хромосомные (делеции) или генные мутации (в генах, несущих информацию о синтезе ДНК-полимераз).
IV. Полезные — в любой микробной популяции в каждый момент времени существует множество особей с изменениями молекулярной конституции, обеспечивающих резистентность к неблагоприятным воздействиям (например, к антибиотикам).
Д. По характеру изменений в первичной структуре ДНК:
I. Точечные — замена или вставка пары азотистых оснований в ДНК, которая приводит к изменению одного кодона, когда повреждения ограничиваются одной парой нуклеотидов:
Вставки или выпадения одной пары нуклеотидов (мутации со сдвигом считывания).
Транзиции — замены одного пуринового основания на другое или одного из пиримидиновых оснований на другое.
Трансверсии — одно из пиримидиновых оснований заменяется пуриновым или наоборот.
Виды точковых мутаций по индуцируемым последствиям:
миссенс-мутации — происходит изменение всех последующих кодонов, в результате вместо одной аминокислоты кодируется другая;
нонсенс-мутации — образуется бессмысленный кодон, не кодирующий ни одну из аминокислот.
II. Генные — изменения одного гена.
III. Хромосомные (геномные аберрации) — изменения нескольких генов:
Нехватки — выпадение части хромосомы:
а) делеции — утрата нескольких пар нуклеотидов в середине хромосомы;
б) дефишенсии — потеря концевого участка хромосомы.
Дупликации (повторения) — удвоение участка хромосомы.
Инверсии (перевороты) — отрыв участка хромосомы, поворот его на 180º и прикрепление к месту отрыва.
Инсерции (вставки) — вставки коротких или протяженных последовательностей посторонней ДНК.
Транспозиции (перемещения, горизонтальный перенос генов) — перемещение группы нуклеотидов (IS-последовательностей или транспозонов) в пределах хромосомы из одного участка ДНК в другой или из репликона в репликон (из хромосомы в плазмиду и наоборот). Транспозиции могут вызывать делеции или инверсии генетического материала, а при включении в новый участок ДНК — дупликации в 6–9 пар нуклеотидов.
Теоретически мутации могли бы привести к вымиранию бактериальной популяции, однако в любой живой клетке существуют биохимические механизмы, способные полностью или частично восстанавливать исходную структуру ДНК.
Механизмы восстановления повреждений ДНК:
А. Репарации.
I. Световая репарация (фотореактивация) — репарационная система, осуществляющая реверсию поврежденной УФ-излучением ДНК к исходной структуре под действием дополнительного УФО.
При УФО фагов, бактерий и простейших наблюдается резкое снижение их жизнедеятельности. Однако их выживаемость резко повышается при дополнительном воздействии видимым светом. Оказалось, что под действием УФ-излу-чения в молекуле ДНК образуются димеры (химические связи между двумя пиримидиновыми основаниями одной цепочки), что препятствует считыванию
информации. Видимый свет активирует ферменты, разрушающие димеры.
Световая репарация осуществляется несколькими ферментами:
фотолиазой — расщепляет тиминовый димер и восстанавливает целостность соседних тиминовых оснований;
О6-метилтрансферазой — удаляет О6-метильную группу из остатков гуанина после действия метилирующих агентов;
ДНК-пурин инсертазой — осуществляет встраивание утерянного при мутации основания в апуриновый сайт;
ДНК-гликозилазой — удаляет дефектные основания.
Все эти процессы происходят в один этап под действием конкретного фермента и безошибочно восстанавливают исходную структуру ДНК.
II. Темновая репарация — эксцизия (удаление) неправильно спаренных или поврежденных оснований из ДНК с последующим восстановлением исходной структуры. Темновая репарация осуществляется несколькими ферментами в две фазы:
1. Дорепликативная (до удвоения молекулы ДНК):
эндонуклеаза распознает место повреждения, расщепляет цепь ДНК вблизи дефекта;
экзонуклеаза удаляет поврежденный фрагмент;
ДНК-полимераза восполняет дефект, проникает в брешь и встраивает в нее отсутствующие нуклеотиды на матрице второй сохранившейся нити ДНК.
2. Пострепликативная (после удвоения молекулы ДНК): осуществляется путем рекомбинаций, при этом дефекты ДНК застраиваются фрагментами неповрежденных нуклеотидов. ДНК-лигаза сшивает вновь синтезированный участок с основной нитью ДНК.
Темновая репарация основана на ресинтезе нуклеотидной цепи на базе неповрежденной матрицы, поэтому она также является практически безошибочной.
Б. Активация механизмов, обеспечивающих резистентность к повреждениям. Кроме механизмов исправления повреждений, клетки имеют возможность обойти вызванную повреждениями блокаду репликации ДНК, например, путем репарации в процессе рекомбинации.
В. Обратная мутация (истинная реверсия) — измененный при первой мутации генотип точно восстанавливается второй мутацией, в результате чего восстанавливается и фенотип (например, измененный при первой мутации триплет после второй мутации будет кодировать ту же аминокислоту, что и раньше).
Г. Супрессорная мутация — восстанавливается только фенотип, изменившийся в результате первой мутации. Данная мутация может быть:
I. Внутригенной (в исходном гене) — если при первой мутации произошла вставка или выпадение нуклеотидов в одном из участков ДНК, а в другом участке — мутация противоположного рода (выпадение или вставка), то правильность считывания информации восстанавливается.
II. Экстрагенной (в других участках хромосомы) — вторичная мутация, подавляющая выражение первичного мутационного изменения; происходит в генах-супрессорах, кодирующих синтез тРНК, что приводит к изменению последней, в результате чего в синтезируемый полипептид доставляется нужная аминокислота.
Генетические рекомбинации. Горизонтальная передача генетической информации у бактерий осуществляется путем генетических рекомбинаций.
Генетическая рекомбинация — взаимодействие между двумя различными геномами, которое приводит к образованию рекомбинаций ДНК и формированию дочернего генома, сочетающего гены обоих родителей.
Типы генетических рекомбинаций:
гомологичная — в процессе разрыва и воссоединения ДНК происходит обмен между участками ДНК, обладающими высокой степенью гомологии;
сайт-специфическая — происходит только в определенных участках генома и не требует высокой степени гомологии ДНК (например, включение плазмиды в хромосому бактерии).
Особенности рекомбинаций у бактерий определяются отсутствием истинного полового процесса и мейоза у прокариот, а также гаплоидным набором
генов.
В процессе рекомбинации бактерии условно делятся на клетки-доноры, которые передают генетический материал, и клетки-реципиенты, которые этот материал воспринимают. В клетку-реципиент проникает не вся, а только часть хромосомы клетки-донора, т. е. один или несколько генов. Образуется один рекомбинант, генотип которого представлен в основном генотипом реципиента с включением фрагментов хромосомы донора.
Рекомбинационная изменчивость у бактерий происходит в результате включения в ДНК реципиентной клетки участка ДНК донорской клетки путем трансформации, трансдукции, конъюгации.
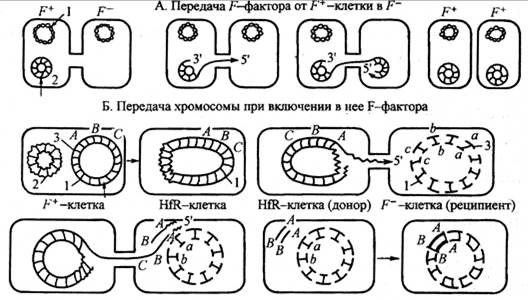
Конъюгация — перенос генетического материала при непосредственном контакте донорской и реципиентной клеток с помощью конъюгативных пилей (рис. 74). Контролируется tra(transfer)-опероном. Необходимым условием конъюгации является наличие в клетке-доноре трансмиссивной конъюгативной
F-плазмиды. Клетки-доноры, обладающие F-плазмидой, обозначаются как
F+-клетки; клетки-реципиенты, не имеющие F-плазмиды, — F--клетки. Соотношение в бактериальной популяции F+- и F--клеток 1: 10-5. Трансмиссивная плазмида кодирует половые пили, образующие конъюгационную трубочку между клеткой-донором и клеткой-реципиентом, по которой плазмидная ДНК передается из клетки-донора в клетку-реципиент.
|


б
Рис. 74. Конъюгация:
а — передача F-фактора от F+-клетки в F–; б — передача хромосомы при включении в нее
F-фактора
Передача генетического материала при конъюгации начинается с расщепления ДНК в районе локализации F-плазмиды. Одна нить донорской ДНК передается через конъюгационный мостик в реципиентную F--клетку, достраивается комплементарная нить до образования двунитевой структуры. Другая нить донорской ДНК остается в клетке, т. е. донор сохраняет свое генетическое постоянство.
Если переданная F-плазмида сохраняется в реципиентной клетке в автономном состоянии, то донор и реципиент меняются полами. Если переданная донорская ДНК рекомбинирует с гомологичным участком реципиентной ДНК с образованием стабильной генетической структуры, то клетка-реципиент получает донорские свойства. Донорские клетки, имеющие встроенную в хромосому
F-плазмиду, называются Hfr-клетками (англ. High frequency of recombination — высокая частота рекомбинаций).
Для полового процесса бактерий нехарактерна репродуктивная изоляция: конъюгация может происходить между родами одного семейства (например, эшерихиями и сальмонеллами, сальмонеллами и шигеллами).
Биологическая значимость конъюгации хорошо видна на примере распространения резистентности бактерий к антибиотикам. Резистентность к антибиотикам бактерия может получить в результате мутации, что происходит 1 раз на каждые 106 клеточных делений. Однако, однажды изменившись, генетическая информация может быстро распространяться среди сходных бактерий посредством конъюгации, поскольку каждая третья из близкородственных бактерий способна к этому типу генетического переноса.
Трансдукция — передача генетического материала от бактерии-донора к бактерии-реципиенту с помощью фаговой ДНК (рис. 75). У бактерий обнаружены бактериофаги двух типов — вирулентные и умеренные.
|
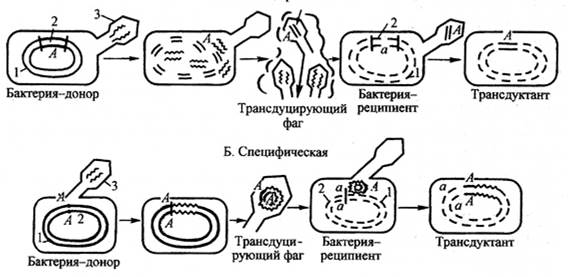
б
Рис. 75. Трансдукция:
а — неспецифическая; б — специфическая
Вирулентные бактериофаги после размножения в клетках бактерий приводят к их лизису. Они существуют в вегетативном (размножение в клетках бактерий) или в зрелом (метаболически инертное состояние вне бактериальных клеток) состоянии.
Умеренные бактериофаги — факторы изменчивости бактерий, которые напоминают по своим свойствам плазмиды. Кроме вегетативного и инертного состояния, они могут быть также в состоянии профага (интегрированное с хромосомой состояние) и реплицироваться вместе с хромосомой бактерии. Бактерии, несущие профаг, называют лизогенными (от греч. lysis — растворение — способность фага лизировать бактерии). Эти бактерии, содержащие в своих хромосомах генетический материал фага, не продуцируют инфекционных фаговых частиц, хотя и сохраняют такую способность. Она может проявиться в определенных условиях, когда произойдет индукция профага. При индукции профаг вырезается из хромосомы бактерии, переходит в вегетативное состояние и размножается. В клетке образуются зрелые фаговые частицы, которые высвобождаются в окружающую среду после ее лизиса. Индукцию профага можно вызвать различными физическими или химическими агентами. Наиболее распространенным индуктором является УФО лизогенных клеток. Лизогения широко распространена среди бактерий и актиномицетов. Фенотипическим проявлением лизогении может быть изменение наследственных признаков микроорганизмов: типа колоний, антигенных и других свойств. Лизогенные клетки обладают селективными преимуществами по сравнению с нелизогенными, они резистентны к гомологичным суперинфицирующим фагам.
Изменчивость лизогенных бактерий может быть связана со следующим:
Приобретением генов, переносимых фагами от их предыдущих хозяев (бактерий-доноров). В процессе репликации фага внутри бактерий фрагмент бактериальной ДНК проникает в фаговую частицу и переносится вместе с ней в бактерию-реципиент. В результате включения в хромосому фаговой ДНК происходит фаговая (лизогенная) конверсия — изменение свойств бактерий. Из-за того что трансдуцируются небольшие фрагменты ДНК, то вероятность рекомбинации, затрагивающей определенный признак, очень мала и составляет 10–6–10–8. Например, дифтерийная палочка без умеренного бактериофага не выделяет экзотоксин и не вызывает заболеваний. Попав в клетку-рецепиент, умеренный бактериофаг, несущий ген токсигенности, интегрируется с хромосомой и изменяет свойства клетки (наделяет ее способностью продуцировать экзотоксин и вызывать дифтерию). Поэтому при выявлении носительства нетоксигенных штаммов проводится санация носителей с применением антибиотиков.
Экспрессией «молчащих» генов бактерий-реципиентов. В последнем случае фаговая ДНК, встраиваясь вблизи поврежденного промотора, заменяет его. При этом у бактерии-реципиента появляются новые признаки.
Типы трансдукции:
1. Общая (неспецифическая) трансдукция — перенос вирулентным бактериофагом фрагмента любой части бактериальной хромосомы и возможность передачи любого признака, т. к. в клетки-реципиенты могут быть внесены практически любые гены.
В инфицированной вирулентным бактериофагом клетке в ходе сборки дочерней популяции в головки некоторых фагов может проникнуть фрагмент бактериальной ДНК (вместе с вирусной ДНК либо вместо нее). Это происходит потому, что после фаговой инфекции бактериальная ДНК фрагментируется и кусочек бактериальной ДНК того же размера, что и фаговая ДНК, проникает в вирусную частицу с частотой 1 на 1000 фаговых частиц.
При общей трансдукции участок донорской ДНК встраивается в нуклеоид, при бинарном делении передается обеим клеткам.
2. Абортивная трансдукция — внесенный фрагмент ДНК донора не встраивается в хромосому реципиента, а остается в цитоплазме и там самостоятельно функционирует. При бинарном делении остается лишь у одной клетки и затем теряется в потомстве.
3. Специфическая трансдукция наблюдается, когда фаговая ДНК интегрирует в бактерию с образованием профага. При исключении ДНК фага из бактериальной хромосомы в результате случайного процесса захватывается прилегающий к месту включения фаговой ДНК фрагмент бактериальной хромосомы. Из-за того что большинство умеренных фагов интегрируют в бактериальную ДНК в специфических участках, для таких бактериофагов характерен перенос в клетку-реципиент определенного участка бактериальной ДНК донора. Специфическая трансдукция может служить механизмом переноса вирулентных генов среди бактерий при условии, что эти гены локализованы в непосредственной близости от мест интеграции профага.
Трансформация — передача свободных фрагментов ДНК (плазмидной или хромосомной) от донорской клетки к реципиентной без их непосредственного контакта и образование на этой основе рекомбинанта (рис. 76). При трансформации среди бактериальных популяций могут распространяться гены, кодирующие факторы патогенности, резистентность к антибиотикам, однако в обмене генетической информацией трансформация играет незначительную роль.
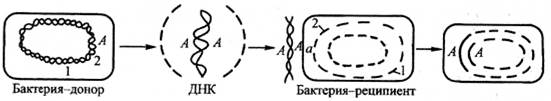
Рис. 76. Трансформация
Впервые явление трансформации было обнаружено на пневмококках при изучении переноса наследственных признаков от капсульных вирулентных пневмококков, убитых при нагревании, к живым бескапсульным клеткам пневмококков, не обладающим вирулентностью. Активным началом в этом процессе являлась ДНК.
Трансформация может произвольно происходить в природе у некоторых видов бактерий, чаще у Грам+, причем не только в пределах одного вида, но и между разными видами. Однако чем дальше отстоит один вид от другого в таксономическом отношении, тем меньше частота межвидовой трансформации.
Типы трансформации:
1. Абортивная трансформация — как правило, любая чужеродная ДНК, попадающая в бактериальную клетку, расщепляется рестрикционными эндонуклеазами.
2. Интегративная трансформация — чужеродная ДНК интегрируется в геном бактерии.
После поглощения ДНК клетками начинаются ее преобразования, предшествующие рекомбинации с хромосомой: разрывы ДНК на более короткие фрагменты и расплетание двунитевой ДНК на однонитевые участки. Затем такие нити образуют синапс с гомологичными участками хромосомы реципиента и рекомбинируют с ними, замещая одну из нитей ДНК хромосомы. В момент замещения хромосома в определенном участке имеет одну свою и одну чужую нить ДНК. При последующей репликации происходит образование двух новых нитей на своей и чужой матрице. Отражением этого является то, что в колонии, выросшей из клетки-трансформанта, содержится обычно смесь исходных реципиентных и рекомбинантных клеток, наследовавших признаки обоих родительских штаммов.
Трансформация используется для картирования хромосом, поскольку трансформированные клетки включают различные фрагменты ДНК. Определение частоты одновременного приобретения двух заданных характеристик (чем ближе расположены гены, тем более вероятно, что они оба включатся в один и тот же участок ДНК) дает информацию о взаиморасположении соответствующих генов в хромосоме. При трансформации клетка поглощает менее 1 % всего генома донора. Поэтому генетические карты, построенные посредством трансформации, показывают последовательность расположения генов лишь на небольших участках бактериальных хромосом.
К трансформации примыкают явления, в основе которых также лежит поглощение ДНК бактериальной клеткой. Одно из них — трансфекция, когда клетки поглощают искусственно выделенную фаговую ДНК. В результате в клетке начинается развитие фага с последующим лизисом клетки и освобождением зрелых фаговых частиц. Таким же путем можно ввести в бактерию плазмидную ДНК, передать рекомбинантную ДНК, сконструированную генно-инженерными методами, и передать в живую бактериальную клетку ДНК разного происхождения. Перенос экстрагированной ДНК является основным методом генной инженерии, используемым при конструировании рекомбинантных штаммов с заданным геномом.
Фенотипическая изменчивость
Фенотипическая (модификационная, ненаследственная) изменчивость — фенотипические, временные, наследственно не закрепленные изменения у бактерий. Модификации также контролируются геномом бактерий, но в отличие от мутаций не сопровождаются изменениями первичной структуры ДНК. Модификации возникают как адаптивные (лат. adaptatio — приспособление) реакции бактерий на изменения окружающей среды. Это позволяет бактериям быстро приспосабливаться к изменяющимся условиям среды и сохранять численность популяции. После устранения причины бактерии реверсируют к исходному фенотипу.
Фенотип (от греч. phaino — являю) — совокупность экспрессированных (реализованных) генетически детерминированных признаков, т. е. индивидуальное проявление генома. При этом микроорганизм наследует не признак, а потенциальную способность к проявлению этого признака. Условия окружающей среды способствуют проявлению (экспрессии) генов или, наоборот, подавляют их функциональную активность.
Генотип микроорганизмов проявляется в фенотипе в виде определенных признаков: в способности к образованию жгутиков, капсулы, ферментации углеводов, образованию токсинов. При изменении условий существования фенотип бактерий изменяется при сохранении генотипа.
Фенотип бактерий обозначают теми же знаками, что и генотип, но с прописной буквы.
Виды модификаций бактерий:
Морфологические — проявляются обратимыми изменениями морфологии (обратимая утрата капсулы, жгутиков, фимбрий, КС, способности к спорообразованию). Например, образующиеся под действием пенициллина L-формы бактерий, лишенные КС, могут сохраняться и даже размножаться внутри клеток хозяина, а после прекращения действия пенициллина вновь реверсировать к исходной форме. При выращивании многих бактерий на питательной среде с суббактериостатическими концентрациями антибиотиков и антисептиков также можно получить их модификации, характеризующиеся изменением морфологических признаков. Например, B. anthracis при 42, 5 º С спор не образует, а при
35–37 º С — образует споры.
Биохимические — проявляются индуцибельным синтезом ферментов. Например, кишечная палочка только в присутствии лактозы синтезирует ферменты, необходимые для ее ферментации. Стафилококки только в присутствии пенициллина синтезируют фермент пенициллиназу, разрушающий данный антибиотик.
Антигенные — проявляются сменой антигенов микроорганизмов в ходе инфекционного заболевания в результате включения «молчащих» генов (без их перестройки). К модификациям такого рода относятся изменения антигенной структуры гонококка, трепонемы сифилиса, боррелий возвратного тифа, холерного вибриона.
Стандартное проявление модификации — распределение однородной популяции на несколько типов — диссоциация. Обычно диссоциации возникают в условиях, неблагоприятных для исходной популяции. Примером диссоциации может служить изменение вида и структуры бактериальных колоний на твердых питательных средах.
Для обозначения диссоциирующих колоний используют первые буквы английских названий: S-колонии (англ. smooth — гладкий); R-колонии (англ. rough — шероховатый); М-колонии (англ. mucoid — слизистый) и D-колонии (англ.
dwarf — карликовый).
SR - диссоциация — появление в чистой культуре, образующей S-формы колоний, R-форм колоний как внешнее проявление изменений свойств образующих их бактериальных клеток.
Механизмы SR-диссоциации:
инсерционная мутация, приводящая к утрате генов, контролирующих синтез полисахаридных звеньев ЛПС наружной мембраны КС (у E. coli);
лизогенизация фагами (у C. diphtheriae);
интеграция в хромосому R-плазмиды, транспозонов или IS-последова-тельностей;
рекомбинации (у S. pyogenes).
Биологическое значение SR-диссоциации. В процессе диссоциации одновременно с изменением морфологии колоний изменяются другие свойства бактерий:
R-формы более резистентны к физическим и химическим факторам внешней среды, дольше сохраняются в воде, молоке;
S-формы более резистентны к фагоцитозу и действию антител.
Из-за того что диссоциации сопровождаются изменениями морфологических, биохимических, антигенных и вирулентных свойств возбудителей значительно усложняется этиологическая диагностика.
Популяционная изменчивость — изменчивость, возникающая в результате конкурентных отношений в популяции бактерий между особями с различными генотипами. При этом происходит селективный отбор мутантных особей, потомство которых будет составлять все увеличивающуюся часть популяции, в результате чего изменяется генотипический состав и фенотипические свойства популяции в целом.
Практическое использование изменчивости
Данная способность бактерий может использоваться в следующих целях:
получение аттенуированных вакцинных штаммов;
получение антибиотиков;
изучение механизмов антибиотикорезистентности;
биотехнология (получение диагностических, лечебных и профилактических препаратов с помощью генно-инженерных методов);
разработка биологического оружия (с этой целью отбираются вирулентные штаммы микроорганизмов, резистентные к антимикробным веществам);
изменчивость патогенных микроорганизмов — основная движущая сила в развитии и совершенствовании систем защиты человека от чужеродной генетической информации. Микроорганизмы — важный фактор естественного отбора в человеческой популяции.
ГЕНОМИКА
Геномика — наука о строении и функционировании генома, изучающая:
хранение генетической информации (геном и отдельные гены на молекулярном, индивидуальном и популяционном уровнях);
передачу генетической информации (механизмы экспрессии и регуляции генов, возможности переноса генов в другие системы);
реализацию генетической информации в конкретные свойства и признаки организма;
причины и механизмы изменения генетической информации на разных этапах развития организма, взаимосвязи между генами и их эволюцию;
клонирование организмов и использование знаний в генно-инженерных целях;
создание естественной классификации микроорганизмов (генеалогического древа) на основе генетических признаков;
разработку высокоточных методов диагностики и идентификации микроорганизмов — определение плазмидного профиля, рестрикционный анализ, молекулярная гибридизация, ПЦР, секвенирование.
Направления геномики:
1. Структурная — изучает первичную структуру генома (секвенирование генома) и его организацию, границы генов и их организацию, структуру белков и других биомолекул клетки. Использует методы картирования, секвенирования, рентгеноструктурного анализа, биоинформатики.
2. Функциональная — изучает функции генов и механизмы регуляции их активности, экспрессию генов при физиологических и патологических процессах. Использует методы биоинформатики, клонирования, направленного мутагенеза, ядерно-магнитного резонанса.
Биоинформатика — направление биологии, основанное на компьютерном анализе первичной, вторичной, третичной структуры молекул ДНК, молекул РНК и белков. Для этого используются специальные компьютерные программы и информационные базы данных.
 |
Рис. 78. Способы представления генетических связей при составлении генеалогического древа
Разделы геномики:
Транскриптомика — изучает транскриптомы — совокупность мРНК клетки и изменения в них в зависимости от среды и стадии развития.
Протеомика — изучает закономерности функционирования белков клетки в конкретный период ее развития, характер и последствия их биологических взаимодействий, роль в регуляторных и эффекторных процессах.
Метаболомика — изучает метаболиты и изменения в их составе в разные фазы жизненного цикла.
Эпидемический процесс — процесс возникновения и распространения среди населения инфекционных заболеваний, вызванных циркулирующим в коллективе возбудителем. Эпидемический процесс включает 3 звена: источник инфекции, механизм передачи и восприимчивый организм.
Источник инфекции — инфицированный организм человека или животного, в котором возбудитель живет, размножается, накапливается и выделяется во внешнюю среду. При сапронозах источником инфекции может быть сама внешняя среда.
Механизм передачи — процесс перемещения возбудителя из зараженного организма в восприимчивый.
Фазы (стадии) механизма передачи:
выделение возбудителя из организма хозяина во внешнюю среду;
пребывание возбудителя на объектах внешней среды;
внедрение возбудителя в восприимчивый организм.
Признак
Период (стадия) заболевания
 Клинические симптомы
Клинические симптомы

Окончание табл. 40
|
Признак |
Период (стадия) заболевания | |||
| инкубационный | продромальный | разгар | исход | |
| Эпидемиологические особенности | Обычно больной не представляет опасности как источник инфекции, т. к. возбудитель не выделяется из организма (исключения: ВГА и ВИЧ) | Чаще возбудитель не выделяется в окружающую среду (исключения: корь и коклюш) | Возбудитель интенсивно выделяется в окружающую среду, пути выделения зависят от локализации процесса, степень опасности для окружающих варьирует в зависимости от резистентности возбудителя (максимальная при туберкулезе, незначительная при гонорее и менингококковой инфекции) и особенностей макроорганизма | Как правило, продолжается выделение возбудителя в окружающую среду. Эпидемическая значимость повышается, часто она выше, чем в разгар заболевания, т. к. субъективно человек чувствует себя лучше и его социальные контакты расширяются |
 Примечание. При организации противоэпидемических мероприятий важно своевременное выявление всех контактных с инфекционным больным лиц и установление за ними медицинского наблюдения на срок максимального инкубационного периода.
Примечание. При организации противоэпидемических мероприятий важно своевременное выявление всех контактных с инфекционным больным лиц и установление за ними медицинского наблюдения на срок максимального инкубационного периода.
 |
Продромальный период характеризуется появлением первых общих неспецифических симптомов (недомогание, снижение аппетита, общая слабость, головная боль, миалгии, субфебрильная температура), четкая характерная симптоматика отсутствует. В продромальном периоде возбудитель интенсивно размножается в месте его локализации, инвазирует ткани, продуцирует токсины и ферменты.
Продолжительность продромального периода 1–3 суток, но может увеличиваться до 10 дней и зависит от этиологии инфекционного заболевания. Для ряда заболеваний (лептоспироз, грипп) продромальный период не типичен. Отсутствие продромального периода может свидетельствовать о более тяжелой форме инфекционного процесса.
Период разгара (развития) болезни характеризуется типичными для данной болезни симптомами, достигающими своей максимальной выраженности и определяющими специфическую клиническую картину заболевания. Наиболее типичными признаками инфекционной болезни являются лихорадка, воспаление, поражение центральной и вегетативной нервной системы, нарушение функций сердечно-сосудистой системы и органов пищеварения. При некоторых заболеваниях появляются кожные высыпания, желтуха и другие симптомы.
В период разгара возбудитель заболевания активно размножается в организме, выделяет токсины и ферменты, которые действуют на ткани.
Длительность периода разгара и развития болезни зависит от вида возбудителя, иммунологической реактивности организма, своевременной диагностики, эффективности лечения.
В период разгара болезни происходит активная перестройка иммунологической реактивности организма и выработка специфических антител класса IgM, затем IgG и IgA. При хронических заболеваниях развивается ГЗТ.
Больной в этот период наиболее опасен для окружающих, вследствие максимального выделения возбудителя из организма в окружающую среду и их высокой вирулентности. Однако при тяжелом течении заболевания социальная активность больных как источников инфекции снижена. При легком течении заболевания в стадию разгара больные очень опасны как источники инфекции.
Период исхода заболевания. Возможны следующие варианты исхода инфекционного заболевания:
1. При благоприятном течении заболевания период разгара переходит в стадию выздоровления (реконвалесценции), которая характеризуется постепенным исчезновением клинических симптомов заболевания, восстановлением нарушенных функций организма, нейтрализацией и выведением возбудителя и токсинов из него. При большинстве инфекционных заболеваний в период выздоровления организм полностью освобождается от возбудителя, формируется иммунитет. Следует помнить, что клиническое выздоровление опережает патоморфологическое восстановление поврежденных органов и полное освобождение организма от возбудителя!
2. Иногда заболевание переходит в хроническую форму с периодами ремиссий и рецидивов (псевдотуберкулез, сыпной тиф, герпетическая инфекция).
3. В некоторых случаях после перенесенного заболевания развивается микробоносительство (стафилококковые инфекции, брюшной тиф, холера).
4. Выздоровление может сопровождаться остаточными явлениями в виде повреждения органов и тканей (мышечная атрофия после перенесенного полиомиелита или клещевого энцефалита, дефекты кожи после натуральной оспы).
5. Еще один вариант исхода заболевания — суперинфекция — заражение тем же видом микроорганизма до его полного выздоровления (гонорея).
6. Иногда возникает вторичная инфекция — присоединение к развивающейся первичной инфекции другой инфекции, вызванной новым видом возбудителя (стафилококковая постгриппозная пневмония).
7. Возможна индукция аутоиммунных процессов (как осложнение стрептококковых инфекций, протозойных инвазий).
8. Наиболее тяжелый вариант — это летальный исход.
ПАТОГЕННОСТЬ
На протяжении жизни человек контактирует с огромным миром микроорганизмов, но вызывать инфекционный процесс способна лишь ничтожно малая часть этого мира (примерно 1/30 000). Эта способность в значительной степени определяется патогенностью возбудителя.
Патогенность (болезнетворность) (от греч. pathos — страдание, genos — происхождение) — видовой полидетерминантный признак возбудителя, характеризующий его потенциальную способность вызывать инфекционный (инвазионный) процесс у чувствительного к нему хозяина.
Патогенность характеризуют следующие признаки:
Потенциальность — может реализоваться при определенных условиях:
наличии восприимчивого макроорганизма;
определенном влиянии факторов внешней среды.
Видовой признак — проявляется в отношении особей одного вида: бактерии куриной холеры непатогенны для человека, а гонококк и вирус кори непатогенны для животных. Патогенность появилась в ходе эволюции микроорганизма и приспособления его к паразитированию в организме человека.
Полидетерминантность — контролируется совокупностью хромосомных генов и мобильных генетических элементов (плазмид, транспозонов, умеренных фагов).
Острова патогенности бактерий — нестабильные фрагменты ДНК некоторых микроорганизмов, где локализованы хромосомные и (или) плазмидные гены, отвечающие за высокий уровень патогенности.
Впервые были описаны в 1980 г. в Германии у уропатогенных E. coli, затем были найдены у других микроорганизмов.
Характеристика островов патогенности:
располагаются в геноме патогенных бактерий вблизи генов, кодирующих тРНК, которая часто действует как мишень для интеграции с чужеродной ДНК;
отсутствуют в геноме непатогенных бактерий того же или близкородственных видов;
составляют 5–20 % генома, содержат до 200 генов, кодирующих один или более фактор патогенности (капсулу, адгезины, инвазины, белки секреторных систем, токсины);
могут утрачиваться и передаваться другим микроорганизмам;
способны к горизонтальной внутиривидовой и межвидовой передаче, поэтому имеют высокую степень гомологии и часто отличаются соотношением Г+Ц от остальной части генома, что свидетельствует о чужеродном происхождении таких вставок;
имеют мозаичное строение, т. к. их участки приобретены в разное время от разных хозяев, структура ОП отражает этапы эволюции микроорганизмов и их хозяев;
в состав ОП входят мобильные элементы (IS-последовательности, транспозоны, умеренные фаги), гены подвижности, кодирующие интегразы, транспозазы, участки инициации считывания;
в состав геномных ОП входят гены, необходимые для осуществления конкретных функций микроорганизма (получение питательных веществ, резистентность к антибиотикам, патогенность).
Открытие ОП, способных горизонтально распространяться среди бактерий, способствовало пониманию того, каким образом, несмотря на разнообразие бактерий и их хозяев, существуют универсальные механизмы вирулентности, используемые разными видами бактерий.
Специфичность — способность вызывать типичные для данного вида возбудителя патоморфологические и патофизиологические изменения в определенных тканях и органах при естественных для него способах заражения. Специфичность определяется:
биологическими особенностями возбудителя;
локализацией возбудителя в организме;
избирательным поражением тканей и органов.
Динамичность — патогенность может приобретаться (при определенных условиях патогенными для человека могут быть истинные сапрофиты), изменяться (патогенность одних микроорганизмов может ослабляться, а других — усиливаться) и утрачиваться.
Качественная категория.
Классификация микроорганизмов по степени патогенности:
а) облигатно-патогенные — способны преодолевать защитные механизмы макроорганизма и вызывать инфекционные заболевания у восприимчивых людей. Патогенными для человека являются около 3000 видов микроорганизмов (1000 видов бактерий и риккетсий, 1000 видов вирусов, 500 видов грибов,
270 видов гельминтов), которые живут и питаются за счет органических субстратов. С одной стороны, основная цель патогенных бактерий — размножение. С другой — бактерии не стремятся убивать хозяина, т. к. в большинстве случаев смерть хозяина означает и гибель микроорганизма;
б) условно-патогенные — обнаруживают как в окружающей среде, так и в составе нормальной микрофлоры разных биотопов организма человека. При пассивном проникновении (через поврежденную кожу и слизистые) во внутреннюю среду и в стерильные зоны мочевых, дыхательных и половых путей в большой инфицирующей дозе и (или) при резком снижении местного и общего иммунитета УПМ вызывают заболевания. УП представители нормальной микрофлоры находятся с макроорганизмом в отношениях мутуализма, комменсализма или нейтрализма. Их существование обеспечивает естественную резистентность организма и антагонизм к патогенным штаммам. Однако в определенных условиях (иммунодефицитные состояния, травмы, операции) они могут вызывать эндогенные инфекции;
в) непатогенные — сапрофиты (греч. sapros — гнилой, phytos — растение) — питаются органическими веществами от отмерших организмов, являются симбионтами человека: живут в кишечнике, на коже, на слизистых, где обеспечивают защиту (конкурентным способом не дают патогенным бактериям заселить эти участки) либо участвуют в переваривании пищи и синтезе витаминов. Например, молочнокислые бактерии в кишечнике питаются его содержимым и задерживают развитие гнилостных бактерий.
Генотип патогенного микроорганизма фенотипически проявляется вирулентностью.
ВИРУЛЕНТНОСТЬ
Вирулентность — биологическое свойство микроорганизма, характеризующее меру патогенности конкретного штамма патогенного возбудителя (степень фенотипического проявления патогенности в момент исследования). Вирулентность определяет способность микроорганизма в определенной дозе вызывать определенные заболевания.
Вирулентность характеризуют следующие признаки:
Характеристика вирулентности:
Индивидуальный (штаммовый) признак микроорганизма, количественное выражение патогенности.
Вариабельность. Штаммы вида по этому признаку могут быть:
а) высоковирулентные — обладают способностью вызывать более тяжелые заболевания и быстрее распространяться среди людей, чем слабовирулентные;
б) умеренновирулентные — вызывают заболевания у здоровых людей в более высоких инфицирующих дозах;
в) слабовирулентные — вызывают заболевания у людей со сниженной функцией иммунной системы;
г) авирулентные — не вызывают заболеваний.
Динамичность — определяется совокупностью факторов патогенности; подвержена фенотипическому и генотипическому изменению; возможно естественное и искусственное снижение либо повышение вирулентности.
Снижение вирулентности (аттенуация) происходит при создании условий, неблагоприятных для размножения возбудителей, но не вызывающих их гибель. Может быть:
а) генотипическое:
мутации;
рекомбинации;
утрата внехромосомных факторов наследственности (плазмид, транспозонов, IS-последовательностей);
б) фенотипическое:
многократное пассирование культур микроорганизмов через организм маловосприимчивых или иммунных животных и людей;
неблагоприятные условия культивирования при воздействии химических, физических и биологических факторов: отсутствие в питательной среде некоторых веществ или наличие веществ, угнетающих рост, высокие или низкие температуры культивирования, воздействие УФ или g-излучения.
Варианты микроорганизмов, искусственно стойко лишенные вирулентности (аттенуированные штаммы) используют для изготовления живых вакцин (против туляремии, сибирской язвы, чумы, полиомиелита).
Повышение вирулентности, в свою очередь, бывает:
а) генотипическое:
мутации;
рекомбинации;
приобретение внехромосомных факторов наследственности (плазмид, транспозонов, IS-последовательностей);
б) фенотипическое: пассирование культур микроорганизмов через организм высоковосприимчивых животных и людей.
Для характеристики вирулентности пользуются качественными и количественными показателями.
Количественная категория.
Определение вирулентности.
Качественное определение вирулентности проводится прямым (биопроба) или косвенным (наличие ферментов вирулентности) способами.
Количественный критерий вирулентности — минимальное количество микроорганизмов, которое при определенном способе заражения животных определенного вида, веса и возраста в течение заданного времени вызывает гибель определенного количества животных или заболевание.
Оценка степени вирулентности осуществляется в условиях эксперимента на животных и не может быть целиком распространена на инфекционную патологию у людей. Определение вирулентности микробных культур чаще всего проводят на белых мышах. Очень важно соблюдать стандартность всех условий опыта. Для определения вирулентности применяют суточную культуру микроорганизма. Ее выращивают на мясо-пептонном агаре, смывают физраствором и стандартизуют по оптическому стандарту так, чтобы в 1 мл этого раствора содержалось определенное количество микробных тел. В тех случаях, когда получить агаровую культуру невозможно, пользуются суточной бульонной культурой; готовят ряд последовательных десятикратных разведений. Исследуемую взвесь бактерий вводят животным различными способами в зависимости от целей и задач исследования. Каждую дозу культуры вводят одновременно нескольким животным.
Показатели, характеризующие степень вирулентности:
а) Dcl (Dosis certe letalis) — наименьшая доза микробных клеток, являющаяся смертельной для всех 100 % животных, взятых в опыт;
б) Dlm (Dosis letalis minima) — наименьшая доза микробных клеток, которая при определенном способе заражения вызывает гибель 95 % восприимчивых подопытных животных определенного вида, веса и возраста в течение заданного времени;
в) LD50 (Dosis letalis 50 %) — доза микробных клеток, вызывающая гибель 50 % зараженных животных, является более точной дозой для сравнения относительной вирулентности различных бактерий;
г) ИД50 (инфицирующая доза 50 %) — доза микробных клеток, которая вызывает клинически проявляющуюся локальную или генерализованную инфекцию у 50 % особей.
Вирулентность связана с токсигенностью (способностью образования токсинов) и инвазивностью (способностью проникать в ткани хозяина, размножаться и распространяться). Токсигенность и инвазивность имеют самостоятельный генетический контроль, часто находятся в обратной зависимости (возбудитель с высокой токсигенностью может обладать низкой инвазивностью и наоборот).
ФАКТОРЫ ПАТОГЕННОСТИ
Каждому патогенному виду микроорганизмов присущ свойственный только ему набор конкретных материальных субстратов — факторов патогенности.
В роли факторов патогенности выступают:
структурные компоненты микробной клетки (белки, полисахариды, липиды и их комплексы);
ферментные системы;
бактериальные токсины;
метаболиты, выделяемые в среду.
Факторы патогенности обеспечивают основные этапы инфекционного процесса:
проникновение паразита в макроорганизм и адаптацию его там;
адгезию — способность бактерий прикрепляться к клеткам макроорганизма;
колонизацию — размножение бактерий на поверхности клеток макроорганизма;
инвазию — проникновение бактерий через слизистые и соединительнотканные барьеры макроорганизма в подлежащие ткани;
агрессию — подавление неспецифической и иммунной защиты макроорганизма;
повреждение клеток и тканей экзотоксинами, эндотоксинами, ферментами обмена веществ и ферментами-токсинами;
переход возбудителя к другому хозяину.
Этапы инфекционного процесса:
I. Попав в организм хозяина, микроорганизмы адаптируются в области входных ворот. Конкуренция между собственной и заносной микрофлорой обеспечивается благодаря выделению бактериоцинов, синтезу индуцибельных ферментов, локальному изменению pH. Способность к адаптации имеет решающее значение для облигатно-патогенных микроорганизмов.
II. В механизме адаптации проникших в организм бактерий большое значение придается их способности к адгезии на поверхности эпителиальных клеток, которая облегчает микроорганизмам доступ к необходимым источникам энергии.
Адгезия — пусковой механизм инфекционного процесса — способность микроорганизма адсорбироваться на чувствительных клетках. Посредством адгезии организм контролирует численность бактерий, не допуская чрезмерной колонизации ими эпителиальных поверхностей. Способность организма влиять на численность адгезированных бактерий имеет большое значение в тех случаях, если резидентный вид принадлежит к УПМ и повышенная колонизация может приводить к развитию патологических процессов.
Адгезия обеспечивается:
Неспецифическими физико-химическими механизмами, которые реализуются на ранних стадиях адгезионного взаимодействия.
Поверхности бактериальной клетки и эукариотической клетки-мишени в норме заряжены отрицательно. Для возникновения непосредственного контакта они должны преодолеть электростатическое отталкивание. Чтобы их адгезия стала возможной, необходимо предварительное отщепление отрицательно заряженных фрагментов бактериальными ферментами (нейраминидазой, гиалуронидазой).
Для обеспечения адгезии важна также роль гидрофобных соединений, образующихся при метаболизме и обеспечивающих гидрофобные контакты между участниками процесса адгезии.
Специфическими (лиганд-рецепторные) взаимодействиями с участием адгезинов, находящихся на поверхности микроорганизмов и взаимодействующих с клеточными рецепторами тканей человека (рецепторами адгезии). Межмолекулярные взаимодействия возможны лишь при наличии химического сродства, комплементарности между молекулами: каждый бактериальный адгезин подходит к клеточному рецептору мишени как «ключ к замку». Принципы комплементарности лиганд-рецепторных взаимодействий и взаимной приспособляемости — важнейшие принципы, лежащие в основе взаимоотношений в системах «микрофлора–хозяин». Специфические механизмы играют наиболее важную роль в адгезии. Поэтому микроорганизмы прилипают не к любым клеткам, а только к тем, которые имеют соответствующие рецепторы. Взаимодействие осуществляется посредством активных центров. Особенностями расположения активных центров и их количеством определяется способность макромолекул
к взаимодействию.
Каждый микроорганизм имеет свои собственные, оригинальные по устройству и химическому составу факторы адгезии (адгезины):
у Грам– бактерий — пили I и общего типов;
у Грам+ бактерий — белки и ТК КС;
капсульные полисахариды клебсиелл, поверхностные белки, ЛПС;
гемагглютинины вирусов.
Адгезины расположены на поверхности микроорганизма и ответственны за связывание его с соответствующими структурами чувствительной клетки (рецепторами адгезии). Адгезины разнообразны по строению и обусловливают высокую специфичность адгезии: одни микроорганизмы прикрепляются к клеткам эпителия дыхательных путей, другие — кишечного тракта, третьи — мочевыделительной системы.
Объектами биохимической активности микроорганизмов являются разнообразные биомолекулы макроорганизма — рецепторы адгезии, экспрессированные на эпителиоцитах:
нативные — существующие изначально;
индуцированные — образующиеся после адсорбции вирусов (например, вирусный гемагглютинин, встроенный в ЦПМ), поэтому на таких клетках впоследствии могут адгезироваться бактерии (часто после гриппа наблюдаются вторичные стафилококковые пневмонии);
приобретенные — появляются при определенных условиях (Ig, альбумины, фибронектин).
Аппаратом специфической адгезии обладает не только мутуалистическая микрофлора, но и патогенные микроорганизмы. Такая ситуация представляется на первый взгляд странной: зачем клеткам хозяина создавать на своей мембране локусы для прикрепления патогенных бактерий? При изучении механизма действия микробных токсинов было выяснено, что рецепторы, ранее рассматривавшиеся как специфичные для некоторых токсинов, на самом деле служат клеткам для распознавания других сигнальных макромолекул (гормонов, ферментов, нейромедиаторов). Между рядом гормонов и некоторыми токсинами обнаружено большое сходство в строении и в эффекторных функциях, например, в способности активировать локализованную в плазматической мембране аденилатциклазу.
В нормальном состоянии многие рецепторы эпителия экранированы рядом поверхностных структур, поэтому их взаимодействие с лигандными структурами невозможно по пространственным причинам. Однако при нарушении гомеостаза в результате активации аппарата агрессии как организма (активация лизоцима), так и микрофлоры (действие нейраминидазы) возможно удаление экранирующих структур. В этом случае возникают контакты между адгезинами патогенной микрофлоры и рецепторами клеток хозяина. Парадокс этого процесса состоит в том, что защитный аппарат хозяина провоцирует контакт с патогеном.
Еще один вариант специфической адгезии связан с возможностью возникновения у бактерий новых структур или механизмов благодаря регуляции их генной активности. Этому могут способствовать такие факторы внешней среды, как редокс-потенциал, рН, температура, ионная сила, свободные радикалы, метаболиты. Часто появление адгезинов у микроорганизмов связано с наличием у них или приобретением внехромосомных генетических элементов.
Если молекулярных мишеней нет или у них некомплементарная конфигурация, и доступ к ним прегражден стереохимическими барьерами, микроорганизм просто не сможет оказать на хозяина биохимического влияния. Этот фактор лежит в основе механизмов врожденного иммунитета, обеспечивающих антимикробную защиту живых существ. Именно принцип химической некомплементарности спасает нас от некоторых микроорганизмов. Блокирование адгезии также приводит к тому, что микроорганизм не вызывает инфекционный процесс.
III. Инвазия — способность микроогранизмов проникать через слизистые, кожу, соединительнотканные барьеры во внутреннюю среду организма и распространяться по его тканям и органам. Инвазия может быть:
1. Механической. К ней относятся:
активная подвижность лептоспир, обеспечивающая проникновение в макроорганизм через неповрежденные кожу и слизистые оболочки;
внедрение бледной трепонемы через микротравмы кожи и слизистых.
2. Химической — осуществляется с помощью следующих микробных ферментов:
гиалуронидазы, которая расщепляет гиалуроновую кислоту — основной компонент соединительной ткани, увеличивает проницаемость слизистых оболочек и соединительной ткани, характерна для C. perfringens, Streptococcus, Staphylococcus;
нейраминидазы (сиалидазы), которая расщепляет нейраминовую (сиаловую) кислоту, составляющую межклеточную основу между эпителиальными клетками, что способствует проникновению микроорганизмов и их токсинов в ткани. Нейраминидаза продуцируется Грам+ и Грам– патогенными бактериями, присутствует у некоторых вирусов (в. гриппа). V. cholerae с помощью этого фермента может преодолевать слизистые оболочки и распространяться в межклеточном веществе. Наличие нейраминидазы не всегда свидетельствует об инвазивной способности: C. diphtheriae образует этот фермент, но обладает слабой инвазивной способностью;
фибринолизинов (стрептокиназы и стафилококкокиназы), которые растворяют сгусток фибрина, ограничивающий местный очаг воспаления, что позволяет бактериям быстро распространяться в органы и ткани;
коллагеназы, которая интенсивно расплавляет мышечную ткань, т. к. гидролизует коллаген — основной компонент мышечного волокна и способствует продвижению бактерий (продуцируется С. histolyticum и С. perfringens, другими патогенными бактериями).
3. Биологической:
а) проникновение в организм с помощью переносчиков (трансмиссивный путь передачи): вши переносят боррелий, риккетсий; блохи — иерсиний чумы; комары — малярийных плазмодиев; клещи — боррелий, арбовирусы;
б) внедрение в геном эукариотических клеток характерно для ретровирусов и ДНК-овых вирусов;
в) внутриклеточное проникновение микроорганизмов:
пенетрация — проникновение внутрь эпителиальных клеток, разрушение эпителиоцитов и проникновение в подлежащие ткани — характерна для эшерихий, сальмонелл, иерсиний;
для внутриклеточных облигатных паразитов (риккетсий, хламидий и вирусов) характерно размножение только внутри клеток хозяина, которое сопровождается поражением клеточных структур и гибелью клеток;
бактерии рода Yersinia имеют инвазин, который связывается с интегринами хозяина и направляет захват бактерии, пристегивая по механизму «молнии» мембрану эукариотической клетки вокруг бактерии.
IV. Агрессия — способность возбудителя противостоять элиминирующим механизмам организма хозяина благодаря агрессинам (факторам агрессии). Агрессия — один из способов поддержания персистенции возбудителя в макроорганизме.
Факторы агрессии:
Бактерии, которые легко перевариваются фагоцитами, обычно не могут вызвать инфекцию. Патогенные бактерии в процессе эволюции выработали ряд механизмов, помогающих им не только избегать фагоцитоза и уничтожения, но и выжить и размножаться внутри фагоцитов — антифагоцитарные факторы. К ним относятся:
а) подавление стадии поглощения биологически активными веществами — компонентами бактериальной клетки:
полисахаридными капсулами S. pneumoniae, H. influenzae, T. pallidum,
К. pneumoniae;
М-белком и фимбриями стрептококков;
поверностным полисахаридом P. aeruginosa;
О-антигеном Е. coli;
К-антигеном Е. coli, Vi-антигеном S. typhi;
белком A S. aureus, который связывается с Fc-фрагментом IgG и блокирует его опсонинсвязывающую способность;
б) выживание внутриклеточных паразитов внутри фагоцитов благодаря механизмам, блокирующим бактерицидные вещества хозяина. Внутриклеточное расположение защищает бактерии от внеклеточных бактериоцинов, антител и лекарственных препаратов. К внутриклеточным патогенам относятся М. tuberculosis, L. monocytogenes, S. typhi, S. dysenteriae, Y. pestis, L. pneumophila, Rickettsia, Chlamydia. Так, клетки L. pneumophila включают в свою поверхность компонент комплемента С3b и используют этот белок для связывания с поверхностью макрофага. После поглощения бактерии остаются в вакуолях, которые не сливаются с лизосомами благодаря растворимому белку легионелл;
в) подавление слияния фагоцитарных лизосом с фагосомами, благодаря чему бактерии избегают действия лизосомальных протеолитических ферментов и выживают внутри фагосом ( Salmonella, M. tuberculosis, Legionella, Chlamydia). Так, микобактерии синтезируют сульфатиды, которые выходят из фагосом и модифицируют лизосомальные мембраны так, что слияние становится невозможным;
г) выживание внутри фаголизосомы благодаря резистентности к лизосомальным ферментам. У микобактерий туберкулеза и лепры резистентность к лизосомальным ферментам обеспечивается воскообразной гидрофобной КС и миколовыми кислотами. Клетки Staphylococcus продуцируют каталазу и супероксиддисмутазу, нейтрализующие токсические кислородные радикалы, которые генерируются в фагоцитах. В. anthracis недоступны для переваривания за счет капсулы, построенной из поли-D-глютамата;
д) выход из фагосом. Внутриклеточному проникновению часто способствуют компоненты цитоскелета эукариотической клетки. После вхождения в клетку фагоцита бактерии находятся в фагосоме и некоторые из них продолжают в ней оставаться и реплицироваться, в то время как другие быстро выходят в цитозоль клетки. Для этой цели R. prowazekii использует фермент фосфолипазу, которая гидролизует фагосому. У бактерий рода Listeria тот же эффект обеспечивается посредством листериолина и фосфолипазы. Оказавшись в ЦП, Listeria двигаются по ходу полимеризации актина. Бактерии рода Shigella также лизируют фагосомы и индуцируют полимеризацию актина для внутриклеточного передвижения и межклеточного распространения;
е) киллинг, или деструкция, макрофагов под действием ферментов или токсинов.
Разрушение макрофагов до поглощения бактерий. Гемолизины лизируют эритроциты. Например, патогенные стрептококки продуцируют гемолизин, который связывается с холестерином на мембранах, лизирует лизосомы, в результате чего их содержимое попадает в ЦП нейтрофилов, что ведет к гибели клетки. Сходным механизмом обладает лейкоцидин Staphylococcus.
Гибель макрофагов может наступить в результате действия токсина, например экзотоксина P. aeruginosa. Отечный фактор В. anthracis и аденилатциклаза Bordetella резко снижают активность макрофагов.
Уничтожение фагоцитов после поглощения бактерий. Многие внутриклеточные паразиты ( Mycobacterium, Brucella, Listeria ) оказывают токсическое действие на фагоциты после их поглощения. Эти бактерии размножаются в фагосомах, продуцируют вещества, которые проходят через мембрану фагосом, лизируют лизосомы и в итоге разрушают макрофаги.
Ферменты агрессии микрорганизмов:
протеазы — разрушают иммуноглобулины (антитела);
плазмокоагулаза — свертывает плазму крови, в результате стафилококки одеваются в фиброзный чехол, что препятствует поглощению микроорганизмов лейкоцитами и защищает их от фагоцитоза;
лецитиназа — разрушает лецитин, входящий в состав оболочек клеток (лейкоцитов, эритроцитов, миоцитов), способствует развитию лейкопении;
ДНК-аза — деполимеризует ДНК;
дезоксирибонуклеаза — разрушает лейкоциты.
Одна из причин, благодаря которой организм не отторгает нормальную микрофлору, несмотря на множественные взаимодействия, заключается в ее слабой иммуногенности для хозяина. В основе этого явления также лежит молекулярная мимикрия.
Для паразита перекрестнореагирующие антигены играют защитную роль, для организма хозяина — могут стать пусковым механизмом аутоиммунных заболеваний.
Примеры антигенной мимикрии:
общие антигены у b-гемолитических патогенных стрептококков серогруппы А, клеток миокарда и клубочков почек человека, поэтому образующиеся на белок стрептококков антитела взаимодействуют с тканями организма, что ведет к аутоиммунному поражению ткани миокарда и суставов при ревматизме или развитию гломерулонефрита;
общие антигены у E. coli O14 и О86 и клеток эпителия слизистой толстой кишки, что ведет развитию хронического аутоиммунного колита;
общие антигены у возбудителя чумы и эритроцитов человека с I группой крови, поэтому иммунокомпетентные клетки этих людей слабо реагируют на возбудителя чумы как на чужеродный антиген, что нередко приводит к летальному исходу;
наличие у микроорганизмов рецепторов к Fc-фрагментам антител. Эти рецепторы в норме есть у клеток иммунной системы (лимфоцитов, макрофагов, нейтрофилов). В норме патогенные микроорганизмы опсонизируются IgG через Fab-фрагменты фагоцитируются. Наличие у бактерий рецепторов к Fc-фрагментам антител «переворачивает» молекулу иммуноглобулина, в результате бактерия оказывается защищенной антителами хозяина от фагоцитоза;
наличие у возбудителя рецепторов к b2-микроглобулину может привести к нарушениям иммунной регуляции, развитию аутоиммунных заболеваний.
Другие:
угнетение Т-хелперов под действием вируса кори;
разрушение макрофагов и Т-хелперов под действием ВИЧ;
угнетение продукции цитокинов (ИЛ1, ИЛ2, g-INF) некоторыми микроорганизмами;
компоненты клеточных мембран и капсул Грам– бактерий (Salmonella, Yersinia, Brucella, E. coli) предохраняют клетки от комплемент-опосредованного лизиса и от действия лизоцима.
Экзотоксины. Характеристика:
Вещества белковой природы, секретируются микробной клеткой прижизненно или связаны с ней, характерны для Грам+ и Грам– бактерий, аэробов
и анаэробов. Основные симптомы заболеваний, вызываемых C. diphtheriae (дифтерия), B. pertussis (коклюш), V. cholerae (холера), B. anthracis (сибирская язва), C. botulinum (ботулизм), C. tetani (столбняк) и энтерогеморрагической E. coli (кровавая диарея и гемолитико-уремический синдром), являются результатом действия экзотоксинов.
Обладают высокой активностью и проявляют свой эффект в ничтожных концентрациях по сравнению с другими факторами патогенности. Типичный алгид — острая форма холеры — развивается при введении добровольцам per os
25 мкг очищенного холерного энтеротоксина. Клиническая картина стафилококковой энтеротоксемии развивается у человека при введении препаратов энтеротоксинов А и В в дозах 20 и 500 нг на 1 кг массы тела соответственно. Токсическая доза дифтерийного токсина для детей составляет менее 100 мкг на 1 кг массы тела. Токсические дозы ботулинического и столбнячного токсинов составляют соответственно 1 и 2, 5 нг на 1 кг массы тела.
Высокоспецифичны, изменяют нормальный метаболизм клеток хозяина.
Имеют латентный период действия (в это время они циркулируют в крови), а затем связываются с мембранами чувствительных клеток и проникают в них. Клеточные рецепторы для разных токсинов неодинаковы, и фиксируются:
на холинсодержащих рецепторах: О-стрептолизин, пневмолизин, тетанолизин;
на ганглиозидах определенного типа: энтеротоксин кишечных бактерий, холероген, ботулотоксин, тетаноспазмин;
на фосфолипидах клеточной мембраны: дифтерийный экзотоксин.
Токсический эффект осуществляется только после связывания экзотоксинов с чувствительными клетками-мишенями организма. До момента фиксации в тканях экзотоксины могут быть нейтрализованы специфическими антитоксическими антителами, поэтому принципиальное значение имеет ранее проведение серотерапии при заболеваниях, где основным фактором патогенности являются экзотоксины (дифтерия, столбняк, ботулизм, анаэробная раневая инфекция, стафилококковый токсикоз).
Экзотоксины являются сильными антигенами, высокоиммуногенны. Они вызывают образование специфических нейтрализующих антител — антитоксинов.
По чувствительности к температуре различают экзотоксины:
термолабильные: дифтерийный (60 º С — 1 ч), столбнячный (60 º С —
20 мин);
термостабильные: ботулинический (кипячение 10–30 мин), стафилококковый (кипячение 2, 5–3 ч).
Под действием формалина при 37 º С некоторые экзотоксины подвергаются инактивации (токсичность утрачивается, иммуногенность сохраняется) и превращаются в анатоксины. Последние используют:
в качестве вакцин для профилактики заболеваний (дифтерии, столбняка, ботулизма, стафилококкового токсикоза);
в виде антигенов для иммунизации животных с целью получения антитоксических сывороток.
Другие сферы применения экзотоксинов в медицине:
применение ботулинического нейротоксина в косметических целях для уменьшения глубоких морщин, при лечении мышечной гиперактивности (косоглазие, писчий спазм, гемифасциальный спазм, тремор и тики). Микродозы инъекций очищенного токсина в определенные точки вызывают паралич мышц и устраняют мышечный спазм. Терапию следует постоянно продолжать, так как действие токсина продолжается только несколько месяцев;
использование протеолитической активности стрептокиназы для восстановления проходимости тромбированных артерий при инфаркте миокарда;
использование дифтерийного экзотоксина и экзотоксина А Pseudomonas spp. в качестве цитотоксических компонентов иммунотоксинов (сочетают ферментативно активную часть молекулы токсина и моноклональные антитела) для лечения больных с
В-клеточными лимфомами, лейкемией и при трансплантации костного мозга (клинические испытания).
Классификации экзотоксинов:
I. По молекулярной организации экзотоксины делятся на 2 группы:
Состоящие из двух фрагментов — имеют бифункциональную АВ-струк-туру: ферментативно активная субъединица А (активатор, имеет большую молекулярную массу) нековалентно связана с транспортной субъединицей В (имеет меньшую молекулярную массу), непосредственно взаимодействующей со специфическим рецептором клетки-мишени. Токсическая группа А проникает внутрь клетки и блокирует метаболические реакции. Высокая токсичность белковых токсинов объясняется особенностью строения участков их молекул, имитирующих структуру макромолекул организма, поэтому по механизму действия они являются антиметаболитами. Типичную АВ-структуру имеют ST-токсины, термолабильный токсин E. coli, холерный токсин и экзотоксин бордетеллы коклюша.
Составляющие единую полипептидную цепь. Нейротоксины синтезируются в виде неактивных полипептидов с молекулярной массой до 150 кДа. Они высвобождаются при лизисе бактериальной клетки и активируются путем протеолитического расщепления незащищенной петли полипептида. Каждая активная молекула нейротоксина состоит из тяжелой (100 кДа) и легкой (50 кДа)
цепочек, соединенных единичной бисульфидной связью. Тяжелая цепочка нейротоксинов содержит два домена: участок, ответственный за транслокацию токсина и область, регулирующую связывание токсина с клеткой. Легкие цепочки нейротоксинов содержат цинксвязывающие последовательности, необходимые для осуществления протеазной активности токсина, зависящей от ионов цинка.
II. По степени связи с бактериальной клеткой экзотоксины делятся на
3 класса:
Секретируемые во внешнюю среду (экзотоксин C. diphteriae; отечный, летальный токсин B. anthracis).
Частично секретируемые и частично связанные с микроорганизмом (тетаноспазмин C. tetani, нейротоксин C. botulinum).
Связанные с микроорганизмом и попадающие в окружающую среду при разрушении клетки (цито-, энтеро-, нейротоксин S. dysenteriae, «мышиный» токсин Y. pestis).
III. По механизму действия бактериальные токсины делятся на 6 групп (табл. 41):
Мембранотоксины, повреждающие клеточные мембраны — вызывают разрушение клеток в результате формирования пор (рис. 82, а). Формируя трансмембранные поры, они нарушают селективный вход и выход ионов через плазматическую мембрану (RTX-токсины Грам– бактерий, α -токсин C. perfringens, стрептолизин S. pyogenes, α -токсин S. aureus (одна из фракций экзотоксина, лейкоцидин)).

А б в
Рис. 82. Механизмы действия некоторых бактериальных токсинов:
a — повреждение клеточных мембран под действием α -токсина S. aureus; б — ингибирование синтеза белка токсином Шига (Stx); в — активация вторичных мессенджеров (ST-энтеротоксины, экзотоксин C. botulinum (С3) и токсины А и В C. difficile (CdA и CdB), цитотоксический некроти-
зирующий фактор (CNF) E. coli и дермонекротический токсин (DNT) Bordetella spp.)
α -Токсин S. aureus обладает цитолитическими свойствами в отношении различных типов клеток (моноцитов, лимфоцитов, эритроцитов, тромбоцитов, эндотелиоцитов).
Стадии повреждения клеточной мембраны под действием α -токсина:
протомеры токсина связываются с мембраной клетки-мишени при помощи рецепторов или неспецифически абсорбируются фосфотидилхолином или холестеролом, входящими в состав билипидного слоя мембраны;
связанные с мембраной протомеры олигомеризуются в нелитический гептамерный комплекс;
гептамер претерпевает ряд конформационных изменений, в результате формируется «ножка», которая проникает сквозь ЦПМ. Через образовавшуюся пору происходит вход и выход небольших молекул и ионов, что ведет к набуханию и гибели ядерных клеток и осмотическому лизису эритроцитов.
При образовании пор также запускаются вторичные процессы (активация эндонуклеаз, увеличение экзоцитоза тромбоцитов, высвобождение цитокинов
и медиаторов воспаления, выделение эйкозаноидов), которые могут обусловливать развитие патологических последствий.
Ингибирующие белковый синтез — субстратами для этих токсинов являются фактор элонгации и рибосомальная РНК (рис. 82, б). Подавление белкового синтеза приводит в итоге к гибели клетки-мишени.
Дифтерийный экзотоксин и экзотоксин А Pseudomonas вызывают АДФ-рибо-зилирование фактора элонгации, нарушая синтез белка.
S. dysenteriae серотипа 1 и E. coli вырабатывают ST-токсины, инактивирующие рибосомальную РНК и нарушающие ее взаимодействие с факторами элонгации. ST-токсины являются мощными цитотоксинами.
Активирующие пути метаболизма, контролируемые вторичными мессенджерами (англ. message — сообщение) — нарушают синтез различных клеточных белков, не вызывая непосредственной гибели клеток (рис. 82, в). Активация или модификация вторичных мессенджеров под действием токсинов обусловливает нарушения процессов передачи сигналов, имеющих значение в поддержании разнообразных функций клеток (функциональные блокаторы).
Цитотоксический некротизирующий фактор (CNF) E. coli активирует Rho-белки, которые являются регуляторами актинового цитоскелета, и играет важную роль в развитии внекишечных инфекций (особенно инфекций мочевыводящих путей). Дермонекротический токсин Bordetella spp. также активирует Rho. Клостридиальные цитотоксины инактивируют Rho.
Холероподобные токсины обнаружены у V. с h о lerae, НАГ-вибрионов, патогенной E. coli (LT-энтеротоксин), С. jejuni. Они взаимодействуют с энтероцитами, что ведет к активации аденилатциклазы, накоплению цАМФ, увеличению проницаемости стенки тонкой кишки, выведению воды и электролитов в просвет кишечника, что приводит к диарее и обезвоживанию. Сибиреязвенный и чумной токсины также инактивируют аденилатциклазу.
Термостабильные ST -энтеротоксины обнаружены у энтеротоксигенных штаммов Е. coli (ЭТКП), К. pneumoniae, Y. enterocolitica, Y. pseudotuberculosis, они активируют гуанилатциклазу, которая превращает внутриклеточный ГМФ в эпителиальных клетках в цГМФ. Увеличение концентрации цГМФ нарушает транспорт электролитов в кишечнике: подавляется абсорбция ионов натрия и повышается секреция ионов хлора, изменения ионных потоков приводят к развитию секреторной диареи. ЭТКП вызывают диарею путешественников и являются основным этиологическим фактором диарей у детей во всем мире.
Нейротоксины C. botulinum и C. tetani имеют сходную структуру, ферментативную активность, избирательно действуют на нервную систему; не вызывают видимых повреждений нервных клеток. Клеточными мишенями нейротоксинов является группа белков, необходимых для стыковки и соединения синаптических пузырьков с пресинаптическими плазматическими мембранами с последующим высвобождением нейромедиаторов. Ингибируя высвобождение нейромедиаторов, нейротоксины блокируют передачу нервных импульсов в клетках головного и спинного мозга. Таким образом, они блокируют функции жевания, глотания, дыхания.
Ботулотоксины вызывают ботулизм новорожденных и пищевой ботулизм, они существуют в виде больших комплексов, включающих нейротоксин и один или несколько белков, которые обеспечивают защиту и стабильность молекулы токсина в ЖКТ. Ботулотоксины связываются с рецепторами на пресинаптической мембране моторных нейронов периферической нервной системы. Протеолиз белков-мишеней в этих нейронах ингибирует высвобождение ацетилхолина, препятствуя мышечным сокращениям.
Столбнячный экзотоксин (тетаноспазмин), синтезируемый в ранах вегетативными формами C. tetani, не формирует комплексов с белками. Он действует на ЦНС, поражая два вида нейронов: первоначально связывается с рецепторами пресинаптической мембраны моторных нейронов, затем с помощью обратного везикулярного транспорта перемещается в спинной мозг, где может внедриться в тормозные и вставочные нейроны. Расщепление везикулоассоциированного мембранного протеина в этих нейронах приводит к высвобождению глицина и
g-аминомасляной кислоты, которые вызывают мышечные сокращения.
Различия в клинических проявлениях интоксикации ботулотоксином (пониженный тонус мышц) и столбнячным экзотоксином (спастический паралич) являются следствием воздействия данных токсинов на различные нейроны.
Суперантигены, активирующие иммунный ответ макроорганизма (стафилококковые энтеротоксины серотипов A–E, G и H, пирогенные экзотоксины стрептококков группы А (серотипы A–C и F), суперантиген стрептококков группы А и стафилококковый суперантиген). Эти белковые молекулы напрямую связваются с рецепторами Т-лимфоцитов, что приводит к массивной пролиферации последних, которая сопровождается массивным высвобождением лимфоцитарных (ИЛ2, ФНО, g-интерферон) и моноцитарных (ИЛ1, ИЛ6, ФНО) цитокинов. Цитокины вызывают гипотензию, высокую температуру тела и диффузную эритематозную сыпь.
Суперантигены термостабильны, имеют сходную биологическую активность. Стафилококковый суперантиген рассматривают как ключевую субстанцию в развитии синдрома стафилококкового токсического шока, в последние годы его стали связывать и с развитием синдрома Кавасаки — одной из причин приобретенных пороков сердца у детей.
Эксфолиатины S. aureus, влияющие на процесс взаимодействия клеток между собой и с межклеточными веществами, вызывают пузырчатку новорожденных (отслоение эпидермиса и образование сливающихся пузырей, жидкость в которых стерильна; фокус стафилококковой инфекции находится при этом вдали от места кожного повреждения, чаще всего в пупочной ранке).
Эритрогенины S. pyogenes , вызывающие сыпь при скарлатине и покраснение кожи при внутрикожном введении восприимчивым людям.
Таблица 41
Мембранотоксины
Продолжение табл. 41
| Микроорганизм | Токсин | Механизм действия | Мишень | Заболевание | Роль в развитии инфекции |
|
Ингибиторы синтеза белков | |||||
| C. diptheriae | Дифтерийный токсин | АДФ-рибозил-трансфераза | Фактор элонгации 2 | Дифтерия | + |
| P. aeruginosa | Экзотоксин А | –//– | –//– | Пневмония* | (+) |
| E. coli S. dysenteriae | Токсин Шига | N-гликозидаза | 28S рРНК | Гемморагический колит, ГУС | + |
|
Протеазы | |||||
| B. anthracis | Летальный фактор | Металлопротеаза | MARKK1/ MARKK2 | Сибирская язва | + |
Окончание табл. 41
| Микроорганизм | Токсин | Механизм действия | Мишень | Заболевание | Роль в развитии инфекции |
| C. botulinum | Нейротоксины A–G | Zn-металло-протеазы | VAMP/синап-тобревин, SNAP-25, синтаксин | Ботулизм | + |
| C. tetani | Столбнячный токсин | VAMP/синап-тобревин | Столбняк | + |
Примечания. CNF — цитотоксический некротизирующий фактор; LT — термолабильный токсин; ST — термостабильный токсин; CLTD — цитолетальный разрыхляющий токсин;
EAST — термостабильный токсин энтероагрегативной E. coli; MAPKK — митогенактивируемая киназа протеинкиназ; VAMP — везикулоассоциированный мембранный белок; SNAP-25 — синаптосомальноассоциированный белок; * другие заболевания также связаны с данным микроорганизмом; ** токсин продуцируют также бактерии других родов; + — имеются доказанные причинно-следственные взаимоотношения между токсином и заболеванием; (+) — роль данных токсинов в патогенезе показана на животных моделях или на клеточной культуре; ? — роль данных токсинов в патогенезе неизвестна.
Роль экзотоксинов в патогенезе заболеваний:
Многие факторы патогенности продуцируются только патогенными штаммами и отсутствуют у авирулентных штаммов (энтеротоксины
E. coli).
Штаммы одного вида могут продуцировать один ( С. diphtheriae,
С. tetani, В. anthracis ) или несколько типов токсина, различающихся по иммунохимическим свойствам, но сходных по молекулярной структуре и механизму действия, например:
V. cholerae — холероген и шигеллоподобный токсин;
S. aureus — энтеротоксины типов А и В;
Е. coli — LT-энтеротоксин, ST-энтеротоксин и шигеллоподобный токсин;
С. botulinum — 7 типов нейротоксинов.
Сходная клиническая картина заболеваний, вызываемых патогенными штаммами различных видов бактерий, связана с их способностью продуцировать одинаковые типы токсинов или различные типы токсинов со сходным механизмом действия. Четко эта закономерность прослеживается в отношении холероподобных диарей. Диарейный синдром развивается за счет холероподобных токсинов, обладающих сходными антигенными свойствами, молекулярной структурой и механизмом действия, обнаруженных у V. с h о lerae, НАГ-вибрионов, С. jejuni.
Более тяжелую холероподобную диарею вызывают термостабильные энтеротоксины (ST-энтеротоксины), которые продуцируют патогенные штаммы
Е. coli, К. pneumoniae, Y. enterocolitica, Y. pseudotuberculosis.
Различные клинические формы инфекционных заболеваний, вызываемые разными патогенными штаммами одного вида бактерий, связаны с их способностью продуцировать различные т ипы токсинов.
Различные штаммы S. aureus могут продуцировать один из 7 типов энтеротоксинов, которые вызывают энтеротоксемию. Другие штаммы S. aureus могут продуцировать два типа эксфолиатинов. Причиной синдрома стафилококкового токсического шока является «токсин синдрома стафилококкового токсического шока».
У Е. coli обнаружено 8 типов токсинов, при этом прослеживается следующая закономерность:
штаммы, продуцирующие LT-энтеротоксин, вызывают холероподобную диарею;
штаммы, продуцирующие ST-энтеротоксин, вызывают более тяжелую диарею;
штаммы, продуцирующие шигеллоподобный токсин, вызывают дизентерие-подобное заболевание.
Клиническая картина заболеваний не во всех случаях зависит от типа токсина, который продуцирует конкретный штамм. Дифтерийный токсин обнаружен у С. diphtheriae, С. ulcerans, С. pseudotuberculosis, шигеллезный — у S. dysenteriae, S. flexneri, E. coli, V. cholerae, V. parahaemolyticus,
C. jejuni, НАГ-вибрионов. Шигеллоподобный токсин обнаружен у многих штаммов холерного вибриона, хотя они в основном вызывают холеру.
Эндотоксины. Характеристика:
Липополисахаридные комплексы КС, главным образом Грам– бактерий, освобождаются только после гибели бактерий. Существенной частью эндотоксина считается липид А, однако токсические свойства эндотоксина определяются всей молекулой ЛПС, поскольку один липид А менее токсичен, чем молекула ЛПС в целом. Образование эндотоксинов присуще энтеробактериям, бруцеллам, риккетсиям, чумной палочке.
Менее токсичны, чем экзотоксины.
Неспецифичны: в сыворотке крови переболевших людей и при иммунизации животных различными ЛПС обнаруживаются антитела низкой специфичности и наблюдается сходная клиническая картина.
Действуют быстро.
Являются гаптенами или слабыми антигенами, обладают слабой иммуногенностью. Сыворотка животного, иммунизированного эндотоксином, обладает слабой антитоксической активностью и не нейтрализует эндотоксин.
Термостабильны, не инактивируются температурой, при нагревании активность эндотоксина повышается.
Не инактивируются химически (не переходят в анатоксины при обработке формалином).
Сравнительная характеристика бактериальных токсинов приведена в табл. 42.
Существуют физиологические механизмы поступления очень небольших (порядка нанограммов) количеств эндотоксина в кровоток. Всасываясь в толстом кишечнике и поступая в печень, большая часть эндотоксина в норме элиминируется фагоцитами, но часть проникает в системный кровоток, вызывая ряд физиологических эффектов.
При поступлении в кровь малых доз эндотоксина наблюдается:
стимуляция фагоцитоза, повышение резистентности организма;
увеличение температуры тела в результате действия токсина на клетки крови (гранулоциты, моноциты), из которых выделяются эндогенные пирогены (ИЛ1), действующие на гипоталамические терморегуляционные центры;
активация комплемента по альтернативному пути;
поликлональная стимуляция и пролиферация В-лимфоцитов, синтез Ig M;
реализация противоопухолевого иммунитета (секреция ФНО);
активация противовирусной защиты.
Таблица 42
ГРУППЫ ХИМИОПРЕПАРАТОВ
Существуют следующие группы химиопрепаратов:
Сульфаниламиды — более 100 производных сульфаниловой кислоты были открыты и используются с 30-х гг. XX в. Среди них различают препараты короткого (стрептоцид, этазол, норсульфазол, сульфацил, сульфадимезин), среднего (сульфазин) и длительного (сульфапиридазин, сульфамонометоксин, сульфадиметоксин, сульфален) действия.
Механизм действия — антиметаболический: сульфаниламиды являются структурными аналогами парааминобензойной кислоты (ПАБК), ингибируют ее превращение в дигидрофолат. Таким образом, они нарушают синтез фолиевой кислоты, необходимой для синтеза нуклеиновых кислот и аминокислот. Эффект разных препаратов проявляется на разных стадиях метаболического пути.
Сульфаниламиды обладают бактериостатическим действием в отношении большинства клинически значимых Грам+ и Грам– бактерий. Они применяются местно (в растворах, мазях, аэрозолях) для лечения ожоговых ран, воспалительных заболеваний глотки и полости рта (например, аэрозоль «Ингалипт» — комбинированный препарат стрептоцида и норсульфазола) и для общего лечения гнойной инфекции и инфекций мочевыводящих путей (в таблетках и инъекционных формах). Однако активность сульфаниламидов подавляется гноем, который богат аминокислотами и пуринами, что связано с распадом белков и нуклеиновых кислот. Продукты этого распада способствуют инактивации препаратов данной группы.
Роль сульфаниламидов в последнее время значительно снизилась в результате распространения резистентных к ним штаммов и появления мощных антибиотиков. Резистентность к сульфаниламидам связана с появлением в результате мутаций новых ферментов, нечувствительных к действию ингибиторов. Гены, кодирующие новые ферменты, локализуются на плазмидах или входят в состав транспозонов, что обеспечивает быстрое внутри- и межвидовое распространение резистентности. Между отдельными сульфаниламидами, как правило, отмечается практически полная перекрестная резистентность.
Комбинированным препаратом, который продолжает широко использоваться для лечения некоторых инфекций, является ко-тримоксазол (бисептол), в состав которого, помимо сульфаметоксазола, входит триметоприм (диаминопиримидин, аналог дигидрофолиевой кислоты). Триметоприм, являясь ингибитором фермента дигидрофолатредуктазы, блокирует превращения дигидрофолата в тетрагидрофолат. Триметоприм в 20–100 раз активнее сульфаметоксазола, а их совместное действие является синергидным.
Использование ко-тримоксазола дает хороший эффект при инфекциях мочевыводящих путей, бронхитах и пневмонии, вызванной Pneumocystis carinii. Его также применяют при шигеллезе, сальмонеллезе, брюшном тифе, менингококковой, стрептококковой, стафилококковой инфекциях.
Среди побочных эффектов сульфаниламидов отмечаются: аллергические реакции (эритема, синдромы Стивенса–Джонсона, Лайела), гематотоксичность (гематолитическая анемия, тромбоцитопения), гепатотоксичность.
Нитрофурановые препараты (нитрофурантоин (фурадонин), нифуроксазид, нифурател, фуразидин, фурацилин, фуразолидон, фурагин, фурамаг и др.).
Механизм действия: взаимодействие с НАДН2-дегидрогеназой мезосом бактерий. Являясь акцепторами кислорода, нитрофураны нарушают процесс клеточного дыхания бактерий, ингибируют биосинтез нуклеиновых кислот.
В зависимости от концентрации оказывают бактериостатическое или бактерицидное действие.
Нитрофураны активны в отношении многих Грам+ и некоторых Грам– бактерий, а также грибов, простейших, риккетсий. Резистентны к нитрофуранам Pseudomonas spp., Proteus spp., значительная часть штаммов Enterobacter spp. и Klebsiella spp. Частота приобретенной резистентности к нитрофуранам среди чувствительных микроорганизмов невысокая. Препараты данной группы нетоксичны, не раздражают слизистые оболочки, применяются в виде водных и спиртовых растворов для обработки ран, промывания полостей (фурацилин), в мазях и аэрозолях («Лифузоль»), в таблетках (фуразолидон, фурадонин, фурамаг) для лечения мочеполовых и кишечных инфекций. Фурамаг — комплексное соединение фурагина и карбоната магния, отличается высокой биодоступностью. По отношению к стафилококкам действует сильнее всех нитрофуранов, к некоторым Грам– бактериям — сильнее антибиотиков.
Среди побочных эффектов нитрофуранов отмечаются: гепатотоксичность, нейротоксичность, диспептические расстройства.
Производные 8 - оксихинолина (хинозол, энтеросептол, мексаза, мексаформ, хлорхинальдол, интестопан, нитроксолин (5-НОК), налидиксовая (неграм, невиграмон) кислота, пипемидиевая кислота (палин)) являются нефторированными хинолонами. Они обладают антибактериальной (умеренно активны в отношении Грам– бактерий при отсутствии значимой активности в отношении Грам+), противопаразитарной и противогpибковой активностью. Действуют цидно.
Механизм действия: образование комплексных соединений с ионами металлов и устранение их стимулирующего влияния на активность ферментов микроорганизмов.
При длительном применении эти препараты могут вызывать побочные явления: периферические невриты, миелопатии и поражения зрительного нерва, нарушения функций печени и почек. В связи с этим производные 8-оксихино-лина противопоказаны детям с поражениями периферической нервной системы, патологией глаз. Они не назначаются новорожденным и, особенно, недоношенным детям. Энтеросептол и мексаформ содержат йод, поэтому противопоказаны больным с повышенной чувствительностью к йодсодержащим лекарственным средствам.
8-Оксихинолины применяют для лечения мочеполовых и кишечных инфекций, вызванных Грам– бактериями, в большинстве случаев патогенной кишечной палочкой. Резистентность к 8-оксихинолинам формируется медленно.
Производные хиноксалин - 1, 4 - диоксида (хиноксидин, диоксидин) — противомикробные препараты «глубокого» резерва.
Механизм действия: вызывают структурные изменения в ЦП микроорганизмов и нарушают синтез бактериальной ДНК. Хиноксалины обладают широким спектром действия в отношении Грам+ и Грам– бактерий и оказывают бактерицидное действие. Они эффективны против штаммов бактерий, резистентных к действию других химиопрепаратов, но высокотоксичны, поэтомy используются для лечения тяжелых гнойно-воспалительных процессов только у взрослых. Активность хиноксалинов усиливается в анаэробной среде.
Производные парааминосалициловой кислоты (ПАСК) и гидразидизоникотиновой кислоты (ГИНК) получены синтетическим путем.
Механизм действия: блокируют синтез миколовой кислоты. Активны в отношении некоторых штаммов микобактерий.
Препараты тяжелых металлов: мышьяка, висмута, сурьмы и ртути (бийохинол, бисмоверол, моно- и дихлорид ртути и др.).
Механизм действия: образование нерастворимых соединений металлов с сульфгидрильными группами белков микроорганизмов, а также нарушение синтеза тимина и гуанина. Активны в отношении спирохет и простейших. Резистентность к препаратам тяжелых металлов формируется медленно.
Нитроимидазолы (производные ароматических соединений имидазола): метронидазол, трихопол, метрагил, тинидазол, орнидазол, секнидазол.
Механизм действия: повреждение ДНК, вызываемое высокоактивными радикалами, высвобождающимися при восстановлении нитрогруппы препарата. Действие метронидазола зависит от ферментов анаэробного метаболизма, модифицирующих его структуру в активную форму. Аэробные микроорганизмы естественно резистентны к метронидазолу, т. к. не могут превратить его в активную форму.
Применяются для лечения протозойных инвазий (трихомониаза, лямблиоза, амебиаза) и инфекций, вызванных анаэробными бактериями, за исключением Actinomyces spp. и Propionibacterium spp. Резистентность анаэробов к метронидазолу встречается редко.
Метронидазол легко преодолевает ГЭБ и эффективен при лечении абсцессов мозга. Он является альтернативой ванкомицину при борьбе с C. difficile.
Противогрибковые препараты: антибиотики полиеновой группы (нистатин, леворин, амфотерицин В), производные имидазола (клотримазол (канестен), миконазол, кетоконазол (низорал)) и других азолов (инраконазол (оругал), флуконазол (дифлюкан)).
Механизмы действия имидазолов:
ингибируют биосинтез стеролов, что приводит к повреждению наружной клеточной мембраны грибов и повышению ее проницаемости;
ингибируют синтез триглицеридов, фосфолипидов;
уменьшают активность ферментов, тормозящих образование свободных радикалов, что приводит к внутриклеточному накоплению перекиси водорода и повреждению клеточных органелл;
угнетают синтез нуклеиновых кислот в ядрах грибковых клеток.
Имидазолы хорошо проникают во все биологические среды и ткани организма. Их используют системно при лечении кандидоза и глубоких микозов. При комбинации имидазолов с полиеновыми антибиотиками наблюдается аддитивный эффект.
Противовирусные препараты: аналоги нуклеозидов (ацикловир, ганцикловир, видарабин, идоксуридин, рибавирин, ламивудин, антиретровирусные препараты), озетальмивир, производные амантадина (амантадин, ремантадин), интерфероны и индукторы интерферонов (цилоферон, неовир, арбидол).
Механизмы действия аналогов нуклеозидов: ингибирование репликации вирусов путем блокирования ферментов, участвующих в биосинтезе вирусных нуклеиновых кислот. Для уменьшения токсического действия препаратов их используют в виде пролекарств (протоксинов), которые в вирусинфицированных клетках превращаются в токсины благодаря действию вирусспецифических ферментов.
Озетальмивир (тамифлю) — эффективный и селективный ингибитор нейраминидазы вирусов гриппа А и В — фермента, катализирующего процесс высвобождения вновь образованных вирусных частиц из инфицированных клеток, их проникновения в клетки эпителия дыхательных путей и дальнейшего распространения по организму.
Механизмы действия производных амантадина: препятствуют депротеинизации вирионов и поступлению вирусной нуклеиновой кислоты в клетку-мишень. Эффективны вначале заболевания при инфицировании некоторыми штаммами вирусов гриппа А.
Механизмы противовирусного действия интерферонов: подавление трансляции вирусных РНК в клетках. Действие интерферонов универсально либо за счет активации латентной рибонуклеазы, которая разрушает и-РНК, либо за счет запрета пролонгации полипептидной цепочки и ингибирования синтеза вирусных белков.
Механизмы противовирусного действия индукторов интерферонов: стимулируют в организме образование собственного эндогенного интерферона.
В связи с высокой токсичностью противовирусных препаратов этиотропная терапия при большинстве вирусных инфекций отсутствует. Противовирусные препараты применяются для лечения гриппа, герпеса, ВИЧ-инфекции, вирусных гепатитов.
Противоопухолевые препараты: антибиотики (антрациклины (даунорубицин), флеомицины (блеомицин), актиномицины (дактиномицин)), алкилирующие агенты (митомицин, новэмбихин, хлорбутин, миелосан), антиметаболиты (метотрексат, фторурацил), растительные алкалоиды (винбластин, винкристин) ингибируют синтез нуклеиновых кислот и рост опухолевых клеток. Они обладают высокой антимитотической активностью при низкой избирательности действия, поэтому высокотоксичны, обладают иммуносупрессивным действием.
Противопаразитарные (антипротозойные и антигельминтные) препараты блокируют различные этапы жизенного цикла паразитов.
Например, нитрогруппа метронидазола восстанавливается внутриклеточными транспортными протеинами последних, взаимодействует с ДНК простейших и ингибирует синтез нуклеиновых кислот. Метронидазол используют для лечения трихомониаза и амебиаза.
Мебендазол вызывает необратимое нарушение утилизации глюкозы, истощает запасы гликогена в тканях гельминтов, а также тормозит синтез АТФ. Мебендазол используют для лечения энтеробиоза.
Антибиотики.
АНТИБИОТИКИ
Антибиотики (от греч. anti — против, bios — жизнь) — химиопрепараты биологического (преимущественно микробного), полусинтетического или синтетического происхождения, которые в малых концентрациях подавляют развитие или вызывают гибель чувствительных к ним микроорганизмов и опухолевых клеток во внутренней среде животного организма.
Высокая специфичность антибиотиков и их отличие от антисептиков определяются мишенями действия. Мишени действия антибиотиков являются уникальными для прокариот и отсутствуют у эукариот. Благодаря этому препараты этой группы отличаются значительной терапевтической широтой — разницей между концентрациями, оказывающими антибактериальное действие, и концентрациями, проявляющими токсические эффекты на организм человека.
Требования к антибиотикам
К антибиотикам предъявляют следующие требования:
Высокая селективность действия (избирательное подавление микроорганизмов обеспечивается различием строения клеток прокариот и эукариот).
Высокая активность, т. е. действие в малых дозах.
Наличие спектра действия (перечня чувствительных к данному препарату видов микроорганизмов). При установленной этиологии заболевания и известной чувствительности штамма микроорганизма используются препараты узкого спектра действия. При эмпирической антибиотикотерапии предпочтение отдается антибиотикам широкого спектра действия.
Химиотерапевтический индекс больше 3. Он определяется по следующей формуле:
| ХТИ = | максимальная переносимая доза (Dmt-doses maxima toleranta) |
| минимальная лечебная доза (Dmc-doses minims curativa) |
ХТИ определяет токсичность препарата: чем ХТИ выше, тем менее токсичен препарат.
Хорошая растворимость в нормальных и патологических жидкостях организма, хорошая всасываемость, действие в очаге воспаления при слабокислых значениях рН. Относительно медленное выведение из организма (период полужизни).
Отсутствие повреждающего, в т. ч. токсического действия на организм хозяина.
Отсутствие связывания с белками макроорганизма.
Отсутствие кумуляции в организме.
Медленная селекция резистентных к ним форм микроорганизмов.
Стабильность при хранении, невысокая стоимость препаратов.
Классификация
Выделяют следующие виды антибиотиков:
1. По антимикробному спектру действия:
суперузкого спектра — на 1 вид бактерий;
узкого — на 1–2 вида бактерий;
широкого — на несколько видов бактерий;
суперширокого — на бактерии, гельминты, грибы и простейших.
2. По происхождению:
микробного происхождения: из бактерий — грамицидин, полимиксин; из грибов — пенициллин; из актиномицетов — стрептомицин;
растительного происхождения: из высших растений — фитонциды, из семян редиса — рафанин, из чеснока — аллизин;
животного происхождения — лизоцим, эритрин, эмолин;
полусинтетические и синтетические.
Вначале использовались антибиотики биологического происхождения — продукты жизнедеятельности живых организмов. Путем химической модификации антибиотиков биологического происхождения были получены полусинтетические антибиотики, обладающие новыми ценными свойствами: кислото- и ферментоустойчивостью, расширенным спектром антимикробного действия, лучшим распределением в тканях и жидкостях организма, меньшим числом побочных эффектов. Когда была расшифрована химическая структура антибиотиков, некоторые из них выгоднее стало получать синтетическим путем.
3. По типу действия:
бактериостатические (левомицетин, тетрациклины, линкозамиды, макролиды). Они ингибируют синтез белков и предотвращают размножение бактерий, но не вызывают их гибели. Бактериостатические антибиотики неэффективны у иммунокомпроментированных организмов;
бактерицидные (пенициллины, цефалоспорины, аминогликозиды, рифампицин, полипептиды). Они уничтожают микроорганизмы, нарушая проницаемость ЦПМ или ингибируя синтез РНК.
Для характеристики типа действия препарата определяют его минимальную ингибирующую концентрацию (МИК) и минимальную бактерицидную концентрацию (МБК). Препарат является бактерицидным, если МБК равна МИК или превышает ее.
4. По направленности действия:
противобактериальные;
противопротозойные;
противоопухолевые.
Противобактериальные антибиотики по спектру противомикробного действия разделяются на следующие:
действующие преимущественно на кокки (стафилококки, стрептококки, менингококки, гонококки) и некоторые Грам+ палочки (коринебактерии, клостридии): бензилпенициллин, бициллины, феноксиметилпенициллин, пенициллиназоустойчивые пенициллины (оксациллин, метициллин), цефалоспорины I поколения, макролиды, ванкомицин, линкомицин;
широкого спектра действия, активные в отношении Грам+ и Грам– палочек: хлорамфеникол, тетрациклины, аминогликозиды, полусинтетические пенициллины широкого спектра действия (ампициллин, азлоциллин) и цефалоспорины II поколения;
с преимущественной активностью в отношении Грам– палочек: полимиксины, цефалоспорины III поколения;
противотуберкулезные (стрептомицин, рифампицин, флоримицин);
противогрибковые (нистатин, леворин, гризеофульвин, амфотерицин В).
5. По химическому строению:
b -Лактамные антибиотики ( b-лактамы) — азотсодержащие гетероциклические соединения с b-лактамным кольцом. Они блокируют синтез пенициллинсвязывающих белков, входящих в состав КС бактерий. Действуют бактерицидно на размножающиеся бактерии. Между отдельными представителями группы b-лактамов существуют значительные различия в уровне и спектре антибиотической активности.
Пенициллины — активной молекулой является 6-аминопенициллиновая кислота. Первым был получен бензилпеннициллин из гриба Penicillum natatum (продуцировал 20 ед/мл пенициллина). Сейчас отобраны штаммы грибов, продуцирующие более 25 000 ед/мл пенициллина.
В зависимости от спектра антимикробного действия выделяют 6 поколений пенициллинов (табл. 44).
Цефалоспорины — большая группа естественных (получены из грибка цефалоспорум) и полусинтетических антибиотиков, производных аминоцефалоспориновой кислоты. В зависимости от спектра антимикробного действия выделяют 4 поколения цефалоспоринов (табл. 45).
Монобактамы (азтреонам). Активны только в отношении аэробных Грам– бактерий (по уровню активности соответствует цефалоспоринам III поколения), резистентны к b-лактамазам.
Карбапенемы (имипенем (тиенам), меропенем) обладают наиболее широким спектром антибактериальной активности из всех известных антибиотиков, в т. ч. в отношении штаммов, резистентных к пенициллинам, цефалоспоринам и аминогликозидам. Являются антибиотиками резерва при тяжелых полирезистентных нозокомиальных инфекциях, не поддающихся лечению препаратами других групп.
Таблица 44
Поколение
Препараты
Активны в отношении
Неактивны
в отношении
Отношение к b -лактамазам
и другие особенности
 Второе
Второе
Окончание табл. 45
|
Поколение |
Препараты |
Активны в отношении | Неактивны | Отношение к b -лактамазам | |
| пероральные | парентеральные | ||||
| Цефодизим Цефиксим Цефтизоксим Цефпирамид | |||||
 Четвертое Четвертое
| – | Цефепим (максипим) Цефпиром (кейтен) | В отношении Грам+ бактерий, особенно стафилококков, более активны, чем III поколение, но менее активны, чем I поколение. Более активны против резистентных Грам– бактерий, чем III поколение. Высоко активны в отношении P. aeruginosa. На B. fra - gilis не действуют, но активны в отношении Грам+ анаэробов | Некоторых штаммов | Более устойчивы к действию хромосомных β -лактамаз. Частично разрушаются плазмидными β -лак-тамазами расширенного спектра |
Устойчивы к плазмидным b-лактамазам широкого спектра Грам– бактерий, но разрушаются хромосомными и плазмидными b-лактамазами расширенного спектра Грам– бактерий.
Аминогликозиды имеют в своей структуре аминоспирт и аминосахар. Препараты I поколения получены из актиномицетов рода Streptomyces.
Аминогликозиды — антибиотики широкого спектра действия. Они оказывают бактерицидное действие независимо от фазы размножения микроорганизмов, в т. ч. и на микроорганизмы, находящиеся в фазе покоя.
Механизм действия: подавление синтеза белка путем необратимого связывания с 30S-субъединицей бактериальных рибосом. Гентамицин также может воздействовать на синтез белка, нарушая функции 50S-субъединицы рибосомы. В зависимости от спектра антимикробного действия выделяют 3 поколения аминогликозидов (табл. 46).
Таблица 46
Сравнительная характеристика внехромосомных факторов наследственности
| Плазмиды | IS-последовательности | Транспозоны | ||
| Величина генома (число пар нуклеотидов) | ||||
| 2000–600 000 | 1000 | 2000–25 000 | ||
| Способность к самостоятельной репликации |
||||
Последнее изменение этой страницы: 2019-04-09; Просмотров: 455; Нарушение авторского права страницы