
|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |

|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |
|
Расход | |||||||||
| № | Вещество | G т/час | V м3/с | % | № | Вещество | G т/час | V м3/с | % |
| 1 | Метан | 257.14 | 100 | 100 | 1 | Углерод | 102.02 | 39.7 | |
| 2 | Водород | 31.2 | 561.2 | 12.6 | |||||
| 3 | Метан | 92.6 | 208.9 | 36 | |||||
| Потери | |||||||||
| 4 | Метан | 25.7 | 10 | 10 | |||||
| 5 | Водород | 3.5 | 63 | 0.9 | |||||
| 6 | Углерод | 2.08 | 0.81 | ||||||
| Итого: | 257.14 | 100 | Итого: | 257.1 | 100 | ||||
13. Определяем нормальный молярный тепловой эффект реакции:
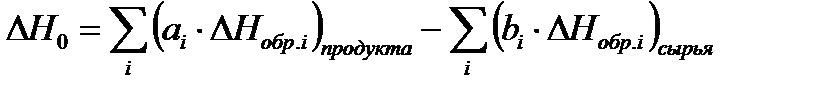
∆ H 0 = 1 * 0 + 2 * 0 - 1 * ( - 75) = 75 Кдж / пробег;
14. Определяем молярные и удельные теплоемкости сырья и продуктов:
C 0 CH =18+61*300/1000= 36 дж/(моль*град) = 2 Кдж /(кг*град );
CtCH =18+61*1700/1000= 120 дж/(моль*град) = 7 Кдж/(кг*град );
CtC = 17+ 4*1700/1000 = 24 дж/(моль*град) = 2 Кдж /(кг*град );
CtH = 27+ 3*1700/1000 = 32 дж/(моль*град) = 16 Кдж /(кг*град );
15. Определяем изменение температуры:
∆ T = Tp – T 0 = 1700 – 300 = 1400;
16. Определяем изменение теплоемкости:
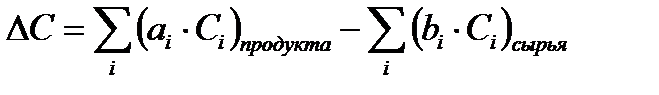
∆ C = 1 * 24 + 2 * 32 – 1 * 36 =24 +64–36 =+ 52 дж / (моль*град );
17. Определяем молярный тепловой эффект при температуре реакции:
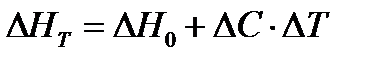
∆ HT = 75000 + 1400 * 52 = 150 Кдж / пробег; Следовательно - Реакция эндотермическая, т.е. идет с поглощением тепла и запись этого вклада в таблицу теплового баланса осуществляется в части «Расход».
18. Определяем химический эквивалент реакции:
Q хр = ∆ HT ∙ G / μ = 150 * 28.34 / 12 = 354 Мвт;
Примечание: При решении задачи по расчету материального баланса и температурного режима химической реакции работа на этом и завершается.
19. Определим энтальпии (теплосодержание) сырья и продуктов:
Примечание: Энтальпия или теплосодержание рассчитывается, как произведение массового расхода рассматриваемого реагента на его теплоемкость при температуре реагента и абсолютную температуру.
HCH 4 = G ∙ C ∙ T = 257.14 * 2 * 300 / 3.6 = 43 Мвт;
HCH 4невст = G ∙ C ∙ T = 92.6 * 7 * 1700 / 3.6 = 306 Мвт;
HC = G ∙ C ∙ T = 102.02 * 2 * 1700 / 3.6 = 96 Мвт;
HH = G ∙ C ∙ T = 31.2 *16 *1700 / 3.6 = 236 Мвт;
HCH 4потери = G ∙ C ∙ T = 25.7 * 2 * 300 / 3.6 = 4.3Мвт;
HC потери = G ∙ C ∙ T = 2.08 * 2 * 1700/ 3.6 = 2 Мвт;
HH потери = G ∙ C ∙ T = 3.5 * 16* 1700/ 3.6 = 26 Мвт.
Заполним таблицу теплового баланса:
Таблица 7.2.3
Тепловой баланс химического процесса
| Приход | Расход | ||||||
| № | Вещество | Теплота Мвт | % | № | Вещество | Теплота Мвт | % |
| 1 | Метан | 43 | 4 | 1 | Углерод | 96 | 8.5 |
| 2 | Водород | 236 | 21 | ||||
| 3 | Метан | 306 | 27 | ||||
| Потери | |||||||
| 4 | Метан | 4.3 | 0.4 | ||||
| 5 | Водород | 26 | 2.3 | ||||
| 6 | Углерод | 2 | 0.2 | ||||
| 7 | Хим.эквив. | 354 | 31 | ||||
| 8 | Теплов.пот. | 102 | 9 | ||||
| 2 | Теплоноситель | 1083 | 96 | ||||
| Итого: | 1126 | 100 | Итого: | 1126 | 100 | ||
14. Определим массовый расход теплоносителя:
Qтн = Gтн ∙ rs
Gтн = Qтн / rs = 1083 Мвт /1000Кдж/кг
1083 кг / с = 3900 тонн в час.
21 . Скорректируем таблицу материального баланса:
Таблица7.2.4
Материальный баланс химического процесса
Приход
Расход
Задача 7.2.4. При бомбардировке альфа-частицами ядер изотопа бора-11 образуются нейтроны. Написать уравнение соответствующей ядерной реакции. Какой изотоп образуется в результате этой реакции.
Решение: Зарядовые Z и массовые A числа альфа-частицы, изотопа бора-11 и нейтрона соответственно равны: Zα = 2; ZB = 5; Zn = 0; Aα = 4; AB = 11; An = 1.
С учетом обозначения химических элементов можно написать:
5 B 11 + 2 He 4 = X + 0 n 1 ,
где X - изотоп неизвестного элемента.
Так как суммарные зарядовые и массовые числа в отдельности до и после ядерной реакции остаются неизменными, то согласно законам сохранения электрического заряда и барионного числа для неизвестного изотопа X после несложного подсчета получаем Z = 7 и A = 14.
Таким образом, ядерная реакция имеет вид:
5 B 11 + 2 He 4 = 7 N 14 + 0 n 1 .
В результате этой ядерной реакции образуется изотоп азот – 14.
Задача 7.2.5. За какое время распадется 20% атомов радиоактивного изотопа, если его период полураспада равен 4 суткам?
Решение: Из закона радиоактивного распада: N = N 0 ∙ e -λ t определим время распада t; для чего сделаем следующие простые преобразования (логарифмирование):
N / N 0 = e -λ t →N 0 / N = e λ t →ln ( N 0 / N ) = λ∙ t → t =( ln ( N 0 / N )) / λ.
С учетом связи между постоянной распада λ и периодом полураспада Т:
λ = ln 2 / T , находим t = T ∙ ln ( N 0 / N ) / ln 2 .
По условию за время t распадается 20% от начального числа атомов. Следовательно, N =0.8 ∙ N 0 и N 0 / N = 1.25.
Подставляя численные значения в формулу для t , получим:
t = 4 ∙ ln 1.25 / ln 2 = 4 ∙ 0.223 / 0.693 = 1.29 суток = 30 час 55 мин.
Задача 7.2.6. Какова кинетическая энергия α_частиц, вылетающих в результате распада 86 Rn 222 →84 Po 218 +2 He 4
Решение: В результате α_распада ядер более тяжелые обычно покоятся, а α_частицы вылетают из ядер и обладают значительной кинетической энергией.
В процессах распада полная кинетическая энергия частиц сохраняется.
Е10 = Е20 + Еα0 + Екин
Поэтому кинетическая энергия α_частиц равна:
Екинα = Е10 – Е20 - Еα0
или
Екин = (М10 –М20 - мα0) ∙ с2,
где Е10 = М10 ∙ с2 _ энергия покоя распадающегося ядра,
М10 _ масса покоя распадающегося ядра,
Е20 = М20 ∙ с2 _ энергия покоя получившегося ядра,
М20 _ масса покоя получившегося ядра,
Еα0 _ энергия покоя α_частицы,
мα0 _ масса покоя α_частицы.
Представляя массы покоя частиц в килограммах и умножая на квадрат скорости света, получим кинетическую энергию α_частиц в джоулях.
Но в таблицах обычно указываются массы элементов в атомных единицах массы, а энергия в ядерной физике определяется в мегаэлектрон-вольтах (МэВ = 106 эВ = 1,6.10-13 Дж).
В этих единицах с2 = 9.1016 м2/с2 = 931 МэВ/а.е.м.
Тогда кинетическая энергия α_частиц, выражаемая в мегаэлектронвольтах, равна
Екин = (М10 – М20 - мα0) . 931.
7.3. Задачи для самостоятельного решения
7.3.1. Написать недостающее обозначение в реакции окисления железа с образованием ржавчины: 4 Fe + … = 2 Fe 2 O 3 . С каким веществом при этом вступает в реакцию железо?
7.3.2. Написать недостающую химическую формулу вещества в реакции: 8 Al + 3 Fe 3 O 4 = 4 Al 2 O 3 + … . Какое вещество образуется в результате данной химической реакции?
7.3.3. Написать недостающее обозначение в реакции получения серной кислоты: SO 3 + … = H 2 SO 4 . С каким веществом вступает в реакцию серный ангидрид?
7.3.4. Написать недостающую химическую формулу вещества в реакции: Fe 2 O 3 + 3 CO = 2 Fe + … . Какое вещество образуется в результате химической реакции восстановления железа?
7.3.5. Определите число протонов и нейтронов, входящих в состав двух изотопов углерода: 1) 6 C 14 , 2) 6 C 15 и двух изотопов магния: 12 Mg 24 , 12 Mg 25.
7.3.6. Во сколько раз радиус ядра урана 92 U 238 больше радиуса ядра протона?
7.3.7. Какова плотность ядерного вещества, выраженная числом нуклонов в 1 см3 и в кг/м3 ? Считать, что в ядре с массовым числом А все нуклоны плотно упакованы в сферическом объеме.
7.3.8. Составить материальный баланс процесса и рассчитать тепловой режим реактора ( Q хр ), если процесс характеризуется химической реакцией: Fe 2 O 3 + CO = Fe + CO 2 . Расход оксида железа – 172,8 тонн в сутки; Степень превращения СО= 90%; Потери Fe2O3 = 10%; Температура сырья = 300К; Температура реакции = 6270С;
Таблица 7.3.1
Теплофизические данные
| Вещество | Теплота образования | Ср = а + в*Т | |
| А | в*103 | ||
| Fe2O3 | -800 | 100 | 70 |
| CO | -100 | 30 | 4 |
| Fe | 0 | 10 | 20 |
| CO2 | -400 | 40 | 10 |
| Кдж/моль | Дж / (моль* град) | ||
Атомные массы: железо=56, кислород=16, углерод=12.
7.3.9. Составить материальный и тепловой балансы процесса:
СН4 + О2 = СО + Н2 .
Производительность по Н2 – 86.4тонн в сутки
Степень превращения СН4 – 80%;
Температура сырья =300К;
Температура реакции =4270С;
Таблица 7.3.1
Теплофизические данные
| Вещество | Теплота образования | Ср = а + в*Т | |
| а | в*103 | ||
| СН4 | -70 | 20 | 60 |
| CO | -100 | 30 | 4 |
| О2 | 0 | 30 | 3 |
| Н2 | 0 | 30 | 3 |
| Кдж/моль | Дж / (моль* град) | ||
Атомные массы: С- 12; Н-1; О-16
7.3.10. Составить материальный и тепловой балансы процесса:
SO 2 + O 2 = SO 3
Расход двуокиси серы = 2520 м3 в час. Степень превращения O2 = 90%; Температура сырья = 300К; Температура реакции = 4270С;
Таблица 7.3.1
Теплофизические данные
| Вещество | Теплота образования | Ср = а + в*Т | |
| а | в*103 | ||
| SO2 | -300 | 40 | 10 |
| O2 | 0 | 30 | 3 |
| SO3 | -400 | 60 | 30 |
| Кдж/моль | Дж / (моль* град) | ||
Атомные массы: серы =32,кислорода=16.
7.3.11. Составить материальный баланс процесса. Рассчитать тепловой режим реактора (Qр). NH 3 + O 2 = N 2 O + H 2 O . Расход аммиака -9488 м3/час. Потери NH3 = 10%; Температура сырья = 300К; Температура реакции = 7270С;
Таблица 7.3.1
Теплофизические данные
| Вещество | Теплота образования | Ср = а + в*Т | |
| а | в*103 | ||
| N2O | 80 | 50 | 10 |
| H2O | -200 | 30 | 10 |
| NH3 | -50 | 30 | 30 |
| O2 | 0 | 30 | 3 |
| Кдж/моль | Дж / (моль* град) | ||
Атомные массы: водорода =1, азота=14, кислорода=16.
7.3.12. Составить материальный баланс процесса. Рассчитать тепловой режим реактора . С2Н5ОН = С4Н6 +Н2О +Н2 , Производительность по Н2 - 268800м3/час; Степень превращения - 50%; Температура сырья = 300К; Температура реакции = 2270С;
Таблица 7.3.1
Теплофизические данные
| Вещество | Теплота образования | Ср = а + в*Т | |
| а | в*103 | ||
| С2Н5ОН | -200 | 20 | 200 |
| H2 | 0 | 30 | 3 |
| С4Н6 | 100 | -3 | 300 |
| Н2О | -200 | 30 | 10 |
| Кдж/моль | Дж / (моль* град) | ||
Атомные массы: водорода = 1, углерода =12, кислорода - 16.
7.3.13. Составить материальный и тепловой балансы процесса:
HNO 2 = HNO 3 + NO + H 2 O ; Производительность по NO – 16129 м3/час; Степень превращения - 80%; Температура сырья = 300К; Температура реакции = 8270С;
Таблица 7.3.1
Теплофизические данные
| Вещество | Теплота образования | Ср = а + в*Т + с / Т2 | ||
| а | в*103 | с*10-5 | ||
| NO | 90 | 30 | 4 | - |
| H2O | -200 | 30 | 10 | - |
| HNO2 | -100 | 30 | 2 | - |
| HNO3 | -300 | 30 | 3 | - |
| Кдж/моль | Дж / (моль* град) | |||
Атомные массы: водорода =1, азота = 14, кислорода=16.
7.3.14. Определите энергию связи ядра атома гелия 2 He 4 , если масса изотопа 2 He 4 равна 4.00388 а.е.м., масса протона mp = 1.00814 а.е.м., масса нейтрона mn = 1.00899 а.е.м.
7.3.15. Определите энергию связи, приходящуюся на один нуклон в ядре атома бериллия 4 Be 9 , если масса изотопа бериллия 4 Be 9 равна 9.01505 а.е.м.
7.3.16. Найти энергию, освобождающуюся при ядерной реакции: 3 Li 7 + 1 H 1 → 2 He 4 + 2 He 4 , если масса изотопа 3 Li 7 равна 7.01823 а.е.м.
7.3.17. Определите энергию, выделяющуюся при термоядерной реакции: 1 H 2 + 2 He 3 → 1 H 1 + 2 He 4, если масса изотопа 2 He 3 равна 3.01699 а.е.м.
7.3.18. Сколько атомов радона распадается за 1 сутки из 106 атомов?
7.3.19. Найти постоянную распада радона, если известно, что число атомов радона уменьшается за 1 сутки на 18.2%.
7.3.20 _ 7.3.24. Дописать ядерную реакцию и определить кинетическую энергию частиц, вылетающих в результате распада:
1) 23090 Th → 22688 Ra +?
2) 14 7 N + 42 He → 178 O +?
3) 226 88 Ra → ? + 42 He
4) 234 92 U → 23090 Th
5) 14 7 N + 21 H → ? + 4 2 He
7.3.25. При бомбардировке изотопа 7 N 14 нейтронами получается изотоп 6C14, который оказывается бета-радиоактивным. Написать уравнение обоих реакций.
8. Симметрия и законы сохранения (макроскопические процессы)
Общие сведения
Для макроскопических процессов, таких как, гидромеханических, тепловых, массообменных используют одно или несколько уравнений материального баланса. Рассмотрим подобные уравнения для ряда таких процессов.
Отстаивание используется для разделения жидких и газовых неоднородных систем, которые состоят из двух фаз. Известны четыре фазовых состояния: твердое, жидкое, газообразное и плазменное. В качестве неоднородных систем можно назвать: суспензию, эмульсию: дым, пену, туман. Подобные системы имеют место в промышленном производстве и в быту.
Суспензия – это неоднородная система состоящая из внутренней фазы в виде твердых частиц и внешней фазы в виде жидкости
Эмульсия – это неоднородная система состоящая из внутренней фазы в виде жидкости и внешней фазы в виде другой жидкости.
Пена - это неоднородная система состоящая из внутренней фазы в виде газа и внешней фазы в виде жидкости.
Туман - это неоднородная система состоящая из внутренней фазы в виде жидкости и внешней фазы в виде газа.
Пыль, дым – это неоднородная система состоящая из внутренней фазы в виде твердых частиц и внешней фазы в виде газа .
Очень часто возникает необходимость в разделении таких неоднородных систем. Такая неоднородная система как суспензии состоит из твердой распределенной фазы и жидкой - сплошной фазы. Для разделения подобных жидких неоднородных систем применяют фильтрование и осаждение с использованием потенциального поля сил. Потоки вещества, возникающие при отстаивании, изображены на рис. 8.1:
исходная суспензия, GF , bF
осветленная жидкость, GО , bО
Отстаивание
сгущенная суспензия, GC , bC
Рис.8.1. Функциональная схема отстаивания.
Введем следующие обозначения: GF , GO , GC - расходы, соответственно исходной суспензии, осветленной жидкости, сгущенной суспензии, (кг/с); bF, bO, bC - концентрации твердого вещества соответственно исходной смеси, осветленной жидкости, сгущенной суспензии, %. Тогда можно записать два уравнения материального баланса:
Первое уравнение - баланс по потокам - GF = GO + GC ,
второе уравнение - баланс по твердому веществу -
GF ´ bF GO ´ bO GC ´ bC
¾¾¾¾ = ¾¾¾¾ + ¾¾¾¾ .
100 100 100
Уравнения материального баланса идентичны для всех процессов разделения неоднородных систем таких, как отстаивание, гравитационное и инерционное разделение, фильтрование, центрифугирование, магнитная сепарация и электроочистка.
Выпаривание - тепловой процесс, предназначенный для повышения концентрации растворов твердых веществ, pаствоpов солей, щелочей. При выпаривании под действием тепловой энергии вода (растворитель) превращается в пар, благодаря чему концентрация раствора повышается. Выпаривание проходит при температуре кипения растворителя, а испарение - при любой температуре. Потоки, имеющие место при выпаривании, представлены на рис.8.2. Введем следующие обозначения: G1, G2 -расходы соответственно исходного и упаренного растворов, в кг/с; W-расход вторичного пара, в кг/с; Х1, Х2 - концентрация твердого вещества в исходном и упаренном растворах, % (массовые).
упаренная влага, W
исходный раствор
Выпаривание упаренный раствор,
G1 , X1 G2 , X 2
Рис.8.2. Функциональная схема выпаривания.
Тогда уравнения материального баланса для выпаривания будут иметь вид:
G1 = G2 + W - по потокам
G1 ´ X1 / 100= G2 ´ X2 / 100 - по твердому веществу.
Абсорбция - массообменный процесс, заключающийся в поглощении газов или паров жидкими поглотителями - абсорбентами. Данный процесс широко используется для чистки, разделения газов, при рекуперации растворителей.
Потоки, имеющие место при абсорбции, показаны на рис.8.3.
Очищенный газ,
Gk , Yk
исходная смесь газов, GН,YН
Абсорбция
Абсорбент, L н , Хн Абсорбент, L к , Х к
Рис.8.3. Функциональная схема абсорбции.
Введем следующие обозначения: LН, LК;GН, GK-расходы соответственно поглотителя и газовой смеси, кг/с. Xн, Xк -концентрации поглощаемого компонента соответственно в исходном (чистом) абсорбенте и загрязненном поглотителе или на входе в аппарат и на выходе из аппарата, % (масс.). Yн, Yк - концентрация поглощаемого компонента соответственно в исходной и уходящей газовой смеси, % (массовые). Тогда уравнение материального баланса будет иметь вид :
Gн + Lн = Gк + Lк,
Gн ´ Yн + Lн ´ Xн= Gк ´ Yк+ Lк ´ Xк .
При Gн=Gк=G и Lн=Lк=L , что возможно при переходе между фазами незначительного количества вещества, из системы уравнений после преобразований остается только одно уравнение:
G (Yн - Yк) = L (Xк - Xн).
Данное уравнение представляет собой баланс по поглощаемому компоненту.
Ректификация - массообменный процесс, заключающийся в разделении гомогенных жидких смесей или сжиженных газов перегонкой в результате противоточного взаимодействия паровой и жидкой фаз. Потоки, имеющие место при непрерывной ректификации показаны на рис.8.4.
Исходная смесь, Ректификат, GD , ХD
Ректификация ( РК)
GF , XF Кубовый остаток, GW , ХW
Рис.8.4. Функциональная схема ректификации.
Введем обозначения: РК - ректификационная колонна, GF, GD, GW - соответственно расходы исходной смеси, ректификата, кубового остатка, кг/с; XF, XD, XW - концентрации легколетучего компонента соответственно в исходной смеси, ректификате, кубовом остатке, % (массовые). Тогда уравнения материального баланса имеют вид:
Первое уравнение - баланс по потокам - G F =G D +G W ,
второе уравнение - баланс по легколетучему компоненту,
G F ´ X F =G D ´ X D +G W ´ X W .
Сушка - тепло-массообменный процесс, предназначенный для снижения влажности материалов путем подвода тепла нагретым газом (воздухом). Воздух является тепловлагоносителем. Потоки, имеющие место при конвективной сушке (КС), показаны на рис.8.5.
влажный материал, Gн , bН
воздух,
вентиляторнагревание сушка
Х0 X0 =Х1 W + L, X2
воздух,L, Xо
высушенный материал, Gк , bК.
Рис. 8.5. Процесс конвективной сушки.
Воздух вентилятором подается в калорифер (теплообменник), нагревается и поступает в сушилку, куда входит влажный материал в количестве Gн, с влажностью bН. После сушилки получаем высушенный материал в количестве Gк, с влажностью bК. Воздух перед сушилкой имеет влагосодержание X1, а после сушилки - Х2. При нагревании воздуха в калорифере влагосодержание не меняется, т.е. X1 =X2. Под влагосодержанием X понимают количество пара (жидкости) в кг, приходящегося на 1кг абсолютно сухого газа (воздуха). Тогда уравнения материального баланса имеют вид:
GН = GК + W ),
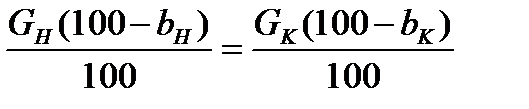
где: W - расход испаряемой влаги, в кг/с. Первое уравнение выражает баланс по потокам, второе - баланс по по твердому веществу. Для газовой фазы (воздуха) можно записать уравнение материального баланса по влаге:
L X 1 - W = L X2 ,
откуда расход абсолютно сухого воздуха, L, в кг/с равен:
L = W / ( X2 - X1 ) .
Теплообмен – это процессы, связанные с передачей энергии в виде тепла, которые сопровождаются, либо изменением температуры, либо изменением агрегатного состояния, либо совершением работы. При этих процессах тепло передается от одного тела (горячий теплоноситель) другому (холодный теплоноситель). К тепловым процессам относят: нагревание, охлаждение, испарение, конденсация, плавление, затвердевание, выпаривание, получение искусственного холода. Передача тепла от одного тела к другому происходит посредством теплопроводности, конвекции и излучением.
Для протекания процесса передачи тепла необходимо наличие некоторой разности температур между горячим и холодным теплоносителями – движущей силы процесса теплопередачи – температурного напора.
Процесс теплообмена описывается уравнением теплопередачи:
Q = k ∆ t ср S τ ,
где Q – количества тепла, k – коэффициент теплопередачи, ∆ t ср – средняя разность температур, S – поверхность теплообмена, τ – время, Q / τ – тепловая нагрузка или мощность.
Количество тепла, передаваемое в единицу времени от одного тела к другому, называется тепловым потоком (Дж/с, Вт).
При теплообмене между теплоносителями происходит уменьшение энтальпии (теплосодержания) горячего теплоносителя увеличение энтальпии холодного теплоносителя.
Количество теплоты, передаваемое от горячего теплоносителя холодному составляет Q г и называется тепловой нагрузкой:
Q г = G(I1 – I2) =g(i2 – i1) +Q п = Q х + Q п
Обычно в теплообменниках Q п ≈2-3% от тепловой нагрузки.
Теплосодержание ( I , i )определяется как произведение теплоемкости на температуру, причем произведение количества теплоносителя на теплоемкость называется водяным эквивалентом ( W , w ):
I=C T , i= c t , W = G C, w = g c.
Q г = G C ( T н – T к ) = W ∆T;
Q х = g c ( t к – t н ) = w ∆t;
Температура холодного теплоносителя в процессе теплообмена увеличивается, т.е. t к > t н ;
Температура горячего теплоносителя в процессе теплообмена уменьшается, т.е. T н > T к ; T > t .
Эти изменения отражаются на температурной диаграмме рис.8.6. Обозначение теплообменника на функциональной схеме изображено на рис.8.7.
Рис.8.6. Температурная диаграмма теплообмена
Рис. 8.7. Типовая схема теплообменника
При фазовом переходе величины I 1 , I 2 в уравнении теплового баланса представляют собой энтальпии поступающей фазы и уходящей другой фазы вещества, что предполагает, по крайней мере, изменение агрегатного состояния. Изменения агрегатного состояния происходит при постоянной температуре, но, однако, требует подвода или отвода теплоты фазового перехода.
В процессе теплообмена горячие и холодные теплоносители могут двигаться по-разному: прямотоком, противотоком и перекрестным током. С особенностями взаимного движения теплоносителей связана эффективность теплообмена.
Эффективность теплообмена определяется средней разностью температур между холодным и горячим теплоносителями.
∆ t ср = (∆ t б + ∆ t м ) / 2 если ∆ t б / ∆ t м ≤2;
∆ t ср =(∆ t б - ∆ t м ) / ln (∆ t б / ∆ t м ) если ∆ t б / ∆ t м > 2.
Методика решения комбинированной задачи расчета макроскопического процесса:
1. Согласно содержания задачи составляется функциональная схема типового процесса. При этом на схему наносятся все исходные данные задания;
2. Составляются уравнения материального и энергетического(теплового) баланса;
3. Отображается температурная диаграмма теплового процесса и определяется средняя движущая сила процесса – разность температур горячего и холодного теплоносителей.
4. Рассчитываются массовые и тепловые потоки и определяется поверхность теплообмена.
5. Определяется, если возможно, оптимальный вариант.
6. В конце выполненной работы следует привести ответы на поставленные вопросы данной задачи, в той размерности, какая требуется
Примеры решения задач
Задача 1. Исходная суспензия направляется в отстойник непрерывного действия. Концентрация твердой фазы в исходной суспензии – Хн , % ; в осветленной жидкости – Х0 , % ; в сгущенной суспензии – Хк , % . Расход исходной суспензии – G н , т/час. Осветленная жидкость нагревается от t н , 0С до t к , 0С. В качестве теплоносителя используется горячая вода с начальной температурой t ’ н , 0С и с конечной температурой t ’ к , 0С. Теплоемкость осветленной жидкости – С1 , КДж / ( кг 0К ); теплоемкость горячей воды - С2 , КДж / ( кг 0К ). Определить расход теплоносителя , кг / час и поверхность теплообмена S , м2 для прямотока и противотока.
| Вариант | Хн | Х0 | Хк | Gн | tн | tк | t’н | t’к | С1 | С2 | К |
| 2-1 | 14 | 2 | 32 | 5 | 10 | 80 | 95 | 30 | 5,0 | 4,5 | 0,75 |
Решение: Составляем структурную схему процесса.
| Осаждение |
| G н X н t н |
| G к X к |
| G о X о t н |
| G тн t ’ н |
| G о tк |
| G тн t ’ к |
Составляем уравнения материального и теплового баланса.
G н = G к + Go
G н X н = G к X к + Go X о
Q х = Go C1 (t к - t н ); Q г = G тн C2 (t’ н – t’ к )
Q х = Q г = Q ; Q = К Δ t ср S
Рисуем температурную диаграмму процесса.
| 100 |
| 50 |
| начало |
| конец |
Возможен только один режим противотока. (оптимизация невозможна)
Δtб = t’к - tн = 30 – 10 = 20 ; Δtм = t’н - tк = 95 – 80 = 15;
Δtб / Δtм = 20 / 15 = 1.33 < 2; Следовательно Δtср = 17.5.
Осуществляем расчеты: 5 = G к + Go ; 5 · 14 = G к · 32 + Go · 2.
Следовательно, Go = 3 т/час, G к = 2 т/час.
Q х = Go C1 (t к - t н ) = 3 · 5 · 70 / 3.6 = 291.7 квт
G тн = Q г / (C2 (t’ н – t’ к )) = 291.7 / ( 4.5 · 65 ) · 3600 = 3600 кг / час
S = Q / (К Δ t ср ) = 22.2 м2.
8.3. Задачи для самостоятельного решения
8.3. 1. Исходный раствор азотнокислого аммония концентрацией Хн % подается на выпаривание, предварительно нагреваясь в теплообменнике от начальной температуры t н 0С до конечной – t к 0С. В качестве теплоносителя используется насыщенный водяной пар с параметрами ts(температура конденсации, 0С ), rs (удельная теплота конденсации, КДж/кг ). Конечная концентрация раствора после выпаривания – Хк % ; расход испаряемой влаги при выпаривании – W т/час . Определить поверхность теплообмена S , м2; расход теплоносителя для прямотока и противотока, кг/час, если коэффициент теплопередачи равен К, Вт/(м2 0К); теплоемкость раствора – Ср, Дж/(кг 0К).
| Вариант Задания | Хн | Хк | tн | tk | ts | rs | K | W | Cp |
| 1-1 | 20 | 45 | 15 | 130 | 143 | 2141 | 170 | 5 | 3000 |
| 1-2 | 18 | 45 | 20 | 130 | 143 | 2141 | 160 | 10 | 3500 |
| 1-3 | 25 | 40 | 16 | 120 | 151 | 2117 | 150 | 8 | 4000 |
| 1-4 | 15 | 40 | 21 | 120 | 133 | 2171 | 140 | 12 | 4100 |
| 1-5 | 16 | 42 | 17 | 122 | 158 | 2095 | 130 | 14 | 3200 |
| 1-6 | 17 | 42 | 22 | 125 | 151 | 2117 | 120 | 15 | 3400 |
| 1-7 | 18 | 43 | 18 | 124 | 133 | 2171 | 110 | 20 | 3600 |
| 1-8 | 19 | 43 | 23 | 124 | 151 | 2117 | 100 | 9 | 3800 |
| 1-9 | 22 | 44 | 19 | 120 | 133 | 2171 | 110 | 13 | 3400 |
| 1-10 | 23 | 44 | 25 | 120 | 133 | 2171 | 120 | 16 | 3600 |
| 1-11 | 17 | 42 | 14 | 110 | 140 | 2100 | 135 | 7 | 4200 |
| 1-12 | 19 | 41 | 22 | 115 | 135 | 2000 | 145 | 8 | 4000 |
8.3.2. Исходная суспензия направляется в отстойник непрерывного действия. Концентрация твердой фазы в исходной суспензии – Хн , % ; в осветленной жидкости – Х0 , % ; в сгущенной суспензии – Хк , % . Расход исходной суспензии – Gн , т/час. Осветленная жидкость нагревается от tн , 0С до tк , 0С. В качестве теплоносителя используется горячая вода с начальной температурой t’н , 0С и с конечной температурой t’к , 0С. Теплоемкость осветленной жидкости – С1 , КДж / ( кг 0К ); теплоемкость горячей воды - С2 , КДж / ( кг 0К ). Определить расход теплоносителя , кг / час и поверхность теплообмена S, м2 для прямотока и противотока, если коэффициент теплопередачи равен К, Квт/(м2 0К);
| Вариант задания | Хн | Х0 | Хк | Gн | tн | tк | t’н | t’к | С1 | С2 | К |
| 2-1 | 15 | 2 | 30 | 5 | 10 | 80 | 95 | 30 | 5,0 | 4,5 | 0,75 |
| 2-2 | 12 | 1,5 | 25 | 10 | 12 | 85 | 96 | 40 | 4,2 | 5,1 | 0,8 |
| 2-3 | 10 | 1,2 | 26 | 15 | 14 | 90 | 97 | 50 | 6,0 | 5,0 | 0,6 |
| 2-4 | 8 | 2,0 | 30 | 20 | 16 | 90 | 96 | 40 | 5,2 | 4,5 | 0,5 |
| 2-5 | 12 | 2,0 | 35 | 25 | 18 | 80 | 95 | 50 | 6,0 | 4,8 | 0,3 |
| 2-6 | 10 | 2,0 | 32 | 22 | 20 | 90 | 97 | 30 | 3,8 | 4,2 | 0,1 |
| 2-7 | 13 | 1,8 | 27 | 30 | 16 | 85 | 97 | 40 | 3,8 | 4,2 | 0,2 |
| 2-8 | 12 | 1,2 | 30 | 2,5 | 10 | 87 | 95 | 38 | 4,0 | 4,3 | 0,4 |
| 2-9 | 8 | 1,8 | 32 | 7,0 | 12 | 90 | 96 | 35 | 4,3 | 5,0 | 0,3 |
| 2-10 | 12 | 1,5 | 30 | 6,0 | 15 | 85 | 95 | 30 | 4,4 | 5,2 | 0,5 |
| 2-11 | 11 | 1,0 | 40 | 40 | 10 | 90 | 96 | 30 | 6,0 | 4,0 | 1,0 |
| 2-12 | 9 | 1,4 | 36 | 33 | 13 | 88 | 93 | 44 | 5,5 | 4,4 | 0,8 |
8.3.3. В абсорбер подается V м3 / час газа, содержащего Y н % аммиака. В качестве абсорбента используется вода, которая содержит аммиака X н %. После абсорбции содержание аммиака в газе Y к %; а в воде X к %. Вода подаваемая в абсорбер, предварительно охлаждается от t н , 0С до t к , 0С. В качестве хладагента используется оборотная холодная вода, начальная температура которой – t ’ н , 0С, а конечная - t ’ к , 0С . Теплоемкость воды (абсорбента ) - С1, Дж/ (кг 0К ) ; теплоемкость оборотной воды – С2, КДж/ (кг 0К ). Определить поверхность теплообмена S , м2; расход оборотной холодной воды в кг / час для прямотока и противотока, если коэффициент теплопередачи равен К, Квт / ( м2 0К ), а плотность исходного газа ρ = 1,3 кг / м3.
| Вариант задания | Ун | Ук | V | Xн | Xк | tн | tк | t’ н | t’ к | С1 | С2 | К |
| 3-1 | 5.0 | 1.5 | 3000 | 0.2 | 1.2 | 95 | 20 | 8 | 45 | 3000 | 4.0 | 0.06 |
| 3-2 | 6.0 | 1.2 | 2000 | 0.3 | 1.8 | 85 | 15 | 10 | 50 | 3100 | 3.2 | 0.08 |
| 3-3 | 7.0 | 2.0 | 2500 | 0.4 | 2.3 | 70 | 18 | 12 | 45 | 3200 | 3.5 | 0.09 |
| 3-4 | 4.0 | 1.0 | 1500 | 0.2 | 1.3 | 90 | 20 | 15 | 55 | 3500 | 4.5 | 0.10 |
| 3-5 | 4.5 | 1.3 | 1800 | 0.15 | 1.5 | 95 | 20 | 20 | 47 | 3400 | 4.1 | 0.15 |
| 3-6 | 5.5 | 1.4 | 1600 | 0.18 | 1.4 | 75 | 25 | 19 | 58 | 3300 | 3.3 | 0.20 |
| 3-7 | 4.8 | 1.7 | 1700 | 0 | 1.6 | 80 | 19 | 19 | 55 | 4000 | 3.4 | 0.30 |
| 3-8 | 5.2 | 0.8 | 2200 | 0 | 1.7 | 83 | 23 | 18 | 60 | 3400 | 4.5 | 0.40 |
| 3-9 | 5.7 | 1.0 | 2400 | 0.25 | 2.1 | 78 | 22 | 25 | 65 | 2800 | 3.0 | 0.25 |
| 3-10 | 7.2 | 1.5 | 2600 | 0.5 | 2.0 | 90 | 22 | 22 | 62 | 3000 | 4.0 | 0.18 |
| 3-11 | 6.8 | 1.1 | 2700 | 0.35 | 1.9 | 99 | 33 | 22 | 77 | 2700 | 3.5 | 0.25 |
| 3-12 | 6.9 | 1.3 | 2700 | 0.33 | 1.8 | 88 | 44 | 33 | 77 | 2500 | 3.0 | 0.15 |
8.3.4. В ректификационной колонне непрерывного действия происходит разделение смеси метиловый спирт-вода. Концентрация исходной смеси по метиловому спирту – Х f , %; концентрация кубового остатка по воде – Х* w, %. Концентрация ректификата по метиловому спирту – Х D , %. Расход исходной смеси Gf , т/час. После разделения ректификат охлаждается от начальной температуры t н , оС до конечной температуры t к , оС . В качестве хладагента используется оборотная вода с начальной температурой – t * н , оС и конечной – t * к , оС. Теплоемкость ректификата – С1, кдж/(кг . оК); оборотной воды – С2, дж/(кг . оК). определить поверхность теплообмена S , (м2), расход оборотной воды в кг/час для прямотока и противотока, если коэффициент теплопередачи – К, квт/(м2 . оК).
| Вариант | Gf | Xf | XD | X*W | tн | tк | t*н | t*к | C1 | C2 | К |
| 4-1 | 5,0 | 20 | 97 | 98 | 78 | 30 | 20 | 65 | 4,21 | 3800 | 1,0 |
| 4-2 | 5,5 | 22 | 96 | 97 | 79 | 35 | 25 | 65 | 4,30 | 3750 | 1,1 |
| 4-3 | 6,0 | 24 | 97 | 98 | 78 | 31 | 21 | 66 | 4,25 | 3700 | 1,05 |
| 4-4 | 6,5 | 26 | 95 | 97 | 79 | 32 | 22 | 66 | 4,22 | 3650 | 1,15 |
| 4-5 | 7,0 | 28 | 96 | 98 | 78 | 33 | 23 | 67 | 4,23 | 3600 | 1,20 |
| 4-6 | 7,5 | 23 | 95 | 97 | 79 | 34 | 24 | 65 | 4,24 | 3850 | 1,25 |
| 4-7 | 8,0 | 21 | 97 | 98 | 78 | 30 | 25 | 66 | 4,26 | 3900 | 1,30 |
| 4-8 | 8,5 | 25 | 96 | 97 | 79 | 31 | 24 | 67 | 4,27 | 3900 | 1,35 |
| 4-9 | 9,0 | 27 | 95 | 98 | 78 | 32 | 23 | 65 | 4,28 | 3950 | 1,40 |
| 4-10 | 9,5 | 30 | 97 | 97 | 79 | 33 | 22 | 66 | 4,29 | 4000 | 1,45 |
| 4-11 | 10,0 | 28 | 94 | 94 | 74 | 24 | 14 | 74 | 4,00 | 3000 | 1,4 |
| 4-12 | 10,0 | 25 | 95 | 95 | 75 | 25 | 25 | 75 | 4,05 | 3500 | 1,5 |
8.3.5. В отстойник непрерывного действия подается исходная суспензия. Концентрация твердого вещества в исходной суспензии – Хн,%; в осветленной жидкости – Хо, %; в сгущенной суспензии – Хк, %. Расход сгущенной суспензии – G сс , т/час. Исходная суспензия перед подачей в отстойник охлаждается холодной водой от начальной температуры – t н , оС до конечной - t к , оС. Начальная и конечная температуры холодной воды: t ’ н и t ’ к , в оС. Теплоемкость исходной суспензии – С1, в кДж/(кг . оС), теплоемкость холодной воды – С2, в дж/(кг . оК). коэффициент теплопередачи К, в квт/(м2 . оК), определить расход теплоносителя в кг/час, поверхность теплообмена для прямотока и противотока.
| Вариант задания | Gс.с | Хн | Хо | Хк | tн | tк | t*к | t*к | К | С1 | С2 |
| 5-1 | 5,0 | 8,0 | 2,0 | 20 | 95 | 30 | 8 | 40 | 0,8 | 1,0 | 4200 |
| 5-2 | 6,0 | 10 | 2,5 | 22 | 90 | 31 | 9 | 45 | 0,9 | 1,1 | 4000 |
| 5-3 | 7,0 | 11 | 1,8 | 21 | 85 | 32 | 10 | 40 | 1,1 | 1,2 | 4100 |
| 5-4 | 8,0 | 9,0 | 1,9 | 23 | 80 | 33 | 11 | 41 | 1,2 | 1,3 | 4200 |
| 5-5 | 9,0 | 12 | 2,1 | 24 | 94 | 34 | 12 | 42 | 1,3 | 1,4 | 4250 |
| 5-6 | 4,0 | 13 | 2,2 | 25 | 93 | 35 | 8 | 43 | 1,4 | 1,5 | 4150 |
| 5-7 | 3,0 | 14 | 2,3 | 27 | 92 | 36 | 9 | 44 | 1,5 | 1,6 | 4250 |
| 5-8 | 2,0 | 10 | 2,4 | 28 | 91 | 37 | 10 | 39 | 0,7 | 1,5 | 4300 |
| 5-9 | 1,0 | 9,0 | 2,5 | 26 | 88 | 38 | 11 | 40 | 0,6 | 1,3 | 4000 |
| 5-10 | 10.0 | 8,0 | 2,4 | 29 | 84 | 40 | 12 | 42 | 0,5 | 1,2 | 4100 |
| 5-11 | 5,0 | 11 | 3,0 | 30 | 93 | 33 | 13 | 43 | 0,3 | 1,3 | 4300 |
| 5-12 | 9,0 | 12 | 2,0 | 42 | 82 | 22 | 12 | 52 | 0,2 | 1,2 | 3200 |
8.3.6. Исходная суспензия направляется на разделение в отстойник непрерывного действия. Начальная концентрация твердой фазы в суспензии Хн , %; в осветленной жидкости Хо , %; в сгущенной суспензии Хк , %. Расход исходной суспензии G н , т/час. Сгущенная суспензия нагревается от начальной температуры – t н , оС до конечной t к , оС. В качестве теплоносителя используется насыщенный водяной пар с параметрами ts и rs, где: ts - температура конденсации пара, оС; rs – теплота конденсации, кдж/кг. Определить расход теплоносителя, кг/час и поверхность теплообмена для прямотока и противотока, если коэффициент теплопередачи равен К, квт/(м2 . оК), С1 – теплоемкость сгущенной суспензии, дж/(кг . оК).
| Вариант задания | Gн | Хн | Хо | Хк | tн | tк | ts | rs | С1 | К |
| 6-1 | 25 | 8 | 1,5 | 20 | 15 | 175 | 183 | 2009 | 1000 | 1,0 |
| 6-2 | 24 | 9 | 1,5 | 25 | 20 | 180 | 187 | 1995 | 1100 | 1,1 |
| 6-3 | 23 | 10 | 1,7 | 22 | 18 | 140 | 158 | 2095 | 1200 | 1,2 |
| 6-4 | 22 | 11 | 1,8 | 23 | 16 | 160 | 175 | 2040 | 1300 | 1,3 |
| 6-5 | 21 | 12 | 1,9 | 24 | 17 | 130 | 151 | 2117 | 1000 | 1,4 |
| 6-6 | 20 | 13 | 2,0 | 26 | 19 | 120 | 143 | 2141 | 1100 | 1,5 |
| 6-7 | 26 | 14 | 1,9 | 27 | 19 | 175 | 183 | 2009 | 1200 | 1,6 |
| 6-8 | 27 | 15 | 1,8 | 28 | 18 | 180 | 187 | 2009 | 1300 | 0,07 |
| 6-9 | 28 | 16 | 1,7 | 29 | 17 | 175 | 158 | 2095 | 1400 | 0,08 |
| 6-10 | 29 | 17 | 1,6 | 30 | 16 | 140 | 175 | 2040 | 1500 | 0,09 |
| 6-11 | 31 | 11 | 1,1 | 31 | 11 | 111 | 191 | 2111 | 1111 | 1,1 |
| 6-12 | 22 | 12 | 1,2 | 42 | 22 | 92 | 122 | 2200 | 1200 | 1,2 |
8.3.7. Исходная суспензия направляется в отстойник непрерывного действия, концентрация твердой фазы в исходной суспензии- хн, % ; в осветленной жидкости - хо, % ; в сгущенной суспензии - хк, % . Расход сгущенной суспензии- G сс, т/час. Исходная суспензия нагревается от начальной температуры t н, о С до конечной t к, о С; г s - температура конденсации пара, кДж/кг. Определить расход теплоносителя, кг/час; поверхность теплообмена для прямотока и противотока, если известно, что теплоемкость исходной смеси – С1, дж/(кг.0К) ; коэффициент теплопередачи равен К, кВт/(м2 .0К).
| Вариант задания | Хн | Х0 | Хк | Gcc | tн | tк | ts | rs | C1 | К |
| 7-1 | 12 | 2,0 | 30 | 3,0 | 20 | 95 | 104 | 2249 | 4500 | 0,8 |
| 7-2 | 11 | 1,5 | 32 | 4,0 | 21 | 96 | 109 | 2237 | 4600 | 0,7 |
| 7-3 | 10 | 1,4 | 34 | 5,0 | 22 | 94 | 113 | 2227 | 4700 | 0,6 |
| 7-4 | 9 | 1,3 | 32 | 6,0 | 23 | 93 | 116 | 2217 | 4400 | 0,5 |
| 7-5 | 8 | 1,2 | 28 | 7,0 | 24 | 92 | 120 | 2208 | 4300 | 0,4 |
| 7-6 | 7 | 1,1 | 34 | 6,0 | 25 | 91 | 133 | 2171 | 4200 | 0,85 |
| 7-7 | 10 | 2,1 | 30 | 5,0 | 18 | 90 | 100 | 2260 | 4100 | 0,75 |
| 7-8 | 11 | 2,2 | 28 | 4,0 | 19 | 88 | 105 | 2248 | 4000 | 0,65 |
| 7-9 | 12 | 2,3 | 28 | 3,5 | 17 | 90 | 110 | 2234 | 3900 | 0,55 |
| 7-10 | 9 | 2,2 | 30 | 4,5 | 16 | 92 | 115 | 2221 | 3800 | 0,45 |
8.3.8.В конвективную сушилку направляется Gf , т/час влажного материала с начальной влажностью - b н , % . Воздух, направляемый в сушилку, нагревается от начальной температуры t н 0 С до конечной t к, оС. Расход воздуха, покидающего сушилку вместе с испаряемой влагой, равен G к , т/час. Теплоемкость нагреваемого воздуха –Св кДж/(кг.оК). Воздух нагревается насыщенным водяным паром с параметрами ts и rs , где: ts- температура конденсации пара, оС; rs-теплота конденсации пара, кДж/кг. Коэффициент теплопередачи равен К, Вт/(м2. оК). Найти поверхность теплообмена, расход пара в кг/час для условий прямотока и противотока, если известно, что: G к = G в + W, где G в- расход воздуха, поступающего в сушилку, т/час; W-расход влаги, удаляемой из материала в сушилке, т/час.
| Вариант задания | Gк | bн | bк | Gf | tн | tk | ts | rs | Св | К |
| 8-1 | 7,0 | 15 | 0,8 | 5,0 | -20 | 100 | 151 | 2117 | 4,2 | 750 |
| 8-2 | 6,5 | 16 | 0,7 | 5,5 | -15 | 95 | 143 | 2141 | 4,3 | 800 |
| 8-3 | 8,0 | 17 | 0,9 | 6,0 | -12 | 95 | 151 | 2117 | 4,4 | 850 |
| 8-4 | 8,5 | 18 | 1,0 | 6,5 | -10 | 110 | 158 | 2095 | 4,5 | 900 |
| 8-5 | 9,0 | 19 | 1,1 | 7,0 | -8 | 115 | 133 | 2171 | 4,6 | 700 |
| 8-6 | 10 | 20 | 1,2 | 7,5 | -9 | 110 | 151 | 2117 | 4,7 | 650 |
| 8-7 | 9,5 | 21 | 1,3 | 8,0 | -5 | 95 | 143 | 2141 | 4,8 | 600 |
| 8-8 | 11 | 22 | 1,4 | 8,5 | -2 | 100 | 143 | 2141 | 4,9 | 550 |
| 8-9 | 12 | 23 | 1,5 | 9,0 | -25 | 110 | 143 | 2141 | 5,0 | 500 |
| 8-10 | 10 | 24 | 1,6 | 8,0 | -30 | 115 | 151 | 2117 | 4,1 | 450 |
8.3.9.Исходный раствор NaOH концентрацией – хн, %.подается на выпаривание. Концентрация упаренного раствора – хк, %. Расход испаряемой влаги при выпаривании – W , кг/час. Упаренный, сконцентрированный раствор охлаждается в теплообменнике рассолом. Начальная температура рассола –t н , оС ; конечная – t к . оС. Сконцентрированный раствор входит с начальной температурой t `н оС и уходит с конечной – t `к, оС . Найти расход рассола в кг/час, поверхность теплообмена для прямотока и противотока, если коэффициент теплопередачи- К, кВт/(м2. 0К); теплоемкость раствора NaOH – С1,дж/(кг.оК); теплоемкость рассола- С2, кДж/(кг.оК).
| Вариант задания | Хн | Хк | W | tн | tk | tн* | tk* | C1 | C2 | К |
| 9-1 | 10 | 40 | 400 | -5 | 10 | 80 | 10 | 2800 | 4,0 | 0,7 |
| 9-2 | 11 | 41 | 500 | -6 | 11 | 90 | 12 | 2700 | 4,2 | 0,8 |
| 9-3 | 12 | 38 | 600 | -7 | 12 | 100 | 13 | 2600 | 4,4 | 0,6 |
| 9-4 | 13 | 39 | 700 | -8 | 13 | 85 | 11 | 2500 | 4,6 | 0,5 |
| 9-5 | 14 | 42 | 800 | -9 | 14 | 95 | 14 | 2900 | 4,8 | 0,4 |
| 9-6 | 15 | 43 | 900 | -10 | 11 | 105 | 15 | 3000 | 4,1 | 0,3 |
| 9-7 | 16 | 44 | 1000 | -12 | 12 | 75 | 18 | 3100 | 4,3 | 0,2 |
| 9-8 | 12 | 45 | 300 | -14 | 13 | 70 | 17 | 3200 | 4,5 | 0,1 |
| 9-9 | 14 | 42 | 1100 | -15 | 14 | 84 | 16 | 3300 | 4,7 | 0,05 |
| 9-10 | 15 | 41 | 1200 | -10 | 11 | 78 | 15 | 3400 | 4,0 | 0,25 |
8.3.10. В абсорбер подается газ, содержащий – Y н , % аммиака. В качестве абсорбента используется вода, которая содержит аммиака – Хк, % ; После абсорбции в воде аммиака будет– ХК, , а в газе-Ук. Воздух после абсорбции нагревается от начальной температуры t к , 0С до конечной до t к , оС. В качестве теплоносителя используется горячая вода с начальной температурой – t н `, оС ; конечной – t к `, оС. Известен расход поглотителя L , т/час. Определить расход горячей воды в кг/час, поверхность теплообмена для прямотока и противотока, если известны теплоемкость воздуха – С1, дж/(кг.оК); теплоемкость горячей воды- С2, кДж/(кг.оК), коэффициент теплопередачи равен К, кВт/(м2.оК).
| Вариант задания | Yн | Yк | L | Xк | Xн | tн | tк | tн* | tк* | C1 | C2 | К |
| 10-1 | 5,0 | 0,8 | 4,0 | 1,2 | 0,0 | 18 | 70 | 95 | 72 | 2,3 | 3000 | 0,04 |
| 10-2 | 6,0 | 0,7 | 4,5 | 1,0 | 0,1 | 17 | 69 | 96 | 73 | 2,4 | 3100 | 0,05 |
| 10-3 | 5,5 | 0,6 | 5,0 | 1,3 | 0,2 | 16 | 68 | 97 | 75 | 2,5 | 3200 | 0,06 |
| 10-4 | 5,0 | 0,5 | 5,5 | 1,4 | 0,3 | 15 | 67 | 94 | 76 | 2,6 | 3300 | 0,07 |
| 10-5 | 4,5 | 0,7 | 6,0 | 1,5 | 0,1 | 14 | 66 | 93 | 77 | 2,6 | 3400 | 0,08 |
| 10-6 | 4,0 | 0,8 | 6,5 | 1,6 | 0,0 | 13 | 65 | 92 | 78 | 2,7 | 3500 | 0,09 |
| 10-7 | 4,8 | 0,9 | 7,0 | 1,7 | 0,0 | 12 | 64 | 91 | 79 | 2,8 | 3600 | 0,10 |
| 10-8 | 5,2 | 1,0 | 7,5 | 1,8 | 0,2 | 12 | 63 | 90 | 80 | 2,9 | 3700 | 0,11 |
| 10-9 | 6,5 | 1,1 | 8,0 | 1,7 | 0,3 | 15 | 62 | 89 | 78 | 2,8 | 3800 | 0,12 |
| 10-10 | 7,0 | 1,2 | 8,5 | 1,5 | 0,2 | 16 | 61 | 88 | 77 | 3,0 | 3900 | 0,13 |
8.3.11. В абсорбере из газа поглощается СО. Начальная концентрация СО в газе равна Y н ,% ; конечная концентрация – Y к , % . В качестве абсорбента используется моноэтаноламин, начальная концентрация СО в моноэтаноламине - Хн,%; конечная – Хк, % . Расход поглотителя равно L , т/час. Газ, содержащий СО , предварительно охлаждается от начальной температуры – t `н, оС до конечной – t ’ к , оС. В качестве хладагента используется артезианская вода с параметрами: t н , оС и t к , оС. Определить расход холодной воды в кг/час, поверхность теплообмена для прямотока и противотока, если теплоемкость воздуха – С1, дж/(кг.оС) ; теплоемкость артезианской воды- С2, кДж/(кг.оК); коэффициент теплопередачи равняется К, кВт/(м2.оК).
| Вариант задания | Yн | Yк | L | Xк | Xн | tн | tк | tн | tк | C1 | C2 | К |
| 11-1 | 5,0 | 0,8 | 4,0 | 1,2 | 0,0 | 9,0 | 70 | 95 | 72 | 3400 | 3,7 | 0,04 |
| 11-2 | 5,5 | 0,9 | 4,5 | 1,1 | 0,1 | 10 | 69 | 96 | 74 | 3300 | 3.8 | 0.05 |
| 11-3 | 6.0 | 0.7 | 5.5 | 1.3 | 0.2 | 11 | 68 | 97 | 76 | 3200 | 3.9 | 0.06 |
| 11-4 | 6.5 | 0.6 | 5.0 | 1.4 | 0.3 | 12 | 67 | 94 | 78 | 3100 | 4.0 | 0.07 |
| 11-5 | 7.0 | 0.9 | 6.0 | 1.5 | 0.0 | 13 | 66 | 93 | 79 | 2900 | 4.1 | 0.08 |
| 11-6 | 7.5 | 1.0 | 6.5 | 1.6 | 0.1 | 14 | 65 | 92 | 80 | 3000 | 4.2 | 0.09 |
| 11-7 | 8.0 | 1.1 | 7.5 | 1.7 | 0.2 | 15 | 65 | 91 | 81 | 3100 | 4.3 | 0.10 |
| 11-8 | 8.0 | 1.2 | 7.0 | 1.8 | 0.3 | 16 | 66 | 90 | 82 | 2900 | 4.4 | 0.11 |
| 11-9 | 7.0 | 1.3 | 7.5 | 1.9 | 0.1 | 17 | 67 | 89 | 78 | 2800 | 4.5 | 0.12 |
| 11-10 | 6.0 | 1.4 | 8.0 | 1.8 | 0.2 | 18 | 68 | 88 | 75 | 2700 | 4.6 | 0.13 |
9. Особенности биологического уровня организации материи. Генетика и эволюция (биологические процессы)
Общие сведения
Генетика
Генетика – это наука, изучающая закономерности наследственности и изменчивости. Методы генетики: гибридологический, генеалогический, близнецовый, цитогенетический, биохимический, популяционно-статистический и т.д.
Наследственность – это свойство организмов передавать определенные признаки и свойства. Различают ядерную и цитоплазматическуюнаследственность. Носителями ядерной наследственности являются хромосомы ядра, а цитоплазматической – ДНК митохондрий и пластид. Материнская наследственность передается от матери потомкам.
Изменчивость – свойство организмов приобретать новые признаки в течении жизни.
Наследственная изменчивость закрепляется в генотипе и передается потомкам. К ней относят, прежде всего, комбинативную и мутационную изменчивости.
Последнее изменение этой страницы: 2019-04-10; Просмотров: 302; Нарушение авторского права страницы