
|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |

|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |
Лабораторная химическая посуда и приборыСтр 1 из 23Следующая ⇒
Лабораторная химическая посуда и приборы
МАТЕРИАЛы При проведении исследований или экспериментов в лаборатории органического синтеза используется весьма разнообразная химическая посуда, соединительные и запирающие узлы (шланги, пробки, шлифы), различные смазки для создания герметичности, фильтры, тепло- и хладоносители. В настоящее время для изготовления лабораторной посуды, сопутствующей техники для проведения химического эксперимента используется широкий спектр различных материалов. Основными материалами для изготовления химической лабораторной посуды являются стекло, фарфор, пластмасса и др.
СТЕКЛО Основные требования, предъявляемые к лабораторной посуде и изделиям из стекла - это термическая и химическая стойкость. Под химической стойкостью понимают способность стекла противостоять разрушающему действию воды, кислот, щелочей и других химических реагентов. Под термической стойкостью понимают способность стекла выдерживать без разрушения резкие колебания температуры. Твердость и гладкость поверхности облегчает мытье, а прозрачность позволяет следить за ходом химического эксперимента. Химико-лабораторное стекло - стекло, обладающее высокой химической и термической устойчивостью, пригодное для обработки на стеклодувной горелке; применяется в производстве химико-лабораторной посуды, приборов и аппаратов химической промышленности. Стекло отличается высокой химической устойчивостью к большинству органических растворителей, растворам минеральных кислот, за исключением фтороводородной кислоты, а также концентрированных щелочей. По сравнению с другими материалами стекло обладает высокой прозрачностью и сравнительно небольшим коэффициентом линейного расширения. Твердость и гладкость поверхности облегчает мытье, а прозрачность позволяет следить за ходом химического эксперимента. Недостатками стекла являются его хрупкость и невысокая устойчивость к резким изменениям температуры. Свойства стекла существенно зависят от их состава. Водостойкость и кислотоустойчивость, а также термостойкость возрастают с увеличением содержания в них кремнезёма и уменьшением содержания щелочных окислов. Щёлочеустойчивые стекла содержат, как правило, двуокись циркония, окись лантана, двуокись олова. Наиболее устойчивые по отношению ко всем реагентам и термостойкие — кварцевые стекла. Все химико-лабораторные стекла делятся на 4 основные категории: ХУ-1 — химически устойчивые 1-го класса; ХУ-2 — химически устойчивые 2-го класса; ТУ — термически устойчивые; ТУК — термически устойчивые кварцевые стекла. Разработаны также стекла с высокой устойчивостью к щелочам типа ДГ-З. В настоящее время разработаны материалы чрезвычайно широкого универсального диапазона применения. Синтезированы такие качества стекла как жаростойкость, прочность, биоактивность, управляемая электропроводность и т.д. В сочетании с прозрачностью, отражательной способностью, стойкостью к агрессивным средам эти свойства делают стекло универсальным материалом. Различные виды стёкол используется во всех сферах человеческой деятельности от строительства, изобразительного искусства, оптики, медицины до измерительной техники, высоких технологий и космонавтики, авиации и военной техники. Виды стекол Основной недостаток обычных стёкол — хрупкость. Для того чтобы расширить сферу применения стекла, его подвергают закалке (закалённое стекло), создают многослойные композиты (триплекс). Армирование, вопреки распространенному мнению, ослабляет стекло, делает его более хрупким по сравнению с таким же монолитным стеклом. Стеклообразующие вещества: стеклообразующим веществам относятся: SiO2, B2O3, P2O5, TeO2, GeO2, AlF3 и др. В зависимости от основного используемого стеклообразующего вещества, неорганические стекла бывают оксидными (силикатное, кварцевое, германатное, фосфатное, боратное), фторидными, сульфидными и т. д. Базовый метод получения силикатного стекла заключается в плавлении смеси кварцевого песка (SiO2), соды (Na2CO3) и извести (CaO). В результате получается химический комплекс с составом Na2O·CaO·6SiO2. Кварцевое стекло Кварцевое стекло получают плавлением кремнезёмистого сырья высокой чистоты (обычно кварцит, горный хрусталь). Оно состоит только из диоксида SiO2 и является самым термостойким стеклом. Коэффициент его линейного расширения в пределах 0-1000 0С составляет всего 6·10-7. Поэтому раскаленное кварцевое стекло, опущенное в холодную воду, не растрескивается. Температура размягчения кварцевого стекла равна 1250 0С. Полное же плавление кварцевого стекла происходит при температуре 1500-1600 0С. Кварцевое стекло следует тщательно предохранять от различного рода загрязнений, даже таких как жирные пятна от рук. Перед нагреванием его поверхность необходимо протереть от прозрачных следов разбавленной фтороводородной кислотой, а от жирных пятен этанолом или ацетоном. Поверхностные загрязнения могут явиться причиной расстеклования, т. е. перехода из метастабильного стеклообразного состояния в кристаллическое. Такой переход необратим и может привести к быстрому механическому разрушению изделия. Кроме того, расстеклование делает кварцевое стекло непригодным для длительного нагревания при температурах выше 1100 0С. Изделия из кварцевого стекла устойчивы к действию всех кислот за исключением фосфорной (H3PO4) и концентрированной фтороводородной (HF). На них не действует хлор (Cl2) и HCl до 1200 0С, до 250 0С сухой фтор (F2). Водные растворы NaF и H2[SiF6] разрушают кварцевое стекло при нагревании. Кроме того, оно абсолютно непригодно для работы с водными растворами и расплавами гидроксидов щелочных металлов. Даже кратковременный контакт с большинством расплавов хлоридов металлов, щелочных металлов, магнием и алюминием делают невозможным дальнейшее использование изделий. При высокой температуре кварц ведет себя как сильная кислота и взаимодействует не только с основаниями, но и с оксидами металлов. Кварцевое стекло может быть также природного происхождения, образующееся при попадании молнии в залежи кварцевого песка. Этот факт и лежит в основе одной из исторических версий происхождения технологии изготовления стекла.
Стекло марки Викор (Vicor) Стекло марки «викор» содержит около 96 % SiO2 и обладает многими свойствами кварцевого стекла. Получают «викор» обработкой боросиликатного стекла хлороводородной кислотой при нагревании, извлекая бораты щелочных металлов. Остающийся тонкопористый материал подвергают спеканию.
Фарфор Фарфор – белый керамический материал, обладающий водо- и газонепроницаемостью и механической прочностью. Состоит из SiO2 (75 %), Al2O3 (19-21 %), K2O (3-4 %) Термостойкость неглазурированного фарфора составляет 1400-1500 0С. Глазурированный фарфор менее термостоек и его можно применять только до 1200 0С. А при длительном нагревании такого фарфора при температуре 1000 0С глазурь расстекловывается и отслаивается. Фарфор химически устойчив к действию большинства кислот и кислых расплавов, за исключением HF и H3PO4. Хлороводород разъедает фарфор при 800 0С, а выше 1000 0С фарфор разрушается от воздействия хлора. Фарфор постепенно разрушается при контакте с расплавами и концентрированными водными растворами гидроксидов щелочных металлов, кальция и бария. Фарфор применяют для производства тиглей, ступок, чашек, шпателей, стаканов и других лабораторных изделий. Тонкостенные фарфоровые тигли можно вносить непосредственно в пламя газовой горелки, а затем охлаждать до комнатной температуры. Толстостенные фарфоровые изделия следует нагревать и охлаждать с осторожностью. Полимерные материалы Ассортимент полимерных материалов, применяемых в лабораториях органического синтеза, увеличивается с каждым годом. Химическая посуда, изготовленная из полимерных материалов имеет ряд преимуществ перед стеклянной, однако существуют и серьезные недостатки, из-за которых именно стекло остается главным и важнейшим материалом при изготовлении лабораторной химической посуды. Основным преимуществам полимерной посуды перед стеклянной
Фторопласт- 4 (тефлон) Фторпласт-4 (тефлон в США, полифлон в Японии, хостафлон в Германии, флюон в Англии ) – политетрафторэтилен ( – СF2 – CF2 – )n, обладает высокой химической стойкостью. Фторопласт-4 устойчив к действию кипящих фтороводородной, серной, азотной, фосфорной кислот и их смесей. Тефлон также проявляет высокую устойчивость в растворах и расплавах щелочей (KOH, NaOH). Не разрушается фторопласт-4 и под действием кипящих органических растворителей. Такие реагенты как фтор (F2), трихлорид фтор (FCl2), дифторид кислорода (OF2) оказывают заметное влияние только при температуре выше 150 оС. Щелочные металлы и их оксиды легко разрушают полимер при температуре выше 200 оС. Изделия из фторопласта-4 применяют в интервале температур от -190 до +260 оС. Разложение полимера происходит при температуре выше 360 оС. Фторопласт-4 обладает низким коэффициентом трения, хорошими диэлектрическими свойствами, но низкой теплопроводностью. Из фторопласта часто производят химические стаканы, чашки, трубки, шланги, сифоны, пластины для фильтрования.
Фторопласт-3 Фторопласт -3 (дайфло в Японии, кель-F в США) - полихлорфторэтилен (CF 2– CClF)n. Представляет собой прозрачный полимер, уступающий фторопласту-4 по химической и термической устойчивости.Фторопласт-3 начинает разрушаться при температуре выше 200 оС. Изделия из этого полимера можно охлаждать даже жидким азотом, не опасаясь растрескивания. Фторопласт-3 устойчив к действию большинства кислот, растворителей, окислителей, включая фтор (F2). При нагревании в хлорсодержащих органических растворителях (хлороформ, дихлорэтан, дихлорметан, тетрахлорметан), толуоле, диэтиловом эфире фторопласт-3 набухает с увеличением массы примерно на 20 %. Из фторопласта-3 производят в основном мерную посуду.
Полиэтилен Полиэтилен – прозрачный полимер с мономерной единицей ( – CH2 – )n. В настоящее время производится полиэтилен высокого давления (политен, луколен), устойчивый до 100 оС, и полиэтилен низкого давления (хостален), сохраняющий свою прочность до 120 оС. В сосудах из полиэтилена низкого давления можно кипятить воду. Однако такие изделия очень плохо переносят охлаждения до низких температур. Так, ниже -30 оС, изделия из полиэтилена становятся твердыми, как стекло. Следует отметить высокую химическую устойчивость полиэтилена в отношении концентрированных галогеноводородных кислот (кроме фтороводородной), фосфорной кислоты, 30 %-й азотной кислоты и 50 %-го водного раствора KOH и NaOH. В концентрированной серной кислоте полиэтилен устойчив при температуре ниже 40 оС. В органических растворителях происходит его набухание. Из всех полимерных материалов полиэтилен обладает наименьшей проницаемостью для водных паров. Как правило, из полиэтилена производят мерную лабораторную посуду, в том числе для работ с фтороводородной кислотой любой концентрации.
Полипропилен Полипропилен (моплен, новолен, провакс и др.) – полимер с мономерной единицей ( – CH2 – CH(CH3) – )n, по химической стойкости уступает лишь фторопластам. Рабочая температура лежит в интервале от -20 до +140 оС. В условиях комнатной температуры изделия из полипропилена устойчивы к действию водных растворов галогеноводородных кислот, фосфорной кислоты, хлорной кислоты (до 10 %), азотной (до 50 %) и серной (до 90 %) кислот. Также полипропилен не разрушается в водных растворах гидроксидов калия и натрия, аммиака, пероксида водорода. Органические растворители вызывают незначительное набухание полипропилена. Галогены и большинство органических кислот абсорбируются полипропиленом и медленно диффундируют через него. Из полипропилена, в основном, производят мерную посуду, химические стаканы, шланги и пробки.
Материалы для фильтрования Ассортимент материалов для фильтрования достаточно широк: бумага, мелкопористое стекло, волокнистые полимерные вещества, керамика, стекловолокно и др. Выбор материалов фильтра определяется состоянием осадка и составом раствора и их взаимодействия с материалом фильтра.
Фильтровальная бумага Фильтровальная бумага представляет собой продукт кислотной или щелочной переработки коротковолокнистой целлюлозы. Она гигроскопична и может содержать 5-6 % остаточной влаги. Основным параметром фильтровальной бумаги является ее плотность или пористость. Как правило, пористость указывается на упаковке с фильтровальной бумагой соответствующим цветовым обозначением. В частности, черной или розовой лентой на пачке круглых фильтров отмечается крупная пористость бумаги со средним размером пор порядка 3, 5-4, 0 мкм. Белой лентой показывают бумагу средней пористостью (3, 0-3, 5 мкм), а синей – мелкопористую Горячие водные растворы щелочей и сильных кислот превращают фильтровальную бумагу в студенистую массу, не изменяя ее состав, а водные растворы пероксида водорода и азотной кислоты даже невысоких концентраций разрушают полностью. Поэтому суспензии, содержащие эти вещества, через бумажные фильтры фильтровать не следует.
Стеклянные фильтры Стеклянные фильтры представляют собой пластинки из размельченного и затем спеченного стекла разного состава. Они различаются по пористости и толщине. Через стеклянные фильтры можно фильтровать концентрированные кислоты, кроме фтороводородной, и разбавленные растворы щелочей. Горячие концентрированные растворы щелочей разрушают такие фильтры. Достоинством стеклянных фильтров является легкость промывки и высушивания осадка, возможность быстрого фильтрования под вакуумом. Такие фильтры легко очищаются и имеют большой срок использования. Нагревать стеклянные фильтры можно с осторожность до 350 оС с последующим постепенным охлаждением.
Тканевые фильтры тканевые фильтры представляют собой фильтры из различных полимерных материалов, выбор которых обусловлен составом суспензии, видом растворителя и температурой разделяемых фаз. Полиакрилонитриловые ткани (нитрон, орлон, плутон) отличаются высокой прочностью в сухом и влажном состоянии. Они удобны для фильтрования концентрированных серной и хлороводородной кислот, концентрированных водных растворов щелочей даже при 100 оС. Полиамидные ткани (капрон, нейлон, анид) проявляют устойчивость к действию разбавленных кислот при комнатной температуре и щелочей при температурах до 100 оС. Изделия из резины Резина – продукт вулканизации каучука, обладающий способностью к обратимым деформациям. Температура эксплуатации обычной резины находится в интервале от -50 оС до +150 оС. Теплостойкие резины выдерживают температуру до 200 оС, а морозоустойчивые до -150 оС. При температуре ниже 70 оС резина устойчива к действию. Такие окислители, как галогены, пероксид водорода, водные растворы перманганатов и дихроматов щелочных металлов разрушают резину. Резина набухает в органических растворителях и растворяет в заметных количествах многие газы, особенно SO2, NH3, H2S, CO2, N2O, CH4, O2, CO и N2. В меньшей степени это происходит с водородом и гелием. Эти газы очень медленно проникают через резину. Кроме того, резина проницаема для водяного пара, поэтому применение ее в вакуумной технике ограничено. При длительном действии кислорода воздуха и света изделия из резины стареют, поверхность их сначала становится клейкой, а затем хрупкой, после чего резина растрескивается. Наиболее часто из резины изготавливают пробки и шланги. Они применяются в работах с веществами, которые не разрушают резину и не вызывают ее набухание. Перед применением новые резиновые изделия, как правило, нагревают в 2-5 %-м водном растворе KOH или NaOH, а затем в чистой воде и хранят в закрытом темном сосуде. СМАЗКИ Смазки играют важную роль в обеспечении нормального соединения элементов лабораторной установки между собой. Наиболее часто смазки используются для обработки шлифов, которые в сухом состоянии не являются герметичными и при поворачивании одной шлифованной поверхности относительно другой без смазки на них могут появляться повреждения. При длительном простаивании смазанных конструкций их подвижные элементы могут заедать, а их разъединение на отдельные элементы может быть сильно затрудненно. По этой причине после проведения химического эксперимента необходимо как можно быстрее разбирать установки на элементарные составляющие. Даже отсоединение смазанной шлифованной пробки от колбы может превратиться в сложную задачу. Однако нагревание и аккуратное раскачивание, как правило, позволяют значительно облегчить процесс разъединения. В виду возможного контакта смазок с реагентами они должны обладать высокой химической и термической стойкостью, нерастворимостью, а при работе с вакуумом – обладать низким давлением пара. Универсальных смазок не существует, однако существующий их ассортимент позволяет сделать правильный выбор при проведении различных лабораторных экспериментов и манипуляций. Основными видами смазок являются: силиконовая, фторопластовая и высоковакуумная. Силиконовая смазка представляет собой кремнийорганических соединений, характеризующихся высокой химической стойкостью, гидрофобностью, термоокислительной стабильностью и относительно малым изменением вязкости с изменением температуры. Такая смазка может использоваться при температурах до 200 оС. Фторопластовая смазка изготавливается на основе фторопласта-3 с низкой степенью полимеризации. Такая смазка устойчива к действию дымящей азотной кислоте, галогенов, озона и другим сильным окислителям. По смазочным свойствам такая смазка уступает только силиконовой. Высоорвакуумная смазка используется при работе с высоким вакуумом. Она состоит из 1-3 % поливинилового спирта, 15-20 % маннита и глицерина. Такая смазка позволяет поддерживать вакуум порядка 0, 001 Па (7· 10-6 мм.рт.ст.) Очистка посуды Для выбора способа очистки лабораторной посуды и моющего средства необходимо знать свойства загрязняющих посуду веществ, их растворимость в холодной и горячей воде, в растворах щелочей и кислот, способность к окислению с образованием водорастворимых соединений.
Предварительная очистка Грубые механические загрязнения удаляют с поверхности химической посуды с помощью ершей с применением мыльных растворов. При использовании ершей необходимо соблюдать осторожность, так как при сильном надавливании на стеклянную посуду ее можно повредить (проткнуть) металлической частью ерша. Кроме того, если ершом не удается проникнуть к месту загрязнения, в мыльный раствор можно набросать обрезки фильтровальной бумаги или кусочки тканевых материалов, а затем многократно встряхнуть очищаемый сосуд. После удаления грубых загрязнений необходимо очистить лабораторную посуду от жировых примесей. Для этого используют обработку посуды «острым» паром в течение 30-60 мин., что позволяет удалить пятна воска, парафина, жиров и другие органические примеси. При этом также происходит выщелачивание стекла, удаление из него полисиликатов щелочных металлов с одновременным их гидролизом и образованием на поверхности стекла защитной пленки из диоксида кремния SiO2. В некоторых случаях для удаления смолистых, жировых и других органических примесей, нерастворимых в воде, используют органические растворители. При этом необходимо учитывать пожаро- и взрывоопасные свойства растворителей, работать только в вытяжном шкафу вдали от источника искры или огня. Посуду, промытую органическими растворителями, затем моют водой с мылом или другими моющими средствами, а завершают мытье всполаскиванием чистой водой. Часто, завершающим этапом очистки лабораторной посуды является обработка ее такими специальными моющими средствами, как хромовая смесь, перманганатная смесь, смесь Комаровского, смесь Тарасова и др.
Очистка хромовой смесь ю Хромовая смесь состоит из дихромата калия или натрия и концентрированной серной кислоты. Наиболее распространенным рецептом приготовления данной смеси является добавление 5-9 г. тонкоизмельченного K2Cr2O7 или Na2Cr2O7 к 100 мл концентрированной серной кислоте при энергичном перемешивании. Хромовая смесь хорошо разрушает многие органические вещества, окисляя их до более простых, растворимых в воде соединений. Обработку посуды данной смесью следует проводить в вытяжном шкафу, т.к. при этом выделяется ядовитый и летучий триоксид хрома (CrO3).
K2Cr2O7 + H2SO4 = 2CrO3 + K2SO4 + H2O
Для полноценной очистки стеклянной и кварцевой посуды достаточно наполнить ее нагретой до 50-60 оС смесью на 5-10 мин. Затем посуду промывают водопроводной водой и в завершении несколько раз теплой (60-70 оС) чистой водой. Хромовая смесь непригодна для очистки стеклянных пористых материалов, например, стеклянных фильтров из-за сильной адсорбции ионов Cr2O72- и [Cr(H2O)6]3+. Фильтры при этом приобретают стойкую зеленую окраску. Хромовая смесь не удаляет с поверхности сосудов такие загрязнения как остатки керосина, парафин, воск. Смесь становится непригодной для использования, как только приобретает зеленую окраску в результате восстановления CrVI в CrIII.
Другие моющие средства
Смесь Комаровского состоит из равных по объему частей 5-6%-го водного раствора пероксида водорода (H2O2) и 20-25%-го расвора хлороводородной кислоты. Ее применяют для удаления поверхностных загрязнений стеклянной кварцевой и полимерной посуды. Смесь Комаровского оставляет поверхность более чистой, чем хромовая или перманганатная. Для эффективной очистки лабораторной посуды смесь предварительно нагревают до 30-40 0С, а после мытья посуду тщательно ополаскивают чистой водой. Смесь Тарасова состоит из 10 г стирального порошка, 50 г карбоната аммония, 50 г лимонной кислоты и 50 г этилендиаминотетрауксусной кислоты (ЭДТА, EDTA) растворенных в 10 л чистой воды. В виду наличия эффективных комплексообразоватей смесь Тарасова используется для очитки посуды от многих примесей, сорбируемых поверхностью стекла, кварца и полимерных материалов. При взаимодействии компонентов смеси с загрязняющими веществами происходит их связывание в устойчивые водорастворимые комплексные соединения. Перед применением смесь Тарасова нагревают до 60-70 0С, а затем на 10-15 мин помещают в нее грязную посуду. В завершении посуду тщатель ополаскивают чистой водой. Сушка посуды
Лабораторную посуду, очищенную и вымытую вышеописанными средствами, в завершении подвергают высушиванию. Сушку часто проводят в обычном сушильном шкафу сухим горячим воздухом при температуре 80-105 оС. Для охлаждения высушенную посуду оставляют на некоторое время в выключенном шкафу. В некоторых случаях, если есть срочная необходимость в посуде, допускается ополаскивание ее сначала этиловым спиртом, а затем диэтиловым эфиром или ацетоном. Спирт удаляет водную пленку с поверхности, а эфир или ацетон смывают пленку спирта и легко и очень быстро испаряются со стенок сосуда. 3. меры безопасности при работе Основные правила работы со стеклом просты и не требуют особых пояснений. В то же время именно несоблюдение элементарных мер предосторожности служит причиной большинства травм в лабораториях. Поэтому коротко остановимся на самых важных правилах, соблюдение которых должно войти в привычку у каждого, кто работает со стеклом: 1. Стекло - хрупкий материал, имеющий малое сопротивление при ударе и незначительную прочность при изгибе. Применение физической силы при работе со стеклянными деталями связано с опасностью их поломки. Однако во всех случаях лучше недооценить прочность стеклянной детали, чем переоценить ее. Вероятность ранения рук пропорциональна усилию, приложенному к стеклянной детали. 2. Нужно помнить, что стеклянная посуда не предназначена для работы при повышенном давлении. Ни при каких обстоятельствах нельзя допускать нагревание жидкостей в закрытых колбах или приборах, не имеющих сообщение с атмосферой, даже в тех случаях, когда температура нагрева не превышает температуры кипения жидкости. 3. Категорически запрещается использовать посуду, имеющую трещины или отбитые края. Острые края стеклянных трубок следует немедленно оплавить в пламени горелки. В качестве временной меры допускается зачистка краев трубок на мелкозернистом наждачном камне. Острые края стеклянных трубок опасны не только как источник травм, но и порчи резиновых шлангов, которые на них одеваются, что может послужить причиной аварии. 4. В рабочем столе или шкафу следует держать только самую необходимую, постоянно используемую посуду. Важно, чтобы посуда в столе содержалась в порядке, мелкие детали в неглубоких коробках в один слой на вате. При выдвижении ящиков стола предметы не должны ударяться друг о друга. Минимальный запас посуды в лаборатории необходим, однако он должен храниться отдельно. Если посуда не имеет своего постоянного места, хранится неаккуратно, в тесноте, она неизбежно бьется, что повышает вероятность травм. 5. Осколки разбитой посуды убирают только с помощью щетки и совка, ни в коем случае не руками. 6. Стеклянные приборы и посуду больших размеров можно переносить только двумя руками. Крупные (более 5 литров) бутыли с жидкостями переносят вдвоем в специальных корзинах или ящиках с ручками. 7. Запрещается поднимать бутыли за горло.
ЛАБОРАТОРНАЯ ПОСУДА Лабораторную посуду можно разделить по назначению на посуду общего назначения, специального назначения и мерную. По сорту стекла различают посуду: из простого стекла, специального стекла, из кварца. К группе общего назначения относятся те предметы, которые всегда должны быть в лаборатории и без которых нельзя провести большинство работ. Такими являются пробирки, воронки простые и делительные, стаканы, плоскодонные колбы, круглодонные колбы, колбы Бунзена, холодильники. К группе специального назначения относятся те предметы, которые употребляются для одной какой-либо цели, например, специальные холодильники, аппарат Сокслета, приборы для определения температуры плавления и кипения и др. К мерной посуде относятся мерные цилиндры и мензурки, пипетки, бюретки и мерные колбы. 4.1 Колбы (англ. flask, нем. kolben, фр. fiole) Колба — стеклянный сосуд с круглым или плоским дном, обычно с узким длинным горлышком. Разновидность технических сосудов, применяемых в химических лабораториях. Колбы различают соответственно: круглодонные, конические, плоскодонные, грушевидные, остроконечные. По типу горла: колбы с коническими шлифами, колбы с цилиндрическими шлифами, колбы с простым горлом под резиновую пробку. По емкости: от 5 мл до 50 литров. По виду материала: колбы стеклянные, кварцевые, металлические.
Колбы являются основной лабораторной посудой для проведения органического синтеза. Конические и плоскодонные колбы (рис. 12, 13) обычно используют в качестве приемников при перегонке жидкости, для кристаллизации, а также для приготовления растворов. Их нельзя применять для нагревания жидких веществ до высоких температур и использовать при вакуум-перегонке. Несоблюдение этих правил может привести к серьезным последствиям, например, взрыву. Для перегонки, в том числе и под вакуумом, используют круглодонные колбы (15, 20, 21), которые могут быть широкогорлыми и узкогорлыми, длинногорлыми и короткогорлыми. Колбы могут быть двух-, трехгорлые (рис. 16-19) и т. д. Многие колбы обычно применяют для специальных синтезов. Круглодонные колбы, снабженные отводной трубкой, называют колбами Вюрца (рис. 20). Они предназначены для перегонки жидкости под атмосферным давлением. Круглодонные колбы с боковыми вертикальными отверстиями, имеющим отводную трубку, называются колбами Кляйзена (рис. 20) и используются при перегонке при пониженном давлении. Применяется при перегонке и колба Фаворского - круглодонная колба с дефлегматором и отводной трубкой.
4.1.1 КОЛБЫ КОНИЧЕСКИЕ (англ. conical flask) Колбы конические Типа Кн Конические колбы (колбы Эрленмейера, рис. 12) широко используемый тип лабораторных колб различного объема, который характеризуется плоским дном, коническим корпусом и цилиндрическим горлышком. Колба названа по имени немецкого химика Эмиля Эрленмейера, который создал её в 1861 г. В соответствии с ГОСТ 23932-90 (Посуда лабораторная стеклянная) конические колбы изготавливают двух исполнений - с взаимозаменяемыми конусами и с цилиндрическими горловинами. Примеры условного обозначения данного типа лабораторной посуды:
Колба ПМ Кн-1-25-14/23 ТС ГОСТ 23932-90. Колба типа Кн ( коническая ), ПМ ( со стеклянной пробкой ), номинальной вместимостью 25 мл, с взаимозаменяемыми конусами и конусом 14/23, из термически стойкого стекла группы ТС по ГОСТ 23932-90. Колба Кн-2-100-22 ТС ГОСТ 23932-90. Колба типа Кн ( коническая ), исполнения 2, номинальной вместимостью 100 мл, без взаимозаменяемого конуса, диаметром горловины 22 мм, из термически стойкого стекла группы ТС по ГОСТ 23932.
КОЛБЫ ПЛОСКОДОННЫЕ
Плоскодонные колбы (рис. 13) представляют собой тонкостенные сферические емкости с усеченной нижней поверхностью различной вместимости, предназначенные для использования в лабораторных условиях. В соответствии с ГОСТ 25336-82 (Посуда лабораторная стеклянная) колбы плоскодонные изготавливают двух исполнений - с взаимозаменяемыми конусами и с цилиндрическими горловинами. Примеры условного обозначения данного типа лабораторной посуды:
Колба П-2-100-22 ТС ГОСТ 23932-90. Колба типа П ( плоскодонная ), исполнения 2, номинальной вместимостью 100 мл, без взаимозаменяемого конуса, диаметром горловины 22 мм, из термически стойкого стекла группы ТС ГОСТ 23932-90.
Рисунок 13. – Плоскодонная колба. Колбы Бунзена В англоязычной литературе – колба Бюхнера (Bü chner flask) Колба Бунзена (рис. 14) представляет собой коническую толстостенную Колбы Бунзена изготавливают из стекла марки ТС, в соответствии с ГОСТ 23932-90 " Посуда и оборудование лабораторные стеклянные. Общие технические условия". Номинальная вместимость в обозначении и наименовании колб Бунзена является условной. ГОСТ 25336-82 требует, чтобы колбы с тубусом (колбы Бунзена) выдерживали предельное остаточное давление не более 13, 33 гПа Примеры условного обозначения данного типа лабораторной посуды: Колба с тубусом (Бунзена) 1-250-29 ГОСТ 23932-90. Колба с тубусом (Бунзена) исполнения 1 ( без взаимозаменяемого конуса ) номинальной вместимостью 250 мл по ГОСТ 23932-90.
Рисунок 14. - Колбы Бунзена. КОЛБЫ КРУГЛОДОННЫЕ
Круглодонные колбы (рис. 15) представляют собой тонкостенные сферические емкости различной вместимости, предназначенные для использования в лабораторных условиях. В соответствии с ГОСТ 25336-82 (Посуда лабораторная стеклянная) колбы круглодонные изготавливают двух исполнений - с взаимозаменяемыми конусами и с цилиндрическими горловинами. В соответствии с ГОСТ 25336-82 колбы с взаимозаменяемыми конусами должны изготавливаться со стеклянными крючками или коррозионностойкими хомутиками.
Колба К-1-100-14/23 ТС ГОСТ 23932-90. Колба типа К ( круглодонная ), номинальной вместимостью 100 мл, с взаимозаменяемым конусом 14/23, из термически стойкого стекла группы ТС по ГОСТ 23932.
Рисунок 15. - Одногорлые круглодонные колбы.
4.1.4.2 Колбы круглодонные КГУ-2, КГП-3 Круглодонные колбы представляют собой тонкостенные сферические емкости различной вместимости с двумя и более горловинами, предназначенные для использования в лабораторных условиях (рис. 16-19). В соответствии с ГОСТ 25336-82 (Посуда лабораторная стеклянная) колбы круглодонные изготавливают двух исполнений - с взаимозаменяемыми конусами и с цилиндрическими горловинами. В соответствии с ГОСТ 25336-82 колбы с взаимозаменяемыми конусами должны изготавливаться со стеклянными крючками или коррозионностойкими хомутиками.
Колба КГУ-2-100-19/26-14/23 ТС ГОСТ 23932-90. Колба типа КГУ-2 ( круглодонная с двумя горловинами ), номинальной вместимостью 100 мл, с взаимозаменяемыми конусами 19/26 14/23, из термически стойкого стекла группы ТС по ГОСТ 23932.
Рисунок 16. – Двугорлые колбы
Рисунок 17. – Трехгорлые колбы
Рисунок 18. – Многогорлые колбы
Рисунок 19. – Пример использования трехгорловой колбы 4.1.4.3 Колбы Вюрца Колба Вюрца (рис. 20) — круглодонная колба с припаянной к горлу стеклянной отводной трубкой. Используется как составная часть прибора для перегонки. Названа в честь французского химика Шарля Вюрца Колбы Вюрца изготавливают из стекла марки ТС, в соответствии с ГОСТ 23932-90. Номинальная вместимость в обозначении и наименовании колб Вюрца является условной.
Рисунок 21 – Колбы Кляйзена | Людвиг Кляйзен (1851-1930) | ||||||||||||||||||||||||||||||||||||||||
Стакан Н-1-100 ТС ГОСТ 23932-90
Стакан типа Н (низкий) исполнения 1 (с носиком) номинальной вместимостью 100 мл из термически стойкого стекла группы ТС по ГОСТ 23932-90.
Химические стаканы могут также быть изготовлены из пластика и фарфора.

| 
| 
| 
|
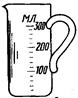
| а – Стеклянные химические стаканы | б – Химические стаканы из фарфора или пластика | ||
Рисунок 24. - Химические стаканы
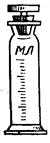
Мерные цилиндры (рис. 25) - представляют собой емкости цилиндрической формы, различной вместимости, изготовленные из стекла или полимерных материалов и предназначенные для измерения объемов жидких веществ.
 
|  
| 
|
Рисунок 25 - Мерные цилиндры
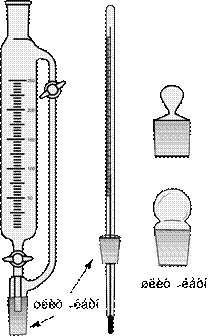
4.3 Холодильники (англ. Condrnser, нем. Laborkü hler )
Холодильник — лабораторный прибор для конденсации паров жидкостей при перегонке или нагревании (кипячении).
Самый простой холодильник представляет собой длинную стеклянную трубку. Более сложные по конструкции холодильники представляют собой стеклянную трубку различной конфигурации, впаянную в другую, более широкую, трубку. Внешняя часть холодильника («рубашка») имеет два боковых отвода. Через них с помощью резиновых шлангов холодильник соединяют с водопроводным краном. Один из них – нижний – присоединяют к крану, а другой – верхний – отводят в раковину. Холодильник соединяется с приемником при помощи специального приспособления – аллонж, позволяющего направлять стекающую жидкость.
КЛАССИФИКАЦИЯ ХОЛОДИЛЬНИКОВ
| По принципу действия Прямой Обратный |
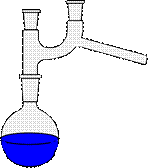
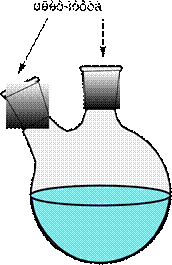
Прямой холодильник (рис. 26 б) используют для отгонки растворителей из реакционной среды, для разделения смесей жидкостей на компоненты или для очистки жидкостей перегонкой.
Обратный холодильник (рис. 26 а) используют в установках для проведения синтеза, для растворения веществ. Пары попадая в обратный холодильник охлаждаются, конденсируют и образующаяся при этом жидкость стекает обратно в реакционную колбу.
|
| |
| а - Установка с обратным (восходящим) холодильником | б - Установка с прямым (нисходящим) холодильником |
Рисунок 26. – Применение прямого и обратного холодильника.
| По типу охлаждения Водяной (рис. 27) Воздушный (рис. 28) |
По типу охлаждающего агента, заполняющего внутреннюю «рубашку», различают холодильники:
- водяной с проточной водой;
- водяной с непроточной водой;
- воздушный.
Воздушный холодильник прменяют для конденсации паров жидкости с
Т. кип. > 150 С, водяной с проточной водой – с Т. кип. жидкости < 120 С, водяной с непроточной водой - с Т. кип. жидкости от 120 до 150 С.

| 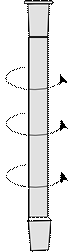
|
| Рисунок 27. – Холодильник с водяным охлаждением | Рисунок 28. – Холодильник с воздушним охлаждением |
По строению внутренней трубки
По конструкции внутренней трубки, охлаждающей рубашки, а, следовательно, поверхности охлаждения различают холодильники:
- «труба в трубе»;
- шариковый;
- змеевиковый;
- комбинированный и др. (рис. 29).
Применение конкретного типа холодильника обуславливается необходимой интенсивностью охлаждения.
| 
| 
| 
| 
| 
|
| 
| |
| а | б | в | г | д | е | ж | з | |

| 
| 
| 
| 
|
|
| ||
| и | к | л | м | н | о | п | ||
Рисунок 29. Холодильники различной конструкции.
Воздушный холодильник (рис. 29 а, о)
Относится к простейшим по конструкции холодильникам и представляет собой длинную стеклянную трубку. Такой холодильник применяется только при работе с высококипящими жидкостями (т. кип. > 150°С), поскольку охлаждающее действие воздуха невелико. Холодильник может применяться в качестве прямого или обратного. В качестве обратного такой холодильник малоэффективен: движение жидкости преимущественно отвечает ламинарному потоку и вещество легко «выбрасывается». В качестве нисходящего такой холодильник можно использовать при небольшой скорости перегонки.
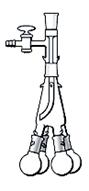
Холодильник Вейгеля-Либиха ( чаще Либиха, англ. Liebig condenser )
(рис. 29 б, п)
Впервые был предложен в 1771 г. Вейгелем, а затем использован
Либихом. Применяется преимущественно в качестве нисходящего холодильника. В качестве обратного холодильника он малоэффективен, т.к. имеет малую охлаждающую поверхность и ламинарное течение паров. С этой целью он применяется для относительно высококипящих (Т кип.> 100 0С) соединений. Так как на наружной поверхности холодильника конденсируется атмосферная влага, которая через капиллярные течи в шлифе может попадать внутрь колбы, шлифы на холодильнике и колбе следует тщательно смазывать. Рекомендуется также на холодильнике выше шлифа надевать манжету из сухой фильтровальной бумаги. Более высококипящие жидкости (Т кип. > 160 0С) в месте спая трубок (рис. 30) могут обусловить возникновение внутреннего напряжения, что вызывает появление трещин, или полное разрушение стекла.

Рисунок 30. Места возможных трещин при резком перепаде температур
Коэффициент теплообмена для холодильников Либиха длиной от 300 до 1000 мм изменяется от 105 до 35 Вт/(м2K), т.е. уменьшается с увеличением длины холодильника.
Холодильник Либиха может выполнять функции и воздушного холодильника, если его расположить вертикально и пар высококипящей жидкости направить в рубашку через верхний отросток, а из нижнего отбирать конденсат. В результате разогрева в центральной трубке возникнет непрерывный вертикальный поток холодного воздуха. В этом случае наиболее эффективные холодильники с более широкой центральной трубкой и по возможности меньшим диаметром окружающей ее рубашки.
Холодильник Веста ( англ. West condenser ) (рис. 29 в)
Представляет собой модификацию холодильника Либиха, отличием от которого является меньшее расстояние между внутренней и наружной трубкой, что позволяет увеличить скорость движения охлаждающего агента. Холодильник Веста имеет вдвое больший коэффициент теплообмена, чем холодильник Либиха и более эффективен для охлаждения паров низкокипящих жидкостей.
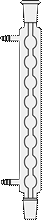
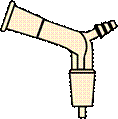
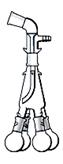
Шариковый холодильник Аллина (англ. Allihn condenser ) ( рис. 29 г)
Является типичным обратным холодильником. Благодаря большей поверхности охлаждения холодильники Аллина короче холодильников Вейгеля-Либиха. Через шариковый холодильник удобно вставлять ось мешалки, вводить в реактор различные вещества, хорошо смываемые в колбу конденсатом и подогреваемые им. Обычно число шариков у таких холодильников колеблется от 3 до 8. По эффективности в качестве обратного холодильника холодильник Аллина уступает холодильнику Димрота (рис. 29 ж, з), выдерживающему значительные перепады температур. Во избежание захлебывания, когда конденсат не успевает стекать обратно в колбу с кипящей жидкостью, обратный шариковый холодильник устанавливают в наклонном положении, но наклон не должен быть слишком большим, чтобы конденсат не скапливался в шарах. Скопление конденсата приводит к уменьшению эффективной охлаждающей поверхности холодильника.
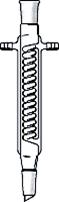
Змеевиковый холодильник ( холодильник Грэхема )
(англ. Graham condenser) (рис. 29 д, е)
Никогда не используется как обратный, т.к. конденсат, который недостаточно хорошо стекает по сгибам змеевика, может быть выброшен из холодильника и послужить причиной несчастного случая. Змеевиковый холодильник, установленный вертикально, является наиболее эффективным нисходящим холодильником, особенно для низкокипящих веществ.
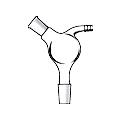
Холодильник Димрота (англ. Dimroth condenser), (рис. 29 ж, з)
Очень эффективный обратный холодильник. Он имеет наиболее высокий коэффициент теплообмена, достигающий 120 Вт/(м2К). Его также можно использовать в качестве нисходящего, если можно пренебречь относительно большими потерями дистиллята на змеевике. Спай змеевика с рубашкой находится вне зоны с большим перепадом температур, поэтому применяя такой холодильник при работе с жидкостями, кипящими выше 1600С можно не опасаться осложнений. Для более эффективного охлаждения используется холодильник Димрота с двойной рубашкой (рис. 29 з).
Чтобы улучшить работу холодильников с рубашкой, усилив перенос теплоты, создают турбулентный поток охлаждающей жидкости. Для этого трубки подачи и отвода жидкости рубашки припаивают так, чтобы их оси были расположены тангенциально по отношению к рубашке (рис. 14 и) . Тогда вода или другая охлаждающая жидкость начнет двигаться в холодильнике по спирали.
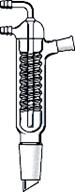
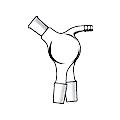
Холодильник Фридриха (Фридрихса, Фридерихса)
(англ.Friedrich condenser), (рис. 29 и, к)
В таком холодильнике пары омывают змеевиковую трубку с проточной водой и стенки внутренней широкой цилиндрической трубки, снаружи которой течет вода, поступающая из змеевика. Этот холодильник с интенсивным охлаждением пара является, в сущности, комбинацией холодильников Либиха и Димрота. Он очень эффективен для фракционной перегонки жидких смесей, так как в нем конденсат практически не задерживается.
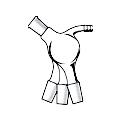
Холодильник Ширма-Хопкинса (чаще холодильник Хопкинса, рис. 29 л).
Состоит из рубашки, через которую пропускают пар, и «пальца», находящегося внутри рубашки, - устройство, через которое протекает жидкий хладоагент. При использовании данного типа холодильника скорость потока пара должна быть как можно ниже.
Охлаждающий палец (англ. Cold fingers), (рис. 29 м)
Этот обратный холодильник особой формы (его можно специально не закреплять в системе охлаждения) используется, прежде всего, в приборах для полумикрометодов. Если «охлаждающий палец» введен в реакционный сосуд на пробке, прибор не должен быть герметичным.
Холодильник Дьюара (рис. 29 н)
В качестве охлаждающего агента в таком холодильнике используется смесь сухого льда (твердый диоксид углерода) с ацетоном или спиртом, или жидкий азот.

| 
| ||
| Юстус Либих (1803-1873) | Джеймс Дьюар (1842-1923) |
ОБОЗНАЧЕНИЕ ХОЛОДИЛЬНИКОВ
Таблица 5. – Варианты обозначения холодильников
| Обозначение | Тип холодильника |
| ХПТ | с прямой трубкой |
| ХШ | шариковые |
| ХСН | спиральные с наружным охлаждением |
| ХСВ | спиральные с внутрениим охлаждением |
| ХСВО | спиральные с внутренним охлаждением обратимые |
| ХСД | спиральные с внутренним и наружным охлаждением двустенные |
| ХП | пальчиковые |
Холодильники, изготовленные без взаимозаменяемых конусов, должны иметь размеры сливной трубки: длина не менее 70 мм, диаметр не менее 13 мм, длина верхней части холодильника не менее 65 мм. 
Рисунок 31. – Дефлегматоры различной конструкции.
а – елочный дефлегматор, б - колонка Видмера, в - колонка Дафтона,
г - колонка Вигре с насадкой, д - дефлегматор (колонка) с холодильником
4.5. Капельные воронки ( англ. Drop funnel )
Капельные воронки предназначены для постепенного прибавления жидкого компонента к реакционной массе до или вовремя проведения органического синтеза. Воронки бывают с цилиндрическими, шарообразными или грушевидными емкостями для жидкости (с пробкой в верхней части) и часто – с длинными отводными трубками с краном (рис. 32). Чтобы стеклянный кран не пропускал жидкость, шлиф слегка смазывают вазелинам.

|
Рисунок 32. – Капельная воронка.
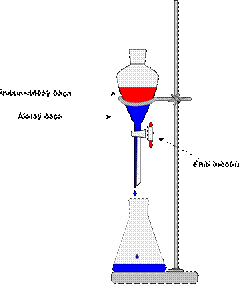
Делительные воронки
Делительные воронки (рис. 33) – это удлиненный цилиндрический или грушевидный стеклянный сосуд, применяемый, как правило, для разделения несмешивающихся жидкостей и для экстракции. Эти воронки в отличие от капельных воронок имеют более толстые стенки и меньшую длину отводной трубки.

| 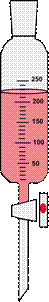
|
Рисунок 33. – Делительные воронки.
| ОБРАТИТЕ ВНИМАНИЕ!!! При использование круглодонных колб емкость 1 л и более, для уменьшения нагрузки на дно сосуда, при сборке установки их помещают на кольцо |
|
| 
| |
|
|
| ||
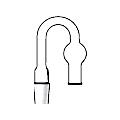
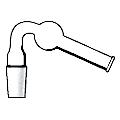
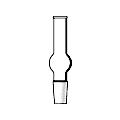
Хлоркальциевые трубки
Хлоркальциевые трубки (рис. 34) предназначены для защиты реакционной смеси или одного из реагирующих веществ от влаги воздуха. В качестве поглотителя влаги используют хорошо прокаленный хлорид кальция.
| 
| 
|
Рисунок 34. – Конструкции хлоркальциевых трубок.
При проведении перегонки хлоркальциевая трубка устанавливается на аллонж (рис. 35 б). В установке с обратным холодильником она помещается в верхнее его отверстие (рис. 35 а).
| 
|
| а б | |
Рисунок 35. – применение хлоркальциевой трубки
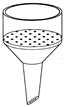
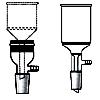
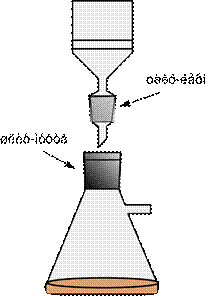
2.7. Воронки (англ. funnel)
Воронки предназначены для переливания жидкостей (рис. 36 а, в, г), добавления жидких и сухих реагентов (рис. 36 б) в реакционную массу, фильтрования суспензий (рис. 36 д-к). Воронки имеют нисходящий конус. В зависимости от назначения могут быть изготовлены из стекла, пластмассы, фарфора.
| 
| 
| 
|
| а | б | в | г |
| 
| 
| 
|
| д хирш | е | з | и, к |
Рисунок 36. – Воронки.
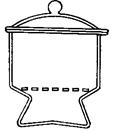
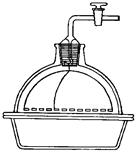
2.8. ЭКСИКАТОРЫ ( англ. Desiccator, vacuum desiccators)
Эксикатор – стеклянный толстостенный сосуд с крышкой, в котором поддерживается определённая влажность воздуха (обычно близкая к нулю). Эксикаторы предназначены для высушивания веществ в вакуумом при комнатной температуре и для хранения при лабораторных работах. Различают обычные (рис. 37 а, 38 а) и вакуумные эксикаторы (рис. 37 б, 38 б-г). В вакуумном эксикаторе имеется тубус, в который на резиновой пробке или шлифе вставляют трубку с краном. Эту трубку через манометр и предохранительную трубку соединяют с водоструйным или масляным насосом и создают в эксикаторе вакуум. Плоскость соединения с крышкой для достижения герметичности смазывается специальной смазкой.
Эксикатор имеет особую форму для размещения решётчатого фарфорового поддона, на который устанавливаются бюксы. На дно эксикатора помещается гигроскопичное вещество для осушения или раствор, поддерживающий определённое парциальное давление водяных паров.
В соответствии с ГОСТ 25336-82 эксикаторы изготавливаются в двух исполнений - с краном (исполнение 1) и без крана (исполнение 2). ГОСТ 25336-82 требует, чтобы эксикаторы исполнения 1 (с краном) выдерживали предельное остаточное давление не более 60 гПа (45 мм рт. ст.) в течение одних суток.
Примеры условного обозначения:
 Эксикатор 1-100. Эксикатор исполнения 1 (с краном) диаметром корпуса 100 мм.
Эксикатор 1-100. Эксикатор исполнения 1 (с краном) диаметром корпуса 100 мм.
 Эксикатор 2-240. Эксикатор исполнения 2 (без крана) диаметром корпуса 250 мм.
Эксикатор 2-240. Эксикатор исполнения 2 (без крана) диаметром корпуса 250 мм.
|
|
|
| |||
| а | б |
| |||
|
Рисунок 3 7 – Эксикаторы. |
| ||||
|
|
| 
| ||
| а – эксикатор Шейблера | б – вакуум-эксикатор Шейблера | в – модификация вакуум-эксикатор Шейблера | г – эксикатор Руппе | ||
Рисунок 38 (а-г). – Эксикаторы различной конструкции.
Термометры
В химических лабораториях чаще всего применяют ртутные или спиртовые термометры (рис. 39). Термометры бывают различной конструкции. Наиболее распространены обычные ртутные термометры (химические) и технические (с прямой и изогнутыми трубками). Используют также и палочковые термометры, представляющие собой толстостенный капилляр, на который с наружной стороны нанесена градуировка в виде закрашенных в черный или красных цвет штрихов. Обычные химические термометры позволяют измерять температуру в пределах от -30 до 360оС. Наиболее распространены термометры со шкалой в 100, 150, 200, 250, 300 и 360оС. Иногда используют и специальные (газонаполнительные) термометры со шкалой до 550 и даже до 750оС. Для очень точных измерений применяют образцовые («нормальные») термометры, имеющие цену деления в 0, 1оС. Такими термометрами обычно определяют температуры плавления и кипения веществ.
При работе с термометрами необходимо соблюдать ряд правил.
1. После каждого измерения температуры остывший термометр протирают спиртом.
2. Термометр следует хранить в специальном футляре или отведенном для него месте в ящике лабораторного стола.
3. Если термометр разбился, необходимо сразу же собрать пролившуюся ртуть и уничтожить ее следы. Остатки ртути обрабатывают серой или хлорным железом.
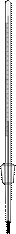
| 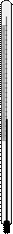
| 
|
Рисунок 39. – Термометры.
Перемешивание. Мешалки
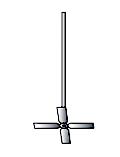
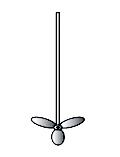
Скорость химической реакции прямо пропорциональна гомогенности массы. Поэтому при проведении органических синтезов в гетерогенной системе часто требуется перемешивание. Эффективность перемешивания во многом зависит от конструкции мешалок. Удобны в применении мешалки, изготовленные из толстых стеклянных палочек (рис. 40 а-в), так как перед опытом им можно придать любую форму в зависимости от величины реакционного сосуда, ширины горла и других требований, предъявляемых в данных условиях. Для перемешивания больших количеств жидкости применяются металлические мешалки (рис. 40 г), а для размешивания тяжелых осадков или вязких жидкостей – мешалки Гершберга (рис. 40 д). Мешалки последнего типа применяются для измельчения расплавленного натрия.
Магнитные мешалки позволяют осуществлять перемешивание в закрытом сосуде. Они состоят из вращаемого с помощью электродвигателя магнита, который вызывает движение железного стерженька в реакционной колбе. Железный стержень заключен в стеклянную или тефлоновую трубку. Магнитные мешалки применяются при гидрировании, работе в высоком вакууме, для перемешивания малых количеств реагентов и др.
Для перемешивания малых количеств реагентов также отдается предпочтение магнитным мешалкам.

| 
| 
|
| а | б | в |
| 
| 
|
| г | д | е |
Рисунок 40 (а-е). – Мешалки.
Склянки промывные
Склянка Тищенко (рис. 41) – стеклянный прибор, применяемый для промывания и осушки газов. Представляет собой закрытую емкость с противоположно расположенными отводными концами. Внутри емкости находится перегородка.
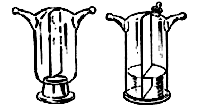
|
Рисунок 41 - Склянка Тищенко
Промывная склянка Вульфа ( Салюцо - Вульфа, рис. 42). Служит для промывания газов, а также в качестве предохранительного сосуда при работах с вакуум-насосом. Представляет собой стеклянную емкость с двумя или тремя горлами, причем может иметь отводную трубку, расположенную у ее основания.
Рисунок 42 - Промывная склянка Вульфа
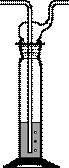
Склянка Дрекселя (рис. 43). Как и склянка Вульфа, предназначена для промывания газов, но отличается от склянки Вульфа формой и конструкцией.
|
Рисунок 43 - Склянка Дрекселя
Переходники и НАСАДКИ
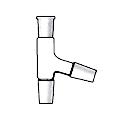
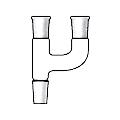
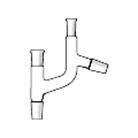
Переходники (переходы) применяются в процессе соединения деталей установок для перехода от одного размера стандартного шлифа к другому (рис. 44 а).
насадки применяются для трансформации одних элементов лабораторной установки в другие или для их соединения друг с другом (через насадку) (рис. 44 б-е).
Ассортимент насадок достаточно велик. Некоторые из них используются для подсоединения установки к вукуум-линии (рис. 44 б, в), а для соединения перегонной колбы к холодильнику применяется насадка Вюрца (рис. 44 г.). Часто, в случае отсутствия двухгорлой колбы используют насадку Кляйзена (рис. 44 д.), которая трансформирует одногорлую колбу в двугорлую. Еще одна насадка Кляйзена, но с отводной трубкой (насадка Кляйзена К-типа) (рис. 44 е) применяется при вакуумной перегонке. В одну из трубок помещают капилляр, для равномерного кипения жидкости в вакууме, в другую термометр, а отводную трубку подсоединяют к холодильнику.
| 
| 
|
| а | б | в |
| 
| 
|
| г – насадка Вюрца | д - насадка Кляйзена | е - насадка Кляйзена К-типа |
Рисунок 44. – Соединительные элементы
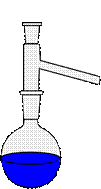
Примеры использования различных насадок показаны на рис. 45
| 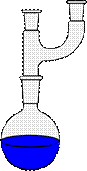
| 
|
Рисунок 45. – Примеры использования соединительных элементов
АЛОНЖИ
Алонж (фр. allonge — удлинитель, надставка) — конструктивный элемент химических приборов (рис 46). Применяется в основном при перегонке для соединения холодильника с приёмником и при других работах.
В конический притёртый шлиф — муфту входит внутренний притёртый шлиф — керн холодильника. Узкий конец аллонжа опускают в приёмник.
В зависимости от выполняемой работы, в лабораториях органического синтеза применяются алонжи различной конструкции. Так, при выполнении простой перегонки может использоваться простейший аллонж, представляющий собой изогнутую трубку, один конец которой соединяется с холодильником, а другой помещается в колбу-приемник (рис 46 а). При получении безводных растворителей используется аллонж с отводом для присоединения хлоркальциевой трубки (рис. 46 б-г). Весьма разнообразны по форме и конструкции аллонжи, использующиеся при перегонке в вакууме. Такие аллонжи обязательно снабжены отводной трубкой для присоединения вакуум линии (водоструйного насоса) и могут иметь несколько трубок для присоединения нескольких приемником одновременно (рис. д-з). Такие устройства имеют название
алонж-«паук». Использование «паука» при перегонке в вакууме позволяет, не отключая вакуум последовательно отгонять жидкости в индивидуальный приемник.
| 
| 
|
| а | б | в |
| 
| 
| 
| 
|
| г | д | е | ж | з |
Рисунок 46. – Алонжи
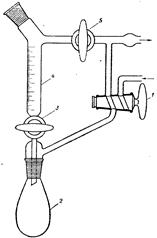
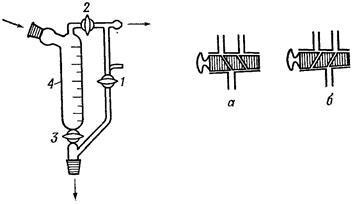
Рисунок 46. – Алонж (насадка) аншютца -тиле
Одним из наиболее удобных при фракционной перегонке и перегонке в вакууме, несомненно, является алонж (насадка) Аншютца-Тиле (иногда форштосс Аншютца-Тиле, рис. ). Он позволяет менять приемники, не нарушая вакуума в приборе и не прерывая перегонки.
Открывая кран 3, переводят собранный в градуированной части алонжа 4 дистиллят в приемник. При необходимости перехода к сбору промежуточной или следующей основной фракции, закрывают кран 3, а кран 1 поворотам на 1800 переводят в положение б. При этом в приемную колбу входит воздух и ее можно заменить на новую
ПРИБОРЫ НА ШЛИФАХ
Стеклянные Шлифы представляют собой плотное соединение двух стеклянных изделий с притертыми, пришлифованными поверхностями.
В лабораторной практике широко используется химическая посуда со стандартными шлифами, позволяющая быстро соединить друг с другом отдельные части установки, добиваясь при этом высокой герметичности. Большинство лабораторных приборов имеет стандартные взаимозаменяемые конические шлифы (нормальные шлифы, НШ). Они обозначаются номерами, соответствующими верхним диаметрам (в миллиметрах). Соединение на шлифах осуществляется при помощи шлифа-муфты (внешний шлиф) и шлифа-керна (внутренний шлиф) (рис. 47). Если отдельные части установки имеют шлифы разных размеров, то следует применять различные переходы на шлифах.
Для крепления муфты и керна, как правило, к их трубкам припаивают “усики” на которые надевают резинку
При работе с коническими шлифами необходимо соблюдать следующие правила:
1. муфта и керн должны быть из одинакового сорта стекла;
2. обе части конического шлифа следует соединять легким вращением;
3. необходимо исключить попадание на шлиф смолообразующих, полимеризующихся и сильнощелочных веществ;
4. краны делительных и капельных воронок и плоские шлифы (крышки эксикаторов) смазывают вазелином;
5. при работе под уменьшенным давлением шлифы необходимо смазывать специальной вакуумной смазкой, которую наносят в небольшом количестве кольцом на среднюю часть конического шлифа и легким вращающим движением керна в муфте добиваются равномерного распределения смазки;
6. правильно смазанный шлиф совершенно прозрачен.
Иногда, при использовании шлифованной посуды очень трудно разъединить шлифы, происходит их “заедание”. Оно, как правило, происходит в результате вдавливания внутреннего шлифа во внешний при работе в вакууме, длительной работы при повышенной температуре, действия шелочей, некоторых кислот, кремнийорганических соединений и ряда других причин.
Заевшие (неразъединяемые) шлифы можно открыть, используя следующие приемы:
1. осторожно постукивая деревянным предметом (молоточком) по шлифу;
2. механическим расшатыванием внутреннего шлифа;
3. нагреванием внешнего шлифа горячей водой, водяным паром или слабым пламенем спиртовки (керн по возможности должен оставаться холодным).
Кроме того, для разъединения “заевших” шлифов можно использовать раствор, состоящий из 10 массовых частей хлоралгидрата, 5 ч. глицерина, 3 ч. концентрированной хлороводородной кислоты и 5 ч. воды. Такой раствор наносят на шлиф или шлиф погружаю в раствор на некоторое время. Вакуумирование сосуда (прибора) облегчает проникновение раствора между притертыми поверхностями.
| 
| 
|
 
|
Рисунок 47. – Соединения на шлифах.
2.12.3. Пробки (англ. stopper)
Пробки служат не только для закупоривания химической посуды, но и для соединения отдельных частей прибора. Они бывают резиновыми, корковыми, пластмассовыми или стеклянными (рис. 48). Отверстия в пробках делают специальными металлическими сверлами, диаметр которых должен быть несколько меньше необходимого отверстия (сверлить начинают с узкого конца пробки).
Предпочтение отдают тем или другим пробкам в зависимости от применяемых веществ, условий и целей работы. Для соблюдения особой герметичности применяют резиновые пробки. Однако резиновые, корковые и пластмассовые пробки нестойки к действию высокой температуры и некоторых химических реагентов. Резиновые пробки и шланги неустойчивы к действию галогенов, сильных кислот и т. д. и набухают в присутствии органических растворителей. Для работ с хлором, бромоводородом, фосгеном, озоном и другими агрессивными веществами целесообразно применять пробки из поливинилхлорида или полиэтилена. Корковые пробки неплотные и поэтому не пригодны для работ в вакууме, кроме того, они очень чувствительны к действию химических веществ.
Следует отметить, что соединения на резиновых и корковых пробках по сравнению со стеклянными шлифами имеют меньшее значение.

| 
| 
| 
|
| а | б | в | г |

| 
| 
| 
|
| д | е | ж | з |
Рисунок 48. – Пробки.
РЕЗИНОВЫЕ ТРУБКИ (ШЛАНГИ)
Шланги служат для соединения отдельных частей в приборах, установках, для подвода и отвода воды и газа. Однако резиновые трубки легко разрушаются при действии высокой температуры и некоторых газов (хлор, кислород, аммиак и др.). Поэтому часто применяют трубки из полиэтилена, которые устойчивы к действию большинства органических веществ и агрессивных сред, но при нагревании легко деформируются.
Металлическое оборудование
В химических лабораториях широко применяют разнообразное металлическое оборудование, преимущественно стальное.
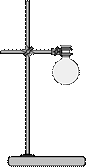
Штатив представляет собой стальной стержень, укрепленный на тяжелой стальной подставке, чаще всего имеющей форму четырехугольника. Обычно стержень укрепляют почти у самого края подставки. Бывают также штативы, у которых стальной стержень укреплен посередине подставки. В этом случае подставка имеет удлиненную форму.
Штативы служат для закрепления на них различных приборов с помощью лапок, колец и муфт (рис. 49, 53).
|
Рисунок 49. – Штатив с лапкой.
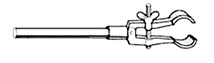
Лапки (рис. 50) бывают самых разнообразных форм и размеров. Они служат для закрепления холодильников, дефлегматоров, делительных воронок, колб, бюреток и т.д.
Внутренняя часть губ лапок обычно покрыта пробкой, чтобы при зажимании не раздавить стекла. Если же пробковая прослойка отсутствует, на губы лапки необходимо натянуть куски резиновой трубки. Закреплять прибор в лапке следует аккуратно, контролируя степень зажима.
|
Рисунок 50. – Лапка.
Муфты (рис. 51) используются для закрепления лапок и колец на штативе.

|
Рисунок 51. – Муфта.
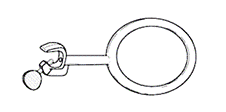
Кольца (рис. 52) служат для закрепления на нужной высоте колб, стаканов и других приборов.
| ОБРАТИТЕ ВНИМАНИЕ!!! При использовании круглодонных колб емкость 1 л и более, для уменьшения нагрузки на дно сосуда, при сборке установки их помещают на кольцо. |
|
Рисунок 52. – Кольцо.

| 
| 
|
Рисунок 53. – Крепления на штативе.
Рисунок 54. – Паровая баня
Масляные и парафиновые бани
Масляные и парафиновые бани используют для нагревания до 250оС, при более высоких температурах они начинают дымить, поэтому работа с ними проводится в вытяжном шкафу. Эти бани обладают относительно большой тепловой инерцией. Баню до половины наполняют минеральными маслами, получаемыми из нефти, и нагреваемый сосуд помещают в баню таким образом, чтобы уровни вещества в сосуде и масла совпали. Максимальная температура, достигаемая с помощью таких бань, зависит от вида применяемого масла, и должна быть на 50о С меньше температуры вспышки масла. Контроль температуры обязательно проводить с помощью контактного термометра.
Применяемое масло должно быть чистым, сухим, без инородных предметов.
| ОПАСНО!!! Необходимо следить, чтобы в горячие масляные бани не попадала вода, т.к. это может привести к сильному вспениванию, разбрызгиванию масла и пожару. |
Для предотвращения попадания воды, конденсирующей на поверхности, обратные холодильники должны иметь около нижнего конца манжету из фильтровальной бумаги.
| ОПАСНО!!! При длительном нагревании до высокой температуры масло в бане может вспыхнуть. Вспыхнувшее масло нельзя тушить ни водой, ни песком. Следует накрывать баню листом асбеста или использовать огнетушитель. |
После работы сразу же следует осторожно обтирать тряпкой, бумагой поверхность колбы, удаляя еще горячее масло.
Гликолевые бани
Часто для нагревания сосуда до температуры 150-200 0С используют гликолевые бани, в которых в качестве теплоносителей применяют этиленгликоль, диэтиленгликоль, полиэтиленкликоль. Такие бани оказываются очень удобными. Попадание в такую баню воды не представляет опасности, а остающийся на поверхности колбы гликоль легко смывается водой. Однако при высоких температурах они тоже дымят, как и масляные бани, потому с ними следует работать только в вытяжном шкафу.
Металлические бани
Для достижения температур выше 100 0С очень часто применяются бани из легкоплавких сплавов (металлические бани) – сплав Вуда или сплав Розе.
Сплав Вуда — тяжелый, легкоплавкий сплав, изобретенный в 1860 году Б.Вудом. Температура плавления 65, 5 °C, плотность 9720 кг/м³. Состав: Олово — 12, 5 %; Свинец — 25 %; Висмут — 50 %; Кадмий — 12, 5 %.
Сплав Розе назван в честь немецкого химика Валентина Розе Старшего. Температура плавления +94 °C. Состав: Олово 25 %; Свинец 25 %; Висмут 50 %. Сплав Розе похож на Сплав Вуда, но отличается от него меньшей токсичностью, так как не содержит кадмия.
Эти сплавы обладают высокой теплопроводностью и позволяют осуществлять быстрый и равномерный обогрев. Их существенными недостатками является высокая цена и при больших размерах бани большая масса при больших размерах бани.
Солевые бани
Для нагревания до температуры выше 100оС можно пользоваться солевыми банями, в которых теплоносителями служат растворы минеральных солей. Как известно, температура кипения растворов солей зависит от природы соли и концентрации раствора. Это дает возможность пользоваться различными степенями нагревания. Солевой раствор можно поместить в обычную водяную баню, при необходимости ее оборудуют приспособлениями для поддерживания постоянного уровня жидкости и постоянной температуры.
Песочные бани
Для осторожного нагревания до высокой температуры или для осторожного прокаливания используют песочные бани. Для этого берут мелкий песок и помещают его в металлическую чашку, насыпая так, чтобы получилась пирамидка. В середину пирамидки устанавливают сосуд, погружая в песок так, чтобы он не касался дна чашки. Температуру нагрева контролируют контактным термометром. Песок для бани должен быть чистым, без механических включений, прокаленным, чтобы сгорели все органические примеси. Песочные бани обладают очень большой тепловой инерцией и с трудом позволяют регулировать температуру. Кроме того, частый контакт стеклянной посуды с песком может приводить к появлению не всегда заметных трещин, что впоследствии, например, при использовании колбы для работы в вакууме, может приводить к взрыву. Поэтому, по возможности, песочные бани следует заменять другими типами нагревательных бань.
Воздушные бани
Из всех теплопроводящих сред, используемых в банях, воздух обладает наименьшей теплопроводностью. Как правило, теплопроводность газов примерно в 20 раз меньше теплопроводности жидкостей, которая в свою очередь примерно в 1000 раз меньше теплопроводности металлов.
Таким образом, переход тепла от газа (например, от горячего воздуха) относительно мал. В случае применения воздушной бани для передачи больших количеств тепла, вероятна опасность перегрева в местах, от которых тепло не отводится внутрь сосуда достаточно быстро (например, в местах, которые не смачиваются кипящей жидкостью). По этой причине воздушные бани не очень пригодны, например, при перегонке больших объемов.
Электрические плитки и колбонагреватели
Для нагревания жидкостных и воздушной бань применяют электрические плитки. Используются плитки с открытой и закрытой спиралью (рис. 55). Первые применяются, если исключено попадание на них нагреваемого вещества. Наиболее удобны и безопасны электрические плиты с закрытой спиралью.

| 
|
| а | б |
Рисунок 55. – Электрические плитки с открытой (а) и закрытой спиралью (б).
| ОПАСНО!!! Запрещается использовать неисправные электрические плитки, имеющие оголенные провода. |
| ОПАСНО!!! Для нагревания легковоспламеняющихся жидкостей запрещается применение любых источников тепла, способных вызвать воспламенение жидкости. |
| ОБРАТИТЕ ВНИМАНИЕ!!! Для нагревания горючих жидкостей с температурой кипения более 100 0С использование электрических плиток с открытой спиралью разрешается только с применением нагревательных бань. |
| ОБРАТИТЕ ВНИМАНИЕ!!! В закрытых вытяжных шкафах разрешается выпаривание горючих жидкостей в количестве не более 250 мл только при условии отсутствия вблизи открытого пламени, равно как и электрических плиток с открытой спиралью |
В последнее время достаточно часто для проведения процессов при нагревании используются колбонагреватели (рис. 56). Они используются для равномерного нагрева плоскодонных и круглодонных сосудов различного объема (от 50 до 2000 мл). Колбонагреватели оснащены регулятором температур. Нагревательный элемент расположен таким образом, что повторяет конфигурацию стеклянной колбы. Это делает работу максимально комфортной и удобной. Колбонагреватели имеют надежную теплоизоляцию, что позволяет избежать термических ожогов при их использовании.

| 
|
Рисунок 56. – Колбонагреватели.
| ОПАСНО!!! Колбонагреватели являются электрическими приборами, поэтому при работе с легковоспламеняющимися жидкостями их использование запрещено. |
Методы выделения и очистки
Органических веществ
Полученные при синтезе вещества, как правило, содержат некоторое количество примесей (исходные вещества, не вступившие в реакцию, побочные продукты, растворители и др.). Чтобы избавиться от них, применяют различные методы очистки и выделения органических веществ. Эти методы довольно разнообразны и зависят, в основном, от агрегатного состояния соединения.
Очистка жидких веществ
Основными видами очистки жидких веществ являются
- простая перегонка,
- фракционная перегонка,
- перегонка в вакууме,
- перегонка с водяным паром,
- экстракция.
Простая перегонка
В тех случаях, когда перегоняемое вещество достаточно устойчиво к нагреванию и практически не разлагается при температуре кипения, для очистки пользуются простой перегонкой при атмосферном давлении .
| ОБРАТИТЕ ВНИМАНИЕ! Простая перегонка применяется в следующих случаях: · для отделения жидкости от растворенных в ней твердых или нелетучих веществ; · для разделения смесей жидкостей, температуры кипения которых различаются более, чем на 80оС. |
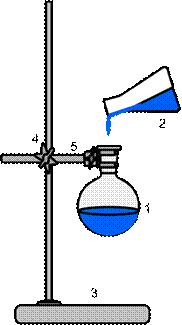
Обычно этот способ перегонки целесообразно применять для жидкостей с температурой кипения до 180оС, так как выше 180оС многие вещества заметно разлагаются. Часто при перегонке температура кипящей жидкости вследствие перегрева несколько выше, чем температура пара. Перегревы, возникающие при отсутствии центров кипения в перегоняемой жидкости, приводят к сильным толчкам, в результате которых вещество вместе с примесями и загрязнениями может быть переброшено в приемник. Существуют различные способы предотвращения или ослабления толчков при кипении. Чаще всего в колбу с жидкостью, подвергаемой перегонке, вносят так называемые «кипелки», роль которых выполняют различные, инертные, пористые материалы (рис. 57).
| ВНИМАНИЕ!!! В перегонную колбу жидкость заливают не более чем на 2/3 ее объема. Для сильно вспенивающихся жидкостей количество жидкости должно быть не более ½ объема колбы. |
| обратите внимание!!! Каждую кипелку можно использовать только один раз, т.к. при охлаждении жидкость заполняет все ее поры и она теряет свои свойства. |
| 
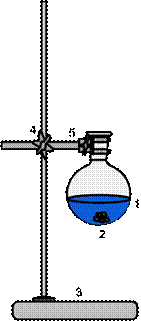
| 
|
| 1 – перегонная колба 2 – перегоняемая жидкость 3 – штатив металлический 4 – муфта 5 – лапка | 1 – перегонная колба 2 – шпатель 3 – кипелки | 1 – перегонная колба 2 – кипелки 3 – штатив металлический 4 – муфта 5 – лапка |
Рисунок 57. - Приготовление смеси для перегонки.
| опасно!!! При нагревании жидкостей выше температуры кипения может произойти перегрев, а затем взрывообразное вскипание. Поэтому при нагревании жидкостей обязательно использование «кипелок», обеспечивающих равномерное кипение по всему объему |
| ОБРАТИТЕ ВНИМАНИЕ!!! Запрещается бросать кипелку в уже нагретую жидкость, т.к. это может вызвать весьма бурное и опасное вскипание жидкости |
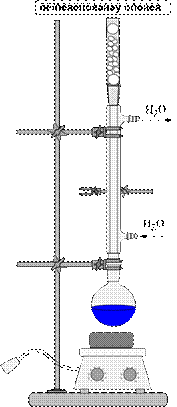
В качестве рабочего сосуда обычно используют круглодонные колбы
(рис. 58). Для перегонки низкокипящих жидкостей берут колбу с высокоприпаянной отводной трубкой, для высококипящих - с низкоприпаянной. Температура кипения обычно контролируется термометром, ртутный шарик которого должен полностью омываться парами кипящего вещества, т.е. верхний край шарика следует устанавливать примерно на 0, 5 см ниже отверстия отводной трубки колбы.
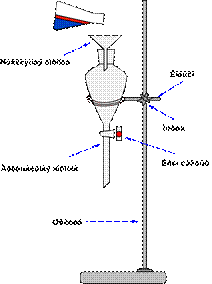
Величину перегонной колбы выбирают в зависимости от количества перегоняемой жидкости и от температуры ее кипения. Жидкость должна занимать не более 2/3 объема колбы. Колба не должна быть слишком большой, особенно при перегонке высококипящих жидкостей, так как в ней остается большое количество перегоняемого вещества. Колбу укрепляют в штативе, зажимая ее лапкой выше отводной трубки. Во избежание загрязнения вещества дистиллят должен по возможности меньше соприкасаться с пробками, поэтому отводную трубку перегонной колбы соединяют с холодильником так, чтобы конец ее выступал из пробки в холодильник не менее чем на 4-5 см и доходил до той части холодильника, который охлаждается водой. Размер холодильника (площадь охлаждения) выбирают в зависимости от температуры кипения отгоняемой жидкости.
Пары веществ, легко кристаллизующихся при комнатной температуре, не должны охлаждаться в холодильнике до температуры затвердевания. Для этого холодильник можно периодически отключать от проточной воды. Жидкости, кипящие в пределах 200-300оС, перегоняются без холодильника, функцию которого в этом случае может выполнять отводная трубка колбы для перегонки. Холодильник соединяют с приемником посредством аллонжа. В качестве приемника обычно употребляют конические или плоскодонные колбы, которые можно поставить на поверхность. При применении в качестве приемников круглодонных колб, их необходимо дополнительно закреплять. Для более полной конденсации паров низкокипящих жидкостей приемник помещают в сосуд с охлаждающей смесью.
Схема установки для простой перегонки показана на рис. 58, 59. Она состоит из перегонной колбы 1 (или колбы Вюрца), термометра 3, нисходящего холодильника Либиха 4, алонжа 5, приемника 6, нагревательного элемента 7. Части прибора крепятся на штативах 8 с помощью муфт 10 и лапок 9. Порядок сборки установки показан на рис. 61. Перед сборкой необходимо проверить колбу на наличие трещин (рис 60)
Когда весь прибор собран, его тщательно проверяют и только тогда начинают нагревать. В зависимости от температуры кипения нагревание ведут, используя различные типы нагревательных бань (рис. 59). Скорость перегонки обычно выбирают такую, чтобы стекало не более 1-2 капель дистиллята в секунду.
Простая перегонка часто применяется для очистки абсолютных растворителей, но в этом случае обязательно к аллонжу присоединяется хлоркальциевая трубка.
| ОБРАТИТЕ ВНИМАНИЕ!!! Перед началом работы необходимо проверить все стеклянные приборы на наличие трещин (звездочек). В случае их обнаружения обязательно произвести замену |
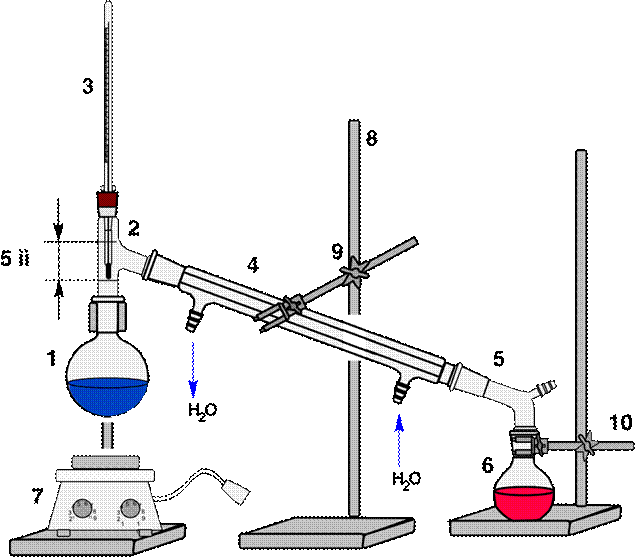
|
| 1 – перегонная колба, 2 – переходник, 3 – термометр, 4 – холодильник Либиха, 5 – алонж, 6 – колба приемник, 7 – плитка электрическая, 8 – штатив, 9 – муфта, 10 - лапка |
Рисунок 58. - Схема установки для простой перегонки без бани.
| ОБРАТИТЕ ВНИМАНИЕ!!! При использовании круглодонных колб емкость 1 л и более, для уменьшения нагрузки на дно сосуда, при сборке установки их помещают на кольцо |
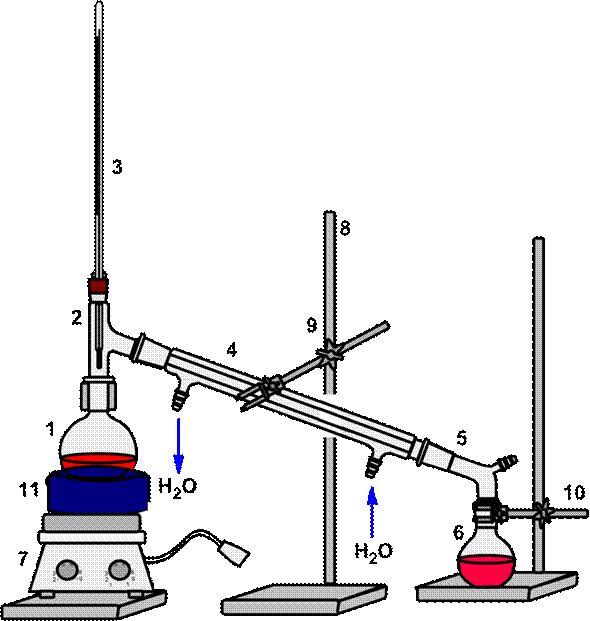
|
| 1 – перегонная колба, 2 – переходник, 3 – термометр, 4 – холодильник Либиха, 5 – алонж, 6 – колба приемник, 7 – плитка электрическая, 8 – штатив, 9 – муфта, 10 – лапка, 11 – водяная баня |
Рисунок 59. – Схема установки для простой перегонки на бане.

| |
| Рисунок 60 Колба с трещиной (звездочкой) | |
|
| |
|
| |
| | |
| 1 – перегонная колба, 2 – переходник, 3 – термометр, 4 – холодильник Либиха, 5 – алонж, | |
Рисунок 61. Порядок сборки установки для простой перегонки
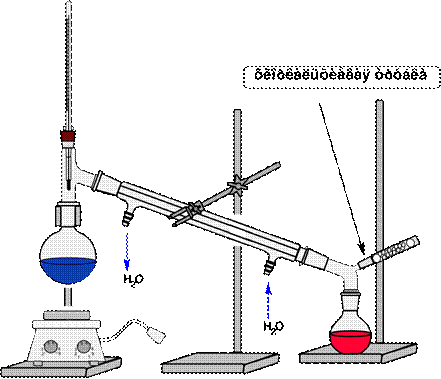
Фракционная перегонка
Фракционной перегонкой называют такой способ ведения ее, когда из смесей жидкостей с различными температурами кипения выделяются отдельные компоненты. Фракционная перегонка применяется для разделения смеси жидкостей с разницей в температурах кипения от 20 о С до 80о С.
Более тщательное разделение смеси нескольких жидкостей, кипящих в узком интервале температур, на относительно чистые отдельные компоненты достигается применением дефлегматора. Принцип работы дефлегматора заключается в том, что при неполном охлаждении пара кипящего раствора, происходит частичная конденсация пара более высококипящей жидкости. Образовавшийся конденсат называется флегма (от греч. ph1еgmа - слизь, мокрота).
| ВНИМАНИЕ!!! Перед началом работы необходимо проверить все стеклянные приборы на наличие трещин (звездочек). В случае их обнаружения обязательно произвести замену |

|
| Рис. Колба с трещиной (звездочкой) |
Флегма стекает обратно в испарительную емкость, а пар обогащается более летучим компонентом и выводится в холодильник, где происходит его охлаждение, конденсация и переход в жидкую фазу (дистиллят). Применение дефлегматора при дробной перегонке способствуют выделению фракций с узким интервалом температуры кипения. При этом полученные дистилляты имеют разный состав. Отводят их (последовательно во времени) в разные приемные емкости. В первой, по времени отбора емкости, будет дистиллят, наиболее богатый низкокипящими компонентами, во второй емкости - менее богатый, и т.д. В каждом из этих дистиллятов (фракциях), преобладает один или несколько компонентов исходной смеси с близкими физико-химическими свойствами.
Схема установки фракционной перегонки представлена на рис. 62.
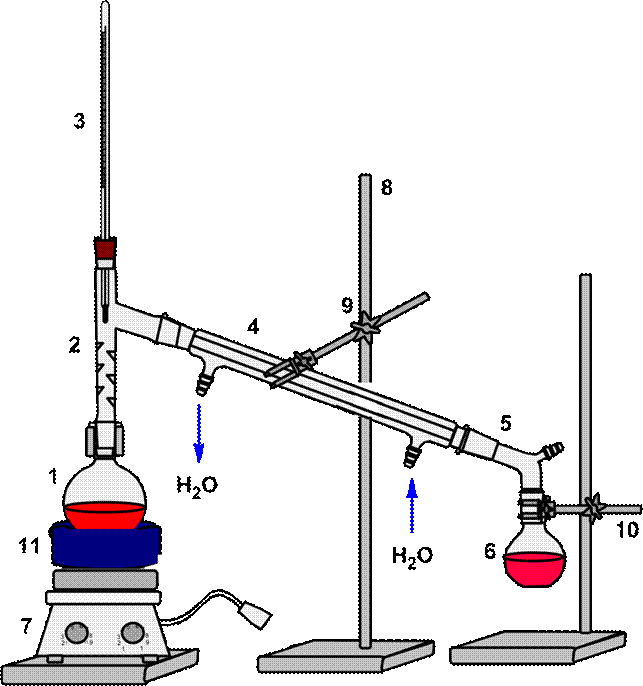
|
| 1 – перегонная колба, 2 – переходник, 3 – термометр, 4 – холодильник Либиха, 5 – алонж, 6 – колба приемник, 7 – плитка электрическая, 8 – штатив, 9 – муфта, 10 – лапка, 11 – водяная баня |
Рисунок 62. – Схема установки для фракционной перегонки.
Рисунок 64. – Установка для вакуумной перегонки.
| ОБРАТИТЕ ВНИМАНИЕ!!! Перед началом работы необходимо проверить все стеклянные приборы на наличие трещин (звездочек). В случае их обнаружения обязательно произвести замену |

|
| Рис. Колба с трещиной (звездочкой) |
Схема установки для перегонки при пониженном давлении показано на рис. 64. Она состоит из перегонной колбы (часто колбы Кляйзена) 1 термометра 3, холодильника 4, алонжа 5 и приемника 6. Колбу закрывают пробкой со стеклянной трубкой, оттянутой на конце в тонкий капилляр 11. Верхнюю часть этой трубки соединяют с резиновым шлангом, имеющим зажим. При пониженном давлении в колбе через этот капилляр проходят в перегоняемую жидкость пузырьки воздуха, что способствует равномерному перемешиванию и кипению жидкости. Скорость пропускания пузырьков воздуха регулируют зажимом на отрезке шлага. Чтобы зажим не полностью перекрывал резиновый шланг, в него вставляют тонкую проволоку. Перегонную колбу соединяют с нисходящим холодильником Либиха 4 с помощью насадки 2 (при использовании колбы Кляйзена насадка не применяется). Алонж 5 должен иметь отвод для соединения системы с масляным, вакуумным или водоструйным насосом 12. Если нужно собрать все фракции, входящие в состав перегоняемой смеси, применяют специализированные аллонжи («пауки»), позволяющие крепить несколько приемников (круглодонные колбочки). Давление, при котором осуществляют перегонку, измеряют ртутным манометром, присоединенным к системе. Чтобы избежать переброса продуктов в насос (при использовании масляного насоса), между ними и прибором устанавливают поглотительную систему (колонки с активированным углем и твердым гидроксидом натрия или калия). Если пользуются водоструйным насосом, то применяют предохранительную склянку. Нагревание производят с помощью электроплитки (7) с баней или без нее. Установка крепится на металлический штатив 8 с помощью муфт 9 и лапок 10.
Работа с установкой требует особого соблюдения правил техники безопасности. После того как прибор собран, необходимо убедиться в его полной герметичности и только затем заполняют перегонную колбу жидкостью. Перегонку проводят в защитных очках, а еще лучше в защитной маске. Во избежание взрыва нельзя перегонять вещества досуха. При выключении системы воздух не должен быстро входить в нее.
Создание ВаКУУМА
В химических лабораториях широко используются разнообразные вакуумные насосы. Самым простым и распространенным среди них является водоструйный насос (рис. 65, 66).
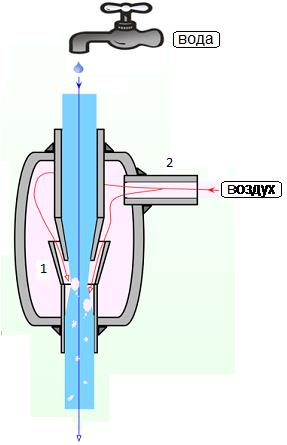
Водоструйный насос — вакуумный насос, использующий для создания разрежения струю воды, которая течёт сквозь него (рис. 65). Создаваемое разрежение определяется давлением паров воды при данной температуре, и, в случае использования холодной водопроводной воды, составляет около 20 мм. рт. ст. Водоструйные насосы изготавливаются из стекла, стали, пластмасс (тефлона) и широко используются в лабораторной практике.
В водоструйном насосе вакуум создается согласно закону Бернулли, который описывает течение жидкости по трубкам с переменным диаметром.
При стационарном течении жидкости сумма статического и динамического давлений ( кинетической энергии, отнесенной к единице объема)
постоянна.
Когда трубка сужается, скорость жидкости в ней растет, и динамическое давление увеличивается. Одновременно статическое давление в узкой трубке уменьшается (поскольку сума должна быть постоянна).
|
Рисунок 65. Принцип работы водоструйного насоса
При переходе из широкой части трубки в более узкую степень сжатия жидкости уменьшается (давление снижается), а при переходе из более узкой части в широкую — увеличивается (давление увеличивается).
Согласно закону Бернулли, в суженной части давление будет понижено. Можно так подобрать форму трубы и скорость потока, что в суженной части давление воды будет меньше атмосферного. Если теперь присоединить к узкой части трубы отводную трубку, то наружный воздух будет засасываться в место с меньшим давлением: попадая в струю, воздух будет уноситься водой.
Именно в этом и состоит принцип водоструйного насоса. В изображенной на рис. модели водоструйного насоса засасывание воздуха производится через кольцевую щель 1, вблизи которой вода движется с большой скоростью. Отросток 2 присоединяется к откачиваемому сосуду. Водоструйные насосы не имеют движущихся твердых частей (как, например, поршень в обычных насосах), что составляет одно из их преимуществ.
Итак, главной частью водоструйного насоса являются два капилляра, вставленные один в другой.
| 
| 
|
Рисунок 66. Варианты водоструйных насосов
Перегонка с водяным паром
Перегонка с водяным паром является эффективным методом очистки жидких органических соединений, нерастворимых или труднорастворимых в воде. Она особенно пригодна в тех случаях, когда продукт реакции загрязнен большим количеством труднолетучих смолистых примесей.
Теоретическое обоснование.
В случае практически нерастворимых друг в друге жидкостей испарение каждой из них идет независимо от другой. Давление паров каждого компонента при неизменной температуре остается постоянным при любых соотношениях масс взятых жидкостей.
Принимая систему за идеальную, по закону Рауля можно найти давление пара каждой жидкости над смесью, а по закону Дальтона - общее давление паров над смесью.
| Закон Рауля PA=PA·XA PB=PB·XB | Закон Дальтона P=PA+PB |
Так как для взаимно несмешивающихся жидкостей XA=1; XВ=1 (мольные доли веществ A и B в жидкости), то:
| P = P A + P B |
Из уравнения видно, что общее давление паров над системой из двух несмешивающихся жидкостей всегда больше, чем давления паров чистых веществ. Т.к. условием начала кипения является равенство давления паров над жидкостью внешнему давлению, то при нагревании общее давление пара над системой достигает значения внешнего давления раньше, чем это возможно для паров чистых веществ. Поэтому такие жидкости всегда кипят при более низкой температуре, чем компоненты, образующие их (табл. 9, 10). Температура кипения остается постоянной, пока полностью не отгонится один из компонентов.
Таблица 9. Давление паров смеси бромбензола и воды
| Температура | Давление пара, мм. рт. ст., | ||
| Вода, PA | Бромбензол, PB | Смесь, P=PA+PB | |
| 30 | 32 | 6 | 38 |
| 40 | 55 | 10 | 65 |
| 50 | 92 | 17 | 109 |
| 60 | 149 | 28 | 177 |
| 70 | 233 | 44 | 277 |
| 80 | 355 | 66 | 421 |
| 90 | 526 | 98 | 624 |
| 95 | 634 | 118 | 752 |
| 95, 5 | 646 | 120 | 766 |
| 100 | 760 | 141 | 901 |
Таблица 10. Давление паров смеси анилина и воды
| Температура | Давление пара, мм. рт. ст., | ||
| Вода, PA | Анилин, PB | Смесь, P=PA+PB | |
| 98 | 707 | 42 | 749 |
| 98, 5 | 720 | 43 | 763 |
| 99 | 733 | 44 | 777 |
Исходя из закона Дальтона, можно определить количество вещества, а затем и массу его в паровой смеси.
| P=PA+PB | 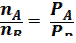
| 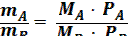
| P – давление паров смеси А+B PA – давление паров А PB – давление паров B nA – количество вещества А nB – количество вещества B mA – масса А в паровой смеси mB – масса B в паровой смеси MA – молекулярная масса А MB – молекулярная масса B |
| Пример: Какую долю анилина содержит смесь после перегонки с паром? Pанилина = 43 мм. рт. ст., Pводы = 720 мм. рт. ст Манилина = 93, Mводы = 18
т.е. на 1 г анилина приходится 3, 24 г воды. Т.о. в смеси содержится около 23, 6 % анилина | |||
Для перегонки с водяным паром применяют установку, которая состоит из парообразователя 6, перегонной колбы 1, холодильника 3, алонжа 4 и приемника 5 (рис. 67).
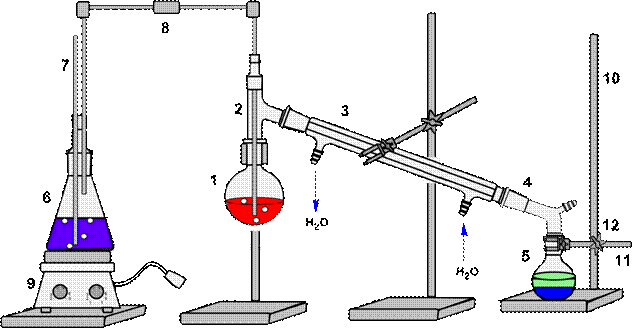
|
| 1 – перегонная колба, 2 – переходник, 3 – холодильник Либиха, 4 – алонж, 5 – колба-приемник, 6 – паровик, 7 – трубка предохранительная, 8 – паровая линия, 9 – плитка электрическая, 10 – штатив, 11 - лапка, 12 – муфта |
Рисунок 67. – Установка для перегонки с водяным паром.
Парообразователь заполняют водой приблизительно до половины и соединяют с колбой. На тройник, который связывает между собой парообразователь и колбу, надевают короткую резиновую трубку с зажимом 8. Зажим остается открытым до начала перегонки для того, чтобы в перегонной колбе не собирался конденсат в результате охлаждения водяных паров. Колбу плотно закрывают резиновой пробкой с двумя отверстиями. В одно отверстие помещают стеклянную трубочку, нижний конец которой доходит почти до дна колбы, а верхний с помощью короткой резиновой трубки соединяют через тройник с парообразователем. Во второе отверстие вставляют короткую, изогнутую под углом в 30-45о стеклянную трубку, соединяющую колбу с холодильником. Вместо пробки с двумя отверстиями можно использовать специальную насадку 2. В колбу помещают вещество, собирают прибор и подогревают парообразователь на электроплитке 9. Образующий водяной пар по резиновой трубке поступает в колбу с веществом, нагревает его. Смесь паров из перегонной колбы поступают в прямой холодильник с водяной рубашкой, где конденсируются. Спустя некоторое время в приемнике собирается эмульсия (вещество в воде), расслаивающаяся при стоянии. В зависимости от плотности перегоняемое вещество будет образовывать верхний или нижний слой. Перегонку заканчивают, когда в холодильнике будут образовываться капли чистого дистиллята (воды). Затем открывают зажим на тройнике (чтобы жидкость из колбы не перебросило в парообразователь) и выключают нагрев.
При перегонке малолетучих веществ пользуются перегретым водяным паром, для получения которого между парообразователем и перегонной колбой включают пароперегреватель (представляющий собой медную трубку, закрученную в пирамиду и снабженную гильзой для термометра). Пароперегреватель нагревается до нужной температуры газовой горелкой. При перегонке с перегретым водяным паром перегонную колбу нагревают на бане, температура которой примерно на 10° выше температуры перегретого пара.
После отсоединения приемника дистиллята от холодильника содержимое переливают в делительную воронку и удаляют водную фазу (рис. 68).
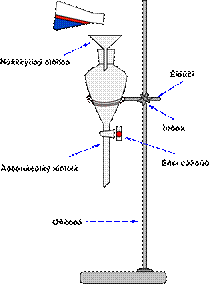
|
| 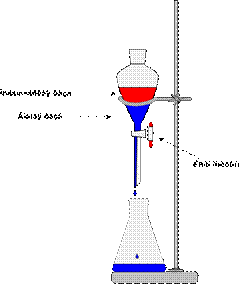
| |
|
|
| ||
Рисунок 68. – Разделение эмульсии на делительной воронке.
КРИСТАЛЛИЗАЦИЯ
Рисунок 69. – Кристаллизаторы.
Сильно загрязненные вещества, обычно, плохо кристаллизуются. Примеси, как правило, замедляют процесс кристаллизации, вероятно в виду их адсорбции на поверхности центров кристаллизации, и способствуют образованию нечистых и плохо сформированных кристаллов, так как мешают быстрой и правильной ориентации молекул вещества на поверхности кристалла. Так, сахароза, содержащая 30% примесей, кристаллизуется в 2 раза медленнее, чем сахароза с 28% примесей, и в 30 раз медленнее, чем чистая сахароза.
В некоторых случаях процесс кристаллизации протекает крайне медленно. Если кристаллизация при охлаждении сразу не наступает, необходимо оставить раствор стоять, по меньшей мере, на сутки, а иногда и на значительно более долгое время.
Следует также иметь в виду, что образование крупных, хорошо сформированных кристаллов, наблюдающееся при медленном охлаждении раствора, нередко может приводить к получению менее чистого продукта, так как крупные кристаллы обычно содержат включения маточного раствора. Относительно мелкие кристаллы, получающиеся при быстром охлаждении и перемешивании раствора, гораздо чище и более однородны по форме. Впрочем, если кристаллы слишком мелки, на их поверхности возможна адсорбция примесей из раствора, что также нежелательно.
Насыщенный раствор — раствор, в котором растворённое вещество при данных условиях достигло максимальной концентрации и больше не растворяется. Осадок данного вещества находится в равновесном состоянии с веществом в растворе.
Пересыщенный раствор — раствор, содержащий при данных условиях больше растворённого вещества, чем в насыщенном растворе, избыток вещества легко выпадает в осадок. Обычно пересыщенный раствор получают охлаждением раствора, насыщенного при более высокой температуре (пересыщение).
Скорость кристаллизации
Скорость кристаллизации определяют преимущественно три фактора:
1. изменение растворимости вещества, т. е. степени насыщенности раствора, в связи с изменением температуры;
2. скорость возникновения центров кристаллизации;
3. скорость роста кристаллов.
Наиболее быстро кристаллизация происходит при температуре на 20–50 оС ниже температуры плавления. Вблизи же температуры плавления вещества происходит резкое падение скорости кристаллизации, что объясняется увеличением влияния выделяющейся теплоты кристаллизации.
Слишком сильное охлаждение часто препятствует кристаллизации. Это в большей степени объясняется увеличением вязкости, которая тормозит правильную ориентацию молекул вещества друг относительно друга и относительно уже имеющейся поверхности кристалла.
Стимуляция кристаллизации
Часто, кристаллическое вещество не выделяется из пересыщенного раствора или же расплавленное вещество не кристаллизуется даже при охлаждении. В таком случае, обычно, применяются несколько приемов, стимулирующих кристаллизацию.
Температурная стимуляция
Часто если быстрой кристаллизации при охлаждении не происходит можно оставить раствор с исследуемым веществом на сутки или более продолжительное время при температуре примерно на 100 оС ниже ожидаемой температуры плавления, после чего выдержать его при температуре на 50 и затем на 30 оС ниже температуры плавления, чтобы образовавшиеся активные центры дали нужный рост кристаллов.
Трение стеклянной палочкой
Широко распространенный и весьма эффективный прием стимулирования кристаллизации заключается в трении стеклянной палочкой о внутренние стенки сосуда. При этом образуется мелкая стеклянная пыль, отдельные частички которой могут случайно оказаться подходящими центрами кристаллизации. Такую же роль могут играть и отдельные точки на образовавшейся в результате трения шероховатой поверхности стекла.
Значение пылинок, всегда находящихся в воздухе лаборатории, очень важно для процесса кристаллизации. Нередко, если кристаллизации не происходит даже при стимуляции, раствор, расплав исследуемого вещества или масло, в виде которого оно выделилось, оставляют в открытом сосуде (колба, стакан, чашка Петри) на долгое время, рассчитывая на возможное попадание на поверхность жидкости таких пылинок, которые вызовут кристаллизацию.
Кристаллизация всегда начинается от стенок сосуда и от поверхности жидкости к центру, а не наоборот. Неверно считать причиной этого явления охлаждение внешних слоев жидкости, так как подобным же образом происходит и кристаллизация вещества из пересыщенных растворов, не подвергаемых охлаждению.
Кристаллизация всегда начинается на твердых поверхностях или на границе раздела фаз. Возможно, и в этих случаях решающее значение имеют определенные твердые частички, плотно приставшие к стенкам или собирающиеся обычно на поверхности жидкости.
Часто можно наблюдать, что повторная кристаллизация в одном и том же сосуде начинается в тех же точка, что и первый раз. Это свидетельствует о наличии центров кристаллизации, не изменяющихся при полном растворении или расплавлении вещества.
И все же часто причиной невозможности кристаллизации является низкая концентрация вещества в растворе, (ненасыщенный раствор). В таком случае часть растворителя необходимо удалить, например, путем выпаривания.
Выпаривание
Выпаривание – процесс концентрирование растворов путём частичного испарения растворителя при
кипении
Выпаривание чаще всего производится при повышенной температуре, иногда при кипении, и/или под вакуумом. На испарение растворителя расходуется тепловая энергия, которую следует подводить извне. При выпаривании повышаются концентрация, плотность и вязкость раствора, а также температура его кипения. При пересыщении раствора растворённое вещество выпадает в осадок.
Наиболее часто в органическом синтезе для выпаривания используется роторный испаритель (рис. 70).
Роторный вакуум - испаритель - прибор, предназначенный для автоматизации перегонки жидкостей при уменьшенном давлении.
Принцип действия
Перегонная колба (А) на шлифе вращается с помощью электромотора (С), что позволяет увеличить поверхность жидкости, которая в виде тонкой плёнки смачивает стенки колбы, и тем самым уменьшить время перегонки и мощность нагрева. Нагрев бани осуществляется термонагревательными элементами, которые передают тепло воде (водяная баня) либо высококипящему маслу (масляная баня), если требуется нагрев выше 100 0С (B). Через трубку (H) прибор подключают к водоструйному или масляному насосу. Пары растворителя конденсируются в холодильнике (F) и стекают в колбу-приёмник (G).
В принципе, возможно применение любого холодильника с подходящим по диаметру шлифом, однако в виду того, что при отгонке летучих растворителей часть паров будет " проскакивать" холодильник и уходить в атмосферу, можно регенерировать лишь половину растворителя или меньше. В связи с этим наиболее рациональным является использование, по возможности, наиболее эффективных холодильников с двойной рубашкой и спиралью.
Иногда, чтобы не потерять большое количество очень летучего растворителя, или предотвратить бурное вскипание и выброс раствора в холодильник (после чего ротор придётся чистить изнутри) имеет смысл производить перегонку при неполном вакууме, слегка приоткрывая кран-задвижку (H), или вовсе не использовать вакуум.
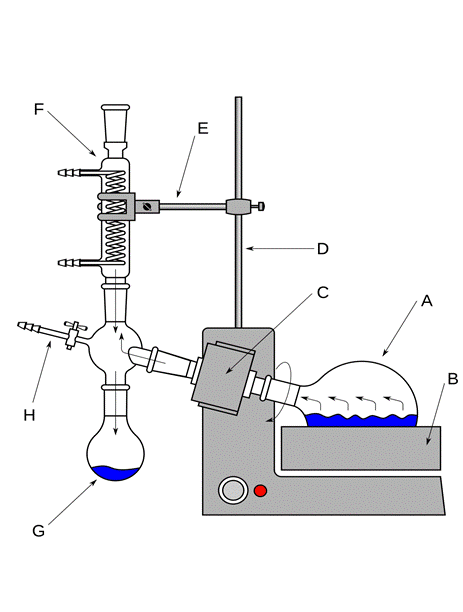
|
| А – Перегонная колба, B – Нагревательный элемент, С – Мотор, D – Штатив, Е – Лапка, F – Холодильник, G – Колба-приемник, H – Трубка с краном для подключения вакуум-линии |
Рисунок 70. Роторный испаритель
Современные роторные испарители имеют микропроцесорный контроль температуры и скорости вращения, некоторые снабжены электроприводом для подъёма-опускания водяной бани.
Роторные испарители подходят для непрерывной и периодической дистилляции при нормальном давлении и в вакууме. Основным преимуществом роторных испарителей является безопасная тепловая обработка чувствительных к температуре сред. Ограничения в использовании роторных испарителей возникают в случае относительно длительного времени выдержки и образовании вязкого конечного продукта. Роторный испаритель позволяет обработать субстанцию с вязкостью до 5000 сПз (мПа). Роторные испарители могут использоваться для упаривания суспензий, проведения кристаллизации и сушки порошков и гранулатов. Также возможно проведение некоторых химических реакций.
Водные растворы можно выпаривать, нагревая их в круглодонной, плоскодонной колбе или фарфоровой чашке на электрической плитке. Небольшие количества органических растворителей (кроме легковоспламеняющихся жидкостей) допускается отгонять на электрических плитках (за исключением плиток с открытой спиралью) (рис 71).
  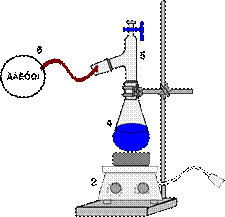
|
| 1 – колба для отгона, 2 – плитка электрическая, 3 – фарфоровая чашка, 4 – колба для отгона, 5 – переходник с затвором, 6 – вакуум-линия |
Рисунок 71. – Варианты установок для упаривания водных растворов и отгонки органических растворителей
Наиболее часто небольшие количества органических растворителей отгоняют при пониженном давлении. Однако при этом происходит утечка испаряющихся паров растворителя с водой водоструйного насоса (рис ).
| ОБРАТИТЕ ВНИМАНИЕ!!! В закрытых вытяжных шкафах разрешается выпаривание горючих жидкостей в количестве не более 250 мл только при условии отсутствия вблизи открытого пламени, равно как и электрических плиток с открытой спиралью. |
Часто, при работе с малыми количествами веществ, для испарения небольшого количества растворителя используют чашки Петри.
Чашка Петри (англ. Petri dish, нем. Petrischale) — лабораторная посуда, имеет форму невысокого плоского цилиндра, закрывается крышкой подобной же формы, но несколько большего диаметра. Применяется в биологии и химии.
Посуда, изобретённая в 1877 году, названа в честь изобретателя, немецкого бактериолога Юлиуса Рихарда Петри, ассистента Роберта Коха.
Чашка Петри обычно изготавливается из прозрачного стекла или пластмассы (прозрачный полистирол) и может иметь самые различные размеры. Наиболее часто используемые варианты имеют диаметр порядка 50 — 100 мм и высоту около 15 мм.
Кроме того, чашка Петри зачастую используется для хранения малых количеств веществ
Фильтрование
Фильтрование - процесс отделения твердой фазы смеси, находящихся в осадке, от жидкой фазы (маточного раствора) через пористую перегородку – фильтр
В качестве фильтра обычно используют фильтровальную бумагу, которая может быть различной пористости. Фильтрами могут служить также различные ткани, пористое стекло, асбест, обычная и стеклянная вата и др. При этом необходимо помнить, что фильтрующие материалы не должны взаимодействовать ни с растворителем, ни с отделяемым осадком.
Фильтрование можно проводить различными способами. Это определяется как характером растворителя, так и свойствами отделяемого вещества при фильтровании. Обычно пользуются двумя способами фильтрования: при атмосферном и пониженном давлении.
Рисунок 72 - Процесс складывания фильтровальной бумаги «гармошкой»
Фильтр (простой или складчатый) вставляют в воронку, укрепленную в кольце, которое присоединено к штативу зажимом. Под воронку ставят стакан, и прибор для фильтрования холодных растворов готов (рис. 73).
|
| 1 – колба Эрленмейера, 2 – стеклянная воронка, 3 – фильтровальная бумага, 4 – суспензия, 5 – фильтрат |
Рисунок 73 – Установка для фильтрования при атмосферном давлении.
Для фильтрования горячих растворов применяют специальную воронку, обогреваемую электрической спиралью или горячей водой (рис. 74).

|
| 1 – паровик, 2 – трубка предохранительная, 3 – змеевик, 4 – горячий раствор, 5 – колба с очищенным раствором, 6 – плитка электрическая |
Рисунок 74. – Установка для горячего фильтрования.
Осадки, полученные фильтрованием при атмосферном давлении, содержат до 30% растворителя.
Рисунок 75. – Установка для фильтрования при пониженном давлении.

| 1 – колба Бунзена, 2 – воронка Бюхнера, 3 – предохранительная склянка, 4 – водоструйный насос, 5 – водопроводный кран |
Рисунок - Схема установки фильтрования в вакууме.
Для предотвращения последствий возможного разрыва колбы Бунзена в ходе фильтрования ее необходимо обернуть полотенцем. На дно воронки Бюхнера кладут бумажный фильтр, смоченный растворителем. Диаметр фильтра должен быть немного меньше внутреннего диаметра воронки, но таким, чтобы фильтр полностью закрывал все отверстия воронки. Водоструйный насос при нормальном напоре воды может создавать вакуум в 1-2 кПа (8-15 мм рт. ст.). Чтобы в колбу Бунзена случайно не попала вода из водоструйного насоса, между ним и колбой устанавливают предохранительную склянку (некоторые конструкции водоструйных насосов позволяют обходиться без предохранительных склянок). Фильтруемую жидкость необходимо доливать равномерно, чтобы осадок все время находился под слоем жидкости. Нужно стараться, чтобы осадок не попадал между фильтром и дном воронки Бюхнера, иначе некоторая часть осадка может попасть в колбу Бунзена (рис. 76).
После окончания фильтрования осадок на фильтре промывают чистым растворителем, отжимают стеклянной пробкой (рис. 76). Если осадок легко окисляются кислородом воздуха, гигроскопичен, или взаимодействует с СО2 воздуха, то процесс фильтрования следует проводить в атмосфере инертного газа.
Полученные таким образом осадки содержат 5-10 % растворителя.
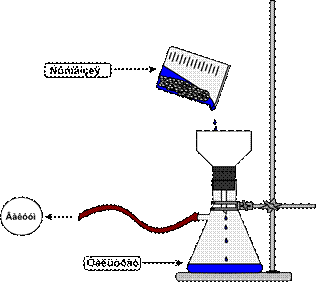
| 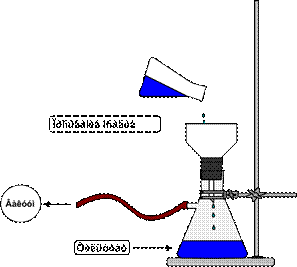
|
Рисунок 76. – Выполнение фильтрования при пониженном давлении.
| 
|
| а – подсоединение к вакуум-линии | б – установка воронки Бюхнера |
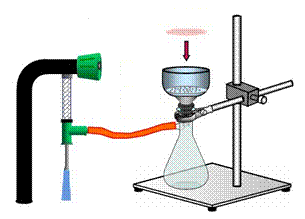
| 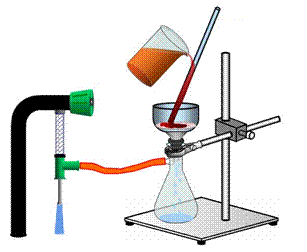
|
| в – установка бумажного фильтра | г - фильтрование |
Рисунок 77 – Стадии фильтрования в вакууме
Экстракция
Рисунок 78. – Последовательность выполнения экстракции из раствора
Распределение вещества между двумя фазами определяется коэффициентом распределения, пропорциональным растворимостям вещества в каждом растворителе. Поэтому при однократном экстрагировании извлечение вещества будет не всегда полным. Экстрагирование следует повторять три- четыре раза, лучше всего проводить его несколько раз малыми порциями, чем использовать всю экстрагирующую жидкость за один прием. Это позволяет уменьшить объем экстрагента.
Для того чтобы определить, закончилось экстрагирование или нет, несколько капель последней порции экстракта упаривают на часовом стекле досуха. Если проба испаряется без остатка, экстрагирование прекращают.
Полученные экстракты обычно промывают в делительной воронке щелочными или кислыми водными растворами, а затем водой. Следует всегда помнить, что при промывке экстрактов растворами карбонатов, вследствие выделения углекислого газа, в делительной воронке может создаться повышенное давление. Чтобы избежать этого, делительную воронку в процессе промывки нужно как можно чаще соединять с атмосферой. После промывки экстракты, обычно, сушат подходящим осушителем.
Требования к растворителям, применяемых при экстракции.
Растворитель должен:
1. быть химически инертен (химически не взаимодействовать ни с экстрагируемым веществом, ни с растворителем, из которого идет экстракция);
2. мало растворяться (не смешиваться) в другом растворителе, который содержит экстрагируемое вещество;
3. заметно лучше (в 2-4 раза) растворять экстрагируемое вещество, чем растворитель, из которого это вещество экстрагируют;
4. не должно химически взаимодействовать ни с экстрагируемым веществом, ни с растворителем, в котором оно растворено;
5. легко удаляться при выделении из него экстрагируемого вещества;
6. быть наиболее безопасным, наименее взрыво- и пожароопасным, токсичным.
Рисунок 79. – Экстракционный аппарат Сокслета
Рис. 80. - Составляющие элементы аппарата Сокслета.
Возгонка
Перекристаллизация
ПЕРЕКРИСТАЛЛИЗАЦИЯ является одним из важнейших методов, применяемых для очистки твердых
органических веществ.
Рисунок 82. - Схема установки для перекристаллизации из воды.
| 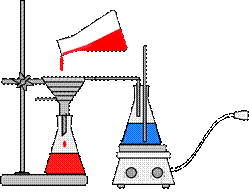
| 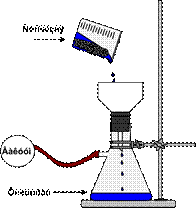
|
| Приготовление насыщенного раствора | Установка для горячего фильтрования | Установка для фильтрования в вакууме |
Рисунок 83. - Схема установки для перекристаллизации из
органического растворителя.
СУШКА ЖИДКОСТЕЙ
В химических лабораториях расходуется большое количество различных растворителей, причем во многих случаях содержание воды в них должно быть ничтожным. Растворы многих органических соединений перед тем, как их подвергнуть перегонке, необходимо избавить от растворенной в них воды, так как ее присутствие при нагревании может привести к разложению перегоняемых веществ. Кроме того, наличие воды в растворе при перегонке ведет к появлению новых фракций. Это связано с потерей основного вещества. Поэтому химику часто приходится сушить органические жидкости.
Широко распространены методы сушки жидкостей при помощи осушающих веществ, которые связывают воду, растворенную в органических жидкостях. Основное требование к осушающим веществам состоит в том, чтобы они не взаимодействовали ни с растворителем, ни с растворенными в нем веществами. Не все осушающие вещества одинаково эффективны. Это обстоятельство всегда необходимо учитывать при их выборе.
| ОБРАТИТЕ ВНИМАНИЕ!!! Осушитель должен удовлетворять следующим основным требованиям: 1. не должен химически взаимодействовать с высушиваемым органическим веществом; 2. не должен каталитически способствовать самоокислению, полимеризации и конденсации высушиваемых соединений; 3. не должен заметно растворяться в органической жидкости; 4. должен высушивать быстро и эффективно; 5. должен быть доступным. |
Максимальная эффективность осушителя определяется упругостью водяных паров над ним (табл.11).
Таблица 11. Упругость водяных паров осушителей
| Вещества | Упругость водяных паров, мм. рт. ст. |
| Р2О5 (Р4О10) | 0, 00002 |
| Mg(ClO4)2 | 0, 0005 |
| KOH | 0, 002 |
| Al2O3 | 0, 003 |
| CaSO4 | 0, 004 |
| H2SO4 | 0, 005 |
| Силикагель | 0, 006 |
| NaOH | 0, 15 |
| CaO | 0, 2 |
| CaCl2 | 0, 2 |
| CuSO4 | 1, 3 |
В таблице 12 приведены сведения о веществах, применяемых для сушки различных классов органических соединений.
Таблица 12 - Осушители для сушки органических жидкостей
| Вещества | Вещества для которых используется осушитель | Вещества для которых нельзя использовать осушитель | Примечание |
| Р2О5 (Р4О10) | Нейтральные и кислые газы, углеводороды, галогеноуглеводоро-ды, растворы кислот, сероуглерод, в качестве осушителя в эксикаторах и сушильных пистолетах | Вещества основного характера, спирты, простые эфиры | Расплывается, при сушке газов осушитель необходимо смешивать с наполнителем |
| H2SO4 | Нейтральные и кислые газы, в качестве осушителя в эксикаторах и сушильных пистолетах | Ненасыщенные соединения, спирты, кетоны, основания | Не применяется при сушке веществ в вакууме при повышенных температурах |
| Натронная известь, CaO, BaO | Нейтральные и основные газы, амины, спирты, простые эфиры | Альдегиды, кетоны, вещества кислого характера | Особенно часто используются для сушки газов |
| NaOH, KOH | Аммиак, амины, простые эфиры, углеводороды, в качестве осушителя в эксикаторах | Альдегиды, кетоны, вещества кислого характера | Расплываются |
| К2СО3 | Кетоны, амины, спирты | Вещества кислого характера | Расплывается |
| Na | Углеводороды, простые эфиры, третичные амины | Галогеноуглеводо-роды, спирты, фенолы, вещества кислого характера, окислители | Остатки после осушения разлагать только спиртом |
| CaCl2 | Углеводороды, кетоны, простые эфиры, алифатические и ароматические галогенопроизводные | Спирты, аммиак, амины | Содержит примеси основного характера |
| MgSO4, Na2SO4, CaSO4 | Альдегиды, кетоны, кислоты, галогенопроизводные, сложные и простые эфиры, растворы веществ, изменяющиеся под влиянием кислых или основных осушителей | - | - |
| Mg(ClO)4 | Газы, в том числе аммиак, в качестве осушителя в эксикаторах | Легкоокисляющиеся органические жидкости | - |
| Силикагель | В качестве осушителя в эксикаторах | - | Поглощает остаточные количества растворителя |
Наиболее эффективными осушающими вещества являются фосфорный ангидрид, натрий, гидроксид калия, гидроксид натрия, серная кислота.
Жидкость, которую нужно подвергнуть сушке, наливают в плоскодонную колбу, бутыль или пробирку и добавляют осушающее вещество. Если в процессе сушки не происходит выделение газообразных веществ, то горло сосуда закрывают пробкой, в противном случае пробкой с хлоркальциевой трубкой. Время от времени сосуд встряхивают. Сушка продолжается несколько часов или дней. В некоторых случаях для ускорения сушки осушаемую жидкость нагревают с осушаемым веществом в круглодонной колбе, снабженной обратным холодильником. Совершенно естественно, что при этом не должно происходить никаких побочных реакций. После окончания сушки жидкость фильтруют или сливают декантацией и подвергают разгонке.
СУШКА ТВЕРДЫХ ВЕЩЕСТВ
Осадки, снятые с фильтра или выгруженные из центрифуги, всегда содержат некоторое количество растворителя: при атмосферном фильтровании - примерно 30 %, при вакуумном фильтровании – 5-10 % растворителя. Существуют различные методы сушки. Выбор метода зависит, прежде всего, от физических и химических свойств веществ, подлежащих сушке. Очевидно, что в процессе сушки вещества не должны разлагаться или претерпевать какие-либо другие химические превращения. Кроме того, выбор метода сушки определяется тем, насколько удаление влаги должно быть полным.
Сушка твердых веществ может проводиться на воздухе при комнатной температуре и при нагревании в сушильном шкафу. При комнатной температуре вещества чаще всего сушат на необожженных пористых фарфоровых и глиняных тарелках или на фильтровальной бумаге . В сушильном шкафу сушка твердых веществ производится на часовых стеклах, фарфоровых противнях, в фарфоровых чашках или бюксах. При этом температура в сушильном шкафу должна быть значительно ниже температуры плавления вещества (более 50оС), подвергаемого сушке. Категорически запрещается сушить в сушильном шкафу на бумаге, так как при этом продукт загрязняется бумажными волокнами, хлопьями подгоревшей и истлевшей бумаги и, кроме того, возможны значительные потери продукта, если в процессе сушки он пропитывает бумагу. Скорость сушки тем больше, чем выше температура. Многие органические соединения при высокой температуре разлагаются и подвергаются окислению кислородом воздуха. Такие соединения сушат при разрежении в лабораторных вакуум - сушильных шкафах.
Весьма успешно сушку можно проводить в присутствии веществ, поглощающих пары удаляемого растворителя. Для этой цели широко применяются эксикаторы и, в частности, вакуум- эксикаторы (рис. 84). В зависимости от характера веществ, подвергаемых сушке, а также от природы растворителя, который нужно удалить, эксикаторы снаряжаются теми или иными осушающими веществами. Для связывания паров воды или спирта применяют едкий натр, хлористый кальций, фосфорный ангидрид, серную кислоту. Последние два осушителя пригодны для связывания кетонов. Заполнять вакуум- эксикатор серной кислотой нельзя. При использовании в качестве осушающего вещества серной кислоты нижнюю часть эксикатора заполняют стеклянными или керамическими кольцами (кольца Рашига). Тем самым уменьшается возможность разбрызгивания серной кислоты и увеличивается поверхность ее соприкосновения с газовой средой. Для связывания паров и газообразных веществ, обладающих кислым характером, в эксикатор ставят чашечку с едким кали. Если в процессе сушки должны быть удалены углеводороды, то вдоль цилиндрической стенки эксикатора помещают лист фильтровальной бумаги, пропитанной парафином. Эксикаторы можно заполнять также силикагелем и цеолитами.
| опасно!!! При работе с вакуумными эксикаторами существует вероятность взрыва. Перед включением насоса их необходимо оборачивать полотенцем или другой тканью |
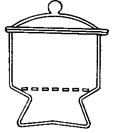
| 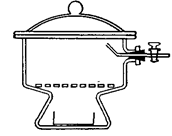
| 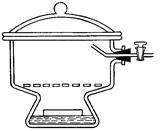
| 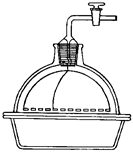
|
| а – эксикатор Шейблера | б – вакуум-эксикатор Шейблера | в – модификация вакуум-эксикатор Шейблера | г – эксикатор Руппе |
Рисунок 84 – Вакуум- эксикаторы
| опасно!!! При высушивании веществ в вакууме и при повышенных температурах запрещается использование серной кислоты |
Перед тем как начать откачивать воздух из эксикатора, его необходимо обернуть полотенцем или закрыть матерчатым колпаком, чтобы в случае разрыва эксикатора избежать неприятных последствий. Затем газоотводную трубку присоединяют с помощью резинового вакуум шланга к вакуумной линии и осторожно открывают кран. Через 5-10 минут кран закрывают и разъединяют газоотводную трубку с вакуумной линией. Для того чтобы соединить эксикатор с атмосферой, осторожно открывают кран. Следует заметить, что газоотводная трубка, находящаяся внутри эксикатора, должна быть изогнута и заканчиваться капилляром, острый конец которого обращен к крышке эксикатора, или же конец газоотводной трубки должен быть экранирован кусочком картона, для того, чтобы при откачке воздуха из эксикатора и при впуске воздуха не происходило распыления вещества.
Многие органические соединения при высокой температуре разлагаются и подвергаются окислению кислородом воздуха. Для сушки таких веществ при повышенных температурах используются, так называемые, сушильные пистолеты (пистолеты Абдергальдена), в которых вещество нагревается парами кипящей жидкости. Для ускорения процесса, высушивание в сушильных пистолетах обычно проводят при пониженном давлении.
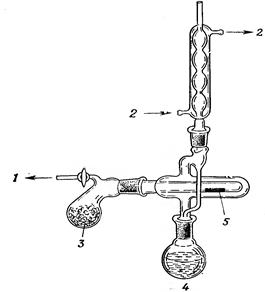
| 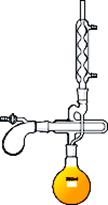
| 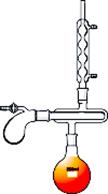
|
| 1 – отвод для ваккума, 2- холодильник, 3-??????, 4- жидкость для нагрева, 5-образец вещества | ||
Рисунок 85. - Сушильный пистолет Абдергальдена
Сушка газов
Для сушки газов твердыми осушителями применяют осушительные колонки (рис ). Для предотвращения смешивания таких аморфных осушителей, как фосфорный ангидрид, колонки наполняют предварительно приготовленной смесью осушителя со стеклянным волокном или другим наполнителем.
Химически индифферентные газы обычно сушат, пропуская их через промывные склянки с концентрированной серной кислотой (рис 86). При этом обязательно устанавливают предохранительные склянки, снабженные специальным устройством от случайного открывания (рис ). Желательно использовать промывные склянки, снабженные барботёром (с пористой пластинкой (рис ).
Низкокипящие газы сушат, вымораживая воду и другие конденсирующиеся примеси в охлаждаемой «ловушки» (рис ). При этом достигается очень высокая степень осушки (таб ). Для охлаждения применяют смесь сухого льда с ацетоном или жидкий воздух ( ). Для защиты от атмосферной влаги используют хлоркальциевые трубки.
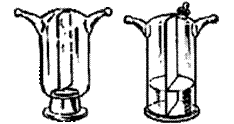
|  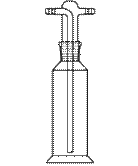 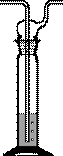
|
| а - Склянка Тищенко | б - Склянка Дрекселя |
Рисунок 86 – Промывные склянки
Таблица 13- Давление водяных паров в газах при различных температурах
| Температура, 0С | Парциальное давление водяных паров, мм. ст. ст. |
| +20 | 17, 5 |
| 0 | 4, 6 |
| -10 | 0, 77 |
| -70 | 0, 002 |
| -100 | 0, 00001 |
Абсолютирование натрием
Большая часть аварий и несчастных случаев, связанных с металлическим натрием, происходит при его использовании в качестве осушителя. Этот способ сушки органических растворителей применяется настолько часто, что даже опытные работники иногда забывают об осторожности. Кроме того, эту операцию нередко поручают лаборантам, не проводя подробного инструктажа.
| обратите ВНИМАНИЕ!!! Натрий можно применять для абсолютирования только углеводородов и простых эфиров. |
Как правило, нельзя использовать натрий для сушки кислот, сложных эфиров, спиртов, галогенпроизводных жирного и ароматического рядов, альдегидов, кетонов, аминов и др.
Натрий используют для окончательной осушки растворителей - для удаления следов воды.
| ВНИМАНИЕ!!! Растворители, содержащие более 0, 5% воды, сушить натрием нельзя — вследствие бурного протекания реакции возможен взрыв. |
Предварительно растворитель должен быть обезвожен с помощью безопасного осушителя, например хлорида кальция или сульфата натрия. При взаимодействии натрия с влагой, содержащейся в растворителе, образуются газообразный водород и гидроксид натрия, который покрывает поверхность металла тонкой пленкой, что замедляет или полностью прекращает дальнейшую реакцию. Чтобы повысить полноту использования натрия, его чаще всего применяют в виде тонкой проволоки, обладающей большой удельной поверхностью.
Если растворитель предполагается оставить над натриевой проволокой на ночь, не следует закрывать сосуд притертой пробкой: выделяющийся водород может создать значительное давление в емкости. В таких случаях необходимо использовать пробку, снабженную хлоркальциевой трубкой.
Для ускорения процесса сушки и более полного удаления воды растворитель кипятят около часа в колбе с обратным холодильником над натриевой проволокой, после чего перегоняют его в сухой приемник, защищенный хлоркальциевой трубкой. Не следует забывать, что для нагревания колбы в таком случае нельзя использовать водяную или глицериновую баню. В качестве жидкого теплоносителя для бани рекомендуется минеральное масло. Натриевую проволоку, оставшуюся после перегонки, уничтожают в той же колбе сразу после ее охлаждения, заливая достаточным количеством этилового спирта. Оставшееся в колбе небольшое количество растворителя перед уничтожением остатков проволоки можно не удалять.
Если необходимо получить очень сухой растворитель для особо точных работ, в перегнанный над натрием растворитель добавляют новую порцию проволоки, над которой его и хранят. Критерием качества осушки служит поверхность проволоки — в сухом растворителе она долгое время остается блестящей. Склянку с сухим растворителем над натриевой проволокой помещают в металлический контейнер, дно и стенки которого необходимо выложить асбестовым картоном. Хранят контейнеры в отдельном ящике для ЛВЖ.
Получения абсолютного эфира
| опасно!!! Эфир очень легко воспламеняется. Его пары тяжелее воздуха и образуют с ним взрывоопасные смеси. При работе с эфиром, во избежание несчастных случаев, необходимо строго соблюдать правила техники безопасности. |
Для получения абсолютного эфира, не содержащего перекисей, эфир многократно встряхивают с безводным хлоридом кальция (количество хлорида кальция обычно составляет 10% от веса абсолютируемого эфира) и оставляют на день. После этого эфир отделяют от хлорида кальция и перегоняют, используя для окончательного обезвоживания металлический натрий.
Полученный абсолютный эфир можно хранить над небольшим количеством натрия в темных склянках с трубкой.
Рисунок 87. – Установки для получения абсолютного этилового спирта.
Дальнейшее обезвоживание спирта можно производить, например, с помощью магния или натрия. В колбу с обратным холодильником помещают 5 г магниевой стружки или натрия, приливают 75-100 мл спирта и прибавляют 0, 5 г иода. Смесь нагревают до начала экзотермической реакцию. После прекращения кипения колбу вновь нагревают до полного растворения магния. Кипячение продолжают еще 30 мин. и спирт перегоняют, тщательно предохраняя дистиллят от влаги воздуха (рис. 87 б). Так можно получить 99, 95%-ный спирт. Он очень гигроскопичен.
Удаление остатков воды удобно производить натрием в присутствии легко омыляющихся этиловых эфиров, имеющих сравнительно высокую температуру кипения.
Таблица 14. – Плотность этанола в зависимость от концентрации
| Плотность г/мл | Содержание этанола, % | Плотность г/мл | Содержание этанола, % | ||
| по массе | по объему | по массе | по объему | ||
| 0, 9858 | 8, 1 | 10 | 0, 9259 | 46, 3 | 54 |
| 0, 9792 | 13 | 16 | 0, 9131 | 52, 2 | 60 |
| 0, 9752 | 16, 3 | 20 | 0, 9040 | 56, 2 | 64 |
| 0, 9712 | 19, 6 | 24 | 0, 8945 | 60, 3 | 68 |
| 0, 9669 | 23 | 28 | 0, 8846 | 64, 6 | 72 |
| 0, 9647 | 24, 7 | 30 | 0, 8743 | 69 | 76 |
| 0, 9623 | 26, 4 | 32 | 0, 8635 | 73, 5 | 80 |
| 0, 9571 | 29, 9 | 36 | 0, 8462 | 80, 7 | 86 |
| 0, 9542 | 31, 6 | 38 | 0, 8336 | 85, 7 | 90 |
| 0, 9512 | 33, 4 | 40 | 0, 8268 | 88, 3 | 92 |
| 0, 9481 | 35, 2 | 42 | 0, 8196 | 91 | 94 |
| 0, 9448 | 37 | 44 | 0, 8117 | 93, 9 | 96 |
| 0, 9413 | 38, 8 | 46 | 0, 8033 | 96, 8 | 98 |
| 0, 9339 | 42, 5 | 50 | 0, 7936 | 100 | 100 |
Рисунок 89 – Подготовка капилляра с веществом
Началом плавления вещества считается момент размягчения вещества и переход его в жидкое состояние, а концом - образование прозрачной жидкости. Во время определения необходимо постоянно следить за веществом в капилляре и одновременно за показанием термометра. Если вещество чистое, сухое, то оно плавится в пределах 0, 5-1, 0оС. Четкая температура плавления, как правило, является признаком его чистоты. Если экспериментально определенная температура плавления ниже описанной в литературе, то вещество не является индивидуальным, содержит примеси.
Многие органические вещества при плавлении разлагаются, и это сопровождается их потемнением, а иногда и обугливанием. В этом случае, конечно, точка плавления будет нечеткой.
Определять температуру плавления необходимо в защитных очках или защитной маске. Это особенно важно, если колба заполнена концентрированной серной кислотой.
Список рекомендуемой литературы
1. Агрономов А. Е. " Лабораторные работы в органическом практикуме" М.: Химия, 1974, издание 2-е, 376 стр.,
2. Берлин А.Я. Техника лабораторной работы в органической химии. — М.: Госхимииздат, 1963. 372 с.
3. Вейганд К. " Методы эксперимента в органической химии" М.: Иностранная литература 1952
4. Гордон А., Форд Р. " Спутник химика" М.: Мир, 1976
5. Захаров Л. Н. Техника безопасности в химических лабораториях: Справ. изд.—2-е изд. перераб. и доп.— Л.; Химия, 1991.— 336 с: ил.
6. Крель Э. " Руководство по лабораторной перегонке" М.: Химия 1980, пер. с немецкого Чернышевой В.И., Шафранского А.В., под ред. Олевского В.М.,
7. Беккер Г., Бергер В., Домшке Г. и др. Органикум. Практикум по органической химии, Мир, 1979 г., 1 т.
8. Беккер Г., Бергер В., Домшке Г. и др. Органикум. Практикум по органической химии, Мир, 1979 г., 2 т.
9. Степин Б. Д. " Техника лабораторного эксперимента в химии" М.: Химия, 1999
10. Юрьев Ю. К. " Практические работы по органической химии" вып.1-2 2-е изд., М.: ИМУ, 1961.
11.Гинзбург
Лабораторная химическая посуда и приборы
МАТЕРИАЛы
При проведении исследований или экспериментов в лаборатории органического синтеза используется весьма разнообразная химическая посуда, соединительные и запирающие узлы (шланги, пробки, шлифы), различные смазки для создания герметичности, фильтры, тепло- и хладоносители. В настоящее время для изготовления лабораторной посуды, сопутствующей техники для проведения химического эксперимента используется широкий спектр различных материалов.
Основными материалами для изготовления химической лабораторной посуды являются стекло, фарфор, пластмасса и др.
| В химических лабораториях основным материалом для изготовления лабораторной посуды является стекло |
СТЕКЛО
Основные требования, предъявляемые к лабораторной посуде и изделиям из стекла - это термическая и химическая стойкость. Под химической стойкостью понимают способность стекла противостоять разрушающему действию воды, кислот, щелочей и других химических реагентов. Под термической стойкостью понимают способность стекла выдерживать без разрушения резкие колебания температуры. Твердость и гладкость поверхности облегчает мытье, а прозрачность позволяет следить за ходом химического эксперимента.
Химико-лабораторное стекло - стекло, обладающее высокой химической и термической устойчивостью, пригодное для обработки на стеклодувной горелке; применяется в производстве химико-лабораторной посуды, приборов и аппаратов химической промышленности.
Стекло отличается высокой химической устойчивостью к большинству органических растворителей, растворам минеральных кислот, за исключением фтороводородной кислоты, а также концентрированных щелочей. По сравнению с другими материалами стекло обладает высокой прозрачностью и сравнительно небольшим коэффициентом линейного расширения. Твердость и гладкость поверхности облегчает мытье, а прозрачность позволяет следить за ходом химического эксперимента.
Недостатками стекла являются его хрупкость и невысокая устойчивость к резким изменениям температуры.
Свойства стекла существенно зависят от их состава. Водостойкость и кислотоустойчивость, а также термостойкость возрастают с увеличением содержания в них кремнезёма и уменьшением содержания щелочных окислов. Щёлочеустойчивые стекла содержат, как правило, двуокись циркония, окись лантана, двуокись олова. Наиболее устойчивые по отношению ко всем реагентам и термостойкие — кварцевые стекла. Все химико-лабораторные стекла делятся на 4 основные категории: ХУ-1 — химически устойчивые 1-го класса; ХУ-2 — химически устойчивые 2-го класса; ТУ — термически устойчивые; ТУК — термически устойчивые кварцевые стекла. Разработаны также стекла с высокой устойчивостью к щелочам типа ДГ-З.
В настоящее время разработаны материалы чрезвычайно широкого универсального диапазона применения. Синтезированы такие качества стекла как жаростойкость, прочность, биоактивность, управляемая электропроводность и т.д. В сочетании с прозрачностью, отражательной способностью, стойкостью к агрессивным средам эти свойства делают стекло универсальным материалом. Различные виды стёкол используется во всех сферах человеческой деятельности от строительства, изобразительного искусства, оптики, медицины до измерительной техники, высоких технологий и космонавтики, авиации и военной техники.
Виды стекол
Основной недостаток обычных стёкол — хрупкость. Для того чтобы расширить сферу применения стекла, его подвергают закалке (закалённое стекло), создают многослойные композиты (триплекс). Армирование, вопреки распространенному мнению, ослабляет стекло, делает его более хрупким по сравнению с таким же монолитным стеклом. Стеклообразующие вещества: стеклообразующим веществам относятся: SiO2, B2O3, P2O5, TeO2, GeO2, AlF3 и др.
В зависимости от основного используемого стеклообразующего вещества, неорганические стекла бывают оксидными (силикатное, кварцевое, германатное, фосфатное, боратное), фторидными, сульфидными и т. д.
Базовый метод получения силикатного стекла заключается в плавлении смеси кварцевого песка (SiO2), соды (Na2CO3) и извести (CaO). В результате получается химический комплекс с составом Na2O·CaO·6SiO2.
Кварцевое стекло
Кварцевое стекло получают плавлением кремнезёмистого сырья высокой чистоты (обычно кварцит, горный хрусталь). Оно состоит только из диоксида SiO2 и является самым термостойким стеклом. Коэффициент его линейного расширения в пределах 0-1000 0С составляет всего 6·10-7. Поэтому раскаленное кварцевое стекло, опущенное в холодную воду, не растрескивается.
Температура размягчения кварцевого стекла равна 1250 0С. Полное же плавление кварцевого стекла происходит при температуре 1500-1600 0С.
Кварцевое стекло следует тщательно предохранять от различного рода загрязнений, даже таких как жирные пятна от рук. Перед нагреванием его поверхность необходимо протереть от прозрачных следов разбавленной фтороводородной кислотой, а от жирных пятен этанолом или ацетоном.
Поверхностные загрязнения могут явиться причиной расстеклования, т. е. перехода из метастабильного стеклообразного состояния в кристаллическое. Такой переход необратим и может привести к быстрому механическому разрушению изделия. Кроме того, расстеклование делает кварцевое стекло непригодным для длительного нагревания при температурах выше 1100 0С.
Изделия из кварцевого стекла устойчивы к действию всех кислот за исключением фосфорной (H3PO4) и концентрированной фтороводородной (HF). На них не действует хлор (Cl2) и HCl до 1200 0С, до 250 0С сухой фтор (F2). Водные растворы NaF и H2[SiF6] разрушают кварцевое стекло при нагревании. Кроме того, оно абсолютно непригодно для работы с водными растворами и расплавами гидроксидов щелочных металлов. Даже кратковременный контакт с большинством расплавов хлоридов металлов, щелочных металлов, магнием и алюминием делают невозможным дальнейшее использование изделий. При высокой температуре кварц ведет себя как сильная кислота и взаимодействует не только с основаниями, но и с оксидами металлов.
Кварцевое стекло может быть также природного происхождения, образующееся при попадании молнии в залежи кварцевого песка. Этот факт и лежит в основе одной из исторических версий происхождения технологии изготовления стекла.
Последнее изменение этой страницы: 2019-06-19; Просмотров: 564; Нарушение авторского права страницы