
|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |

|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |
Тема: «Строение атома.Химическая связь»Стр 1 из 6Следующая ⇒
Лабораторная работа №1 Тема: «Строение атома.Химическая связь» Теоритическая часть Характеристики субатомных частиц Атом – мельчайшая, электронейтральная, химически неделимая частица вещества, состоящая из положительно заряженного ядра и отрицательно заряженной электронной оболочки. Электронная оболочка – совокупность группирующихся вокруг ядра электронов. Электрон – одна из элементарных частиц материи, обладающая массой покоя и элементарным отрицательным зарядом. Когда говорят о массе покоя, то подразумевают, что частица может находиться в состоянии покоя и иметь массу. Существуют частицы, которые не могут находиться в состоянии покоя, например частицы света - фотоны. В этом случае говорят, что фотон не имеет массы покоя. Заряд электрона называется элементарным, так как это наименьший отрицательный заряд в природе. По этой причине заряд электрона условно принимают равным -1. Атомное ядро – центральная, положительно заряженная, сложно организованная часть атома, состоящая из нуклонов, связанных между собой ядерными силами. Нуклоны – общее название двух типов частиц, протонов и нейтронов. С точки зрения атомной физики протон и нейтрон являются двумя состояниями одной и той же частицы – нуклона. Нуклон – структурная единица ядра атома, которая может находиться в двух состояниях, протона и нейтрона. Нуклоны (протоны и нейтроны) состоят из кварков. Табл. Основные характеристики некоторых субатомных частиц Заряд ядра атома соответствует атомному номеру (порядковому номеру) элемента в периодической системе (Z). Заряд ядра определяется числом протонов, следовательно: Так как атом - электронейтральная частица, то: Массовое число (нуклонное число) – сумма числа протонов и нейтронов в ядре данного атома. Если в условии задания не указано массовое число, то его можно взять из таблицы Д.И. Менделеева, округлив до целой величины относительную атомную массу. О том, что такое относительная атомная масса мы поговорим чуть позже. Пока не заостряйте на этом внимание. Где её найти в таблице Д.И. Менделеева показано на рисунке ниже. Для расчета числа нейтронов в ядре используется формула: Для характеристик частицы (протона, нейтрона, атома) применяют следующую запись: X - символ частицы. A - массовое (нуклонное число). Z - заряд Определим состав атома хлора. Порядковый номер хлора в таблице Д. И. Менделеева равен 17, следовательно заряд ядра атома хлора равен +17. Если заряд ядра равен +17, то в ядре атома хлора 17 протонов, а в электронной оболочке 17 электронов. Чтобы определить число нейтронов в ядре атома хлора, округлим до целой величины относительную атомную массу хлора, это значение равно 36. То есть, в ядре атома хлора 36 нуклонов, 17 из них являются протонами, тогда число нейтронов равно 36-17 = 19. Кратко это можно записать следующим образом: Атомы отличаются друг от друга радиусом, массой, зарядом ядра, количеством электронов и другими параметрами. Заряд ядра атома – это наиболее важная его характеристика. Поэтому все атомы можно условно разделить на группы (классифицировать) по заряду их ядер. Такие абстрактные группы принято называть химическими элементами. Химический элемент – вид атомов, с определённым зарядом ядра. Химический элемент - одно из центральных понятий науки химии. По предложению шведского химика Й. Берцелиуса химические элементы обозначают начальной или начальной и одной из последующих букв латинского названия элемента (1813 г). Водород на лат. Hydrogenium (H). Ртуть на лат. Hydrargyrum (Hg) Эти буквенные обозначения называются химическими знаками или химическими символами. Символ отдельного атома совпадает с символом соответствующего ему химического элемента. К примеру, символ S обозначает химический элемент серу или же один атом этого элемента. Если требуется обозначить не один, а несколько атомов, то перед символом элемента ставят соответствующую цифру – коэффициент. 5S – пять атомов элемента серы. Символы и русские названия химических элементов можно найти в таблице Д. И. Менделеева. Несмотря на то что у ядер атомов одного и того же химического элемента одинаковый заряд, они могут отличаться друг от друга массовым (нуклонным) числом по причине разного количества нейтронов. Такие разновидности ядер атомов одного химического элемента называют изотопами. Изотопы – ядра с одинаковым зарядом, но разным массовым числом, т.е разным числом нейтронов. Отметим, что термин изотопы следует употреблять только во множественном числе. В единственном числе следует говорить - нуклид. Что такое нуклиды Вы узнаете чуть позже. К примеру, химический элемент водород (H) представляет из себя смесь атомов с массовыми числами равными 1 и 2, это изотопы водорода - протий (H) и дейтерий (D). Нуклид водорода с массовым числом 3 в природе не встречается, так как его ядро чрезвычайно нестабильно и очень быстро подвергается ядерному распаду, это так называемый тритий (T). Запишем состав изотопов водорода, пользуясь описанными выше правилами. Мы убедились, что изотопы отличаются массовыми числами, а также количеством нейтронов в ядре. Заряд ядер изотопов одинаковый, так как они принадлежат одному химическому элементу. Содержание изотопов в земной коре разное ввиду их разной стабильности. Чем устойчивее изотоп, тем выше его содержание. Содержание изотопов элемента Х может быть оценено в массовых или мольных долях. Доля – отношение части к целому. Массовая доля (w или w%) – отношение массы части системы к массе всей системы.
Оптические спектры атома Атомные спектры, спектры оптические, получающиеся при испускании или поглащении света (электромагнитных волн) свободными или слабо связанными атомами; такими спектрами обладают, в частности, одноатомные газы и пары. Атомные спектры являются линейчатыми — они состоят из отдельных спектральных линий. Атомные спектры наблюдаются в виде ярких цветных линий при свечении газов или паров в электрической дуге или разряде (спектры испускания) и в виде тёмных линий (спектров поглощения). Каждая спектральная линия характеризуется определённой частотой колебаний v испускаемого или поглощаемого света и соответствует определённому квантовому переходу между уровнями энергии Ei и Ek атома согласно соотношению: hv = Ei - Ek, где h — Планка постоянная). Наряду с частотой спектральную линию можно характеризовать длиной волны l = c/v, волновым числом 1/l = v/c (c — скорость света) и энергией фотона hv. Атомные спектры возникают при переходах между уровнями энергии внешних электронов атома и наблюдаются в видимой, ультрафиолетовой и близкой инфракрасной областях. Такими спектрами обладают как нейтральные, так и ионизованные атомы; их часто называют соответственно дуговыми и искровыми спектрами (нейтральные атомы легко возбуждаются и дают спектры испускания в электрических дугах, а положительные ионы возбуждаются труднее и дают спектры испускания преимущественно в искровых электрических разрядах). Спектры ионизованных атомов смещены по отношению к спектрам нейтральных атомов в область больших частот, т. е. в ультрафиолетовую область. Это смещение тем больше, чем выше кратность ионизации атома — чем больше электронов он потерял. Спектры нейтрального атома и его последовательных ионов обозначают в спектроскопии цифрами I, II, III, ... В реально наблюдаемых спектрах часто присутствуют одновременно линии нейтрального и ионизованных атомов; так говорят, например, о линиях FeI, FeII, FeIII в спектре железа, соответствующих Fe, Fe+, Fe2+. Линии А. с. образуют закономерные группы, называются спектральными сериями. Промежутки между линиями в серии убывают в сторону коротких длин волн, и линии сходятся к границе серии. Наиболее прост спектр атома водорода. Волновые числа линий его спектра с огромной точностью определяются формулой Бальмера: 1/l = R(1/n21 - 1/n22), где n1 и n2 значения главного квантового числа для уровней энергии, между которыми происходит квантовый переход (см. Атом, рис. 1, б). Значение n1 = 1, 2, 3, ... определяет серию, а значение n2 = n1 + 1, n1 + 2, n1 + 3,... определяет отдельные линии данной серии; R — Ридберга постоянная (выраженная в волновых числах). При n1 = 1 получается серия Лаймана, лежащая в далёкой ультрафиолетовой области спектра, при n1 = 2 — серия Бальмера, линии которой расположены в видимой и близкой ультрафиолетовой областях. Серии Пашена (n1 = 3), Брэкета (n1 = 4), Пфаунда (n1 = 5), Хамфри (n1 = 6) лежат в инфракрасной области спектра. Аналогичными спектрами, только с увеличенным в Z2 раз масштабом (Z — атомный номер), обладают водородоподобные ионы Не+, Li2+, ... (cпектры HeII, LiIII, ...). Спектры атомов щелочных металлов, обладающих одним внешним (оптическим) электроном помимо заполненных оболочек, схожи со спектром атома водорода, но смещены в область меньших частот; число спектральных серий увеличивается, а закономерности в расположении линий усложняются. Пример — спектр Na, атом которого обладает нормальной электронной конфигурацией 1s2 2s2 2p6 3s (см. в ст. Атом — Заполнение электронных оболочек и слоев) с легко возбуждаемым внешним электроном 3s; переходу этого электрона из состояния 3s в состояние 3p соответствует жёлтая линия Na (дублет l = 5690 Для атомов с двумя или несколькими внешними электронами спектры значительно усложняются, что обусловлено взаимодействием электронов. А. с. особенно сложны для атомов с заполняющимися d- и f-оболочками; число линий доходит до многих тысяч, и уже нельзя обнаружить простых серий, аналогичных сериям в спектрах водорода и щелочных металлов. Однако и в сложных спектрах можно установить определённые закономерности в расположении линий, произвести систематику спектра и определить схему уровней энергии. Систематика спектров атомов с двумя или более внешними электронами основана на приближённой характеристике отдельных электронов при помощи квантовых чисел n и l (см. Атом) с учётом взаимодействия этих электронов друг с другом. При этом приходится учитывать электростатические взаимодействия электронов — отталкивание по закону Кулона, и магнитные взаимодействия спиновых и орбитальных моментов (см. Спин, Спин-орбитальное взаимодействие), которые приводят к тонкому расщеплению уровней энергии (см. Тонкая структура). Благодаря этому у большинства атомов спектральные линии представляют собой более или менее тесную группу линий, называемую мультиплетом. Так, у всех щелочных металлов линии двойные (дублеты), причём расстояния между мультиплетными уровнями увеличиваются с увеличением атомного номера элемента. У щёлочноземельных элементов наблюдаются одиночные линии (сингулеты) и тройные (триплеты). Спектры следующих столбцов таблицы Менделеева образуют всё более сложные мультиплеты, причём нечётным столбцам соответствуют чётные мультиплеты, а четным столбцам — нечётные. Кроме тонкой структуры, в А. с. наблюдается сверхтонкая структура, обусловленная магнитными моментами ядер. Сверхтонкая структура по порядку величины в 1000 раз уже обычной мультиплетной структуры и исследуется методами радиоспектроскопии. В А. с. проявляются не все переходы между уровнями энергии данного атома или иона, а лишь вполне определённые, допускаемые (разрешенные) т. н. отбора правилами, зависящими от характеристик уровней энергии. В случае одного внешнего электрона возможны лишь переходы, для которых азимутальное квантовое число l увеличивается или уменьшается на 1; правило отбора имеет вид: Dl = ±1. В результате s-yровни (l = 0) комбинируют с р-уровнями (l = 1), р-уровни — с d-yровнями (l = 2) и т. д., что определяет возможные спектральные серии для атомов щелочных металлов, частный случай которых представляет главная серия Na (переходы 3s ® np, где n = 3, 4, 5, ...); другие переходы этим правилом отбора запрещены. Для многоэлектронных атомов правила отбора имеют более сложный вид. Энергия ионизации Энергия ионизации - энергия, необходимая для удаления одного моля электронов от одного моля атомов какого либо элемента, называется первой энергией ионизации I1. В результате ионизации атомы превращаются в положительно заряженные ионы. Энергию ионизации выражают либо в килоджоулях на моль [кДж/моль], либо в электронвольтах [эВ].
Энергию ионизации можно определить путем бомбардировки атомов электронами, ускоренными в электрическом поле. То наименьшее напряжение поля, при котором скорость электронов становится достаточной для ионизации атомов, называется потенциалом ионизации атомов данного элемента и выражается в вольтах. Энергия ионизации, выраженная в электронвольтах, численно равна потенциалу ионизации, выраженному в вольтах. Na0 - ē = Na+ - 5, 14 эв Cs0 - ē = Cs+ - 3, 9 эв Энергия ионизации характеризует восстановительную способность элемента, т.е. металличность. Активные металлы обладают очень малыми значениями энергии ионизации. Первая энергия ионизации определяется электронным строением элементов и ее изменение имеет периодический характер. Энергия ионизации возрастает по периоду. Наименьшие значения энергии ионизации имеют щелочные элементы, находящиеся в начале периода, наибольшими значениями энергии ионизации характеризуются благородные газы, находящиеся в конце периода. Пики на кривой зависимости энергии ионизации от порядкового номера элемента наблюдаются у элементов с законченной s-подоболочкой (Be, Mg) и d-подоболочкой (Zn, Cd, Hg), и р- подоболочкой, в АО которой находится по одному электрону (N, P, As). Минимумы на кривой наблюдаются у элементов, имеющих на внешней подоболочке по одному электрону (щелочные металлы, В, Al, Ga, In). В одной и той же группе энергия ионизации несколько уменьшается с увеличением порядкового номера элемента, что обусловлено увеличением размеров атомов и расстояния внешних подоболочек от ядра. Кроме первой энергии ионизации, элементы с многоэлектронными атомами могут характеризоваться второй I2, третьей I3, и более высокой энергией ионизации, которые равны соответственно энергии отрыва молей электронов от молей ионов Э+, Э2+и т. д. При этом энергии ионизации возрастают с увеличением их номеров, т.е. I1I2I3. Особенно резкое увеличение ионизации наблюдается при отрыве электронов из заполненной подоболочки.
Значения первой - пятой энергий ионизации для элементов Ia - IVa групп второго и третьего периодов
Становится очевидным, почему ионы Li+ и Na+ образуются легко, а образование ионов Li2+ и Na2+ энергетически не выгодно. Аналогичная закономерность возникает и для элементов следующих групп, что объясняет существование ионов Mg2+и А13+. Особого внимания заслуживает ионизация атомов d-элементов четвертого периода. Атомы этих элементов в первую очередь теряют 4s-электроны, а затем уже 3d-электроны. Таким образом, ионизация атомов железа и меди передается следующими схемами:
С помощью величины энергии ионизации характеризуют, как правило, элементы, находящиеся в начале периода. Для элементов, находящихся в конце периода, отрыв электрона с образованием положительно заряженного иона в целом не характерен. В то же время атомы этих элементов способны присоединять один или несколько электронов с образованием отрицательно заряженного иона - аниона. Сродство к электрону Энергия, поглощаемая или выделяющаяся при присоединении электрона к атому, иону, радикалу или молекуле в газовой фазе при Т = 0К без передачи частице кинетической энергии, называется сродством к электрону. Сродство к электрону Еср количественно выражается в [кДж/моль] или [эВ]. F0 + ē = F - + 3, 58 эв I0 + ē = I - + 3, 3 эв Сродство к электрону - параметр атома данного элемента, менее подчиняющийся периодическому изменению, чем энергия ионизации. Тем не менее существуют следующие закономерности: · сродство к электрону элементов, имеющих завершенные ns2-подуровни (гелий и элементы IIa группы), np6-подуровни (благородные газы) и ns2(n - 1)d10-подуровни (цинк, кадмий, ртуть), равно нулю; · в каждом периоде сродство к электрону максимально у галогена;
Сродство к электрону атомов элементов IVa - VIIa групп второго-четвертого периодов (знак «-» означает выделение энергии, знак «+» - поглощение)
Элемент | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| II | Углерод | Азот | Кислород | Фтор | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Еср = -122 кДж/моль | Еср = +7 кДж/моль | Еср = -141 кДж/моль | Еср = -328 кДж/моль | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
III | Кремний | Фосфор | Сера | Хлор | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Еср = -134 кДж/моль | Еср = -72 кДж/моль | Еср = -200 кДж/моль | Еср = -349 кДж/моль | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| IV | Германий | Мышьяк | Селен | Бром | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Еср = -120 кДж/моль | Еср = -77 кДж/моль | Еср = -195 кДж/моль | Еср = -325 кДж/моль | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
· если присоединение первого электрона к атому всегда сопровождается выделением энергии (кроме азота), то для присоединения второго электрона к уже образовавшемуся аниону требуется поглощение энергии
Сродство к электрону атомов и одноатомных анионов некоторых элементов
| Элемент | Сродство к электрону атома | Сродство к электрону иона Х - | Сродство к электрону иона Х 2- |
| Азот | +7 | +800 | + 1290 |
| Кислород | -141 | +780 | - |
| Сера | -200 | +590 | - |
| Селен | -195 | +420 | - |
· ионные радиусы одноатомных катионов меньше атомных радиусов атомов, из которых они образовались, а ионные радиусы анионов - больше.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Энергия ковалентной связи
Под энергией ковалентной связи (выражают в ккал/моль или кДж/моль) обычно понимают энергию, которая необходима для разрыва связи (при образовании ковалентной связи энергия выделяется, при разрыве - поглощается). Чем выше энергия связи, тем прочнее связь.
Энергия связи зависит от ее длины - чем длиннее связь в молекуле, тем проще ее разорвать (затратить меньше энергии).
Энергии связи некоторых молекул (кДж/моль):
· H2 = 453 (длина связи = 60 пм);
· Cl2 = 242 (198 пм);
· HCl = 431 (129 пм).
Кратность ковалентной связи
В некоторых случаях между атомами могут возникать не одна, а две (двойная связь) или три (тройная связь) общих электронных пар (так называемые кратные связи).
Двойная ковалентная связь образуется у атомов, имеющих по два неспаренных электрона; тройная - у атомов, имеющих по три неспаренных электрона
Как видно из таблицы, приведенной ниже, молекула азота примерно в 7 раз " крепче" молекулы фтора.
Таблица зависимости длины и прочности ковалентной связи от ее кратности:
| Молекула | F2 | O2 | N2 |
| Кратность связи | одинарная | двойная | тройная |
| Прочность связи (энергия), кДж/моль | 139 | 494 | 942 |
| Длина связи, пм | 141 | 121 | 109 |
Метод валентных связей
Метод валентных связей (локализованных электронных пар) предполагает, что каждая пара атомов в молекуле удерживается вместе при помощи одной или нескольких общих электронных пар. Поэтому химическая связь представляется двухэлектронной и двухцентровой, т.е. локализована между двумя атомами. В структурных формулах соединений обозначается черточкой:
H-Cl, H-H, H-O-H
Рассмотрим в свете Метода ВС, такие особенности связи, как насыщаемость, направленность и поляризуемость.
Валентность атома — определяется числом неспаренных (валентных) электронов, способных принять участие в образовании химической связи. Валентность выражается небольшими целыми числами и равна числу ковалентных связей. Валентность элементов, проявляющуюся в ковалентных соединениях, часто называют ковалентностью. Некоторые атомы имеют переменную валентность, например углерод в основном состоянии имеет 2 неспаренных электрона и будет двух валентен. При возбуждении атома, возможно распарить другие два спаренных электрона и тогда атом углерода станет четырех валентен:
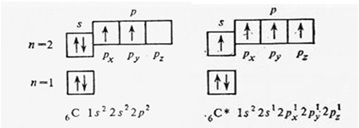 электронное строение атома углерода
электронное строение атома углерода
Возбуждение атома до нового валентного состояния требует затраты энергии, которая компенсируется выделяемой при образовании связей энергией.
Ионная связь
Ионная связь — сильная химическая связь, возникающая в результате электростатического притяжения катионов и анионов. Возникает между атомами с большой разностью (> 1, 7 по шкале Полинга) электроотрицательностей, при которой общая электронная пара переходит преимущественно к атому с большей электроотрицательностью. Это притяжение ионов как разноимённо заряженных тел. Примером может служить соединение CsF, в котором «степень ионности» составляет 97 %. Ионная связь — крайний случай поляризации ковалентной полярной связи. Образуется между типичными металлом и неметаллом. При этом электроны у металла полностью переходят к неметаллу, образуются ионы.
Если химическая связь образуется между атомами, которые имеют очень большую разность электроотрицательностей (ЭО > 1, 7 по Полингу), то общая электронная пара полностью переходит к атому с большей ЭО. Результатом этого является образование соединения противоположно заряженных ионов:
{\displaystyle {\mathsf {A}}\cdot +\cdot {\mathsf {B}}\to {\mathsf {A}}^{+}[: {\mathsf {B}}^{-}]} 
Между образовавшимися ионами возникает электростатическое притяжение, которое называется ионной связью. Вернее, такой взгляд удобен. На деле ионная связь между атомами в чистом виде не реализуется нигде или почти нигде, обычно на деле связь носит частично ионный, а частично ковалентный характер. В то же время связь сложных молекулярных ионов часто может считаться чисто ионной. Важнейшие отличия ионной связи от других типов химической связи заключаются в ненаправленности и ненасыщаемости. Именно поэтому кристаллы, образованные за счёт ионной связи, тяготеют к различным плотнейшим упаковкам соответствующих ионов.
Характеристикой подобных соединений служит хорошая растворимость в полярных растворителях (вода, кислоты и т. д.). Это происходит из-за заряженности частей молекулы. При этом диполи растворителя притягиваются к заряженным концам молекулы, и, в результате Броуновского движения, «растаскивают» молекулу вещества на части и окружают их, не давая соединиться вновь. В итоге получаются ионы, окружённые диполями растворителя.
При растворении подобных соединений, как правило, выделяется энергия, так как суммарная энергия образованных связей растворитель-ион больше энергии связи анион-катион. Исключения составляют многие соли азотной кислоты (нитраты), которые при растворении поглощают тепло (растворы охлаждаются). Последний факт объясняется на основе законов, которые рассматриваются в физической химии. Взаимодействие ионов
Если атом теряет один или несколько электронов, то он превращается в положительный ион — катион (в переводе с греческого — " идущий вниз). Так образуются катионы водорода Н+, лития Li+, бария Ва2+. Приобретая электроны, атомы превращаются в отрицательные ионы — анионы (от греческого «анион» — идущий вверх). Примерами анионов являются фторид ион F−, сульфид-ион S2−.
Катионы и анионы способны притягиваться друг к другу. При этом возникает химическая связь, и образуются химические соединения. Такой тип химической связи называется ионной связью:
Ионная связь — это химическая связь, образованная за счет электростатического притяжения между катионами и анионами.
12 Металлическая связь
Металлическая связь — химическая связь между атомами в металлическом кристалле, возникающая за счёт перекрытия (обобществления) их валентных электронов.
Комплексные соединения
Комплексное соединение — химическое вещество, в состав которого входят комплексные частицы. В настоящее время строгого определения понятия «комплексная частица» нет. Обычно используется следующее определение.
Комплексная(координационная) частица — сложная частица, способная к самостоятельному существованию в кристалле или растворе, образованная из других, более простых частиц, также способных к самостоятельному существованию. Иногда комплексными частицами называют сложные химические частицы, все или часть связей в которых образованы по донорно-акцепторному механизму.
Комплексообразователь — центральный атом комплексной частицы. Обычно комплексообразователь — атом элемента, образующего металл, но это может быть и атом кислорода, азота, серы, иода и других элементов, образующих неметаллы. Комплексообразователь обычно положительно заряжен и в таком случае именуется в современной научной литературе металлоцентром; заряд комплексообразователя может быть также отрицательным или равным нулю.
Лиганды (Адденды) — атомы или изолированные группы атомов, располагающиеся вокруг комплексообразователя. Лигандами могут быть частицы, до образования комплексного соединения представлявшие собой молекулы (H2O, CO, NH3 и др.), анионы (OH− , Cl− , PO43− и др.), а также катион водорода H+.
Внутренняя сфера комплексного соединения — центральный атом со связанными с ним лигандами, то есть, собственно, комплексная частица.
Внешняя сфера комплексного соединения — остальные частицы, связанные с комплексной частицей ионной или межмолекулярными связями, включая водородные.
Дентатность лиганда определяется числом координационных мест, занимаемых лигандом в координационной сфере комплексообразователя. Различают монодентатные (унидентатные) лиганды, связанные с центральным атомом через один из своих атомов, то есть одной ковалентной связью, бидентатные (связанные с центральным атомом через два своих атома, то есть, двумя связями), три-, тетрадентатные и т. д.
Координационный полиэдр — воображаемый молекулярный многогранник, в центре которого расположен атом-комплексообразователь, а в вершинах — частицы лигандов, непосредственно связанные с центральным атомом.
Координационное число (КЧ) — число связей, образуемых центральным атомом с лигандами. Для комплексных соединений с монодентантными лигандами КЧ равно числу лигандов, а в случае полидентантных лигандов — числу таких лигандов, умноженному на дентатность.
Типы комплексных соединений
Существует несколько типов комплексных соединений, в основу которых положены различные принципы.
По заряду комплекса
1) Катионные комплексы образованы в результате координации вокруг положительного иона нейтральных молекул (H2O, NH3 и др.).
[Zn(NH3)4]Cl2 — хлорид тетраамминцинка(II)
[Co(NH3)6]Cl2 — хлорид гексаамминкобальта(II)
2) Анионные комплексы: в роли комплексообразователя выступает ион с положительной степенью окисления, а лигандами являются простые или сложные анионы.
K2[BeF4] — тетрафторобериллат(II) калия
Li[AlH4] — тетрагидридоалюминат(III) лития
K3[Fe(CN)6] — гексацианоферрат(III) калия
3) Нейтральные комплексы образуются при координации молекул вокруг нейтрального атома, а также при одновременной координации вокруг положительного иона — комплексообразователя отрицательных ионов и молекул.
[Ni(CO)4] — тетракарбонилникель
[Pt(NH3)2Cl2] — дихлородиамминплатина(II)
Лабораторная работа №1
Тема: «Строение атома.Химическая связь»
Теоритическая часть
Последнее изменение этой страницы: 2020-02-17; Просмотров: 132; Нарушение авторского права страницы