
|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |

|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |
ТЕПЛОВОЙ БАЛАНС ПРОЦЕССА ГОРЕНИЯ.
РАСЧЁТ ТЕМПЕРАТУРЫ ГОРЕНИЯ
Под температурой горения понимают максимальную температуру, до которой нагреваются продукты горения. В технике и пожарном деле различают теоретическую, калориметрическую, адиабатическую и действительную температуру горения. Теоретическая температура горения – это температура, при которой выделившаяся теплота горения смеси стехиометрического состава расходуется на нагрев и диссоциацию продуктов горения. Практически диссоциация продуктов горения начинается при температуре выше 2 000 К.
Калориметрическая температура горения – это температура, которая достигается при горении стехиометрической горючей смеси с начальной температурой 273 К и при отсутствии потерь в окружающую среду. Адиабатическая температура горения – это температура полного сгорания смесей любого состава при отсутствии тепловых потерь в окружающую среду. Действительная температура горения – это температура горения, достигаемая в условиях реального пожара. Она намного ниже теоретической, калориметрической и адиабатической, т.к. в реальных условиях до 40 % теплоты горения обычно теряется на излучение, недожог, нагрев избытка воздуха и т.д. Экспериментальное определение температуры горения для большинства горючих веществ представляет значительные трудности, особенно для жидкостей и твёрдых материалов. Однако в ряде случаев теория позволяет с достаточной для практики точностью вычислить температуру горения веществ, основываясь только на знании их химической формулы, состава исходной горючей смеси и продуктов горения. В общем случае для вычислений используется следующая зависимость (приближённая, так как Ср=f(T)): Qпг=Vпг*Cр*Tг, где Qпг - энтальпия продуктов горения; Vпг - количество продуктов горения, м3/кг; Cр - средняя объёмная теплоемкость смеси продуктов горения в интервале температур от Т0 до Тг, кДж/(м3*К); Тг - температура горения, К. Энтальпия продуктов горения определяется из уравнения теплового баланса: Qпг = QH + Qисх – Qпот, (24) Qпот = Qи + Qнедож + Qдис с , (25) где Qисп – теплота испарения; Qпот – потери тепла за счёт излучения, недожога и диссоциации продуктов горения. В зависимости от рода учитываемых потерь теплоты в зоне горения (на излучение, недожог, диссоциацию продуктов горения) вычисляется та или иная температура. При кинетическом горении газопаровоздушных смесей потери теплоты из зоны горения пренебрежимо малы, поэтому для этих смесей действительная температура горения близка к адиабатической, которую и используют в пожарно- технических расчетах. Среднюю теплоемкость смеси продуктов горения определить очень сложно. Ориентировочно энтальпия смеси продуктов горения может быть выражена как сумма энтальпий ее компонентов: Qпг = Σ (Vпг)i (Ср)i * Тг , (26)
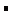
где (Vпг)i – количество i-го компонента продуктов горения; Ср – средняя объемная теплоемкость i-го компонента при Тг и постоянном давлении; Тг – температура горения. При расчётах температуры горения пользуются величиной Qн (низшей теплотой сгорания), так как при температуре горения вода находится в газообразном состоянии. Значения низшей теплоты сгорания вещества (тепловой эффект химической реакции) приводится в справочной литературе, а также может быть рассчитана из следствия закона Гесса: Qн=(Σ Δ Нi*ni)прод-(Σ Δ Нi*ni)исх,, где (27) Δ Нi – теплота образования i-го вещества, ni – количество молей i-го вещества. Согласно следствию из закона Гесса тепловой эффект химической реакции равен разности сумм теплот образования продуктов реакции и теплот образования исходных веществ. Напомним из курса химии, что теплота образования простых веществ (кислорода, азота и др.) равна нулю. Например, рассчитаем теплоту сгорания (тепловой эффект) этана: С2Н6 + 3, 5 * (О2 + 3, 76N2) = 2 CО2 + 3 Н2О + 3, 76 * 3, 5 N2. Низшая теплота сгорания, согласно следствию Гесса равна: Qн=Δ HCO2 *n CO2 +Δ HH2O* nH2O- Δ HC2H6*n C2H6 (28) Подставляя значения теплоты образования СО2, Н2О, С2Н6 из справочных данных, определяют низшую теплоту сгорания этана. При сгорании смеси индивидуальных веществ сначала определяют теплоту сгорания каждого компонента, а затем их суммируют с учётом процентного содержания каждого горючего вещества в смеси:
Если горючее является сложным веществом и его элементный состав задан в массовых процентах, то для расчёта теплоты сгорания используют формулу Менделеева: / Qncм=339, 4*С+1257*H-108, 9(O-N-S)-25(9*H+W), кДж/кг (30) где C, H, O, N, S-процентное содержание данного элемента в горючем веществе; W – содержание влаги в масс. %. Для расчёта температуры горения составим уравнение теплового баланса, считая, что выделившееся в результате сгорания тепло нагревает продукты горения от начальной температуры Т0 до температуры Тг.: Qн(1-η )=Σ српгi*Vпгi (Тг-Т0) Где η – коэффициент теплопотерь (доля потерь тепла на излучение, а также в результате неполноты сгорания); српгi – теплоёмкость i-го продукта горения при постоянном давлении, кДж/мольК; Vпгi – объём i-го продукта горения, м3. Расчёт объёма продуктов горения (СО2, Н2О, SO2, N2) проводится по следующим формулам:
Из уравнения теплового баланса:
Трудность в определении температуры горения по этой формуле заключается в том, что теплоёмкость газа зависит от температуры. Так как газы нагреваются от температуры Т0 до температуры Тг , то в формулу (36) необходимо подставить среднее значение теплоёмкости именно в этом интервале температур. Но температура горения нам неизвестна и мы хотим её найти. В этом случае можно поступить следующим образом. Среднее значение температуры горения большинства веществ в воздухе составляет примерно 1500 К. Поэтому с небольшой погрешностью в определении Тг для расчётов можно взять среднее значение теплоёмкости в интервале температур 273–1500 К. Эти значения для основных продуктов горения приведены в табл. 6. Таблица 6 Средние значения теплоёмкостей основных продуктов горения в интервале температур 273–1500оС
Среднее значение теплоёмкости некоторых газообразных веществ в различных температурных интервалах приведены также в табл. III приложения. Рассмотрим примеры решения задач на расчёт температуры горения.
Популярное:
|
Последнее изменение этой страницы: 2016-03-17; Просмотров: 1785; Нарушение авторского права страницы