Урок 31. Обобщение по теме: Кислородсодержащие соединения.
№130. Подготовка к контрольной работе по теме: Кислородсодержащие соединения.
| В классе
| Дома
|
| Задание 1.
На 3. Дать названия веществам, формулы которых приведены ниже:
А) СН3- СН2- СН2-СН2- ОН;
б) СН3–СН2-СН2 -СООН.
в)
СН3-СН-СОН
I
СН3
На 4.Построить все возможные изомеры для вещества с общей формулой С4Н8О, дать им названия, определить класс.
На 5. Построить все возможные изомеры для вещества с общей формулой С4Н10О, дать им названия, определить класс и охарактеризовать.
| Задание 1.
На 3. Дать названия веществам, формулы которых приведены ниже:
А) СН3- -СОН; б) СН3; в) СН2 -СН2-СН2 -СООН.
I
СН3-С-ОН
I
СН3
На 4.Построить изомеры одного класса для вещества с общей формулой С3Н6О, дать им названия, определить класс.
На 5. Построить все возможные изомеры для вещества с общей формулой С3Н6О2, дать им названия, определить класс.
|
| Задание 2.
На 3.Закончите уравнения химических реакций, укажите названия веществ и тип реакций:
А) СН3-СООН + Мgà; б) СН3-СООН + С2Н5ОНà; в) СН3-СООН + Nа2СО3à.
На 4. С какими из ниже перечисленных веществ будет реагировать этановая кислота: оксид серебра, магний, натрий, водород, кислород, силикат натрия, этанол, этановая кислота, соляная кислота? Запишите уравнения соответствующих реакций, дайте названия полученным веществам и реакциям.
На 5. Осуществите превращения несколькими реакциями. Дайте названия полученным веществам и реакциям:
СН3-СН2-СН2-СН2-СН2ОНà
СН3-СН-СН2-СН2СОН. à
СН3-СН2-СН2-СН2 -СООН.
| Задание 2.
На 3.Закончите уравнения химических реакций, укажите названия веществ и тип реакций:
А) СН3-СООН + Znà; б) СН3-СООН + С3Н7ОНà; в) СН3-СООН + K2СО3à.
На 4. Запишите уравнения соответствующих реакций, дайте названия полученным веществам пропановой кислоты с: цинком, этанолом, гидроксидом натрия?
На 5. Осуществите превращения несколькими реакциями. Дайте названия полученным веществам и реакциям:
СН3- СН2-СН2ОНà
СН3- СН2-СОНà
СН3-СН2 -СН2 -СООН
|
| Задание 3.
На 3 Решите задачу. Вычислите массовую долю углерода в муравьиной кислоте.
На 4. Решите задачу. Сколько воздуха (в л) необходимо для сжигания 6, 4 г метилового спирта.
На 5. Решите задачу. 5 г 95 % раствора муравьиной кислоты смешали с раствором этилового спирта и нагрели. Сколько эфира
(в г ) должно образоваться?
| Задание 3.
На 3. Решите задачу. Вычислите массовую долю кислорода в муравьиной кислоте.
На 4. Решите задачу. Сколько воздуха (в л) необходимо для сжигания 6, 4 г пропилового спирта.
На 5. Решите задачу. 5 г 95 % раствора пропионовой кислоты смешали с раствора этилового спирта и нагрели. Сколько эфира (в г ) должно образоваться?
|
Урок 32. Контрольная работа по химии (10 класс). База
Тема: Кислородсодержащие органические соединения.
Урок 33. Высокомолекулярные соединения.
Самостоятельное изучение.
№ 132. Напишите сообщения по темам и плану.
Высокомолекулярные соединения.
- Классификация ВМС
- химический состав ВМС
- строение нуклеиновых ВМС
- Функции нуклеиновых кислот
- Какие вещества называют ферментами.
- Виды ферментов, их свойства и функции
******************************************************************
Класс.
Урок 34. Основные сведения о строении атома.
План характеристики химического элемента.
- Название
- Химический знак
- Строение ядра (протоны, нейтроны)
- Относительная атомная масса
- Общее число электронов.
- Определить число энергетических уровней (номер периода)
- Распределить число электронов по энергетическим уровням.
- Записать электронную формулу
- Определить степени окисления
- Определить окислительно-восстановительные свойства
- Сравнить с соседями по периоду и группе (сравнивать радиус атома и окислительно-восстановительные свойства)
- Составить генетическую цепочку.
Тренажер:
Харктеристика элемента по П.С.:
План – алгоритм характеристики элемента по его положению в ПСХЭ Д. И. Менделеева
1.Название
2.Химический знак
3.Порядковый номер
4.Номер периода (большой 4-7 или малый 1-3)
5.Номер группы, подгруппа (главная «А» или побочная «Б»)
6.Состав атома: число электронов, число протонов, число нейтронов
Подсказка!
Число электронов = числу протонов = порядковому номеру;
Число нейтронов = атомная масса (Ar из таблицы Менделеева) – число протонов.
7. Вид элемента (s, p, d, f)
Подсказка!
s-элементы: это первые два элемента в 1-7 периодах;
p-элементы: последние шесть элементов1-6 периодов;
d-элементы: это элементы больших периодов (по 10 штук) между s- и p-элементами;
f-элементы: это элементы 6 и 7 периодов – лантаноиды и актиноиды, они вынесены вниз таблицы.
8.Схема строения атома (распределение электронов по энергоуровням), завершённость внешнего уровня
Подсказка! Для написания схемы нужно знать следующее:
Заряд ядра атома = порядковому номеру атома;
Число энергетических уровней определяют по номеру периода, в котором находится элемент;
У s- и p-элементов на последнем (внешнем) от ядра энергетическом уровне число электронов равно номеру группы, в которой находится элемент.
Например, Na+11)2)8)1=номеру группы;
У d- элементов на последнем уровне число электронов всегда равно 2 (исключения – хром, медь, серебро, золото и некоторые другие на последнем уровне содержат 1 электрон).
Например, Ti+22)2)8)10)2; Cr++24)2)8)13)1 – исключение
Максимальное возможное число электронов на уровнях определяют по формуле Nэлектронов = 2n2, где n – номер энергоуровня.
Например, I уровень – 2 электрона, II – 8 электронов, III – 18 электронов, IV– 32 электрона и т.д.
9.Электронная и электронно-графическая формулы строения атома
Подсказка!
Для написания электронной формулы используйте шкалу энергий:
1s< 2s< 2p< 3s< 3p< 4s< 3d< 4p< 5s< 4d< 5p< 6s< 4f< 5d< 6p< 7s…
Помните! На s – орбитали максимум может быть 2 электрона, на p – 6, на d – 10, на f – 14 электронов.
Например, +11Na 1s22s22p63s1; +22Ti 1s22s22p63s23p64s23d2
10.Металл или неметалл
Подсказка!
К неметаллам относятся: 2 s-элемента - водород и гелий и 20 p-элементов – бор, углерод, азот, кислород, фтор, неон, кремний, фосфор, сера, хлор, аргон, мышьяк, селен, бром, криптон, теллур, йод, ксенон, астат и радон.
К металлам относятся: все d- и f-элементы, все s-элементы (исключения водород и гелий), некоторые p-элементы.
11.Высший оксид (только для s, p)
Подсказка!
Общая формула высшего оксида дана под группой химических элементов (R2O, RO и т.д.)
12.Летучее водородное соединение (только для s, p)
Подсказка!
Общая формула летучего водородного соединения дана под группой химических элементов (RH4, RH3 и т.д.) – только для элементов 4 -8 групп.
№ 133. Дайте характеристику химического элемента, согласно плану: Магний и сера; Калию и фосфору
№ 134

№ 135.

№ 136.

Урок 35. Химическая связь.
Таблица. Значения электроотрицательности по Полингу.
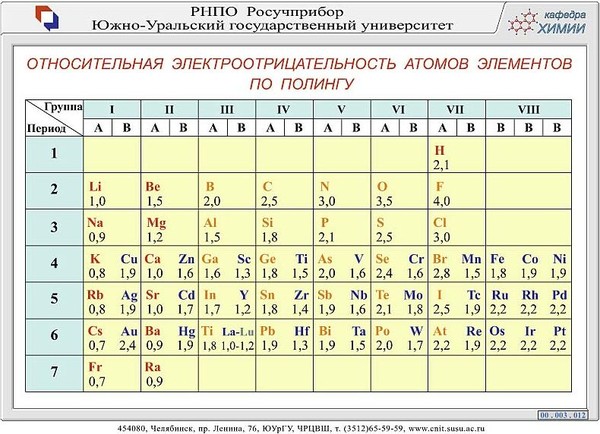
№ 137.


№ 138.



№ 139.

№ 140


