Становление и развитие современной атомистики. Часть 3.
Открытие электрона, мельчайшей отрицательно заряженной частицы, дало реальные основания для выяснения структуры атомов. Начиная с последних лет XIX в. атом, образно говоря, стал примерять одну «электронную одежду» за другой. Но, чтобы остановиться на какой-либо определенной модели, исследователям не хватало весьма важной детали: представления о носителе положительного заряда в атоме, нейтрализующего отрицательные заряды электронов. Тем не менее «электронные» модели атома не замедлили появиться на свет.
Пожалуй, первой из них была модель В.Кельвина (1902), в соответствии с которой электроны распределялись неким образом внутри положительно заряженной сферы. Согласно Ф.Ленарду (1903), атом состоял из «дублетов» отрицательных и положительных зарядов (так называемых динамид). Г.Нагаока (1904) высказал предположение, что атом устроен наподобие планеты Сатурн (вокруг положительно заряженного тела отрицательно заряженные электроны располагаются кольцеобразно).
Все эти модели были результатами теоретических (во многом – чисто математических) построений и носили формальный характер, поскольку не давали основания для попыток связать структуру атомов со свойствами соответствующих элементов.
Дж.Томсон в 1904 г. предложил очередную модель атома: внутри положительно заряженной сферы вращающиеся электроны размещаются в одной плоскости по концентрическим оболочкам (рис. 1).

|
| Рис. 1. Атом Томсона: электроны в облаке, имеющем положительный заряд
|
Хотя вопрос о характере положительного заряда оставался открытым, Томсон математически исследовал подобную модель и выявил случаи равновесного распределения электронов в атоме, т.е. условия существования их устойчивых конфигураций.
Вкратце ход рассуждений ученого заключался в следующем. Наибольшее количество электронов, образующих равновесную конфигурацию («кольцо»), равно пяти. Если же внутри кольца поместить одну или несколько «корпускул» (Томсон всю жизнь называл электроны корпускулами), то оно будет устойчивым и при большем числе образующих его электронов. При увеличении числа электронов они образуют серию концентрических колец, причем количество электронов растет пропорционально радиусу кольца.
Опираясь на свои расчеты, Томсон предпринял первую в своем роде попытку объяснения периодического изменения свойств химических элементов, связав феномен периодичности с закономерным изменением числа электронов в концентрических кольцах, или, как он говорил, в «корпускулярных группах». Обсуждая различные конфигурации колец своей модели, Томсон показывал, что устойчивость этих конфигураций периодически связана с числом «корпускул».

|
| Дж. Томсон (1856–1940)
|
Иначе говоря, воззрения Томсона в скрытой форме содержали исключительно важный вывод – место элемента в периодической системе определяется специфическими особенностями распределения «корпускул» (электронов) в атоме. Подобный вывод был в конечном счете недалек от истины.
Многие современники Томсона положительно характеризовали его идею. Так, Э.Резерфорд, в частности, говорил, что именно Томсону наука обязана объяснением, правда, основанном на общих соображениях, изменения химических свойств атома по мере возрастания числа электронов в нем. Н.Бор отмечал большое влияние работ Томсона на дальнейшее развитие атомной теории. Однако до подлинного понимания сущности периодичности было еще неблизко.
Было неизвестным точное количество электронов в атомах. Поскольку масса электрона весьма мала, то естественным казалось считать, что количество электронов в атомах должно измеряться большими числами (порядка нескольких тысяч). По-прежнему оставался нерешенным вопрос о носителе единичного положительного заряда. Томсон полагал, что его масса должна значительно превосходить массу единичного отрицательного заряда. Подобное предположение впоследствии оказалось соответствующим действительности.

| 
|
| Н.Бор (1885–1962)
| Э.Резерфорд (1871–1937)
|
Все предлагавшиеся атомные модели сыграли ту или иную роль в выяснении действительной структуры атома. Почти каждая из них содержала определенные рациональные зерна. Даже модель Ленарда, поскольку расчеты, проделанные на ее основе, приводили к выводу, что бо'льшая часть объема атома «пуста», даже модель «сатурнианского» атома Нагаоки.
Решающее значение для экспериментального выяснения того, как же все-таки устроен атом, имели исследования рассеяния  -частиц, которыми облучались различные мишени. Здесь-то и проявилась «радиоактивная составляющая» в познании строения вещества: ведь
-частиц, которыми облучались различные мишени. Здесь-то и проявилась «радиоактивная составляющая» в познании строения вещества: ведь  -частица была продуктом одного из видов радиоактивного распада –
-частица была продуктом одного из видов радиоактивного распада –  -распада. В ряде случаев были обнаружены отклонения некоторых
-распада. В ряде случаев были обнаружены отклонения некоторых  -частиц на углы, превышающие 90°. Это аномальное явление свидетельствовало о том, что в атоме сосредоточено интенсивное электрическое поле, ибо в противном случае было бы исключено столь резкое изменение направления движения
-частиц на углы, превышающие 90°. Это аномальное явление свидетельствовало о том, что в атоме сосредоточено интенсивное электрическое поле, ибо в противном случае было бы исключено столь резкое изменение направления движения  -частицы (рис. 2). Развивая эту идею, Резерфорд в 1911 г. выдвинул предположение о существовании в атоме массивного заряженного тела.
-частицы (рис. 2). Развивая эту идею, Резерфорд в 1911 г. выдвинул предположение о существовании в атоме массивного заряженного тела.

|
Рис. 2. Траектории  -частиц, пролетающих вблизи тяжелого ядра -частиц, пролетающих вблизи тяжелого ядра
|
Так появилась на свет ядерная модель атома Резерфорда (сам термин «ядро» был введен Резерфордом в 1912 г.), точнее ее было называть ядерно-планетарной, поскольку она подразумевала, что электроны вращаются вокруг ядра по оболочкам, подобно планетам вокруг Солнца (рис. 3). К идее о положительном заряде ядра Резерфорд пришел не сразу.
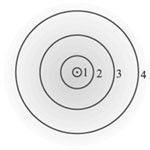
|
| Рис. 3. Планетарная модель атома
|
Стало возможным говорить о разделении свойств атома на два типа: свойства, непосредственно зависящие от ядра, и свойства, определяемые электронными оболочками. К первым относились заряд ядра, масса атома, которая весьма мало отличалась от массы ядра, поскольку суммарная масса электронов была очень мала, а также радиоактивные свойства. Ко вторым относились размеры атома (диаметр атома 10–10 м, диаметр ядра 10–10 м), химические свойства и многие физические свойства, например, электрические, магнитные и оптические.
После того как ядерная модель появилась на свет, центральными все же оказались проблемы, связанные со свойствами, обусловленными электронными оболочками атома. Однако объяснение этих свойств на основе электромагнитной природы сил взаимодействия, определяющих строение атома, столкнулось с фактически неразрешимым противоречием. Оно заключалось в том, что атом, состоящий из положительно заряженного ядра и из отрицательно заряженных электронов, должен быть неустойчив. Ведь электроны в атоме, двигаясь, согласно законам классической механики, вокруг ядра, под действием кулоновских сил притяжения к нему в соответствии с канонами классической электродинамики должны были непрерывно терять энергию вследствие излучения. В итоге электроны все более и более приближались бы к ядру, вплоть до падения на него. Таким образом, атом Резерфорда изначально был обречен на разрушение.
Подобное противоречие было разрешено в 1913 г. Н.Бором, который применил к ядерно-планетарной модели квантовую теорию Планка. Бор рассуждал следующим образом: «…классическая электродинамика недостаточна для описания системы атомного размера. Каково бы ни оказалось изменение в законах движения электрона, представляется необходимым ввести в эти законы величины, чуждые классической электродинамике, т. е. постоянную Планка…» Бор полагал, что если вращающиеся электроны не падают на ядро, то отсюда следует предположение: в атоме есть «пути», двигаясь по которым электроны не теряют энергии. Эти «пути» – так называемые стационарные орбиты, отвечающие «разрешенным» уровням энергии в атоме. Электрон начинает терять энергию только в том случае, если покидает стационарную орбиту. Когда возбужденный атом возвращается в нормальное состояние, «падающий» электрон перескакивает с орбиты на орбиту и теряет энергию не непрерывно, а скачками. «Количественная» оценка этих скачков возможна лишь при условии применения планковской теории. Образно говоря, планковский квант спас атом Резерфорда. Бор таким образом нашел ключ к пониманию внутренней механики атома, создав его квантовую теорию.
Это было величайшее открытие на пути создания современной атомистики. Однако «квантовый атом» также таил в себе противоречие: представление о стационарных орбитах электрона опиралось на квантовую теорию, тогда как расчет этих орбит производился методами классической механики и электродинамики. Тем самым теория Бора не была последовательно ни квантовой, ни классической. Как остроумно заметил английский физик У.Брэгг, принимая теорию Бора, «мы как бы должны по понедельникам, средам и пятницам пользоваться классическими законами, а по вторникам, четвергам и субботам – квантовыми».
В начале января 1913 г. голландский ученый А.Ван ден Брук высказал предположение: порядковый номер элемента (Z) в периодической системе Д.И.Менделеева численно равен заряду ядра его атомов. Кроме того, Ван ден Брук предложил гипотезу о строении атомного ядра. По его мнению, оно должно было состоять из ядер водорода (протонов) и внутриядерных электронов. Этой моделью фактически пользовались до 1932 г.

| 
|
| А.Ван ден Брук (1870–1926)
| Г.Мозли (1887–1915)
|
Идея Ван ден Брука о равенстве заряда ядра атома порядковому номеру оказалась одним из самых фундаментальных «откровений» в зарождавшейся новой атомистике. В том же году она получила экспериментальное подтверждение. Английский физик Г.Мозли детально изучил спектры характеристических рентгеновских лучей, испускавшихся атомами ряда последовательно расположенных элементов (от кальция до цинка). Подобное исследование позволило ему сделать вывод: «Для атома существует фундаментальная величина, которая увеличивается регулярным образом при переходе от одного элемента к соседнему. Эта величина может быть только зарядом центрального положительного ядра… она есть ничто иное, как номер места, занимаемого элементом в периодической системе».
Мозли далее утверждал, что химические свойства элементов управляются величинами их порядковых номеров, тогда как атомные веса являются сами по себе сложной функцией Z. В 1914 г. он продолжил эксперименты со значительно большим количеством элементов и подтвердил правильность своего вывода. Мозли установил величины порядковых номеров элементов от алюминия до золота и зафиксировал отчетливые пробелы, отвечающие не открытым еще элементам (Z = 43, 61, 72 и 75).
Стало очевидно, что последовательность расположения элементов по увеличению атомных весов полностью идентична последовательности по величинам Z. Поэтому существование «аномалий» в последовательности атомных весов Co–Ni, Ar–K, Te–I не противоречило идее периодичности. Точно определилось число элементов между водородом и ураном. Раз и навсегда нижней границей системы элементов был признан водород с Z = 1.
Периодический закон получил наконец физическое обоснование. Сменилась его формулировка. Теперь она звучала так: свойства элементов, а потому и свойства образуемых ими простых и сложных тел находятся в периодической зависимости от зарядов ядер соответствующих элементов.
На смену атомным весам, природа которых все еще оставалась недостаточно ясной, пришла строгая и четкая физическая константа – заряд ядра Z, определяющий число электронов в атоме. Это было своеобразным вторым рождением периодического закона.
Однако выяснение физической сущности периодического закона еще не означало истолкования глубинных причин явления периодичности. Оно не объясняло, почему различные периоды содержат именно такое количество элементов, а не другое и почему периоды начинаются химически активными щелочными металлами, а заканчиваются инертными газами. Иначе говоря, сама структура периодической системы не имела столь же фундаментального обоснования, как периодический закон.
Модель атома требовала дальнейшей детальной разработки, которая заключалась в установлении закономерностей формирования электронных конфигураций атомов по мере роста Z. Именно на этом направлении в начале 1920-х гг. была создана теория периодической системы элементов (главным образом Н.Бором).

