
|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |

|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |
Закон Дальтона. Распределения Максвелла и Больцмана.
Английский физик и химик Джон Дальтон (1766- 1844) в 1793 г., стремясь понять, почему газы в атмосфере составляют смесь с определенными физическими свойствами, а не располагаются друг над другом слоями в соответствии со своими плотностями, установил, что поведение газа не зависит от состава смеси. Д. Дальтон сформулировал закон парциальных давлений газов, а также обнаружил зависимость растворимости газов от их парциального давления. В 1802 г. Парци а льное давл е ние (от лат.–частичный, часть) – давление, которое имел бы газ, входящий в состав газовой смеси, если бы он один занимал объём, равный объёму смеси при той же температуре. Для смеси идеальных газов выполняется закон Дальтона: давление смеси идеальных газов равно сумме парциальных давлений всех компонентов
Значения среднеквадратичной скорости молекул газа, определенные по формуле:
позволяют составить представление о порядке величины среднего значения тепловых скоростей молекул для различных газов. Например, расчеты по этой формуле приТ = 273К дают для молекулярного водорода Но не все молекулы движутся с одинаковыми скоростями. Среди них есть определенная доля молекул с малыми значениями скорости и, наоборот, некоторое число достаточно быстрых молекул. Однако большая часть молекул обладает скоростями, значения которых группируются относительно наиболее вероятной при данной температуре величины, которая не очень существенно отличается от значений, даваемых формулой среднеквадратичной скорости молекул газа. Такое распределение молекул по скоростям устанавливается в газе в результате обмена импульсом и энергией при многочисленных столкновениях молекул между собой и со стенками сосуда.
В пространстве скоростей 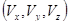 каждому вектору скорости (рис. 2.4) соответствует точка (аналогично обычному пространству каждому вектору скорости (рис. 2.4) соответствует точка (аналогично обычному пространству 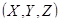 ). ).
Для всего газа в состоянии теплового равновесия эти точки будут распределены с определенной плотностью. Вид этого универсального (не меняющегося во времени) распределения молекул по скоростям, соответствующего состоянию теплового равновесия в газе, был впервые теоретически установлен Максвеллом. С помощью распределения Максвелла определяется относительная доля молекул, абсолютные скорости которых лежат в некотором узком интервале значений dV. Вероятность dP того, что скорость попадает в интервал от Vх до (Vх+ dVх), от Vy до (Vy+ dVy), от Vz до (Vz+ dVz) можно представить в форме:
где Модулю скорости V соответствует шаровой слой (сферический), т.е. все точки, лежащие в этом слое. Поэтому вероятность того, что скорость имеет модуль в интервале от отV до (V+ dV), представляется в виде:
где Функция
является функцией распределения скоростей по модулю. Плотность вероятности или функция распределения
а функция, показывающая вероятность того, что величина скорости имеет значения от V до (V+ dV), называется функцией распределения Максвелла по абсолютным значениям скоростей:
Выдающийся английский физик Джеймс Клерк Максвелл (1831-1879) в 1860 г. вывел закон распределения молекул газа по скоростям, исходя из основных положений молекулярно-кинетической теории, впоследствии названное его именем. Кривая распределения Максвелла показывает, что в системе молекул при данной температуре есть очень быстрые и очень медленные. Поэтому для этой функции распределения были введены три характеристические скорости молекул. 1 – Наиболее вероятная скорость – это скорость, соответствующая максимуму функции F(V). Ее можно определить, приравняв к нулю производную от функции F(V):
Рисунок 2.5 – Кривые распределения Максвелла для разных температур
Отсюда следует, что кроме случаев, когда
дающее выражение для наиболее вероятной скорости молекул газа. При повышении температуры эта наиболее вероятная скорость увеличивается. 2 – Кроме наиболее вероятной скорости, функция F(V) позволяет найти среднюю (среднеарифметическую) скорость:
Вычисление этого интеграла окончательно дает выражение для средней (среднеарифметической) скорости:
3 – Аналогично можно найти и значение среднеквадратичной скорости через интеграл:
решение которого дает значение среднеквадратичной скорости молекул:
Функция распределения скоростей по модулю преобразуется в распределение Максвелла молекул по энергиям:
В заключении следует отметить, что все полученные распределения справедливы только для равновесного состояния термодинамической системы. Вследствие достаточно общего метода их получения, они применимы не только для газов, но и для любых систем, движение микрочастиц которых описывается уравнениями классической механики. Барометрическая формула представляет собой зависимость давления или плотности газа от высоты в поле тяжести Земли. Т.е. барометрическая формула отвечает на вопрос: «Как изменение давления и плотности атмосферы зависит от высоты над поверхностью Земли? »
где Барометрическая формула, определяющая изменение давления с высотой в изотермической атмосфере:
С помощью барометрической формулы получим распределение частиц по потенциальным энергиям. Согласно уравнению Менделеева - Клапейрона:
Молярную массу можно найти из формулы:
Молярная газовая постоянная связана с постоянной Больцмана соотношением:
Потенциальная энергия молекулы в поле силы тяжести:
Если эти четыре последних уравнения подставить в барометрическую формулу и выполнить некоторые преобразования, то получим распределение Больцмана частиц по потенциальным энергиям:
Это распределение справедливо не только для поля силы тяжести, но и для любого потенциального взаимодействия. Оно позволяет найти число частиц с потенциальной энергией ε П в объеме dυ: ε П ~ Тогда число частиц с энергиями от ε 1 доε 2 будет определяться интегралом:
Таким образом, распределение Больцмана представляет собой распределение вероятностей различных энергетических состояний идеальной термодинамической системы (идеальный газ атомов или молекул) в условиях термодинамического равновесия. Это распределение получено австрийским физиком Л. Больцманом (1844-1906) в 1868-1871 годах.
2.1.4 Элементы молекулярной кинетики. Явления переноса Явление переноса – необратимые процессы, происходящие в термодинамически неравновесных системах, в результате которой происходит пространственный перенос энергии, массы, импульса. Для простоты ограничимся одномерными явлениями переноса. Систему отсчета будем выбирать так, чтобы ось Х была ориентирована в направлении переноса. 1 - Теплопроводность – перенос энергии. Если в одной области газа кинетическая энергия больше, чем в другой, то с течением времени вследствие постоянных столкновений молекул происходит выравнивания среднекинетической энергии молекул, т.е. выравнивание температуры. Перенос энергии в форме теплоты в форме теплоты подчиняется закону Фурье:
где Коэффициент теплопроводности численно равен плотности теплового потока при единичном градиенте температуры:
где 2 - Диффузия – перенос массы в результате самопроизвольного проникновения и перемещения частиц двух соприкасающихся жидкости и газов и даже твердых тел. Явление диффузии возникает, когда существует градиент плотности вещества. Явление диффузии для химически однородного газа подчиняется закону Фика:
где
3. Внутреннее трение (вязкость) – перенос импульса. Из-за хаотического теплового движения происходит обмен молекулами между слоями жидкости. После чего импульс слоя, движущегося быстрее, уменьшается, а импульс слоя, движущегося медленнее, увеличивается. Сила внутреннего трения между двумя слоями жидкости подчиняется закону Ньютона:
где η - динамическая вязкость, Согласно II закону Ньютона взаимодействие двух слоев можно рассматривать как процесс, при котором от одного слоя к другому передается импульс, равный по модулю действующей силе. Тогда плотность потока импульса будет равен:
Рассмотренные законы Фурье, Фика и Ньютона не раскрывают молекулярно-кинетического смысла коэффициентов теплопроводности (l), диффузии (D) и динамической вязкости (h), но устанавливает зависимость между ними:
|
Последнее изменение этой страницы: 2020-02-16; Просмотров: 126; Нарушение авторского права страницы