
|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |

|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |
УСТОЙЧВОСТЬ КОМПЛЕКСНЫХ СОЕДИНЕНИЙ ⇐ ПредыдущаяСтр 6 из 6
При характеристике устойчивости комплексов используют такие понятия, как устойчивость и инертность или неустойчивость и лабильность. Устойчивость комплекса является его термодинамической характеристикой и связана с энергиями образующихся связей и с изменением энтропии при комплексообразовании. Инертность и, наоборот, лабильность комплекса являются его кинетическими характеристиками, зависящими от скоростей замещения его лигандов. Устойчивые комплексы могут быть инертными и лабильными. Например, ионы [Cr(H2O)6]3+ и [Fe(H2O)6]3+ имеют близкие значения энергии связи, т.е. обладают почти одинаковой устойчивостью, но первый комплекс инертен и обменивает лиганды медленно, а второй лабилен, так как обменивает лиганды быстро. Неустойчивые комплексы чаще всего являются лабильными. КС могут быть как электролитами, так и неэлектролитами. В первом случае они содержат комплексный катион или анион, то есть являются солью, кислотой или основанием, а во втором – содержат только внутреннюю сферу, то есть относятся к классу нейтральных комплексов. При растворении в воде КС, имеющие внешнюю сферу, диссоциируют как сильные электролиты с образованием комплексного иона, состоящего из частиц внутренней сферы, и ионов внешней сферы. Этот процесс называется первичной диссоциацией. Например К4[Fe(CN)6] ® 4К+ + [Fe(CN)6]4– Наряду с этим процессом, как правило, протекает обратимая ступенчатая диссоциация внутренней сферы, которую называют вторичной диссоциацией. Так для иона [Fe(CN)6]4– этот процесс идет по следующим ступеням первая ступень [Fe(CN)6]4– ↔ CN– + [Fe(CN)5]3– вторая ступень [Fe(CN)5]3– ↔ CN– + [Fe(CN)4]2– и т.д. Подобная запись уравнений вторичной диссоциации комплексов не отражает одного из важных условий протекания процессов в водных растворах: КЧ комплексообразователя должно сохраняться постоянным. Поэтому при отрыве лиганда от комплексного иона его место обязательно заполняется молекулой воды, а процесс вторичной диссоциации правильнее записывать следующим образом первая ступень [Fe(CN)6]4– + Н2О ↔ CN– + [Fe(CN)5(Н2О)]3– вторая ступень [Fe(CN)5(Н2О)]3– + Н2О ↔ CN– + [Fe(CN)4(Н2О)2]2– Количественной характеристикой прочности комплексного иона является константой равновесия процесса вторичной диссоциации, которую называют константой нестойкости Кнест. Например, для иона [Fe(CN)6]4– константы нестойкости первой и второй ступеней выражаются уравнениями
Определение ступенчатых констант нестойкости представляет большие экспериментальные и расчетные трудности, поэтому чаще пользуются величиной общей константы нестойкости Кнест, которая характеризует суммарное равновесие вторичной диссоциации. Например, для иона [Fe(CN)6]4– [Fe(CN)6]4– ↔ 6CN– + Fe2+,
Общая константа нестойкости равна произведению констант нестойкости всех ступеней: Кнест = Кнест, 1·Kнест, 2·Kнест, 3·...Kнест, n (3) Иногда вместо констант нестойкости пользуются обратными величинами – константами устойчивости Куст, относящимися к процессу образования комплексного иона Кнест = 1/Куст (4) Устойчивость комплексных ионов оценивают, сравнивая их ступенчатые константы нестойкости. Если комплексы имеют одинаковое число лигандов, то их устойчивость можно определить по общей константе нестойкости: чем меньше Кнест, тем более устойчив комплексный ион. Значения Кнест некоторых комплеков приведены в табл. 2 приложения. Прочность и состав образующихся комплексных соединений зависит от многих факторов. Помимо природы реагирующих веществ влияние оказывают и условия проведения реакции. В большинстве случаев в малополярных растворителях прочность комплексных соединений выше, чем в полярных, так как в них взаимодействие между ионами комплексообразователя и молекулами растворителя ослаблено. На устойчивость комплексных ионов может влиять и рН среды. Сопоставление Кнест комплексов для реагента и для продукта (при постоянном КЧ) позволяет установить направление смещения равновесия реакции обмена лигандами в растворе. Например для процесса K2[PtCl4] + 4KI ↔ K2[PtI4] + 4KCl, сравнив константы нестойкости ионов [PtCl4]2– и [PtI4]2–, которые равны 1× 10-16 и 1× 10-31 соответственно, видно, что комплексный ион – продукт намного устойчивее комплекса – реагента. Следовательно, равновесие такого процесса сильно сдвинуто вправо, то есть данная реакция протекает в прямом направлении. Разрушение комплекса может произойти при снижении концентрации одного из компонентов, входящих в состав комплексного иона, если, например, в раствор внесено вещество, с которым лиганды связываются более прочно, чем они были связаны с комплексообразователем. Комплексные соединения с малоустойчивой внутренней сферой часто называют двойными солями. В твёрдом состоянии они имеют координационную структуру, а в растворе полностью распадаются на составные ионы. Например К2[CuCl4] ↔ 2K+ + Cu2+ + 4Cl–. Двойные соли можно обозначать перечислением формул простых солей, разделяя их точкой. Например, соль К2[CuCl4] из-за высокого значения константы нестойкости иона [CuCl4]2– часто представляют формулой CuCl2·2КCl. Таким же образом обозначают и кристаллогидраты, являющиеся комплексными соединениями. Различие между кристаллогидратами, двойными солями и комплексными соединениями заключается в их относительной прочности. Двойные соли при диссоциации дают все те ионы, которые находятся в растворах простых солей.
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
П р и м е р 1. Определите заряд комплексообразователя в комплексном соединении [Co(NH3)4Cl2]NO2 назовите это соединение. Р е ш е н и е Внешняя сфера комплексного соединения состоит из одного аниона NO +1 = 1× х + 0·4 + 2·(–1). Отсюда х = +1. Таким образом, КС является комплексным катионом. Название соединения: нитрит дихлоротетрааммин кобальта (+1).
П р и м е р 2. Почему комплексный ион [Cu(NH3)2]+ имеет линейное строение? Р е ш е н и е Определяем заряд комплексообразователя в данном комплексном ионе +1 = 1× х + 0·2. Отсюда х = +1. Электронное строение валентных подуровней иона Cu+ отвечает конфигурации 3d104s04р0. Так как 3d – подуровень не содержит вакансий, то в образовании связей по донорно-акцепторному механизму (в качестве акцептора) со стороны Cu+ участвуют одна 4s и одна 4p орбитали, которые гибридизируются по типу sp. Такому типу гибридизации соответствует линейное строение комплекса.
П р и м е р 3. Определите тип гибридизации АО центрального иона и геометрическое строение комплекса [HgCl4]2–. Р е ш е н и е Электронная конфигурация иона комплексообразователя Hg2+ соответствует записи: 5d106s06р0, а электронно-графическая схема может быть представлена следующим образом
Таким образом, в данном комплексном ионе имеет место sp3 гибридизация АО, в результате которой связи направлены к вершинам тетраэдра и ион [HgCl4]2– имеет тетраэдрическую структуру.
П р и м е р 4. Составьте энергетическую диаграмму образования связей в комплексе [Fe(CN)6]3– и укажите тип гибридизации орбиталей центрального атома. Какими магнитными свойствами обладает комплекс? Р е ш е н и е Электронная конфигурация центрального иона Fe3+: …3d54s04p04d0. Шесть монодентатных лигандов CN– создают сильное октаэдрическое поле и образуют шесть σ –связей, предоставляя неподеленные пары электронов атома углерода на свободные АО комплексообразователя Fe3+, при этом происходит снятие вырождения АО 3d подуровня комплексообразователя. Энергетическая диаграмма комплекса имеет вид
   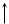   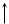      

Пять 3d-электронов полностью распределяются на орбиталях 3dε серии, так как энергия расщепления, которая возникает при взаимодействии с лигандами сильного поля, оказывается достаточной для максимального спаривания электронов. Свободные 3d, 4s и 4р–орбитали подвергаются d2sp3–гибридизации и обуславливают октаэдрическую структуру комплекса
Комплекс находится в низкоспиновом состоянии и является парамагнетиком, т.к. имеется один неспаренный электрон.
П р и м е р 5. Составьте энергетическую диаграмму образования связей в комплексе [CrF4]– и укажите тип гибридизации. Р е ш е н и е Электронная формула Cr3+: …3d34s04p04d0. Монодентатные лиганды F– образуют четыре σ –связи, являются лигандами слабого поля и создают тетраэдрическое поле
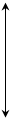 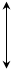
Свободные две 3d, одна 4s и одна 4р АО комплексообразователя гибридизируются по типу d2sp, в результате образуется комплекс тетраэдрической конфигурации, высокоспиновый, парамагнитный.
П р и м е р 6. Объясните, почему ион [CoF6]3– парамагнитный, а ион [Co(CN)6]3– диамагнитный. Р е ш е н и е Электронная формула комплексообразователя Со3+: …3d6. В октаэдрическом поле лигандов F– (лиганд слабого поля) происходит незначительное расщепление d–подуровня, поэтому электроны заполняют АО в соответствии с правилом Гунда (см. рис.3). В этом случае имеется четыре непарных электрона, поэтому ион [CoF6]3– парамагнитный. При образовании иона [Co(CN)6]3– с участием лиганда сильного поля (ион CN–) энергия расщепления d–подуровня будет столь значительна, что превысит энергию межэлектронного отталкивания спаренных электронов. Электроны будут заполнять АО иона Со3+ с нарушением правила Гунда (см. рис.4). Все электроны спарены, сам ион – диамагнитный.
П р и м е р 7. Для иона [Cr(H2O)6]3+ энергия расщепления равна 167, 2 кДж·моль–1. Какова окраска соединений хрома (III) в водных растворах? Р е ш е н и е Для определения окраски вещества определим длину волны, при которой происходит поглощение света. Используем формулу (2)
отсюда выразим λ
Таким образом, ион [Cr(H2O)6]3+ поглощает свет в красной части спектра, что в соответствии с табл. 1 приложения соответствует окраске соединения хрома (III) зелёного цвета.
П р и м е р 8. Максимум поглощения видимого света ионом [Cu(NH3)4]2+ соответствует длине волны λ = 304 нм. Вычислите энергию расщепления d–подуровня. Р е ш е н и е По формуле (2) определяем энергию расщепления
П р и м е р 9. Изобразите распределение электронов по АО в октаэдрическом ионе [Ti(H2O)6]3+. Определите энергию электронного перехода, если ион титана поглощает свет с длиной волны 4930 Å (1 Å = 1× 10–10 м). Р е ш е н и е Определим заряд комплексообразователя в данном ионе (х + 6·0) = +3, х = +3. Молекулы воды являются лигандами слабого поля. Ион Ti3+ имеет электронную конфигурацию 3d14s0. Тогда распределение электронов в октаэдрическом поле лигандов
Ион титана имеет один неспаренный электрон на dε –орбитали, следовательно, комплексный ион парамагнитен. При поглощении ионом света возможен переход этого электрона с dε серии на dγ . Энергия этого электронного перехода может быть вычислена по формуле
П р и м е р 10. Установите, выпадет ли осадок сульфида серебра (I) при температуре 25°С, если смешать равные объёмы 0, 001 М раствора [Ag(CN)2]–, содержащего одноимённый лиганд CN– с концентрацией 0, 12 моль/дм3, и раствора иона-осадителя S2– с концентрацией 3, 5·10–3 М. Р е ш е н и е Процесс диссоциации для данного иона можно представить схемой [Ag(CN)2]– ↔ Ag+ + 2CN– Процесс осаждения можно записать так 2Ag+ + S2– ↔ Ag2S¯ Для того чтобы определить будет ли образовываться осадок необходимо рассчитать ПР(Ag2S) по формуле
Найдём концентрацию ионов серебра, для этого запишем выражение для константы нестойкости комплексного иона
Из табл. 2 приложения выбираем значение константы нестойкости комплекса [Ag(CN)2]– Кнест = 1·10-21. Тогда Рассчитаем произведение растворимости образующегося осадка
По табл. 3 приложения выбираем табличное значение произведения растворимости сульфида серебра ( ПР(Ag2S)табл = 5, 7·10–51) и сравниваем его с расчетным. Поскольку ПРтабл < ПРрасчет, то из данного раствора осадок выпадает, так как соблюдается условие выпадения осадка.
П р и м е р 11. Сколько моль хлорида бария необходимо взять, чтобы осадить ионы SO Р е ш е н и е К[Al(SO4)2] – двойная соль имеет малоустойчивую внутреннюю сферу, поэтому при диссоциации полностью распадается на ионы К[Al(SO4)2] ↔ К+ + Al3+ + 2SO В растворе находится 2 моль ионов SO 2Ва2+ + 2SO требуется 2 моль ионов Ва2+ или 2 моль молекул BaCl2.
П р и м е р 12. Вычислите концентрацию ионов цинка в растворе тетрацианоцинката натрия с концентрацией 0, 3 моль/дм3 при избытке цианид–ионов в растворе равном 0, 01 моль/дм3. Р е ш е н и е Ионы цинка в свободном виде в растворе могут находиться только при полной диссоциации комплекса. Первичная диссоциация протекает практически полностью по схеме Na2[Zn(CN)4] → 2Na2+ + [Zn(CN)4]2– Вторичная диссоциация протекает по уравнению [Zn(CN)4]2– ↔ Zn2+ + 4CN– Запишем для данного процесса выражение константы нестойкости
Из табл. 2 приложения находим значение константы нестойкости данного иона (Кнест = 1, 3·10-17). Поскольку концентрация цианид–ионов, образующихся в результате диссоциации комплекса, гораздо меньше концентрации введенного избытка, можно полагать, что [CN–] » 0, 01 моль/дм3, то есть концентрацией ионов CN–, образующихся в результате диссоциации, можно пренебречь. Тогда
МНОГОВАРИАНТНОЕ ЗАДАНИЕ №1
Для комплексного соединения по соответствующему номеру варианта (см. табл.2) определите: 1) составные части этого соединения; 2) заряд комплексообразователя; 3) название комплексного соединения; 4) тип гибридизации, реализующийся при образовании связей; 5) геометрическую конфигурацию комплекса; 6) при помощи энергетической диаграммы опишите образования связей в комплексе согласно ТПЛ, определите наличие или отсутствие окраски у комплексообразователя; 7) магнитные свойства комплекса; 8) низко– или высокоспиновым является комплекс; 9) напишите уравнения диссоциации комплекса; 10) напишите выражение константы нестойкости комплекса. Таблица 2
МНОГОВАРИАНТНОЕ ЗАДАНИЕ №2 По одному из вариантов табл. 3: 1. Рассчитайте остаточную молярную концентрацию (моль/дм3) катионов комплексообразователя в 0, 006 М растворе комплекса (столбец 1) в присутствии одноименного лиганда с концентрацией 0, 075 моль/л; 2. Установите, выпадет ли осадок при 25 °С, если смешать равные объёмы 0, 005 М раствора комплекса (столбец 1), содержащего одноименный лиганд с концентрацией 0, 04 М, и раствора иона–осадителя, указанного в столбце 2, с известной концентрацией (столбец 3); 3. Для комплекса (столбец 4), зная параметр расщепления (столбец 5) определите положение полосы поглощения и окраску иона в растворе.
Таблица 3
Список литературы
1. Павлов Н.Н. Общая и неорганическая химия: Учеб. для вузов. М.: ООО «Дрофа», 2002; 2. Общая химия в формулах, определениях, схемах / И.Е. Шиманович, М.Л. Павлович, В.Ф. Тикавый, П.М. Малашко; Под ред. В.Ф. Тикавого. Мн.: Унiверсiтэцкае, 1996; 3. Задачи по общей и неорганической химии: Учеб. пособие для студентов высш. учеб. заведений / Р.А. Лидин, В.А. Молочко, Л.Л. Андреева; под ред. Р.А. Лидина. – М.: Гуманитар. изд. центр ВЛАДОС, 2004; 4. Задачи и упражнения по общей химии: Учеб. пособие / Б.И. Адамсон, О.Н. Гончарук, В.Н. Камышова и др.; под ред. Н.В. Коровина. – М.: Высш. шк., 2003; 5. Сборник задач и упражнений по общей химии: Учеб. пособие / С.А. Пузаков, В.А. Попоков, А.А. Филиппова. – М.: Высш. шк., 2004; 6. Химия. Программа, методические указания, решение типовых задач и контрольные задания для студентов-заочников инженерно-технических специальностей вузов / А.И. Бережной, В.И. Елфимов, Л.Д. Томина – М.: Высш. шк., 2004; 7. Сборник задач и упражнений по общей химии: Учеб. пособие для нехим. спец. вузов / Л.М. Романцева, З.И. Лещинская, В.А. Суханова. – 2-е изд., перераб. и доп. – М.: Высш. шк., 1991; 8. Витинг Л.М., Резницкий Л.А. Задачи и упражнения по общей химии: Учеб. пособие для университетов М.: 1976; 9. Глинка Н.Л. Задачи и упражнения по общей химии: Учеб. Пособие для вузов. – М.: Интеграл-Пресс, 2001; 10. Рабинович В.А., Хавин З.Я. Краткий химический справочник. Л.: Высш. шк., 1991. Приложение Таблица 1 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Последнее изменение этой страницы: 2019-03-29; Просмотров: 2264; Нарушение авторского права страницы