
|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |

|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |
РАЗДЕЛЕНИЕ ИНДИВИДУАЛЬНЫХ БЕЛКОВСтр 1 из 14Следующая ⇒
РАЗДЕЛЕНИЕ ИНДИВИДУАЛЬНЫХ БЕЛКОВ Изучение строения и свойств белков невозможно без их выделения из клетки и очистки от других белков и органических молекул. Стадии: 1. Разрушение клеток изучаемой ткани и получение гомогената. 2. Разделение гомогената на фракции центрифугированием, получение ядерной, митохондриальной, цитозольной или иной фракции, содержащей искомый белок.
Избирательная тепловая денатурация - кратковременное нагревание раствора белков, при котором можно удалить часть денатурированных белковых примесей . Высаливание. Различные белки выпадают в осадок при разной концентрации соли в растворе. Постепенно повышая ее концентрацию, можно получить ряд отдельных фракций с преимущественным содержанием выделяемого белка в одной из них. Наиболее часто для фракционирования белков используют сульфат аммония. Белки с наименьшей растворимостью выпадают в осадок при небольшой концентрации солей. 5 Гель-фильтрация — метод молекулярного просеивания молекул через набухшие гранулы сефа-декса (трехмерные полисахаридные цепи декстра-на, имеющие поры). Скорость прохождения белков через колонку, заполненную сефадексом, будет зависеть от их молекулярной массы: чем меньше масса молекул, тем легче они проникают внутрь гранул и дольше там задерживаются, чем больше масса, тем быстрее они элюируются с колонки. Ультрацентрифугирование — метод, заключающийся в том, что белки в центрифужной пробирке помещают в ротор ультрацентрифуги. При вращении ротора скорость оседания белков пропорциональна их молекулярной массе: более тяжелые белки образуют фракции, расположенные ближе ко дну кюветы, более легкие — к поверхности. Ионообменная хроматография - метод фракционирования, основанный на связывании ионизированных групп белков с противоположно заряженными группами ионообменных нерастворимых полимеров. Прочность связывания белка со смолой пропорциональна заряду белка. Белки, адсорбированные на ионообменном полимере, можно смыть возрастающими концентрациями NaCl; чем меньше заряд белка, тем меньшая концентрация NaCl потребуется, чтобы смыть белок, прикрепленный к ионогенным группам смолы. Аффинная хроматография — наиболее специфический метод выделения индивидуальных белков. К инертному полимеру ковалентно присоединяется лиганд какого-либо белка. При пропускании раствора белков через колонку с полимером за счет комплементарного связывания белка с лигандом на колонке адсорбируется только специфичный для данного лиганда белок. Электрофорез белков Метод основан на том, что при определённом значении рН и ионной силы раствора бел- ки двигаются в электрическом поле со скоростью, пропорциональной их суммарному заряду. Белки, имеющие суммарный отрицательный заряд, двигаются к аноду (+), а положительно заряженные белки — к катоду (—). Электрофорез проводят на различных носителях: бумаге, крахмальном геле, полиакрила-мидном геле и др. В отличие от электрофореза на бумаге, где скорость движения белков пропорциональна только их суммарному заряду,в полиакриламидном геле скорость движения белков пропорциональна их молекулярным массам. Разрешающая способность электрофореза в полиакриламидном геле выше, чем на бумаге. Так, при электрофорезе белков сыворотки крови человека на бумаге обнаруживают только 5 главных фракций: альбумины, а,-глобулины, а2-глобулины, в-глобулины и у-глобулины Электрофорез тех же белков в полиакриламидном геле позволяет получить до 18 различных фракций. Для обнаружения белковых фракций полоски бумаги или столбики геля обрабатывают красителем (чаще всего бромфеноловым синим или амидовым чёрным). Окрашенный комплекс белков с красителем выявляет расположение различных фракций на носителе.
3) Хроматография . Принцип основан на способности веществ специфически адсорбироваться на адсорбенте, заключенном в колонке. Ионообменная хроматография метод основан на разделении белков, различающихся суммарным зарядом при определённых значениях рН и ионной силы раствора. При пропускании раствора белков через хроматографическую колонку, заполненную твёрдым пористым заряженным материалом, часть белков задерживается на нём в результате электростатических взаимодействий . В качестве неподвижной фазы используют ионообменники — полимерные органические вещества, содержащие заряженные функциональные группы. Различают положительно заряженные анио-нообменники, среди которых наиболее часто используют диэтиламиноэтилцеллюлозу , и отрицательно заряженные катионообменники, например карбоксиметилцеллюлозу содержащую анионные группы. Выбор ионообменника определяется зарядом выделяемого белка. Так, для выделения отрицательно заряженного белка используют анионооб-менник. При пропускании раствора белка через колонку прочность связывания белка с анионо-обменником зависит от количества отрицательно заряженных карбоксильных групп в молекуле. Белки, адсорбированные на анионообменнике, можно смыть буферными растворами с различной концентрацией соли, и разными значениями рН. Ионы хлора связываются с положительно заряженными функциональными группами анионообменника и вытесняют карбоксильные группы белков. При низких концентрациях соли -СМЫВАются белки, слабо связанные с анионообменником. Постепенное увеличение концентрации соли или изменение рН, что меняет заряд белковой молекулы, приводит к выделению белковых фракций, в одной из которых находится искомый белок. Классификация аминокислот Строение пептида Количество аминокислот в составе пептидов может сильно варьировать. Пептиды, содержащие до 10 аминокислот, называют олигопептиды. Часто в названии таких молекул указывают количество входящих в состав олигопептида аминокислот: трипептид, пентапептид, октапептид и т.д. Пептиды, содержащие более 10 аминокислот, называют «полипептиды», а полипептиды, состоящие из более чем 50 аминокислотных остатков, обычно называют белками.. Мономеры аминокислот, входящих в состав белков, называют «аминокислотные остатки». Аминокислотный остаток, имеющий свободную аминогруппу, называется N-концевым и пишется слева, а имеющий свободную -карбоксильную группу — С-концевым и пишется справа. Пептиды пишутся и читаются с N-конца. Цепь повторяющихся атомов в полипептидной цепи -NH-CH-CO-носит название «пептидный остов» ( Пептиды различаются по аминокислотному составу, количеству и порядку аминокислот. 2. Характеристика пептидной связи Пептидная связь имеет характеристику частично двойной связи, поэтому она короче, чем остальные связи пептидного остова, и вследствие этого мало подвижна. Электронное строение пептидной связи определяет плоскую жёсткую структуру пептидной группы. Плоскости пептидных групп расположены под углом друг к другу Связь между углеродным атомом и аминогруппой или а-карбоксильной группой способна к свободным вращениям (хотя ограничена размером и характером радикалов), что позволяет полипептидной цепи принимать различные конфигурации. Пептидные связи обычно расположены в транс-конфигурации, т.е. -углеродные атомы располагаются по разные стороны от пептидной связи. В результате боковые радикалы аминокислот находятся на наиболее удалённом расстоянии друг от друга в пространстве Пептидные связи очень прочны и самопроизвольно не разрываются при нормальных условиях, В живых организмах пептидные связи в белках разрываются с помощью специальных про-теолитических ферментов Для обнаружения в растворе белков и пептидов, а также для их количественного определения используют биуретовую реакцию
7. Первичная структура белков, т.е. последовательность аминокислот в нем, программируется последовательностью нуклеотидов в ДНК. Выпадение, вставка, замена нуклеотида в ДНК приводит к изменению аминокислотного состава и, следовательно, структуры синтезируемого белка. Методы изучения первичной структуры белка.
Если связанные полипептидные цепи направлены противоположно, возникает антипараллельная ?-структура, если же N- и С-концы полипептидных цепей совпадают, образуется структура параллельного ?-складчатого слоя. 9. Третичная структура – это укладка полипептидной цепи в глобулу ("клубок"). Четкой границы между вторичной и третичной структурами провести нельзя, в основе третичной структуры лежат стерические взаимосвязи между аминокислотами, отстоящими далеко друг от друга в цепи. Благодаря третичной структуре происходит еще более компактное формирование цепи. В стабилизации третичной структуры белка принимают участие: ковалентные связи (между двумя остатками цистеина — дисульфидные мостики); ионные связи между противоположно заряженными боковыми группами аминокислотных остатков; водородные связи; гидрофильно-гидрофобные взаимодействия. При взаимодействии с окружающими молекулами воды белковая молекула «стремится» свернуться так, чтобы неполярные боковые группы аминокислот оказались изолированы от водного раствора; на поверхности молекулы оказываются полярные гидрофильные боковые группы. Связь с первичной структурой. Третичная структура в значительной степени предопределена первичной структурой. Усилия по предсказанию третичной структуры белка основываясь на первичной структуре известна как задача предсказания структуры белка. Однако, окружающая среда, в которой белок сворачивается существенно определяет конечную форму, но обычно непосредственно не принимается во внимание текущими методами предсказания. Большинство таких методов полагаются на сравнения с уже известными структурами, и таким образом включают окружающую среду косвенно. Супервторичная структура белков. сравнение конформаций разных по структуре и функциям белков выявило наличие у них похожих сочетаний элементов вторичной структуры. Такой специфический порядок формирования вторичных структур называют супервторичной структурой белков.она формируется за счёт межрадикальных взаимодействий. Определённые характерные сочетания а-спиралей и б-структур часто обозначают как "структурные мотивы". 1. Супервторичная структура типа б-бочонка В данный структурный мотив входят две а-спирали. Более короткая а-спираль располагается поперёк бороздки, а более длинная а-спираль - в большой бороздке, образуя не-ковалентные специфические связи радикалов аминокислот с нуклеотидами ДНК 3. Супервторичная структурав виде "цинкового пальца" Этот вид супервторичной структуры также часто отмечают в ДНК-связывающих белках. "Цинковый палец" - фрагмент белка, содержащий около 20 аминокислотных остатков, в котором атом цинка связан с радикалами четырёх аминокислот: обычно с двумя остатками цистеина и двумя - гистидина. В некоторых случаях вместо остатков гистидина также находятся остатки цистеина 4. Супервторичная структура Некоторые ДНК-связывающие белки олигомерны, т.е. содержат в своём составе несколько полипептидных цепей. Кроме того, существуют белки, которые функционируют в комплексе с другими белками. Объединение протомеров или отдельных белков в комплексы иногда осуществляется с помощью структурных мотивов, называемых "лейциновая застёжка-молния".
10. Четвертичная структура белка-это количество и взаиморасположение полипептидных цепей Белки, состоящие из одной полипептидной цепи, имеют только третичную структуру (лизоцим, пепсин, миоглобин, трипсин).Их называют мономерами. Для белков, состоящих из нескольких полипептидных цепей, характерна четвертичная структура - объединение отдельных полипептидных цепей с третичной структурой в функционально активную молекулу белка. Каждая отдельная полипептидная цепь называется протомером и чаще не обладает биологической активностью.Олигомерные белки содержат от 2(гексокиназа)до 312(пируватдегидрогеназа)пртомеров.Специфичность связывания протомеров за счет зависит от совокупности радикалов третичной структуры и определяется комплементарностьюпротомеров. Комплементарность-пространственное и химическое соответствие взаимодействующих поверхностей. В молекуле белка может быть несколько протомеров, которые при объединении образуют олигомер или мультимер. Для белков с четвертичной структурой характерно понятие субъединицы. Субъединица – это функционально активная часть молекулы белка. Примером белка с четвертичной структурой является гемоглобин, состоящий из 4 протомеров: 2 α и 2 β - цепей. Взаимодействие полипептидных цепей при формировании олигомера происходит за счет полярных групп аминокислотных остатков. Между полярными группами образуется ионная, водородные связи, гидрофобные взаимодействия. Активные центры возникают при образовании четвертичной структуры. В молекуле белка имеются прочные (ковалентные) связи, а также слабые, что обеспечивает с одной стороны стабильность молекулы, а с другой лабильность.
Кислород связывается с протомерами гемоглобина чере железо(2),который соединен с 4 атомами азота пиррольных колец и атомом азота Гис F8 белковой части протомера.Связывание кислорода с оставшейся координационной связью железа происходит по другую сторону от плоскости гема.Гис Е7 обеспечивает оптимальные условия.Присоединение кислорода к атому железа одного протомера вызывает его перемещение в плоскостььгема,за ним перемещаются остаток Гис F8 и полипептидная цепь.Так как протомер связан с остальными протомерами,а белки обладают конформационной лабильностью,происходит изменение конформации всего белка.Конформационные изменения ,произошедшие в других протомерах,облегчают присоединение следующей молекулы кислорода ,что вызывает новые конформационные изменения в белке и ускорение связывания следующей молекулы кислорода .Четвертая молекула кислорода присоединяется к гемоглобину в 300 раз легче первой. Изменение конформациивсехпротомеров олигомерного белка при присоединение лиганда только к одному из них носит название Кооперативные изменения конформациипротомеров. Аналогичным образом в тканях диссоцифция каждой молекулы кислорода изменяет конфоормацию всех протомеров и облегчает отщепление последующих молекул кислорода.
Амфотерность Так как белки содержат кислые и основные аминокислоты, то в их составе всегда имеются свободные кислые (СОО–) и основные (NH3+) группы. Заряд белка зависит от соотношения количества кислых и основных аминокислот. Поэтому, аналогично аминокислотам, белки заряжаются положительно при уменьшении рН, и отрицательно при его увеличении. Если рН раствора соответствует изоэлектрической точке белка, то заряд белка равен 0. Если в белке преобладают кислые аминокислоты (глутамат и аспартат), то при нейтральных рН заряд белка отрицательный и изоэлектрическая точка находится в кислой среде. Для большинства природных белков изоэлектрическая точка находится в диапазоне рН 4,8-5,4, что свидетельствует о преобладании в их составе глутаминовой и аспарагиновой аминокислот. Если в белке преобладают основные аминокислоты (лизин и аргинин) – при нейтральных рН заряд положительный и обусловлен этими, положительно заряженными, аминокислотами. Амфотерность имеет значение для выполнения белками некоторых функций. Например, буферные свойства белков, т.е. способность поддерживать неизменным рН крови, основаны на способности присоединять ионы Н+ при закислении среды или отдавать их при защелачивании. С практической стороны наличие амфотерности позволяет разделять белки по заряду (электрофорез) или использовать изменение величины рН раствора для осаждения какого-либо известного белка. Наличие как положительных, так и отрицательных зарядов в белке обуславливает их способность к высаливанию, что удобно для выделения белков в нативнойконформации. Влияние рН на заряд белка При смещении рН в растворе изменяется концентрация ионов Н+. При закислении среды (при снижении рН) ниже изоэлектрической точки ионы Н+ присоединяются к отрицательно заряженным группам глутаминовой и аспарагиновой кислот и нейтрализуют их. Заряд белка при этом становится положительным. При увеличении рН в растворе выше изоэлектрической точки концентрация ионов Н+ снижается и положительно заряженные группы белка (NH3+-группы лизина и аргинина) теряют протоны, их заряд исчезает. Суммарный заряд белка становится отрицательным.
Растворимость. Так как большинство белков несет много заряженных групп, то в целом они водорастворимы. Растворимость объясняется:
12. Денатурация белков Разрыв большого количества слабых связей в молекуле белка приводит к разрушению её нативной конформации. Так как разрыв связей под действием различных факторов носит случайный характер, то молекулы одного индивидуального белка приобретают в растворе форму случайно сформировавшихся беспорядочных клубковПотеря нативной конформации сопровождается утратой специфической функции белков. В денатурированном белке гидрофобные радикалы, которые в нативной структуре молекулы спрятаны внутри гидрофобного ядра, оказываются на поверхности. При достаточно высокой концентрации белка и отсутствии сильного отталкивающего заряда молекулы могут объединяться друг с другом гидрофобными взаимодействиями, при этом растворимость белка снижается и происходит образование осадка. · Компактная, плотная пространственная структура нативного белка при денатурации резко увеличивается в размерах и становится легко доступной для расщепления пептидных связей протеолитическими ферментами. · Факторы, вызывающие денатурацию белков · высокая температура (более 50 °С), увеличивающая тепловое движение атомов в молекуле и приводящая к разрыву слабых связей; · интенсивное встряхивание раствора · органические вещества (например, этиловый спирт, фенол и его производные) способны взаимодействовать с функциональными группами белков, что приводит к их конформационным изменениям. · кислоты и щелочи, изменяя рН среды, вызывают перераспределение связей в молекуле белка; соли тяжёлых металлов (такие как медь, ртуть, серебро, свинец и др.) образуют прочные связи с важными функциональными группами белков (чаще всего с -SH), изменяя их конформацию и активность; Реакции осаждения белков Белки в растворе и соответственно в организме сохраняются в нативном состоянии за счет факторов устойчивости, к которым относятся заряд белковой молекулы и гидратная оболочка вокруг нее. Удаление этих факторов приводит к склеиванию молекул белков и выпадению их в осадок. Осаждение белков может быть обратимым и необратимым в зависимости от реактивов и условий реакции. В клинической лабораторной практике реакции осаждения используют для выделения альбуминовой и глобулиновой фракций белков плазмы крови, количественной характеристики их устойчивости в плазме, обнаружения белков в биологических жидкостях и освобождения от них с целью получения без белкового раствора. Обратимое осаждение.Под действием факторов осаждения белки выпадают в осадок, но после прекращения действия (удаления) этих факторов белки вновь переходят в растворимое состояние и приобретают свои нативные свойства. Одним из видов обратимого осаждения белков является высаливание. Высаливание . Насыщенным раствором сульфата аммония осаждается альбуминовая фракция белков, полунасыщенным раствором - глобулиновая фракция. Реактивы: 1) неразведенный яичный белок; 2) насыщенный раствор сульфата аммония; 3) NaOH, 10% раствор, 4) CuSO4, 1% раствор; 5) дистиллированная вода; 6) сульфат аммония в порошке. Необратимое осаждение белков . Необратимое осаждение белков связано с глубокими нарушениями структуры белков (вторичной и третичной) и потерей ими нативных свойств. Такие изменения белков можно вызвать кипячением, действием концентрированных растворов минеральных и органических кислот, солями тяжелых металлов. Осаждение при кипячении. Белки являются термолабильными соединениями и при нагревании свыше 50-60 градусов С денатурируются. Сущность тепловой денатурации заключается в разрушении гидратной оболочки, разрыве стабилизирующих белковую глобулу связей и развертывании белковой молекулы. Наиболее полное и быстрое осаждение происходит в изоэлектрической точке (когда заряд молекулы равен нулю), поскольку частицы белка при этом наименее устойчивы. Белки, обладающие кислыми свойствами, осаждаются в слабокислой среде, а белки с основными свойствами - в слабощелочной. В сильнокислых или сильнощелочных растворах денатурированный при нагревании белок в осадок не выпадает, т.к. его частицы перезаряжаются и несут в первом случае положительный, а во втором - отрицательный заряд, что повышает их устойчивость в растворе. Реактивы: 1) яичный белок, 1% раствор; 2) уксусная кислота, 1% и 10% растворы; 3) NaOH, 10% раствор. Классификация белков · по форме молекул (глобулярные или фибриллярные); · по молекулярной массе (низкомолекулярные, высокомолекулярные и др.); · по химическому строению (наличие или отсутствие небелковой части); · по выполняемым функциям (транспортные, защитные, структурные белки и др.); · по локализации в клетке (ядерные, цито-плазматические, лизосомальные и др.); · по локализации в организме (белки крови, печени, сердца и др.); · по возможности адаптивно регулировать количество данных белков: белки, синтезирующиеся с постоянной скоростью (конститутивные), и белки, синтез которых может усиливаться при воздействии факторов среды (индуцибельные); · по продолжительности жизни в клетке (от очень быстро обновляющихся белков, с Т1/2 менее 1 ч, до очень медленно обновляющихся белков, Т1/2 которых исчисляют неделями и месяцами); · по схожим участкам первичной структуры и родственным функциям (семейства белков). Простые белки белки содержат в своём составе только полипептидные цепи, состоящие из аминокислотных остатков. Их называют "простые белки". основные белки хроматина - гистоны; в их составе содержится много аминокислотных остатков лизина и аргинина, радикалы которых имеют положительный заряд Сложные белки белки, кроме полипептидных цепей, содержат в своём составе небелковую часть, присоединённую к белку слабыми или ковалентными связями. Небелковая часть может быть представлена ионами металлов, органическими молекулами с низкой или высокой молекулярной массой. Такие белки называют "сложные белки". Прочно связанная с белком небелковая часть носит название простетической группы. Простетическая группа может быть представлена веществами разной природы. напр белки, соединённые с гемом, носят название гемопротеины. В состав гемопротеинов, кроме уже рассмотренных выше белков гемоглобинов и миоглобина, входят ферменты - цитохромы, каталаза и пероксидаза. Гем, присоединённый к разным белковым структурам, выполняет в них характерные для каждого из белков функции Белки, соединённые с остатком фосфорной кислоты, называют фосфопротеинами. Фосфорные остатки присоединяются сложноэфирной связью к гидроксильным группам серина, треонина или тирозина при участии ферментов, называемых протеинкиназами. В состав белков часто входят углеводные остатки, придающие белкам дополнительную специфичность и часто уменьшающие скорость их ферментативного протеолиза. Такие белки носят название гликопротеинов. Белки, функционирующие в комплексе с липидами, называют липопротеинами, а в комплексе с металлами - металлопротеинами. |
Сложный белок, состоящий из белковой части (апопротеин) и небелковой части (простетическая группа), называют "холопротеин
16. Необходимое условие для функционирования белков - присоединение к нему другого вещества, которое называют "лиганд".
Активный центр белков - определённый участок белковой молекулы, как правило, находящийся в её углублении ("кармане"), сформированный радикалами аминокислот, собранных на определённом пространственном участке при формировании третичной структуры и способный комплементарно связываться с лигандом.
Высокая специфичность связывания белка с лигандом обеспечивается комплементарностью структуры активного центра белка структуре лиганда
Под комплементарностью понимают пространственное и химическое соответствие взаимодействующих молекул. между функциональными группами лиганда и радикалами аминокислот, образующих активный центр, должны возникать связи, удерживающие лиганд в активном центре.
1. Характеристика активного центра
Активный центр белка - относительно изолированный от окружающей белок среды участок, сформированный аминокислотными остатками.
даже незначительные нарушения общей конформации белка в результате точечных изменений его первичной структуры или условий окружающей среды могут привести к изменению химических и функциональных свойств радикалов, формирующих активный центр, нарушать связывание белка с лигандом и его функцию.
Часто активный центр формируется таким образом, что доступ воды к функциональным группам его радикалов ограничен, т.е. создаются условия для связывания лиганда с радикалами аминокислот.
Основное свойство белков, лежащее в основе их функций, - избирательность присоединения к определённым участкам белковой молекулы специфических лигандов.
2. Многообразие лигандов
к определённым участкам активного центра могут присоединяться небелковые молекулы. прочно связанную с активным центром белка и необходимую для его функционирования, называют "простатическая группа". Миоглобин, гемоглобин и цитохромы имеют в активном центре простетическую группу - гем, содержащий железо
3. Сродство активного центра лиганду. Скорость взаимодействия белка с лигандом определяется концентрациями белка и лиганда в растворе, а также степенью комплементарности белка и лиганда.
Константа диссоциации - характеристика сродства активного центра лиганду.
 где Р - белок, L - лиганд, PL - комплекс белка с лигандом, К1 - константа скорости связывания белка с лигандом, К-1 - константа скорости распада комплекса PL.
где Р - белок, L - лиганд, PL - комплекс белка с лигандом, К1 - константа скорости связывания белка с лигандом, К-1 - константа скорости распада комплекса PL.
Когда скорости образования и распада комплекса равны, говорят о том, что система находится в состоянии равновесия:
[P] [L] K1 = [PL] K-1.
Отсюда: KДИСС=K-1/K1=[P]*[L] / [PL].
Соотношение констант распада [PL] комплекса и его образования называется константой диссоциации (Кдисс) комплекса [PL]. Чем меньше Кдисс , тем больше молекул лиганда связано с белком, тем больше комплементарность между Р и L и тем больше сродство лиганда к белку. То есть между Кдисс и сродством лиганда к белку имеется обратно пропорциональная связь.
17/
В основе функционирования любого белка лежит его способность к избирательному взаимодействию с каким-либо другим веществом — лигандом. Лигандом может быть как низкомолекулярное вещество, так и макромолекула, в том числе другой белок. Лиганд присоединяется к определенному участку на поверхности белковой молекулы — центру связывания (активный центр).
Активный центр белков – определённый участок белковой молекулы, как правило, находящийся в её углублении, сформированный радикалами аминокислот, собранных на определённом пространственном участке при формировании третичной структуры и способный комплементарно связываться с лигандом. В линейной последовательности полипептидной цепи радикалы, формирующие активный центр, могут находиться на значительном расстоянии друг от друга.
Высокая специфичность связывания белка с лигандом обеспечивается комплементарностью структуры активного центра белка и структуры лиганда.
Под комплементарностью понимают пространственное и химическое соответствие взаимодействующих молекул. Лиганд должен обладать способностью входить и пространственно совпадать с конформацией активного центра. Это совпадение может быть неполным, но благодаря конформационной лабильности белка, активный центр способен к небольшим изменениям и «подгоняется» под лиганд. Кроме того, между функциональными группами лиганда и радикалами аминокислот, образующих активный центр, должны возникать связи, удерживающие лиганд в активном центре. Связи между лигандом и активным центром белка могут быть как нековалентными (ионными, водородными, гидрофобными), так и ковалентными.
Тот факт, что ферменты обладают высокой специфичностью, позволил в 1890 г. выдвинуть гипотезу, согласно которой активный центр фермента комплементарен субстрату, т.е. соответствует ему как "ключ замку". После взаимодействия субстрата ("ключ") с активным центром ("замок") происходят химические превращения субстрата в продукт. Активный центр при этом рассматривался как стабильная, жёстко детерминированная структура.
В 1959 г. был предложен другой вариант гипотезы "ключ-замок", объясняющий события в активном центре фермента. По этой гипотезе активный центр является гибкой структуройпо отношению к субстрату. Субстрат, взаимодействуя с активным центром фермента, вызывает изменение его конформации, приводя к формированию фермент-субстратного комплекса, благоприятного для химических модификаций субстрата. При этом молекула субстрата также изменяет свою конформацию, что обеспечивает более высокую эффективность ферментативной реакции. Эта "гипотеза индуцированного соответствия" впоследствии получила экспериментальное подтверждение.
18
19.Четвертичная структура белков
Количество и взаиморасположение полипептидных цепей в пространстве называют "четвертичная структура белков". Отдельные полипептидные цепи в таком белке носят название протомеров, или субъединиц. Белок, содержащий в своём составе несколько протомеров, называют олигомерным.
1. Количество протомеров в структуре
олигомерных белков. В состав олигомерных белков может входить от двух до нескольких десятков протомеров.По сравнению с индивидуальными мономерными белками олигомеры выполняют более сложные функции.
2. Сборка протомеров в олигомерный белок.
Комплементарность протомеров . взаимодействие протомеров осуществляется во многих точках контактирующих поверхностей, с образованием десятков слабых связей. Благодаря этому контактные поверхности соединяются с высокой специфичностью, и ошибки формирования четвертичной структуры белков практически исключены. Комплементарность - универсальный принцип, свойственный живой природе и лежащий в основе узнавания и соединения не только протомеров, но и других (не обязательно белковых) молекул.
2.Кооперативность— это такие изменения состояния системы, взаимодействие элементов которой усиливается с течением процесса изменения так, что существенно ускоряет его ход в целом (положительная кооперативность). Таким образом, сила взаимодействия атомов или молекул возрастает по мере нарастания изменений в системе, делая их коллективно согласованными
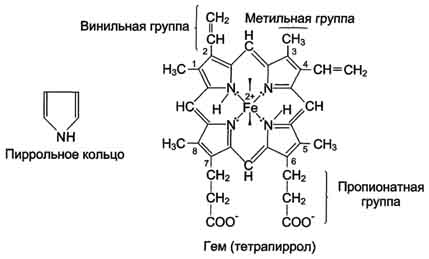
Миоглобин относят к классу гемсодержащих белков, т.е. он содержит простетическую группу - гем, довольно прочно связанную с белковой частью. Миоглобин относят к глобулярным белкам; он имеет только одну полипептидную цепь.
Строение миоглобина
Миоглобин содержит небелковую часть (гем) и белковую часть (апомиоглобин).
· Гем - молекула, имеющая структуру циклического тетрапиррола
· Апомиоглобин - белковая часть миоглобина; первичная структура представлена последовательностью из 153 аминокислот, которые во вторичной структуре уложены в 8 ?-спиралей.
· Третичная структура имеет вид компактной глобулы.
Строение гемоглобина А
Специфичность
Биологическая функция фермента обусловлена наличием в его структуре активного центра. Лиганд, взаимодействующий с активным центром фермента, называют субстратом. В активном центре фермента есть аминокислотные остатки, функциональные группы которых обеспечивают связывание субстрата, и аминокислотные остатки, функциональные группы которых осуществляют химическое превращение субстрата. Условно эти группы обозначают как участок связывания субстрата и каталитический участок, однако следует помнить, что не всегда эти участки имеют чёткое пространственное разделение и иногда могут "перекрываться".
В участке связывания субстрат при помощи нековалентных связей взаимодействует с ферментом, формируя фермент-субстратный комплекс. В каталитическом участке субстрат претерпевает химическое превращение в продукт, который затем высвобождается из активного центра фермента. Схематично процесс катализа можно представить следующим уравнением:
Е + S ↔ ES ↔ ЕР ↔ Е + Р,
где Е - фермент (энзим), S - субстрат, Р - продукт.
Специфичность - наиболее важное свойство ферментов.Различают субстратную и каталитическую специфичности фермента, определяемые строением активного центра.
Субстратная специфичность
Под субстратной специфичностью понимают способность каждого фермента взаимодействовать лишь с одним или несколькими определёнными субстратами. Различают:
Стереоспецифичность
При наличии у субстрата нескольких стереоизомеров фермент проявляет абсолютную специфичность к одному из них. В организме человека наблюдают специфичность ферментов к следующим стереоизомерам.
· Стереоспецифичность к D-сахарам. Большинство моносахаридов и продуктов их обмена в организме человека и других млекопитающих относят к D-стереоизомерам. Ферменты, осуществляющие их метаболизм, имеют специфичность к D-, а не к L-сахарам.

· Стереоспецифичность к L-аминокислотам. Белки человека состоят из аминокислот L-ряда. Большинство ферментов, обеспечивающих превращение аминокислот, имеет Стереоспецифичность к L-аминокислотам.
· Стереоспецифичность к цистрансизомерам. Фермент фумараза оказывает действие только на фумарат. Малеинат (цис-изомер фумарата) не является субстратом фумаразы.

78
· Исключение составляют только ферменты эпимеразы (рацемазы), катализирующие превращение оптических изомеров.
· Стереоспецифичносгь к α- и β-гликозидным связям. Фермент амилаза действует только на а-гликозидные связи, что позволяет гидролизотать крахмал и гликоген (полимеры глюкозы), остатки глюкозы в которых соединены α-гликозидными связями. Целлюлоза - также полимер глюкозы, однако остатки глюкозы в нём связаны β-гликозидными связями. В результате отсутствия у человека ферментов, специфичных к β-гликозидной связи, целлюлоза не гидролизуется в кишечнике человека и не может служить источником глюкозы.
23.понятие холофермент, апофермент, кофактор, субстрат, продукт реакции, ингибитор,активатор.примеры.
1.Простетические группы прочно связаны с белками и даже могут быть присоединены ковалентными связями. Часто играют важную роль в функционировании ферментов. Белок без простетической группы называется «апобелок», а белок с присоединенной группой — «холобелок» (или, соответственно, в случае ферментов — апофермент и холофермент).
Примером может являться гем, который является простетической группой в молекуле гемоглобина.
2.Кофактор-небелковое вещество, которое обязательно должно присутствовать в организме в небольших количествах, чтобы соответствующие ферменты смогли выполнить свои функции. В состав кофактора входят коферменты и ионы металлов (например, ионы натрия и калия).
3.субстрат-вещество, подвергающееся превращению под действием фермента;
4. Ферментативный ингибитор — вещество, замедляющее протекание ферментативной реакции. Различают обратимые и необратимые ингибиторы.Изучение ингибирования ферментов играет важную роль в создании лекарств, в изучении механизма действия и структуры ферментов.
Обратимое ингибирование:
Конкурентное ингибирование(этом случае ингибитор связывается в активном центре фермента и конкурирует за него с субстратом .);( ингибирование сукцинатдегидрогеназ-ной реакции малоновой кислотой)
Бесконкурентное ингибирование(при бесконкурентном ингибировании ингибитор связывается только с фермент-субстратным комплексом, но не со свободным ферментом. Субстрат, связываясь с ферментом, изменяет его конформацию, что делает возможным связывание с ингибитором. Ингибитор, в свою очередь, так меняет конформацию фермента, что катализ становится невозможным.)(
24.
В активном центре фермента субстраты располагаются таким образом, чтобы участвующие в реакции функциональные группы субстратов находились в непосредственной близости друг к другу. Это свойство активного центра называют эффектом сближения и ориентации реагентов. Такое упорядоченное расположение субстратов вызывает уменьшение энтропии и, как следствие, снижение энергии активации (Еа), что определяет каталитическую эффективность ферментов.
Активный центр фермента также способствует дестабилизации межатомных связей в молекуле субстрата, что облегчает протекание химической реакции и образование продуктов. Это свойство активного центра называют эффектом деформации субстрата
Молекулярные механизмы ферментативного катализа
Механизмы ферментативного катализа определяются ролью функциональных групп активного центра фермента в химической реакции превращения субстрата в продукт. Выделяют 2 основных механизма ферментативного катализа: кислотно-основной катализ и ковалентный катализ.
Кислотно-основной катализ
Концепция кислотно-основного катализа объясняет ферментативную активность участием в химической реакции кислотных групп (доноры протонов) и/или основных групп (акцепторы протонов). Кислотно-основной катализ - часто встречающееся явление. Аминокислотные остатки, входящие в состав активного центра, имеют функциональные группы, проявляющие свойства как кислот, так и оснований.
К аминокислотам, участвующим в кислотно-основном катализе, в первую очередь относят Цис, Тир, Сер, Лиз, Глу, Асп и Гис. Радикалы этих аминокислот в протонированной форме - кислоты (доноры протона), в депротонированной - основания (акцепторы протона). Благодаря этому свойству функциональных групп активного центра ферменты становятся уникальными биологическими катализаторами, в отличие от небиологических катализаторов, способных проявлять либо кислотные, либо основные свойства. Ковалентный катализ основан на атаке нук-леофильных (отрицательно заряженных) или электрофильных (положительно заряженных) групп активного центра фермента молекулами субстрата с формированием ковалентной связи между субстратом и коферментом или функциональной группой аминокислотного остатка (как правило, одной) активного центра фермента.
Действие сериновых протеаз, таких как трипсин, химотрипсин и тромбин, - пример механизма ковалентного катализа, когда ковалентная связь образуется между субстратом и аминокислотным остатком серина активного центра фермента.
25. Под комплементарностью понимают пространственное и химическое соответствие взаимодействующих молекул. Лиганд должен обладать способностью входить и пространственно совпадать с конформацией активного центра. Это совпадение может быть неполным, но благодаря конформационной лабильности белка активный центр способен к небольшим изменениям и "подгоняется" под лиганд. Кроме того, между функциональными группами лиганда и радикалами аминокислот, образующих активный центр, должны возникать связи, удерживающие лиганд в активном центре. Связи между лигандом и активным центром белка могут быть как нековалентными (ионными, водородными, гидрофобными), так и ковалентными.
Тот факт, что ферменты обладают высокой специфичностью, позволил в 1890 г. выдвинуть гипотезу, согласно которой активный центр фермента комплементарен субстрату, т.е. соответствует ему как "ключ замку". После взаимодействия субстрата ("ключ") с активным центром ("замок") происходят химические превращения субстрата в продукт. Активный центр при этом рассматривался как стабильная, жёстко детерминированная структура.
Субстрат, взаимодействуя с активным центром фермента, вызывает изменение его конформации, приводя к формированию фермент-субстратного комплекса, благоприятного для химических модификаций субстрата. При этом молекула субстрата также изменяет свою конформацию, что обеспечивает более высокую эффективность ферментативной реакции. Эта "гипотеза индуцированного соответствия" впоследствии получила экспериментальное подтверждение.
26. Ферменты, катализирующие одну и ту же химическую реакцию, но отличающиеся по первичной структуре белка, называют изоферментами, или изоэнзимами. Они катализируют один и тот же тип реакции с принципиально одинаковым механизмом, но отличаются друг от друга кинетическими параметрами, условиями активации, особенностями связи апофермента и кофермента. Природа появления изоферментов разнообразна, но чаще всего обусловлена различиями в структуре генов, кодирующих эти изоферменты. Следовательно, изоферменты различаются по первичной структуре белковой молекулы и, соответственно, по физико-химическим свойствам. На различиях в физико-химических свойствах основаны методы определения изоферментов. По своей структуре изоферменты в основном являются олигомерными белками. Фермент лактатдегидрогеназа (ЛДГ) катализирует обратимую реакцию окисления лактата (молочной кислоты) до пирувата (пировиноградной кислоты).
Состоит из 4 субъединиц 2 типов: М и Н. Комбинация этих субъединиц лежит в основе формирования 5 изоформ лактатдегидрогеназы. ЛДГ1 и ЛДГ2 наиболее активны в сердечной мышце и почках, ЛДГ4 и ЛДГ5 - в скелетных мышцах и печени. В остальных тканях имеются различные формы этого фермента. Изоформы ЛДГ отличаются электрофоретической подвижностью, что позволяет устанавливать тканевую принадлежность изоформ ЛДГ. 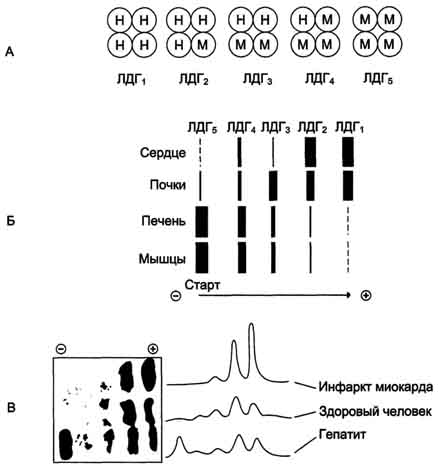
Креатинкиназа (КК) катализирует реакцию образования креатинфосфата: 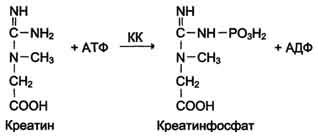
Молекула КК - димер, состоящий из субъединиц двух типов: М и В . Из этих субъединиц образуются 3 изофермента - ВВ, MB, MM. Изофермент ВВ находится преимущественно в головном мозге, ММ - в скелетных мышцах и MB - в сердечной мышце. Изоформы КК имеют разную электрофоретическую подвижность. Активность КК в норме не должна превышать 90 МЕ/л. Определение активности КК в плазме крови имеет диагностическое значение при инфаркте миокарда (происходит повышение уровня МВ-изоформы). Количество изоформы ММ может повышаться при травмах и повреждениях скелетных мышц. Изоформа ВВ не может проникнуть через гематоэнцефалический барьер, поэтому в крови практически не определяется даже при инсультах и диагностического значения не имеет.
27.ФЕРМЕНТАТИВНЫЙ КАТАЛИЗ (биокатализ), ускорение биохим. р-ций при участии белковых макромолекул, называемых ферментами (энзимами). Ф.к.- разновидность катализа.
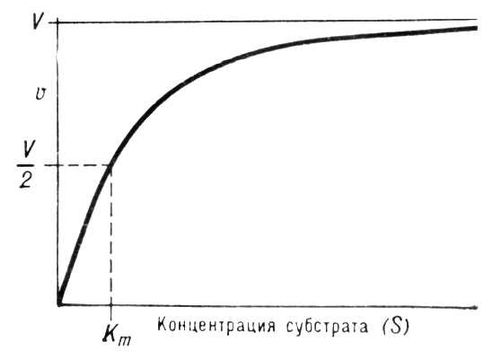
Уравнение Михаэлиса-Ментен: - основное уравнение ферментативной кинетики, описывает зависимость скорости реакции,катализируемой ферментом, от концентрации субстрата и фермента. Простейшая кинетическая схема, для которой справедливо уравнение Михаэлиса:
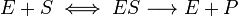
Уравнение имеет вид:
 ,
,
Где: 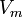 — максимальная скорость реакции, равная
— максимальная скорость реакции, равная 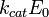 ;
; 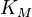 — константа Михаэлиса, равная концентрации субстрата, при которой скорость реакции составляет половину от максимальной;
— константа Михаэлиса, равная концентрации субстрата, при которой скорость реакции составляет половину от максимальной; 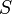 — концентрация субстрата.
— концентрация субстрата.
Константа Михаэлиса: Соотношение констант скорости 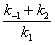
также является константой (Кm).
28. "ингибирование ферментативной активности" - снижение каталитической активности в присутствии определённых веществ - ингибиторов. К ингибиторам следует относить вещества, вызывающие снижение активности фермента. Обратимые ингибиторы связываются с ферментом слабыми нековалентными связями и при определённых условиях легко отделяются от фермента. Обратимые ингибиторы бывают конкурентными и неконкурентными. К конкурентному ингибированию относят обратимое снижение скорости ферментативной реакции, вызванное ингибитором, связывающимся с активным центром фермента и препятствующим образованию фермент-субстратного комплекса. Такой тип ингибирования наблюдают, когда ингибитор - структурный аналог субстрата, в результате возникает конкуренция молекул субстрата и ингибитора за место в активном центре фермента. Неконкурентным называют такое ингибирование ферментативной реакции, при котором ингибитор взаимодействует с ферментом в участке, отличном от активного центра. Неконкурентные ингибиторы не являются структурными аналогами субстрата. Необратимое ингибирование наблюдают в случае образования ковалентных стабильных связей между молекулой ингибитора и фермента. Чаще всего модификации подвергается активный центр фермента, В результате фермент не может выполнять каталитическую функцию. К необратимым ингибиторам относят ионы тяжёлых металлов, например ртути (Hg2+), серебра (Ag+) и мышьяка (As3+). Вещества, блокирующие определённые группы активного центра ферментов - специфические и. Диизопропилфторфосфат (ДФФ). Ацетат йода, п-хлормеркурибензоат легко вступают в реакции с SH-группами остатков цистеина белков. Эти ингибиторы относят к неспецифичным. При бесконкурентном ингибировании ингибитор связывается только с фермент-субстратным комплексом, но не со свободным ферментом.
Величину KI = [E]. [I] / [EI], которая представляет собой константу диссоциации комплекса фермента с ингибитором, называют константой ингибирования.
Четвертичные аммониевые основания ингибируют ацетилхолинэстеразу, катализирующую реакцию гидролиза ацетилхолина на холин и уксусную кислоту .
В качестве ингибиторов ферментов по конкурентному механизму в медицинской практике используют вещества, называемые антиметаболитами. Эти соединения, будучи структурными аналогами природных субстратов, вызывают конкурентное ингибирование ферментов, с одной стороны, и, с другой - могут использоваться этими же ферментами в качестве псевдосубстратов. Сульфаниламидные препараты (аналоги парааминобензойной кислоты), применяемые для лечения инфекционных заболеваний.
Пример лекарственного препарата, действие которого основано на необратимом ингибировании ферментов, - препарат аспирин.
Ингибирования фермента циклооксигеназы, катализирующего реакцию образования простагландинов из арахидоновой кислоты.
29.Регуляция скорости ферментативных реакций осуществляется на 3 независимых уровнях:
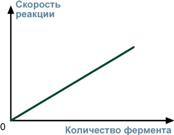
1. изменением количества молекул фермента;
1. Количество молекул фермента в клетке определяется соотношением 2 процессов - синтеза и распада белковой молекулы фермента.
2. Чем больше концентрация исходного субстрата, тем выше скорость метаболического пути. Другой параметр, лимитирующий протекание метаболического пути, - наличие регенерированных коферментов. Важнейшее значение в изменении скорости метаболических путей играет регуляция каталитической активности одного или нескольких ключевых ферментов данного метаболического пути. Это высокоэффективный и быстрый способ регуляции метаболизма. Основные способы регуляции активности ферментов: аллостерическая регуляция; регуляция с помощью белок-белковых взаимодействий; регуляция путём фосфорилирования/дефосфорилирования молекулы фермента; регуляция частичным (ограниченным) протеолизом.
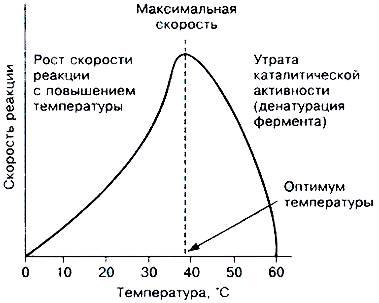
Повышение температуры до определённых пределов оказывает влияние на скорость ферментативной
реакции, подобно влиянию температуры на любую химическую реакцию. С повышением температуры ускоряется движение молекул, что приводит к повышению вероятности взаимодействия реагирующих веществ. Кроме того, температура может повышать энергию реагирующих молекул, что также приводит к ускорению реакции. Однако скорость химической реакции, катализируемая ферментами, имеет свой температурный оптимум, превышение которого сопровождается понижением ферментативной активности
Для большинства ферментов человека оптимальна температура 37-38 °С.
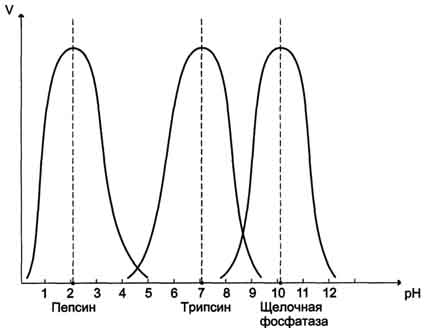
Активность ферментов зависит от рН раствора, в котором протекает ферментативная реакция. Для каждого фермента существует значение рН, при котором наблюдается его максимальная активность. Отклонение от оптимального значения рН приводит к понижению ферментативной активности.
Влияние рН на активность ферментов связано с ионизацией функциональных групп аминокислотных остатков данного белка, обеспечивающих оптимальную конформацию активного центра фермента. При изменении рН от оптимальных значений происходит изменение ионизации функциональных групп молекулы белка. большая часть ферментов организма человека имеет оптимум рН, близкий к нейтральному, совпадающий с физиологическим значением рН
30. Аллостерическими ферментами называют ферменты, активность которых регулируется не только количеством молекул субстрата, но и другими веществами, называемыми эффекторами. Участвующие в аллостерической регуляции эффекторы - клеточные метаболиты часто именно того пути, регуляцию которого они осуществляют.
Аллостерические ферменты играют важную роль в метаболизме, так как они чрезвычайно быстро реагируют на малейшие изменения внутреннего состояния клетки. Имеют большое значение в следующих ситуациях: при анаболических процессах, при катаболических процессах, для координации анаболических и катаболических путей. АТФ и АДФ - аллостерические эффекторы, действующие как антагонисты; для координации параллельно протекающих и взаимосвязанных метаболических путей (например, синтез пуриновых и пиримидиновых нуклеотидов, используемых для синтеза нуклеиновых кислот).
Эффектор, вызывающий снижение (ингибирование) активности фермента, называют отрицательным эффектором, или ингибитором. Эффектор, вызываюший повышение (активацию) активности ферментов, называют положительным эффектором, или активатором. Аллостерическими эффекторами часто служат различные метаболиты.
Особенности строения и функционирования аллостерических ферментов: обычно это олигомерные белки, состоящие из нескольких протомеров или имеющие доменное строение; они имеют аллостерический центр, пространственно удалённый от каталитического активного центра; эффекторы присоединяются к ферменту нековалентно в аллостерических (регуляторных) центрах; аллостерические центры, так же, как и каталитические, могут проявлять различную специфичность по отношению к лигандам: она может быть абсолютной и групповой. протомер, на котором находится аллостерический центр, - регуляторный протомер. аллостерические ферменты обладают свойством кооперативности; аллостерические ферменты катализируют ключевые реакции данного метаболического пути.
конечный продукт может действовать как аллостерический ингибитор фермента, катализирующего чаще всего начальный этап данного метаболического пути:
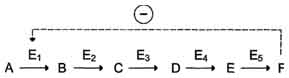
В центральных метаболических путях исходные вещества могут быть активаторами ключевых ферментов метаболического пути.

Кофакторы.
Более 25% всех ферментов для проявления полной каталитической активности нуждается в ионах металлов.
В активном центре фермента
Ионы металла выполняют функцию стабилизаторов молекулы субстрата, активного центра фермента и конформации белковой молекулы фермента, а именно третичной и четвертичной структур.
E-Me-S
2. Роль металлов в стабилизации третичной
Катализе.
Ферментов
Иногда ионы металлов выступают в роли регуляторных молекул. Например, ионы Са2+ служат активаторами фермента протеинкиназы C,катализирующего реакции фосфорилирования белков.Ионы Са2+ также изменяют активность ряда кальций-кальмодулинзависимых ферментов.
Б. Коферметы.
для проявления каталитической активности большинству ферментов необходимо наличие кофермента. Исключение составляют гидролитические ферменты (протеазы, липазы, рибонуклеаза), выполняющие свою функцию в отсутствие кофермента.
Кофермент, локализуясь в каталитическом участке активного центра, принимает непосредственное участие в химической реакции, выступая в качестве акцептора и донора химических группировок, атомов, электронов. Кофермент может быть связан с белковой частью молекулы ковалентными и нековалентными связями. В первом случае он называется простетической группой (например, FAD, FMN, биотин, липоевая кислота). Вместе с тем известны примеры, когда кофермент присоединяется к ферменту нековалентными связями настолько прочно, что не диссоциирует от белковой молекулы, например тиаминдифосфат.
Во втором случае кофермент взаимодействует с ферментом только на время химической реакции и может рассматриваться в качестве второго субстрата. Примеры - NAD+, NADP+.
Апофермент обеспечивает специфичность действия и отвечает за выбор типа химического превращения субстрата. Один и тот же кофермент, взаимодействуя с различными апоферментами, может участвовать в разных химических превращениях субстрата. Например, пиридоксальфосфат в зависимости от того, с каким апоферментом взаимодействует, участвует в реакциях трансаминирования или декарбоксилирования аминокислот.
Химическая природа коферментов, их функции в ферментативных реакциях чрезвычайно разнообразны. Традиционно к коферментам относят производные витаминов, хотя помимо них есть значительный класс небелковых соединений, принимающих участие в проявлении каталитической функции ферментов.
К коферментам относят следующие соединения:
производные витаминов;
гемы, входящие в состав цитохромов, каталазы, пероксидазы, гуанилатциклазы, NO-синтазы и являющиеся простетической группой ферментов;
нуклеотиды - доноры и акцепторы остатка фосфорной кислоты;
убихинон, или кофермент Q, участвующий в переносе электронов и протонов в ЦПЭ;
фосфоаденозилфосфосульфат, участвующий в переносе сульфата;
S-аденозилметионин (SAM) - донор метильной группы;
глутатион, участвующий в окислительно-восстановительных реакциях.
Субстратная специфичность
Под субстратной специфичностью понимают способность каждого фермента взаимодействовать лишь с одним или несколькими определёнными субстратами. Различают:
Стереоспецифичность
При наличии у субстрата нескольких стерео-изомеров фермент проявляет абсолютную специфичность.
к одному из них. В организме человека наблюдают специфичность ферментов к следующим стереоизомерам.
РАЗДЕЛЕНИЕ ИНДИВИДУАЛЬНЫХ БЕЛКОВ
Изучение строения и свойств белков невозможно без их выделения из клетки и очистки от других белков и органических молекул. Стадии:
1. Разрушение клеток изучаемой ткани и получение гомогената.
2. Разделение гомогената на фракции центрифугированием, получение ядерной, митохондриальной, цитозольной или иной фракции, содержащей искомый белок.
| После перевода белков в растворенное состояние, приступают к разделению – фракционированию смеси белков на индивидуальные белки. Для этого применяют разнообразные методы: |
Избирательная тепловая денатурация - кратковременное нагревание раствора белков, при котором можно удалить часть денатурированных белковых примесей
. Высаливание. Различные белки выпадают в осадок при разной концентрации соли в растворе. Постепенно повышая ее концентрацию, можно получить ряд отдельных фракций с преимущественным содержанием выделяемого белка в одной из них. Наиболее часто для фракционирования белков используют сульфат аммония. Белки с наименьшей растворимостью выпадают в осадок при небольшой концентрации солей.
5 Гель-фильтрация — метод молекулярного просеивания молекул через набухшие гранулы сефа-декса (трехмерные полисахаридные цепи декстра-на, имеющие поры). Скорость прохождения белков через колонку, заполненную сефадексом, будет зависеть от их молекулярной массы: чем меньше масса молекул, тем легче они проникают внутрь гранул и дольше там задерживаются, чем больше масса, тем быстрее они элюируются с колонки.
Ультрацентрифугирование — метод, заключающийся в том, что белки в центрифужной пробирке помещают в ротор ультрацентрифуги. При вращении ротора скорость оседания белков пропорциональна их молекулярной массе: более тяжелые белки образуют фракции, расположенные ближе ко дну кюветы, более легкие — к поверхности.
Ионообменная хроматография - метод фракционирования, основанный на связывании ионизированных групп белков с противоположно заряженными группами ионообменных нерастворимых полимеров. Прочность связывания белка со смолой пропорциональна заряду белка. Белки, адсорбированные на ионообменном полимере, можно смыть возрастающими концентрациями NaCl; чем меньше заряд белка, тем меньшая концентрация NaCl потребуется, чтобы смыть белок, прикрепленный к ионогенным группам смолы. Аффинная хроматография — наиболее специфический метод выделения индивидуальных белков. К инертному полимеру ковалентно присоединяется лиганд какого-либо белка. При пропускании раствора белков через колонку с полимером за счет комплементарного связывания белка с лигандом на колонке адсорбируется только специфичный для данного лиганда белок.
Электрофорез белков
Метод основан на том, что при определённом значении рН и ионной силы раствора бел-
ки двигаются в электрическом поле со скоростью, пропорциональной их суммарному заряду. Белки, имеющие суммарный отрицательный заряд, двигаются к аноду (+), а положительно заряженные белки — к катоду (—).
Электрофорез проводят на различных носителях: бумаге, крахмальном геле, полиакрила-мидном геле и др. В отличие от электрофореза на бумаге, где скорость движения белков пропорциональна только их суммарному заряду,в полиакриламидном геле скорость движения белков пропорциональна их молекулярным массам.
Разрешающая способность электрофореза в полиакриламидном геле выше, чем на бумаге. Так, при электрофорезе белков сыворотки крови человека на бумаге обнаруживают только 5 главных фракций: альбумины, а,-глобулины, а2-глобулины, в-глобулины и у-глобулины Электрофорез тех же белков в полиакриламидном геле позволяет получить до 18 различных фракций. Для обнаружения белковых фракций полоски бумаги или столбики геля обрабатывают красителем (чаще всего бромфеноловым синим или амидовым чёрным). Окрашенный комплекс белков с красителем выявляет расположение различных фракций на носителе.
3) Хроматография . Принцип основан на способности веществ специфически адсорбироваться на адсорбенте, заключенном в колонке.
Последнее изменение этой страницы: 2019-04-01; Просмотров: 99; Нарушение авторского права страницы