
|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |

|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |
Важной характеристикой раствора является концентрация. Этой величиной определяются многие свойства растворов.Стр 1 из 7Следующая ⇒
СОДЕРЖАНИЕ:
Лечебное дело » Педиатрия » |
« Химия » для специальности Стоматология » | |||||
| 1. | Введение в лабораторный практикум. Величины, характеризующие количественный состав растворов. Приготовление раствора с заданной концентрацией. | 1. | Введение в лабораторный практикум. Величины, характеризующие количественный состав растворов. Приготовление раствора с заданной концентрацией. | |||
| 2. | Основы химического анализа. Качественный и количественный анализ. Основы титриметрического анализа. Метод кислотно-основного титрования. Алкалиметрия. | 2. | Основы химического анализа. Качественный и количественный анализ. Основы титриметрического анализа. Метод кислотно-основного титрования. Алкалиметрия. | |||
| 3. | Химическая термодинамика и кинетика биохимических реакций. Химическое равновесие. | 3. | Химическая термодинамика и кинетика биохимических реакций. Химическое равновесие. | |||
| 4.
| Растворы. Законы растворимости. Растворы электролитов. Теории кислот и оснований. Коллигативные свойства растворов. Диффузия. Осмос. | 4. | Окислительно-восстановительные взаимодействия. Основы электрохимии. | |||
| 5. | Растворы. Законы растворимости. Растворы электролитов. Теории кислот и оснований. Коллигативные свойства растворов. Диффузия. Осмос. | |||||
| 5. | Кислотно-основное равновесие в организме. Водородный показатель биологических жидкостей. Буферные системы. Буферная емкость. | 6. | Кислотно-основное равновесие в организме. Водородный показатель биологических жидкостей. Буферные системы. Буферная емкость. | |||
| 6. | Коллоидные растворы: получение, очистка и свойства. Коагуляция коллоидных растворов. Коллоидная защита. | 7. | Коллоидные растворы: получение, очистка и свойства. Коагуляция коллоидных растворов. Коллоидная защита. | |||
| 7. | Биогенные s–, p– и d– элементы: биологическая роль, применение в медицине. Комплексообразование в биологических системах. Метод комплексонометрии. | 8. | Биогенные s–, p– и d– элементы: биологическая роль, применение в медицине. Комплексообразование в биологических системах. Метод комплексонометрии. | |||
| 8. | Классификация, номенклатура, изомерия биоорганических соединений. Реакционная способность углеводородов. | 9. | Классификация, номенклатура, изомерия биоорганических соединений. Реакционная способность углеводородов. | |||
| 9. | Строение и реакционная способность гидрокси-, оксосоединений и карбоновых кислот. | 10. | Строение и реакционная способность гидрокси-, оксосоединений и карбоновых кислот. | |||
| 10. | Углеводы. Строение и химические свойства моно-, ди- и полисахаридов. | 11. | Углеводы. Строение и химические свойства моно-, ди- и полисахаридов. | |||
| 11. | Строение, свойства и биологическая роль простых и сложных липидов. Неомыляемые липиды. | 12. | Строение, свойства и биологическая роль простых и сложных липидов. Неомыляемые липиды. | |||
| 12. | Классификация, строение и значение биологически важных гетероциклических соединений. Общая характеристика витаминов. Строение и биологическая роль нуклеозидов, нуклеотидов и нуклеиновых кислот. | 13. | Классификация, строение и значение биологически важных гетероциклических соединений. Общая характеристика витаминов. Строение и биологическая роль нуклеозидов, нуклеотидов и нуклеиновых кислот. | |||
| 13. | Строение, свойства и биологическая роль α -аминокислот. Структурная организация и физико-химические свойства белков. Высокомолекулярные соединения. | 14. | Строение, свойства и биологическая роль α -аминокислот. Структурная организация и физико-химические свойства белков. Высокомолекулярные соединения. | |||
Занятие № 1. Тема: „Введение в лабораторный практикум. Определение исходного уровня знаний. Величины, характеризующие количественный состав растворов. Приготовление раствора с заданной концентрацией ”.
Химия входит в число наук, составляющих фундамент медицины. Химические методы исследования постоянно используются в диагностике заболеваний и профилактических обследованиях. Химический синтез является основой изготовления лекарств. Поэтому, для дальнейшего изучения материала, необходимо знать теоретические основы химии. Наряду с теоретической базой, в медицине применяются экспериментальные методы, помогающие освоению материала.
В настоящее время практикуму, как специфической и важнейшей форме учебной работы, уделяется особое внимание, так как усвоение изучаемого материала, может происходить только в ходе активной деятельности самого учащегося. Эта деятельность реализуется на практике и лабораторных занятиях в процессе решения различных ситуационных задач. Без знания техники лабораторных работ нельзя быть уверенным в точности поставленного эксперимента.
Многие химические процессы протекают лишь при условии, что участвующие в них вещества находятся в растворенном состоянии. Растворы имеют большое значение, как в промышленности, так и в медицине. Важнейшие биологические жидкости – кровь, лимфа, моча, слюна, пот являются растворами солей, белков, углеводов, липидов в воде. Усвоение пищи связано с переходом питательных веществ в растворенное состояние. Биохимические реакции в живых организмах протекают в растворах. В жидких средах организма поддерживается постоянство кислотности, концентрации солей и органических веществ (концентрационный гомеостаз). Биологические жидкости участвуют в транспорте питательных веществ (жиров, аминокислот, кислорода), лекарственных препаратов к органам и тканям, а также в выведении из организма метаболитов (мочевины, билирубина, углекислого газа и т.д.). Приведенные примеры подчеркивают важность изучения свойств растворов для медиков.
Химическую посуду изготавливают из различных материалов, её классифицируют на стеклянную, кварцевую, фарфоровую, металлическую, пластиковую, высокоогнеупорную.
Посуда общего назначения

|
| Рис. 1. Пробирки |

|
| Рис. 2. Химический стакан |
Пробирки представляют собой узкие цилиндрической формы сосуды с закругленным дном; они бывают различной величины и диаметра и из различного стекла. Обычные лабораторные пробирки изготовляют из легкоплавкого стекла, но для особых работ, когда требуется нагревание до высоких температур, пробирки изготовляют из тугоплавкого стекла или кварца. Кроме обычных, простых пробирок, применяют также градуированные и центрифужные конические пробирки (рис. 1).
Для хранения пробирок, находящихся в работе, служат специальные деревянные, пластмассовые или металлические штативы.

|
| Рис. 3. Конические колбы |
|
| Рис. 4. Воронки |
Химические стаканы (рис. 2) имеют различную вместимость от 50 до 1000 см3. Стаканы изготавливают из термо- и химически стойкого стекла. Стаканы из термостойкого стекла маркируют специальным знаком – матовым прямоугольником или кругом.
|
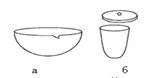
| Рис. 5. Фарфоровая посуда: а - чашка для выпаривания; б - тигель. |
Конические колбы (рис. 3) широко применяются при титровании. Изготавливают колбы из тонкостенного или термостойкого стекла. Они бывают различной вместимости (25 – 2000 см3).
Капельные или капиллярные пипетки применяют для взятия проб, отделения раствора от осадка, а также прибавления малых объемов реактивов. Использованные пипетки опускают в стакан с водой, чтобы не дать реактиву высохнуть в капилляре.
Воронки (рис. 4) служат для переливания жидкостей, фильтрования, приготовления растворов и заполнения бюреток.
В фарфоровых чашках и тиглях (рис. 5) вместимостью 5 – 10 см3нагревают или выпаривают растворы, прокаливают сухие остатки.
|
| Рис. 6. Капельницы |
Стеклянные палочки с оплавленными концами используют для перемешивания растворов.
Часовое или предметное стекло применяют для обнаружения отдельных ионов.
Капельницы (рис. 6) предназначены для работы с индикаторами.
Мерная посуда
|
| 
| б) | |
|
| в) | ||
| а) | |||
| Рис. 7. Мерная посуда для приблизительных измерений: а - цилиндры, б - стакан, в- мензурка | |||
Объем жидкости можно измерить с различной степенью точности, которая определяется задачей анализа. В зависимости от относительной погрешности, допускаемой при измерении объема, мерная посуда делится на две группы – для приблизительного и точного измерения объема.
К посуде для приблизительного измерения объема относятся мерные цилиндры, стаканы и мензурки. Относительная погрешность при измерении объема такой посудой составляет 1 % и более.
Мерные цилиндры (рис. 7 а) – стеклянные и пластиковые толстостенные сосуды с нанесенными на внешней стенке делениями, указывающими объем в см3 (5 – 2000 см3). Чтобы отмерить нужный объем жидкости, ее наливают в мерный цилиндр до тех пор, пока нижний край мениска не достигнет уровня нужного деления. Иногда встречаются цилиндры, снабженные притертыми пробками. Обычно их применяют только при специальных работах.
| | |
| а) | б) |
| Рис. 9. Бюретки (а) и пипетки (б) | |
Мерные стаканы (рис. 7 б) дают самую большую ошибку в измерении объема из-за редких делений, указывающих объем.
Мензурки (рис. 7 в) – сосуды конической формы, на стенке которых нанесена шкала. Вместимость мензурок 50 – 1000 см3.
К посуде для точного измерения объемов относят мерные колбы, мерные пипетки и бюретки. Относительная ошибка при измерении объема составляет менее 1 %. Точный объем измеряют и записывают в виде числа, содержащего два знака после запятой.

|
| Рис. 8. Мерные колбы |
Мерные колбы (рис. 8) предназначены для приготовления растворов точной концентрации, имеют одну метку на длинном узком горлышке. Мерные колбы бывают различной емкости – от 50 мл до 2 л. Они бывают с притертой пробкой и без нее. Мерные колбы служат для приготовления рабочих растворов, для разбавления до определенного объема или же для растворения какого-либо вещества в определенном объеме соответствующего растворителя.
Бюретки и пипетки (рис. 9)– это мерная посуда, используемая при проведении химического анализа. Бюретки используются для титрования.
Работа с рефрактометром.
Одну или две капли исследуемого раствора соли, помещают между призмами рефрактометра. В окно верхней призмы направляют источник света. Через нижнюю призму свет попадает на шкалу прибора, частично её освещая и создавая чёткую границу света снизу и тени сверху. Если граница светотени недостаточно чёткая, имеет радужные полоски, то вращением компенсатора добиваются их исчезновения. Поворотом рычага, на котором закреплён окуляр, добиваются совмещения трёх чёрточек с границей светотени и считывают по левой шкале коэффициент рефракции, по правой - процентное содержание вещества. Контроль работы производится по дистиллированной воде, коэффициент рефракции которой равен 1, 333. Зная коэффициент рефракции раствора, по таблице находят его процентное содержание. Необходимо помнить, что таблица составляется только для определенного вещества.
Вопросы для обсуждения.
| 1. | Предмет и задачи аналитической химии. Качественный и количественный анализ. |
| 2. | Основные понятия качественного анализа: а) аналитические реакции; б) реагент (реактив); в) дробный и систематический метод анализа; г) макро-, микро-, полумикроанализ; д) способы выполнения аналитических реакций. |
| 3. | Методы количественного анализа. Классификация методов количественного анализа. |
| 4. | Закон эквивалентов. Основные понятия объемного (титриметрического) анализа: а) рабочий раствор (титрант); б) исходные вещества, требования к ним; в) анализируемый раствор; г) титрование; д) точка эквивалентности, точка нейтрализации; е) конец титрования. |
| 5. | Индикаторы, выбор индикатора. Понятие о кривых титрования, их анализе. |
| 6. | Метод нейтрализации. Основные реакции метода. Алкалиметрия и ацидиметрия. Техника выполнения метода алкалиметрии. |
| 7. | Значение методов качественного и количественного анализа в медицине и других областях практической деятельности (санитарно-гигиенической практике). |
4. Выполнить тестовые задания (письменно):
| 1. | Какие методы используются при проведении качественного анализа: | |
| А | окрашивание пламени | |
| В | метод парообразования | |
| С | спектрофотометрия | |
| D | метод нейтрализации | |
| 2. | Какой из представленных реагентов можно использовать для качественного определения ионов Cu2+ ? | |
| А | NH4OH | |
| В | NaCl | |
| С | KNO3 | |
| D | FeCl3 | |
| 3. | Аналитические реакции между электролитами записывают: | |
| А | только в ионном виде | |
| В | в ионном виде только слабые электролиты | |
| С | слабые электролиты и малодиссоциированные вещества в молекулярном виде. | |
| D | только в молекулярном виде | |
| 4. | Какая реакция является качественной на ионы SO42-? | |
| А | с ионами Ва2+ | |
| В | с ионами Fe2+ | |
| С | с ионами Na+ | |
| D | с ионами Ca2+ | |
| 5. | Ионы калия окрашивают бесцветное пламя горелки в: | |
| А | красный цвет | |
| В | синий цвет | |
| С | фиолетовый цвет | |
| D | зелёный цвет | |
| 6. | Ионы Рb2+ в растворе можно определить в присутствии ионов: | |
| А | SO42- | |
| В | Clˉ | |
| С | I- | |
| D | NO3- | |
| 7. | Осадок какого цвета выпадает в реакции Ba2+ + SO42- ® BaSO4¯ | |
| А | черный | |
| В | желтый | |
| С | белый кристаллический | |
| D | белый творожистый | |
| 8. | Как называется анион SO32-? | |
| А | сульфат – ион | |
| В | роданид – ион | |
| С | тиосульфат – ион | |
| D | сульфит – ион | |
| 9. | Бромид и иодид серебра окрашены соответственно в: | |
| А | бледно-жёлтый и жёлтый цвет | |
| В | жёлтый и черный цвет | |
| С | бледно-жёлтый и белый цвет | |
| D | голубой и белый цвет | |
| 10. | Соли кальция окрашивают пламя горелки в: | |
| А | насыщенный желтый цвет | |
| В | кирпично – красный цвет | |
| С | желтовато – зеленый цвет | |
| D | светло – фиолетовый цвет | |
| 11. | На какой анион третьей группы реакция с солями железа (III) является качественной: | |
| А | NO3- | |
| В | Cl- | |
| С | SCN- | |
| D | SO32- | |
| 12. | Какой закон используют для расчётов в объёмном анализе? | |
| А | Закон Авогадро | |
| В | Закон эквивалентов | |
| С | Закон постоянства состава | |
| D | Закон перехода количества в качество | |
| 13. | Чему равны эквивалентные массы H2SO4 и NaOH? | |
| А | 98 и 40 | |
| В | 49 и 20 | |
| С | 49 и 40 | |
| D | 98 и 49 | |
| 14. | Как изменится окраска индикатора фенолфталеина в щелочной среде? | |
| А | С бесцветной на желтую | |
| В | С бесцветной на малиновую | |
| С | С бесцветной на красную | |
| D | С бесцветной на фиолетовую | |
| 15. | Какой раствор является стандартным? | |
| А | Раствор с точно известной концентрацией | |
| В | Раствор, концентрацию активного вещества которого надо установить | |
| С | Раствор, содержащий определенную массовую долю растворённого вещества | |
| D | Раствор, не содержащий активного вещества | |
| 16. | Каким методом определяют концентрацию раствора соды Na2CO3: | |
| А | алкалиметрией | |
| В | ацидометрией | |
| С | методом осаждения | |
| D | оксидиметрией | |
| 17. | При титровании сильной кислоты сильным основанием реакция среды изменяется: | |
| А | кислая → нейтральная → щелочная | |
| В | кислая → щелочная | |
| С | кислая → щелочная → нейтральная | |
| D | кислая → кислая | |
| 18. | Для определения кислотности желудочного сока в качестве титранта следует применить: | |
| А | I2 | |
| В | KI | |
| С | KOH | |
| D | НСl | |
| 19. | Как изменяется характер среды раствора (рН) в методе ацидиметрии: | |
| А | нейтральная → кислая → щелочная | |
| В | нейтральная → щелочная → кислая | |
| С | кислая → нейтральная → щелочная | |
| D | щелочная → нейтральная → кислая | |
| 20. | Какие вещества используются в методе нейтрализации в качестве исходных? | |
| А | NaOH, HCl | |
| В | Na2CO3, HCl | |
| С | NH3, H2O | |
| D | BaCl2, H2SO4 |
5. Ситуационные задачи:
| № | Текст задания: |
| 1. | Написать уравнения качественных реакций на ионы меди и хлора в растворе CuCl2 и определить признаки их прохождения. |
| 2. | Для титрования 10 мл анализируемого раствора гидроксида калия методом ацидиметрии израсходовано 16 мл раствора серной кислоты, с молярной концентрацией эквивалента 0, 05 н. Рассчитать молярную концентрацию эквивалента гидроксида калия. |
| 3. | На титрование 25 мл раствора FeSO4 в кислой среде израсходовано 12, 5 мл раствора КМnО4 с С f (КМnО4) = 0, 01 моль/л. Рассчитать массу FeSO4 в растворе. |
| № | Эталоны ответов: |
| 1. | Качественная реакция на ион Cu2+: CuCl2 + 2NaOH → Cu(OH)2¯ + 2NaCl (молекулярное уравнение) голубой Cu2+ + 2Cl- + 2Na+ + 2OH- → Cu(OH)2¯ + 2Na+ + 2Cl- ( полное ионное уравнение) Cu2+ + 2OH- → Cu(OH)2¯ (сокращенное ионное уравнение) Качественная реакция на ион Cl-: CuCl2 + 2AgNO3 → 2AgCl¯ + Cu(NO3)2 (молекулярное уравнение) белый Cu2+ + 2Cl- + 2Ag+ + 2NO3- → 2AgCl¯ + Cu2+ + 2NO3- (полное ионное уравнение) Cl- + Ag+ → AgCl¯ сокращенное ионное уравнение) |
| 2. | 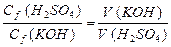 Þ Þ 
|
| 3. | Находим Сf раствора FeSO4 Þ 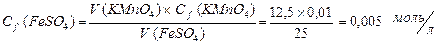 Массу FeSO4 находим по формуле:
Массу FeSO4 находим по формуле: 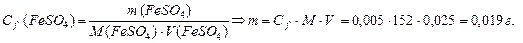
|
6. Задачи для самостоятельного решения (выполнить письменно):
1. Написать уравнения качественных реакций на ион аммония и карбонат-ион в растворе (NH4)2СO3 и определить признаки их прохождения.
2. На титрование 30 мл раствора NaOН затрачено 20 мл раствора HCl с Сf(HCl) = 0, 05 моль/л. Рассчитать массу NaОН в растворе.
3. На титрование 20 мл анализируемого раствора уксусной кислоты методом алкалиметрии израсходовано 25 мл раствора гидроксида натрия, с молярной концентрацией эквивалента 0, 05 моль/л. Рассчитать молярную концентрацию эквивалента уксусной кислоты в растворе.
7. Вспомогательные материалы по самоподготовке:
Аналитическая химия – наука о методах и приемах определения качественного и количественного химического состава веществ или их смесей.
АНАЛИТИЧЕСКАЯ ХИМИЯ
| Качественный анализ | Количественный анализ |
| определение (открытие) химических элементов, ионов, атомов, атомных групп, молекул в анализируемом веществе, смеси веществ. | определение количественного состава вещества т.е. установление количества химических элементов, ионов, атомов, атомных групп, молекул в анализируемом веществе, смеси веществ. |
Качественный анализ
| Систематический (разделение смеси ионов на аналитические группы катионов и анионов) | Дробный (открытие каждого иона без предварительного разделения на ионы) |
Инструментальные
Химические
В химических методах проводят химические реакции и измеряют:
- массу полученного продукта
(гравиметрические методы)
или объем реагента, пошедший на взаимодействие с анализируемым веществом
(титриметрические методы).
Использование физических и физико-химических методов часто требует применения дорогостоящей аппаратуры. Поэтому в качественном анализе эти методы анализа используют не так часто, как химические.
Использование разнообразных типов химических реакций (см. ниже), позволяет считать титриметрический анализ более универсальным методом, чем гравиметрический. Он дает возможность анализировать значительно большее число объектов, кроме того, титриметрический анализ занимает значительно меньше времени чем гравиметрический анализ.
Термин «титриметрический» произошел от слова «титр», что означает содержание вещества (в граммах) в 1 мл раствора.
Титриметрический анализ основан на точном измерении количества реактива, затраченного на реакцию с определенным компонентом. Раствор, содержащий реагент, концентрация которого известна с большой точностью, называется рабочим или стандартным раствором (раствором титранта), или титрованным раствором.
Второй раствор, вступающий во взаимодействие с рабочим раствором, содержит вещество неизвестной концентрации и называется анализируемым раствором.
Актуальность темы:
Все химические реакции сопровождаются выделением или поглощением теплоты, что объясняется разрывом одних химических связей в молекулах исходных веществ и образование других химических связей в молекулах продуктов реакций. Частью термодинамики является термохимия, которая изучает тепловые эффекты реакции.
Термохимические расчеты широко используют в медицине для оценки калорийности пищевых продуктов, составления диет для больных. Знание раздела термодинамики позволяет определить возможность самопроизвольного протекания реакций, направление реакций, биоэнергетику физиологических процессов в живых организмах.
Учение о скоростях протекания химических реакций (т.е. химическая кинетика) представляет для будущих врачей большой интерес, т.к. все биохимические процессы в живых клетках осуществляются с определенной скоростью и зависят от многих факторов, таких, например, как концентрация субстрата, температура.
2. Цель обучения:
Знать основные понятия и законы термодинамики, кинетики, определять тепловые эффекты реакций, определять скорость и порядок реакции, проводить термохимические расчеты по определению изменения энтальпии, энтропии, энергии Гиббса, определять возможность протекания реакций.
3. Вопросы для обсуждения:
1. Предмет и задачи термодинамики. Химическая термодинамика.Термодинамические системы, их классификация. Параметры и функции термодинамических систем.
2. Первое начало термодинамики. Внутренняя энергия. Энтальпия. Закон Гесса, следствия из него. Термохимия. Калориметрия.
3. Второе начало термодинамики. Энтропия. Направление самопроизвольного протекания реакции. Свободная энергия Гиббса, Гельмгольца.
4. Особенности живых организмов как термодинамических систем.
5. Химическая кинетика. Механизмы и скорость химических реакций. Гомогенные и гетерогенные реакции. Факторы, влияющие на скорость протекания реакции (природа реагирующих веществ, площадь поверхности, концентрация, температура, давление, энтропия активации, энергия активации, катализаторы).
6. Закон действия масс. Порядок реакции.
7. Зависимость скорости реакции от температуры. Уравнение Вант-Гоффа.
8. Катализ и катализаторы. Гомогенный и гетерогенный катализ. Понятие об обратимых и необратимых процессах.
9. Понятие о химическом равновесии. Константа химического равновесия. Принцип Ле-Шателье. Факторы смещения химического равновесия (температура, концентрация, давление).
10. Связь между изменением свободной энергией Гиббса и константой химического равновесия.
11. Проявление принципа Ле-Шателье в живых организмах (сопряженные реакции).
4. Ситуационные задачи:
| № | Текст задания: |
| 1. | Рассчитать тепловой эффект реакции (Δ Нº р-ции) при н.у: 4NН3(г)+5О2(г)→ 4NO(г)+6Н2О(ж), пользуясь справочными значениями стандартных теплот (энтальпий) образования веществ. |
| 2. | Рассчитать стандартную энтальпию реакции 2SО2(г)+О2(г)→ 2SО3(г). Указать, будет ли данная реакция экзо- или эндотермической. |
| 3. | Рассчитать изменение энтропии реакции при стандартных условиях: СН4(г)+2О2(г)→ СО2(г)+2Н2О(ж), использовав табличные данные. |
| 4. | Возможно ли самопроизвольное протекание реакции (подтвердить расчетами): С6Н12О6 → 2 СзН6Оз Глюкоза Молочная к-та |
| 5. | Оксид азота (II) взаимодействует с хлором согласно уравнению: 2NO(г) + Cl2(г) ® 2NOCl(г). Константа скорости для этой реакции соответствует 2, 2∙ 104 л/(моль∙ с). Рассчитать скорость образования NOCl, если концентрация NO = 1, 00∙ 10-6 моль/л, концентрация Cl2 = 0, 50∙ 10-6 моль/л. Реакция имеет второй порядок по NO и первый порядок по Cl2. |
| 6. | При повышении температуры на 300 К скорость реакции увеличилась в 64 раза. Вычислить температурный коэффициент (γ ). |
| 7. | В каком направлении сместится химическое равновесие в системе: CO2(г) + С(т) ↔ 2CO(г), Δ H = +171 кДж/моль. а)при повышении температуры? б)при повышении концентрации СО2? |
| 8. | Какой из процессов должен проводиться при высоком давлении? А)N2(г) + 3H2(г) ↔ 2NH3(г), В)CO2(г) + С(т) ↔ 2CO(г), С)Fe3O4(т) + 4H2(г) ↔ 3Fe(т) + 4H2O(г). |
| № | Эталоны ответов: |
| 1. | В соответствии с первым следствием из закона Гесса Δ Нº р-ции = ∑ Δ Нº обр(прод. р-ции) - ∑ Δ Нº обр.(исх. в-в); Δ Нº р-ции = [4 ´ Δ Нº обр(NO)г + 6 ´ Δ Нº обр.(Н2О)ж] – [4 ´ Δ Нº обр.(NHз)г + 5 ´ Δ Нº обр.(О2)г]. Δ Нº р-ции = [4 ´ 91 + 6 ´ (-286) ] - [4 ´ (-46) + 5 х 0] = -1168 кДж, процесс экзотермический. |
| 2. | 2SО2(г) + О2(г) = 2SО3(г); 2 1 2 моль Δ Нº = ∑ Δ Нобрº (прод.) - ∑ Δ Нобрº (реаг.) = [2 (-396)] - [2 (-297) + 1(0)] = -198 кДж. Стандартная энтальпия реакции равна -198 кДж. Реакция экзотермическая. |
| 3. | Δ Sº = [2Sº (Н2О(ж)) + Sº (СО2 (г))] – [Sº (СН4(г)) + 2Sº (О2(г))] Δ Sº = [2´ 70 + 213, 7] – [186, 3 + 2´ 205, 0] = -242, 4 Дж´ К-1. |
| 4. | Необходимо рассчитать величину свободной энергии Гиббса, т.к. она является критерием самопроизвольно протекающего процесса. По таблице найти значение энергии Гиббса глюкозы и молочной кислоты. Δ Gº (реакции) = ∑ Δ Gобрº (продуктов реакции) - ∑ Δ Gобрº (исходных веществ) Δ Gº (реакции) =[2´ (-539)] - [-917]= -161 кДж. Реакция может протекать самопроизвольно в стандартных условиях, т.к.Δ G < 0. |
| 5. | Кинетическое выражение скорости для реакции 2NO (г) + Cl2 (г) ® 2NOCl (г)
=  . .
|
| 6. | Используя формулу 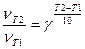 , где υ T 2 – скорость реакции при Т2, υ T 1 – скорость реакции при Т1, γ – температурный коэффициент (предел от 2-4), рассчитать, что , где υ T 2 – скорость реакции при Т2, υ T 1 – скорость реакции при Т1, γ – температурный коэффициент (предел от 2-4), рассчитать, что 
|
| 7. | а) Тепловой эффект реакции, Δ Hр > 0, процесс эндотермический. По принципу Ле-Шателье, при повышении температуры, равновесие в системе смещается в сторону эндотермической реакции, следовательно, при повышении температуры в системе CO2(г) + С(т) ↔ 2CO(г), равновесие сместится в сторону выхода СО (продукт реакции). Б) По принципу Ле-Шателье, при увеличении концентрации одного из реагентов, равновесие в системе смещается в сторону расхода этого реагента, следовательно, равновесие сместится в сторону продуктов реакции (выход угарного газа). |
| 8. | По принципу Ле-Шателье, при повышении давления, равновесие в системе смещается в сторону меньшего объема газов, следовательно, в реакции А при повышении давления равновесие сместится в сторону образования аммиака (объем газа = 2), в реакции Б – в сторону образования СО2 (исходные вещества), в реакции В равновесие системы не сместится (равные объемы газовой фазы). |
5. Выполнить тестовые задания (письменно):
Последнее изменение этой страницы: 2019-10-03; Просмотров: 155; Нарушение авторского права страницы