
|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |

|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |
Г.Я. Двуреченская, Т.В. Перехвальская, Н.Б. ПиковскаяСтр 1 из 21Следующая ⇒
Г.Я. Двуреченская, Т.В. Перехвальская, Н.Б. Пиковская
Основы физиологии человека Под общей ред. В.Ю. Куликова
Новосибирск, 2011 Рецензенты: Двуреченская, Г.Я. Основы физиологии человека: учеб. пособие / Г.Я. Двуреченская, Т.В. Перехвальская, Н.Б. Пиковская. – Новосибирск: Сибмедиздат НГМУ, 2011. – … с.
Аннотация: Учебно-методическое пособие составлено в соответствии с программой изучения дисциплины «Нормальная физиология» и лекционным курсом. Предназначено для самостоятельной работы студентов заочной и вечерней формы обучения, подготовки к практическим занятиям по нормальной физиологии в качестве дополнения к учебнику.
© Двуреченская Г.Я., Перехвальская Т.В., Пиковская Н.Б., 2011 © НГМУ, 2011
Предисловие Вам предлагается методическое пособие для самостоятельной работы во время изучения курса нормальной физиологии, в котором в изложены основные теоретические положения дисциплины. Пособие построено в соответствии с планом изучения нормальной физиологии на кафедре. В разделе «Физиология крови» даны общие представления о внутренней среде организма, структура крови, физиологическое значение основных компонентов плазмы и форменных элементов, общие представления о физиологии иммунной системы. В разделе “ОБЩИЕ СВОЙСТВА ВОЗБУДИМЫХ ТКАНЕЙ” вы изучите общие закономерности функционирования, свойственные всем системам организма. Изучите принципы регуляции и саморегуляции функций, узнаете, что структурной основой нервной регуляции является рефлекторная дуга. Познакомитесь с процессом возбуждения - универсальным свойством всех живых тканей, - “оживляющим” все функции организма. Узнаете, каким образом процесс возбуждения распространяется по нервным волокнам и нервным центрам, достигает рабочего (эффекторного) органа (в качестве примера эффектора будет рассмотрена скелетная мышца), передается структурам этого органа и влияет на их функцию. И, наконец, познакомитесь с одним из механизмов, с помощью которого организм модулирует возбуждение, приводя его в соответствие с конкретной ситуацией – торможением. В разделе «КРОВООБРАЩЕНИЕ» дана общая характеристика системы кровообращения, физиологическая роль сердца и различных сосудов, организация сердечного цикла, принципы саморегуляции деятельности сердца и сосудистого тонуса. В разделе» Физиология дыхания» представлен общий план строения дыхательной системы, этапы процесса дыхания, основные принципы транспорта газов и закономерности регуляции дыхания в соответствии с газовым составом внутренней среды. В разделе «Физиология пищеварения» наряду с общим планом строения системы представлены этапы процесса пищеварения с основными ферментами соответственно отделам, принципы нервной и гуморальной регуляции деятельности пищеварительной системы, физиологические основы рационального питания. Разделы частной физиологии завершаются изучение физиологии почек и водно солевого обмена, основное внимание в котором уделено структуре и функции нефрона и его роли в мочеобразовании. Изучение курса завершается двум разделами интегративной физиологии: физиология эндокринной системы и физиология высшей нервной деятельности, в которых даны представления о системной гормональной регуляции функций организма, принципы регуляции секреции гормонов и их основные эффекты. Изменение поведения – это та высшая форма регуляции, которая, дополняя и видоизменяя деятельность всех регуляторных систем организма, наиболее полно обеспечивает приспособление организма человека и животных к внешним условиям. Введение Оглавление Глава 1. Физиология крови………………………………………………………………….. 1.1. Внутренняя среда организма……………………………………………………………… 1.2. Основные функции крови. Состав плазмы крови и ее свойства……………………….. 1.3. Группы крови…………………………………………………………………………….. 1.4. Форменные элементы крови……………………………………………………………… 1.5. Система гемостаза…………………………………………………………………………. Глава 2. Общие свойства возбудимых тканей………………………………………………
2.1. Механизмы регуляции…………………………………………………………………….. 2.2. Физиологические свойства и особенности функционирования тканей………………. 2.3. Синапс………………………………………………………………………………………. 2.4. Скелетные мышцы………………………………………………………………………… 2.5. Нервная система…………………………………………………………………………… 2.6. Нервная система человека…………………………………………………………………. Глава 3. Кровообращение…………………………………………………………………… 3.1. Строение кровеносной системы человека………………………………………………….. 3.2. Сердечный цикл………………………………………………………………………………. 3.3. Миокард………………………………………………………………………………………. 3.4.Электрокардиография………………………………………………………………………3.5. Законы сердечной деятельности……………………………………………………………. 3.6. Регуляция работы сердца (минутного объема крови)……………………………………. 3.7. Сосудистая система……………………………………………………………………
Глава 4. Физиология дыхания………………………………………………………………. 4.1. Внешнее дыхание (легочная вентиляция)……………………………………………… 4.2. Газообмен в легких и тканях……………………………………………………………….. 4.3. Транспорт газов кровью………………………………………………………………….. 4.4. Регуляция дыхания…………………………………………………………………………
Глава 5. Пищеварение………………………………………………………………………….. 5.1. Общая характеристика пищеварительной системы……………………………………….. 5.2. Пищеварение в полости рта………………………………………………………………… 5.3. Пищеварение в желудке……………………………………………………………………… 5.4. Пищеварение в тонком и толстом кишечнике……………………………………………… 5.5. Питание…………………………………………………………………………………………
Глава 6. Почки и вводно-солевой обмен……………………………………………………. 6.1. Физиология мочеобразования……………………………………………………………. 6.2. Регуляция вводно-солевого обмена……………………………………………………….
Глава 7. Эндокринная система…………………………………………………………………. 7.1. Свойства гормонов, механизм их действия………………………………………………. 7.2. Характеристика гормонов…………………………………………………………………. 7.3.Менструальный цикл……………………………………………………………………………………………………… Глава 8. Высшая нервная деятельность……………………………………………………………. 8.1. Высшие функции коры головного мозга………………………………………………………. 8.2. Память…………………………………………………………………………………………… 8.3. Эмоции……………………………………………………………………………………………… 8.4. Типы высшей нервной деятельности……………………………………………………………. 8.5. Особенности высшей нервной деятельности человека………………………………………… 8.6. Сон…………………………………………………………………………………………
Глава 9. Анализаторы………………………………………………………………………. 9.1. Зрительная сенсорная система…………………………………………………………….. 9.2. Слуховая сенсорная система………………………………… 9.3. Болевая сенсорная система………………………………………..
Глава 1. Физиология крови Внутренняя среда организма Живые организмы находятся в постоянном взаимодействии с внешней средой, получая из нее кислород и питательные вещества и удаляя продукты жизнедеятельности. В процессе эволюции тела клетки живых организмов потеряли связь с внешней средой и стали контактировать только с внеклеточной жидкостью, из которой они получают кислород и питательные вещества и отдают в нее отработанные продукты. Поскольку все клетки живут исключительно в одной и той же среде – во внеклеточной жидкости – ее называют внутренней средой организма. Термин «внутренняя среда организма» ввел французский физиолог Клод Бернар. Внутренняя среда включает такие жидкости, как кровь, лимфа, тканевая, спинномозговая жидкость. Для нормальной жизнедеятельности организма необходимое условие – сохранение постоянства состава и физико-химических свойств внутренней среды организма — гомеостаз (этот термин ввел в 1929 г. Уолтер Кеннон). Абсолютного гомеостаза нет, так как постоянно потребляются питательные вещества и выделяются метаболиты, действуют внешние и внутренние раздражители, под влиянием которых всегда существует тенденция к смещению показателей. Следовательно, это постоянство относительно. Характеристика гомеостаза — биологические константы внутренней среды — это количественные показатели, постоянство которых поддерживается с помощью механизмов нервной и гуморальной регуляции. Биологические константы подразделяются на жесткие и пластичные. При малейшем изменении жестких констант возникают тяжелые нарушения жизнедеятельности. Это рН крови, величина осмотического давления, концентрация ионов Nа, К в плазме крови. Пластичные же константы могут колебаться в значительных пределах, не вызывая нарушений жизнедеятельности организма. К этой группе принадлежит величина кровяного давления, уровень глюкозы, жиров, витаминов и т. д. При отклонении констант от нормы включаются механизмы регуляции, направленные на восстановление измененного показателя (гомеостатические реакции).
Группы крови Астрийский ученый К. Ландштейнер и чешский врач Я. Янский в 1901–1903 г. установили наличие в эритроцитах людей особых антигенов — агглютиногенов и предположили присутствие в сыворотке крови соответствующих им антител — агглютининов. Это послужило основанием для выделения у людей групп крови, не зависящих от пола, возраста и расы. Групповую принадлежность крови обусловливают изоантигены, т. е. собственные антигены, имеющиеся от рождения и являющиеся чужеродными лишь для тех людей, в крови которых этих агглютиногенов нет. У человека описано около 200 изоантигенов. Они объединяются в групповые антигенные системы. Главными носителями антигенных свойств являются эритроциты. Изоантигены передаются по наследству, постоянны в течение всей жизни, не изменяются под воздействием экзогенных и эндогенных факторов. Антитела — иммуноглобулины, образующиеся в крови на введение антигена. Антитела способны взаимодействовать с одноименными антигенами и вызывать ряд реакций, в том числе агглютинацию – склеивание антигенных частиц, фиксированных в мембране эритроцитов, разрушение мембраны и гибель эритроцитов. Антитела к агглютининам крови называются естественными в отличие от иммунных антител, которые образуются в организме при попадании в него инородных тел (например, микробов) и служат для их разрушения. Различные группы крови объединяют в системы, в частности АВ0, Rh (резус) и др. Антигенные системы АВ0 и Rh имеют большое клиническое значение, так как иммунологический конфликт по указанным системам – наиболее частая причина осложнений при переливании крови. Система АВ0. Антигены (агглютиногены) А и В являются полисахаридами, они связаны с белками и липидами, находятся в форменных элементах крови (на мембранах эритроцитов, лейкоцитов, тромбоцитов). Антитела (агглютинины) α и β находятся в плазме крови. Одноименные агглютиногены и агглютинины в крови одного и того же человека не встречаются. Если в эксперименте в пробирке смешать кровь с одноименными агглютиногенами и агглютининами, то произойдет реакция агглютинации (склеивания) эритроцитов. Подобная реакция может произойти и у пациента в случае ошибки при переливании крови! Выделяют четыре основные группы крови системы АВ0: 0αβ (I), встречается у 40–50 % населения земли; Аβ (II), встречается у 30–40 % населения земли; Вα (III) – у 10–20 %; АВ0 (IV) – у 5–8 % всех людей. В эритроцитах I группы нет А- и В-агглютиногенов, поэтому ее называют нулевой, а в плазме содержатся α- и β-агглютинины. В эритроцитах II группы есть агглютиноген А, в плазме — агглютинин β. Для III группы характерно наличие в эритроцитах агглютиногена В, в плазме — агглютинина α. Наконец, в эритроцитах IV группы крови находятся агглютиногены А и В, в плазме агглютининов нет. Агглютинины распределены в соответствии с антигенами следующим образом.
Таблица 1.1 Содержание агглютининов и агглютиногенов в группах крови по системе АВ0
Определение группы крови проводится с двумя сериями сывороток (с различным титром) в течение не менее 5 мин. Во избежание несовместимости крови по анти-А- и анти-В-агглютининам перед переливанием проводят две пробы: на индивидуальную совместимость и на биологическую, для чего в пробирке небольшое количество сыворотки реципиента смешивают с кровью донора и переливают небольшое количество донорской крови несколько раз с перерывами. Отсутствие реакции агглютинации в пробирке и хорошее самочувствие реципиента служат показателями хорошей совместимости крови. По системе АВ0 необходимо переливать только одногруппную кровь (по агглютиногенам АВ0). В исключительных случаях возможно применение правила Оттенберга: допускается переливание крови группы 0αβ (I), не содержащей групповых агглютиногенов, реципиентам других групп. Поэтому человека с 0αβ (I) группой крови можно назвать относительно универсальным донором. В исключительных случаях реципиентам группы АВ0 (IV), не имеющим групповых агглютининов, допускается переливание крови другой совместимой группы (относительно универсальный реципиент), например доноров I(0αβ)), П(Аβ) и Ш(Вα) групп. Однако количество переливаемой крови в таких случаях должно быть ограничено (не более 200 мл), причем очень осторожно следует переливать такую кровь больным с острой кровопотерей. Детям можно переливать только одногруппную кровь. Резус-фактор – антиген, содержащийся в эритроцитах обезьян макака-резуса. Открыт в 1940 г. К. Ландштейнером и А. Винером. Антигены системы резус (Rh) являются липопротеидами. Эритроциты 85 % европейцев содержат Rh-агглютиноген (монгольской расы — 100 %), кровь таких людей называют резус-положительной (Rh+). В эритроцитах 15 % людей резус-антигена нет. Кровь этих людей называется резус-отрицательной, а их самих – резус-отрицательными людьми. Описано несколько разновидностей антигенов системы резус. Cамым активным является антиген D, по которому и определяется резус-принадлежность. Главной особенностью системы резус по сравнению с системой АВ0 является то, что человек не имеет врожденных антител. Резус-антитела (антирезус-агглютинины) формируются при переливании резус-отрицательному человеку резус-положительной крови, что недопустимо. Иммунологический конфликт по антигенной системе резус происходит в следующих случаях: а) при повторном переливании резус-отрицательному человеку резус-положительной крови; б) в случаях беременности, когда кровь женщины резус-отрицательна, а кровь плода резус-положительна. Если кровь резус-положительного донора переливать резус-отрицательному реципиенту, то в организме последнего начнут образовываться специфические по отношению к резус-фактору антитела — антирезус-агглютинины (Rh-антитела). При повторном переливании резус-положительной крови у этого реципиента может наблюдаться гемотрансфузионный шок вследствие агглютинации эритроцитов донора с последующим их гемолизом. Поэтому при переливании крови необходимо выяснить резус-принадлежность крови донора и реципиента и резус-отрицательным реципиентам переливать только резус-отрицательную кровь. Рекомендуется переливать только резус-совместимую кровь, особенно женщинам и детям. Если мать резус-отрицательна, а отец резус-положителен, то плод может быть резус-положительным. При нарушении целостности маточно-плацентарного барьера в период беременности резус-положительным плодом в организме матери могут вырабатываться антирезус-агглютинины. Так, эритроциты Rh+ крови плода попадают в Rh- кровь матери и вызывают выработку у нее Rh-антител, которые, проникая через плаценту в кровь плода, могут вызвать агглютинацию его эритроцитов с последующим их гемолизом. В результате у новорожденного развивается тяжелая гемолитическая анемия, характеризующаяся низким содержанием гемоглобина и снижением количества эритроцитов. Антирезусные тела сохраняются всю жизнь, поэтому каждая следующая беременность более опасна. Таким образом, открытие резус-фактора имеет большое практическое значение, так как позволяет предупреждать гемотрансфузионные реакции, которые могут возникнуть при переливании крови одноименных групп, а также трансплацентарные реакции при беременности.
Форменные элементы крови Содержание гемоглобина и форменных элементов в 1 л крови представлено в табл. 1.2.
Таблица 1.2 Содержание гемоглобина и форменных элементов в крови мужчин и женщин
Эритроциты — красные кровяные тельца, содержащие пигмент –гемоглобин. Эти безъядерные клетки образуются в красном костном мозге, а разрушаются в селезенке. В зависимости от размеров делятся на нормоциты, микроциты и макроциты. Примерно 85 % всех клеток имеет форму двояковогнутого диска или линзы с диаметром 7,2–7,5 мкм. Эритроциты выполняют несколько функций. Дыхательная функция связана с наличием гемоглобина и бикарбоната калия, за счет которых осуществляется перенос кислорода и углекислого газа. Питательная функция обусловлена способностью мембраны клеток адсорбировать аминокислоты и липиды, которые с током крови транспортируются от кишечника к тканям. Эритроциты – самые многочисленные форменные элементы крови. Так, у мужчин в норме содержится 4,5–5,5 · 1012/л, а у женщин — 3,7–4,7 · 1012/л. Однако количество эритроцитов крови изменчиво (их увеличение называется эритроцитозом, а уменьшение — эритропенией). Разрушение эритроцитов происходит через 120 дней в результате физиологического старения. Виды гемоглобина и его значение. Гемоглобин относится к числу сложных белков, принимающих участие в переносе кислорода от легких к тканям. Это основной компонент эритроцитов крови, в каждом из них содержится примерно 280 млн молекул гемоглобина. У мужчин в норме примерно 130–160 г/л гемоглобина, а у женщин — 120–140 г/л. Выделяют несколько форм гемоглобина. Оксигемоглобин содержит двухвалентное железо и способен связывать кислород. Он переносит газ к тканям и органам, где легко его отдает. При образовании оксигемоглобина железо не меняет своей валентности, поэтому это соединение непрочное. При воздействии окислителей (перекисей, нитритов и т. д.) железо из двухвалентного переходит в трехвалентное состояние, за счет чего образуется метгемоглобин – стойкое соединение с кислородом, не распадающееся в тканевых капиллярах и не отдающее тканям кислород. Карбогемоглобин – соединение с углекислым газом, одна из форм транспорта последнего. Карбоксигемоглобин – соединение с угарным газом. Гемоглобин обладает высоким сродством к окиси углерода, поэтому комплекс распадается медленно и соединение гемоглобина с кислородом становится невозможным. Это обусловливает высокую ядовитость угарного газа. Миоглобин по структуре близок к гемоглобину, он находится в мышцах, особенно его много в сердечной мышце. Он связывает кислород, образуя депо, которое используется организмом при снижении кислородной емкости крови. За счет миоглобина работающие мышцы обеспечиваются кислородом. Лейкоциты — бесцветные кровяные тельца с ядрами. Продолжительность их жизни сильно варьирует и составляет от 4–5 до 20 дней для гранулоцитов и до 100 дней для лимфоцитов. Количество лейкоцитов в норме у мужчин и женщин одинаково и составляет в среднем 4 · 109–9 · 109/л. В отличие от эритроцитов, число которых в крови здорового человека относительно постоянно, количество лейкоцитов значительно колеблется в зависимости от времени суток и функционального состояния человека. Увеличение числа лейкоцитов в крови – лейкоцитоз – наблюдается при многих инфекционных заболеваниях. Уменьшение числа лейкоцитов называется лейкопенией. В крови находятся пять видов лейкоцитов: эозинофилы (1–5 %), базофилы (0–1 %), нейтрофилы (46–76 %), лимфоциты (18–40 %), моноциты (2–10 %). Они неодинаковы по величине, форме ядер и свойствам протоплазмы. Диаметр их колеблется от 6 до 25 мкм. По свойствам протоплазмы их делят на две группы: зернистые (гранулоциты) и незернистые (агранулоциты.) Процентное содержание разных видов лейкоцитов по отношению к их общему количеству в периферической крови называется лейкоцитарной формулой, изменения которой свидетельствуют о патологических процессах, возникающих в организме. Лейкоциты выполняют защитную функцию (фагоцитоз, бактерицидное и антитоксическое действие, участие в иммунных реакциях, в процессе свертывания крови и фибринолиза), регенеративную (способствуют заживлению поврежденных тканей) и транспортную (являются носителями ряда ферментов). Тромбоциты – бесцветные, лишенные ядер тельца. Их диаметр в три раза меньше, чем эритроцитов, – 2–3 мкм. Продолжительность жизни – около 4 дней. В среднем в 1 л крови содержится 180 · 109 – 4 · 109 тромбоцитов. Характерной особенностью тромбоцитов является их свойство прилипать к чужеродной поверхности и склеиваться между собой. При этом они разрушаются, выделяя вещества, способствующие свертыванию крови.
Система гемостаза Система гемостаза обеспечивает: 1) сохранение жидкого состояния крови в нормальных условиях существования организма; 2) свертывание крови в случаях повреждения сосудов; 3) восстановление стенок капилляров и других сосудов после их повреждения под действием тех или иных факторов. Гемостаз обеспечивается за счет сосудисто-тромбоцитарного механизма (в сосудах микроциркуляторного русла) и коагуляционного (свертывание крови). Сосудисто-тромбоцитарный механизм гемостаза. При травме тканей происходит спазм сосудов за счет рефлекторного их сокращения и действия на стенку сосудов биологически активных веществ (серотонина, адреналина, норадреналина, тромбоксана А2), которые освобождаются из тромбоцитов и поврежденных тканей. Происходит формирование тромбоцитарной пробки, закрывающей просвет поврежденного сосуда. В основе ее образования лежит способность тромбоцитов прилипать к чужеродной поверхности, склеиваться друг с другом и легко разрушаться, выделяя различные биологически активные вещества («вязкий метаморфоз тромбоцитов»). В результате этих процессов из тромбоцитов выделяются тромбоцитарные факторы. Они запускают процесс свертывания крови, в результате которого образуется фибрин. Нити фибрина оплетают тромбоциты, и образуется тромбоцитарная пробка. Из тромбоцитов выделяется особый белок — тромбостенин, под влиянием которого происходит сокращение тромбоцитарной пробки, образуется тромбоцитарный тромб. Он прочно закрывает просвет микрососуда, и кровотечение останавливается. Коагуляционный механизм гемостаза. Процесс свертывания крови (гемокоагуляция) заключается в переходе растворимого белка плазмы крови фибриногена в нерастворимое состояние — фибрин. В результате процесса свертывания кровь из жидкого состояния переходит в студнеобразное, образуется сгусток, который закрывает просвет поврежденного сосуда. В свертывании крови принимает участие множество факторов. Они получили название факторов свертывания крови и содержатся в плазме крови, форменных элементах (эритроцитах, лейкоцитах, тромбоцитах) и в тканях. Среди них наибольшее значение имеют плазменные факторы, обозначаемые римскими цифрами. Факторы свертывания крови — в основном белки, большинство из них является ферментами, они находится в крови в неактивном состоянии и активируются в процессе свертывания крови. Основными плазменными факторами свертывания крови являются: I — фибриноген; II — протромбин; III — тканевый тромбопластин; IV — ионы Са2+. Факторы с V по XIII — это дополнительные факторы, ускоряющие процесс свертывания крови (акцелераторы). Процесс свертывания крови — ферментативный цепной (каскадный) процесс перехода растворимого белка фибриногена в нерастворимый фибрин. Каскадным он называется потому, что в процессе гемокоагуляции происходит последовательная цепная активация факторов свертывания крови. Процесс свертывания крови осуществляется в три фазы. Первая фаза начинается с активации XII и III факторов, затем активизируются многие другие факторы. Фаза заканчивается активацией X плазменного фактора с образованием сложного ферментного комплекса — протромбиназы. Образование протромбиназы осуществляется по двум механизмам: 1) внешнему; 2) внутреннему. Внешний механизм формирования протромбиназы включается при поступлении тканевого тромбопластина в кровоток из поврежденных тканей и сосудистой стенки, взаимодействии его с плазменным фактором VII и ионами кальция. Образуется кальциевый комплекс, который превращает неактивный плазменный фактор X в его активную форму (Ха). Внутренний механизм образования протромбиназы начинается в момент повреждения стенки сосуда и активации плазменного фактора XII за счет контакта его с отрицательно заряженной поверхностью базальной мембраны. Активный фактор ХIIа превращает ряд факторов в активную форму, что приводит к активации фактор X фактора. Активный фактор X (Ха) взаимодействует с плазменным факторами Vа,VIIа и ионами кальция, в результате чего образуется комплекс, который называется протромбиназой. Вторая фаза — образование активного фермента тромбина из протромбина при действии на него протромбиназы. Тромбин оказывает выраженное коагуляционное действие. Затем растворимый белок плазмы фибриноген переходит в нерастворимый фибрин – образуется сгусток. Он состоит из нитей фибрина и осевших в них форменных элементов крови, главным образом эритроцитов. Кровяной сгусток закрывает просвет поврежденного сосуда. Сгусток, прикрепленный к стенке сосуда, называется тромбом. В последующем тромб, или сгусток, сокращается, а затем растворяется. На схеме представлены основные этапы коагуляционного гемостаза.
Коагуляционный гомеостаз
Механизмы, препятствующие свертыванию крови. В крови содержатся вещества, предотвращающие и замедляющие процесс свертывания крови — ингибиторы (естественные антикоагулянты). Они делятся на первичные (самостоятельно синтезируемые в печени, легких и других органах) и вторичные (образуются в процессе свертывания крови и фибринолиза). К первичным ингибиторам относят антитромбин III и гепарин, обеспечивающие 80 % антикоагулянтной активности крови. Вторичные ингибиторы – это прежде всего отработанные факторы свертывания (фибрин, активные факторы Х1а и Va, фибринпептиды А и В, отщепляемые от фибриногена), а также продукты фибринолиза, в частности антитромбин VI. Гепарин относится к серосодержащим кислым мукополисахаридам, синтезируется в базофильных клетках крови и тканей, а также в тучных клетках соединительной ткани. Гепарин присутствует почти во всех тканях организма и является антикоагулянтом прямого и широкого спектра действия. Гепарин тормозит процесс образования протромбиназы, блокирует превращение протромбина в тромбин, препятствует взаимодействию тромбина с фибриногеном — тормозит протекание всех фаз процесса гемокоагуляции. Зная механизм свертывания крови, можно воздействовать на скорость его протекания с помощью вводимых извне антикоагулянтов. Это могут быть гепарин, производные кумарина, блокирующие синтез витамина К, а также вещества, удаляющие из раствора ионы кальция. Последние (например, лимоннокислый или щавелевокислый натрий) используют при хранении крови, извлеченной из организма. Фибринолиз осуществляется с помощью ферментативной системы, основной функцией которой является расщепление нитей фибрина, образовавшихся в процессе свертывания крови, на растворимые комплексы и восстановление просвета сосуда. В ее состав входят следующие компоненты. 1. Фермент плазмин (фибринолизин) находится в крови в неактивном состоянии в виде плазминогена (профибринолизина). Он расщепляет фибрин, фибриноген, некоторые плазменные факторы свертывания крови и другие белки плазмы крови. 2. Активаторы плазминогена (профибринолизина) относятся к глобулиновой фракции белков. К активаторам относят кислые и щелочные фосфатазы, трипсин, урокиназу. Многие активаторы находятся в плазме крови в неактивном состоянии в виде проактиваторов. Для их активации необходимы лизокиназы тканей, плазмы (фактор ХIIа плазмы). Помимо плазмы крови активаторы плазминогена находятся также в тканях (тканевые активаторы). Особенно их много в матке, легких, щитовидной железе, простате. 3. Ингибиторы пазминогена (антиплазмины) являются альбуминами.
Механизмы регуляции В организме человека клетки, ткани, органы работают как единое целое. Их согласованная работа регулируется двумя механизмами: нервным (с помощью нервных импульсов) и гуморальным (с помощью химических веществ, переносимых жидкостями – от лат. «гумор» – жидкость). Основную роль в гуморальной регуляции играют железы внутренней секреции (эндокринные железы). Нервная регуляция осуществляется посредством передачи к органам нервных импульсов от головного и спинного мозга. Для того чтобы следить за состоянием организма, центральная нервная система должна получать информацию о состоянии его внутренней и внешней среды. Такую информацию мозг получает при помощи рецепторов – специальных устройств, способных превращать энергию различных раздражителей (температуры, давления, химического состава), в электрические импульсы. Эти импульсы поступают в головной и спинной мозг, и на основании полученной информации центральная нервная система отдает органам те или иные команды. Такие команды могут быть отданы и эндокринным железам, которые выделяют гормоны, тем самым обеспечивая связь нервной и гуморальной регуляции в организме. Благодаря таким двусторонним связям мозг регулирует работу органов в соответствии с потребностями организма. Основным механизмом нервной регуляции является рефлекс – ответная реакция организма на изменение во внешней или внутренней среде, осуществляемая с помощью центральной нервной системы в ответ на раздражение рецепторов. Морфологической основой рефлекса является рефлекторная дуга (рис. 2.1).
Рис. 2.1. Схема строения рефлекторной дуги: 1 – рецептор; 2 – афферентный нерв; 3 – афферентный нейрон; 4 – вставочный нейрон; 5 –эфферентный нейрон; 6 – эфферентный нерв; 7 – эффектор
Нервная и гуморальная регуляция обеспечивают постоянство внутренней среды и устойчивость всех функций организма. Это достигается путем саморегуляции. Она заключается в том, что любое отклонение параметров внутренней среды организма от заданного значения включает нервные и гуморальные процессы, возвращающие их к исходному состоянию. Например, повышение артериального давления вызывает возбуждение барорецепторов, сообщающих в центральную нервную систему (ЦНС) о возникшем сдвиге константы, ЦНС посылает импульсы к сосудам и сердцу, сосуды расширяются, сердце сокращается слабее и реже, давление нормализуется.
Синапс Синапс – это структурно-функциональное образование, обеспечивающее переход возбуждения с окончания нервного волокна на иннервируемую клетку (рис. 2.4). Синапсы различают по способу передачи импульса (электрические, химические, смешанные), по локализации (центральные, периферические), по виду процессов на постсинаптической мембране (возбуждающие, тормозящие).
Рис. 2.4. Структура синапса: 1 – пресинаптическое нервное окончание; 2 – нейротрубочки; 3 – митохондрии; 4 – везикулы с медиатором; 5 – пресинаптическая мембрана; 6 – синаптическая щель; 7 – постсинаптическая мембрана; 8 – эффекторная клетка
Рассмотрим работу нервно-мышечного синапса. Нервный импульс по аксону направляется к иннервируемой структуре, достигает конечного участка (терминали) аксона и деполяризует пресинаптическую мембрану. После этого открываются натриевые и кальциевые каналы и ионы кальция из среды, окружающей синапс, входят внутрь терминали аксона. Движение везикул (пузырьков, содержащих медиатор) упорядочивается по направлению к пресинаптической мембране. Ионы кальция стимулируют движение везикул. Достигая пресинаптической мембраны, везикулы разрываются – освобождается ацетилхолин, который поступает в синаптическую щель и взаимодействует с рецепторами на постсинаптической мембране. В результате открываются натриевые каналы и формируется потенциал концевой пластины. Медиаторы – это химические вещества, которые участвуют в передаче возбуждения или торможения в химических синапсах с пресинаптической мембраны на постсинаптическую мембрану. Важная особенность рецепторов постсинаптической мембраны – их способность вступать в биохимическое взаимодействие только с определенным видом медиатора. Межнейронные синапсы мало отличаются от нервно-мышечных. Каналы межнейронных синапсов в мозге регулируются различными медиаторами, поэтому в них могут развиваться как возбуждающие, так и тормозящие процессы. На постсинаптической мембране возбуждающих синапсов под действием медиатора происходит местная деполяризация, которая, суммируясь с аналогичным процессом на других постсинаптических мембранах этого нейрона, может привести к развитию потенциала действия на аксоне нейрона. На постсинаптической мембране тормозящих синапсов развивается процесс гиперполяризации, т. е. увеличения разности потенциалов, что приводит к снижению возбудимости нейрона. В отличие от мышечной клетки скелетной мускулатуры, которая образует одно нервно-мышечное соединение с аксоном нервной клетки, к телу каждого из нейронов, входящих в состав нервного центра, подходит не большое количество нервных окончаний от многочисленных нервных клеток. И в результате на теле каждого нейрона образуется большое число (до 10 тысяч) так называемых аксодендритных и аксосоматических синапсов. Одни из них служат для проведения возбуждения через нервный центр и называются возбуждающими синапсами, а другие – для блокады проведения возбуждения через этот центр и называются тормозящими. В возбуждающих контактах возбуждение передается с помощью медиаторов, которые вызывают местную деполяризацию на постсинаптической мембране. Но для возбуждения нейрона, воспринимающего информацию, недостаточно вызвать деполяризацию в одном контакте. Только при одновременном возбуждении многих участков на постсинаптической мембране деполяризация может достигнуть нужной величины и возбуждение сможет распространяться далее по аксону к следующему нейрону. Тормозящие контакты служат для блокирования проведения возбуждения через нервный центр. Специальные нейроны выделяют медиатор, который на постсинаптической мембране того же воспринимающего нейрона вызывает не деполяризацию, а гиперполяризацию мембраны. Тормозящим медиатором в ЦНС может быть аминокислота глицин, гамма-аминомасляная кислота и др. Под влиянием этих веществ на постсинаптической мембране открываются хлорные каналы, анионы хлора по электрохимическому градиенту поступают в клетку, увеличивая на ней разность потенциалов. В результате возбудимость нейрона понижается и он не может более воспринимать и передавать далее возбуждающий сигнал. Такое торможение называется постсинаптическим гиперполяризационным. Торможение в ЦНС было открыто И.М. Сеченовым (1863 г.), который экспериментально установил наличие в зрительных буграх головного мозга лягушки нервных механизмов, которые угнетают спинальные рефлексы. Значение торможения для жизнедеятельности организма состоит в том, что оно блокирует беспрепятственное распространение возбуждения на многочисленные нервные центры, морфологически связанные друг с другом, и направляет его по определенным нервным путям, осуществляя регулирующую, координирующую функцию, в результате которой в первую очередь осуществляются биологически наиболее важные рефлекторные реакции, а менее важные тормозятся.
Рис. 2.5. Строение возбуждающего (А) и тормозящего (Б) синапсов: 1 – пресинаптические нервные окончания; 2 – везикулы с медиатором; 3 – постсинаптическая мембрана Скелетные мышцы Основу скелетных мышц формируют тонкие пучки поперечно-полосатых мышечных волокон, образующих мясистое брюшко, которое может активно сокращаться. На обоих концах оно переходит в сухожилие и прикрепляется к костям. Каждое мышечное волокно (миофибрилла) представляет собой многоядерную клетку, в состав которой входят мышечные волоконца (протофибриллы), или сократительные мышечные белки, упорядоченное расположение которых и придает мышце поперечную исчерченность. Виды мышечных сокращений: – изотоническое (изменяется длина волокон при неизменном напряжении; – изометрическое (изменяется напряжение при неизменной длине волокон); – смешанное (изменяется и напряжение и длина мышечных волокон). В организме в естественных условиях чаще всего происходит смешанное сокращение. Мышца может сокращаться в одиночном режиме, когда на нее действуют одиночные раздражители, или в режиме непрерывного длительного укорочения – тетануса, когда раздражители действуют с меньшим интервалом, чем длится одно полное сокращение. Тетанус может быть гладким и зубчатым. Гладкий возникает при большой частоте раздражения, при которой мышца не успевает даже частично расслабиться перед следующим сокращением. Зубчатый тетанус развивается при более редкой частоте раздражений, когда мышца успевает частично расслабиться к моменту следующего раздражения (рис. 2.6 и 2.7).
Рис. 2.6. Одиночное мышечное сокращение: 1 – точка раздражения; 1–2 – латентный период; 2–3 – фаза сокращения; 3–4 – фаза расслабления
Рис. 2.7. Зубчатый и гладкий тетанусы
Механизм мышечного сокращения и расслабления. Мышечное волокно содержит два типа белков: сократительные и модуляторные (регуляторные). К сократительным относятся актин и миозин, расположенные в виде толстых и тонких нитей параллельно друг другу. Скольжение актиновых нитей вдоль миозиновых и обеспечивает укорочение мышцы, т.е. ее сокращение (рис. 2.8). В состоянии покоя такого скольжения не происходит, так как взаимодействие сократительных белков блокируется тропонином и тропомиозином (модуляторными белками). При действии раздражителя модуляторные белки меняют свою конфигурацию так, что перестают блокировать сократительные белки и не препятствуют соединению активных центров на нитях актина с выростами (мостиками) на нитях миозина и последующему скольжению нитей актина. Изменение конфигурации тропонина и пропомиозина возможно только в присутствии ионов кальция. Хранилищем (депо) ионов кальция в мышце являются цистерны саркоплазматического ретикулюма (эндоплазматической сети в мышце). В мембранах этих цистерн при развитии в них потенциала действия открываются кальциевые каналы и освободившиеся ионы взаимодействуют с модуляторными белками, создавая условия для скольжения нитей актина. Энергию для этого скольжения дает распад АТФ, который происходит при взаимодействии миозиновых мостиков с активными центрами. Расслабление мышцы также является активным процессом и требует затраты энергии АТФ. Энергия расходуется на работу кальциевого насоса, который против концентрационного градиента возвращает ионы кальция в саркоплазматический ретикулюм. Это приводит к инактивации активных центров на нитях актина и отделению их от миозиновых мостиков. Доказательством активности процесса расслабления служит трупное окоченение, т. е. развитие мышечной контрактуры после смерти, когда отсутствие энергии для работы насосов не позволяет мышцам расслабляться. Эти же механизмы вызывают контрактуру при утомлении, так как при длительной работе слишком много энергии тратится на мышечное сокращение и ее не хватает для возвращения ионов кальция в саркоплазматический ретикулюм. На рис. 2.8 показано строение поперечно-полосатого мышечного волокна и основные механизмы ее сокращения. Скелетные мышцы состоят из поперечно-полосатой скелетной мускулатуры. Основной единицей мышечной ткани является мышечное волокно, которое, в свою очередь, состоит из протофибрилл – пучков сократимых белков (актина и миозина), способных вдвигаться друг в друга. Сокращение мышцы (вхождение актина и миозина друг в друга) происходит только при наличии АТФ и ищнов кальция. Запускается этот процесс в мышце под действием нервных импульсов, поступающих от нервной системы.
Рис. 2.8. Строение мышечной ткани: 1 – мышечное волокно; 2 – пучки сократительных белков; 3 – актин; 4 – миозин
Нервная система Структурная единица нервной ткани – нейрон – имеет тело и отростки. По коротким (обычно многочисленным) отросткам – дендритам – возбуждение передается телу нервной клетки, а по длинному одиночному аксону оно распространяется к другим нейронам или рабочим органам (мышцам и железам). Передача возбуждения с одной клетки на другую осуществляется при помощи синапсов.
Рис. 2.9. Строение нейрона: 1 – аксонный холмик; 2 – тело; 3 – пресинаптические окончания; 4 – дендриты; 5 – аксон; 6 – перехват Ренвье; 7 – миелиновая оболочка
Центральная нервная система . Физиология нервных центров. Центральная нервная система состоит из головного и спинного мозга. Основные отделы головного мозга представлены на рис. 2.10.
Рис. 2.10. Строение головного мозга: 1 – верхний участок спинного мозга; 2 – продолговатый мозг; 3 – мост; 4 – мозжечок; 5 – средний мозг; 6 – четверохолмие; 7 – промежуточный мозг; 8 – кора больших полушарий; 9 – мозолистое тело, соединяющее правое полушарие с левым; 10 – перекрест зрительных нервов; 11 – обонятельные луковицы
Нервным центром называется совокупность нервных клеток, расположенных в определенном отделе центральной нервной системы и регулирующих определенную функцию. Нервные центры в зависимости от расположения подразделяются на спинальные (в спинном мозге), бульбарные (в продолговатом мозге), мезенцефальные (в среднем мозге) и др. Нервные центры подразделяются также на соматические (регулирующие сокращения скелетной мускулатуры) и вегетативные (регулирующие работу внутренних органов). В нервном центре все нейроны связаны между собой с помощью синапсов, поэтому их свойства в значительной степени определяются свойствами последних. Для них характерны одностороннее проведение возбуждения, синаптическая задержка проведения возбуждения, низкая лабильность и высокая утомляемость. Как и в синапсах, в нервных центрах имеет место суммация возбуждения, т. е. сложение местных ответов при последовательном или одновременном поступлении нескольких импульсов к одному нейрону. За счет синаптических связей импульс, поступивший к одному нейрону, может распространяться на другие, рядом лежащие, что способствует распространению возбуждения. Такое явление называется иррадиацией. Противоположное явление, т. е. схождение импульсов от нескольких нейронов к одному, называется конвергенцией. Конвергенция лежит в основе суммации. В нервных центрах может развиваться не только возбуждение, но и торможение. Усиление активности органа или отдела ЦНС называется возбуждением, а снижение (когда нейрон не способен к выработке нервных импульсов) – торможением. Торможение – активный процесс, возникающий при действии раздражителей на нервные центры и проявляющийся в подавлении другого возбуждения. В результате функциональная активность центра снижается или исчезает. К физиологическим свойствам нервных волокон относятся: · возбудимость – способность приходить в состояние возбуждения в ответ на раздражение; · проводимость – способность передавать нервные возбуждения в виде потенциала действия от места раздражения по всей длине; · рефрактерность – способность временно резко снижать возбудимость в процессе возбуждения.
Главная функция нервных волокон – проведение нервных импульсов. По особенностям строения и функциям нервные волокна подразделяются на два вида. Так, безмиелиновые нервные волокна состоят из осевого цилиндра, покрытого оболочкой. Их диаметр 5–7 мкм, скорость проведения импульса 1 – 2 м/с. Миелиновые волокна состоят из осевого цилиндра, покрытого кроме обычной оболочки еще и миелиновой оболочкой. Осевой цилиндр имеет мембрану и аксоплазму. Миелиновая оболочка на 80 % состоит из липидов, обладающих высоким омическим сопротивлением, и на 20 % из белка. Миелиновая оболочка не покрывает сплошь осевой цилиндр, а прерывается и оставляет открытыми участки осевого цилиндра, которые называются узловыми перехватами (перехваты Ранвье). При диаметре 12–20 мкм скорость проведения возбуждения составляет 70–120 м/с. Механизм проведения возбуждения. В безмиелиновых нервных волокнах (рис. 2.11) возбуждение распространяется за счет малых круговых ионных токов, возникающих между возбужденным и невозбужденным участками волокна. Возбужденный участок мембраны на наружной поверхности заряжается отрицательно, а невозбужднный снаружи заряжен положительно. Ток передается от положительного участка к отрицательному. Возбуждение постепенно охватывает соседние участки осевого цилиндра и так распространяется до конца аксона. Такой путь передачи возбуждения энергетически невыгоден, так как требует большой затраты энергии для поддержания ионных градиентов на большой площади. В миэлиновых волокнах при раздражении возбуждение возникает только в области перехвата Ранвье, где и развивается деполяризация. Соседний перехват в это время поляризован, и между ними возникает разность потенциалов, приводящая к развитию круговых токов. При этом возбуждение распространяется скачкообразно, от одного перехвата к другому. Такой способ распространения более экономичен, требует меньших затрат энергии калий-натриевого насоса, поэтому скорость проведения в миэлиновых волокнах значительно выше.
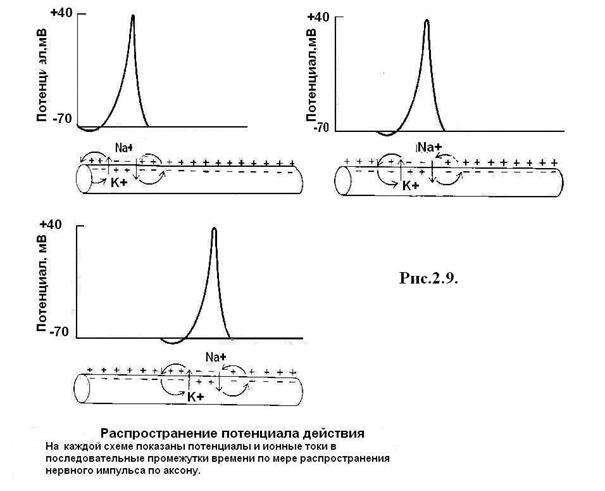
Рис. 2.11. Проведение возбуждения по нервному волокну. На каждой схеме показаны потенциалы действия и ионные токи по мере распространения нервного импульса по аксону
Законы проведения возбуждения по нервному волокну: 1. Закон анатомо-физиологической целостности. Проведение возбуждения по нервному волокну возможно лишь в случае, если не нарушена его целостность и сохранены его физиологические свойства. Сдавление, охлаждение, использование анестетиков делают проведение по нерву невозможным. 2. Закон изолированного проведения возбуждения. Возбуждение распространяется только вдоль нервного волокна, не распространяясь на соседние, которые находятся в этом же нервном стволе. 3. Закон двустороннего проведения возбуждения. Возбуждение распространяется вдоль нервного волокна в обе стороны от места приложения раздражителя. Нервная система человека Единая нервная система условно подразделяется на две части: соматическую (обеспечивает управление скелетной мускулатурой) и вегетативную. Вегетативная нервная система. Это часть нервной системы, которая обеспечивает управление работой всех внутренних органов и систем, желез внутренней секреции, кровеносных и лимфатических сосудов и других органов (см. таблицу). Она также координирует деятельность всех внутренних органов, регулирует обменные, трофические процессы во всех органах и частях тела человека, поддерживает постоянство внутренней среды. По своей функции вегетативная нервная система неподконтрольна нашему сознанию, но находится в подчинении ЦНС. Глава 3. Кровообращение Все функции крови могут осуществляться только при условии непрерывного движения ее по сосудам. Это движение происходит за счет работы сердца, которое выполняет роль насоса. Движение крови по сосудам называют кровообращением. Помимо сердца система органов кровообращения человека представлена кровеносными сосудами – артериями, венами и капиллярами.
Сердечный цикл Правильное чередование сокращений и расслаблений предсердий и желудочков называется сердечным циклом. Весь сердечный цикл длится 0,8 с (при частоте сердечных сокращений 75/мин.). Различают две основные фазы сердечного цикла: – систола-выброс крови из полостей сердца в результате сокращения; – диастола – расслабление, наполнение полостей кровью. Эти основные фазы включают следующие подфазы: · систола предсердий (0,1 с) – кровь поступает в желудочки; · диастола предсердий (0,7 с) – кровь поступает в предсердия; · систола желудочков (0,3 с) – кровь поступает в аорту и лёгочный ствол; · диастола желудочков (0,5 с) – кровь поступает в желудочки; · общая пауза сердца (0,4 с) – желудочки и предсердия в диастоле. Предсердия наполняются кровью, и на 2/3 наполняются желудочки. Всю систолу и начало диастолы сердце невозбудимо, что служит защитой от тетануса и обеспечивает режим одиночного сокращения.
Рис. 3.4. Давление в полостях сердца в разные фазы сердечного цикла: А – правая половина сердца; Б – левая половина (верхние цифры – давление в предсердиях, нижние – в желудочках)
За один сердечный цикл каждый желудочек сердца выбрасывает в среднем 40–70 мл крови. Этот объем крови называется систолическим объемом. При физической нагрузке он может увеличиваться за счет резервного объема, остающегося в сердце в условиях покоя после каждой систолы. Объем крови, выбрасываемой каждым желудочком сердца за одну минуту (МОК), составляет примерно 4,5–5,0 л. Его величину можно рассчитать, умножив систолический объем на частоту сердечных сокращений. При физической нагрузке МОК может возрастать за счет увеличения как систолического объема, так и частоты сердечных сокращений. Миокард Сердечная мышца – миокард – имеет поперечно-полосатое строение, она сокращается по принципу «все или ничего». Это значит, что на раздражитель слабой силы сердечная мышца не реагирует, а на раздражитель достаточной (пороговой или сверхпороговой) силы отвечает сразу максимальным сокращением. Миокард состоит из двух видов мышечных клеток: – рабочих кардиомиоцитов (сократительный миокард), которые соединены между собой при помощи вставочных дисков и образуют миофибриллы. Через диски возбуждение легко переходит с одного кардиомиоцита на другой (вставочный диск – это электрический синапс); – атипичных мышечных клеток, способных генерировать импульсы. Атипическая мышечная ткань имеет менее выраженную поперечную исчерченность, в ней мало миофибрилл, много саркоплазмы. Атипичные мышечные волокна сосредоточены в виде скоплений (узлов) в определенных участках сердца (рис. 3.5).
Рис. 3.5. Проводящая система сердца: 1 правая ножка; 2 – АВ-узел; 3 – СА-узел; 4 – пучок Гиза; 5 – левая ножка; 6 – передняя ветвь; 7 – задняя ветвь; 8 – волокна Пуркинье
Автоматия – способность сердца сокращаться под действием импульсов, возникающих в нем самом. Автоматия обеспечивается атипичной мускулатурой, которая образует ряд узлов и пучков в сердце человека. Их совокупность составляет проводящую систему сердца, которая включает следующие компоненты. ü Предсердный узел – на задней стенке правого предсердия между устьями полых вен. Играет ведущую роль в возникновении возбуждения сердца. Импульс, возникший в этом узле, распространяется по мускулатуре предсердий со скоростью 1000 мм/c. ü Предсердно-желудочковый узел – расположен в нижней части межпредсердной перегородки справа. Может генерировать импульсы, когда не работает предсердный узел. В нормальных условиях предсердно-желудочковый узел лишь проводит импульсы к желудочкам. Обеспечивает задержку, так как скорость проведения возбуждения через предсердно-желудочковый узел узел равна 50–200 мм/с, что необходимо для поочередного сокращения предсердий и желудочков. ü Пучок Гиса – проходит в межжелудочковой перегородке к желудочкам, делится на две ножки. Скорость проведения возбуждения по пучку и ножкам Гиса самая высокая (около 4000 мм/с), что позволяет одновременно охватить возбуждением оба желудочка. ü Волокна Пуркинье – образуют синапсы на кардиомиоцитах, обеспечивают сопряжение поступления возбуждения и мышечного сокращения. Доказательствами автоматии сердца служат следующие опыты: – перерезали нервы, иннервирующие сердце, но оно продолжало работать; – изолировали сердце из организма, но оно продолжало работать; Главным водителем ритма сердца является предсердный узел, в котором периодически (60–80 раз в минуту) возникает импульс. Остальные центры могут генерировать импульсы возбуждения в случае, если предсердный узел выходит из строя. Но количество импульсов, и автоматическая активность элементов проводящей ситемы убывает по мере удаления центра от основания сердца к его верхушке. Это явление получило название убывающего градиента автоматии. Сократительному миокарду присущи все свойства возбудимых тканей. Возбудимость (меньше, чем у скелетной мышечной ткани). Потенциал покоя –90 мВ (выше, чем у скелетной мышцы. Потенциал действия рабочих кардиомиоцитов отличается от такового в скелетных мышцах наличием продолжительной фазы реполяризации (плато реполяризации) (рис. 3.6).
Рис. 3.6. Потенциал действия рабочих кардиомиоцитов
Проводимость (скорость проведения меньше, чем у скелетной мышцы). Проведение возбуждения осуществляется с разной скоростью, что позволяет осуществлять быстрый и последовательный охват возбуждением всех отделов сердца. Рефрактерность. Миокард имеет длительный рефрактерный период (0,3 с). Всю систолу и начало диастолы сердце невозбудимо, что служит защитой от тетануса. Если же раздражение поступает к сердцу после завершения фазы абсолютной рефрактерности, то может возникнуть внеочередное сокращение, называемое экстрасистолой. Как правило, следующая за экстрасистолой диастола длится дольше обычной и носит название компенсаторной паузы. Ее продолжительность связана с тем, что экстрасистола сопровождается развитием абсолютной рефрактерности, во время которой сердце не может ответить сокращением на очередной импульс из синусного узла. Сократимость. Сердце сокращается в режиме одиночного сокращения, благодаря большой длительности рефрактерной фазы. Электрокардиография Электрокардиография - это метод регистрации электрической активности сердца с помощью электродов, помещаемых на различные участки поверхности тела. В электрокардиограмме различают следующие элементы: зубцы Р, Q, R, S, T, комплекс зубцов QRS, интервалы PQ, QT и сегменты PQ, ST и TP (рис. 3.7). В состоянии покоя весь миокард на внешней поверхности заряжен одинаково положительно, разности потенциалов на поверхности миокарда не возникает, и на ЭКГ регистрируется изолиния.
Зубец P отражает возбуждение правого и левого предсердий. Сегмент PQ находится на изолинии, отражает проведение возбуждения через атриовентрикулярный (АВ) узел. Желудочковый комплекс QRS. Первой возбуждается левая часть межжелудочковой перегородки, правая сосочковая мышца и
Рис. 3.7. Электрокардиограмма
внутренняя поверхность обоих желудочков в области верхушки (зубец Q). Далее возбуждаются вся верхушка и боковые стенки желудочков. Разность потенциалов достигает максимума, когда возбуждением охвачена примерно половина миокарда (зубец R). Сегмент ST находится на изолинии. Разность потенциалов в пределах желудочков исчезает, все кардиомиоциты пребывают в возбужденном состоянии, и их поверхность заряжена одинаково отрицательно. Зубец T отражает реполяризацию желудочков. Это самая изменчивая часть ЭКГ, так как реполяризация происходит не одновременно в разных волокнах миокарда. Длительность зубца Т больше, чем комплекса QRS в связи с тем, что процесс реполяризации в кардиомиоцитах протекает дольше деполяризации. Сегмент TP совпадает с периодом покоя всего сердца - общей паузой. Амплитуда зубцов (в милливольтах): Р – 0–0,3; Q – 0–0,06; R – 0,6–1,6; S – 0,15–0,17; T – 0,3. В норме амплитуда зубца P составляет 1/3 высоты R, а высота зубца T ½–1/3 высоты зубца R. Длительность основных элементов нормальной ЭКГ приведена в табл. 3.1.
Таблица 3.1 Сосудистая система По функциональному признаку в сосудистой системе можно выделить следующие основные отделы. 1. Компрессионный отдел. Это аорта и крупные артерии, сосуды эластического типа с упругорастяжимыми стенками. Указанные сосуды растягиваются поступающей из сердца кровью во время систолы, а во время диастолы спадаются, тем самым поддерживая давление крови и подталкивая ее в артериолы и капилляры. 2. Резистивный отдел – артериолы, сосуды с хорошо выраженной мышечной стенкой. Ввиду малого диаметра они создают основное сопротивление току крови и не дают ей быстро оттекать в дистальные отделы, что позволяет поддержать артериальное давление на достаточном уровне даже во время диастолы. 3. Обменный отдел – капилляры, где происходит обмен газами, жидкостью и другими веществами между кровью и тканями. 4. Шунтирующие сосуды – артериовенозные анастомозы, при необходимости обеспечивающие сброс крови из артериальной системы в венозную, минуя капилляры. 5. Емкостные сосуды – вены, обладающие большой растяжимостью и содержащие до 80 % крови. Обеспечивают венозный возврат крови к сердцу. Основные показатели сердечно-сосудистой системы приведены в табл. 3.2. Таблица 3.2 Основные показатели сердечно-сосудистой системы
Давление крови. Несмотря на то что кровь поступает в сосуды из сердца только в фазу систолы, давление в системе сохраняется и в фазу диастолы, а кровь не прекращает своего движения. Давление крови в сосудах создается за счет следующих факторов: – нагнетательной работы сердца; – эластических свойств аорты и крупных артерий; – наличия периферического сопротивления сосудов. Артериальное давление – очень важный интегральный показатель состояния сердечно-сосудистой системы, его постоянно определяют в клинике. Давление, которое создается энергией сокращения сердца в момент систолы, называется систолическим, или максимальным. Оно у молодых людей составляет 100–110 мм рт. ст. и не превышает в норме 140 мм. Давление, которое создается энергией сокращения эластических стенок крупных сосудов в момент диастолы, называется диастолическим. Его величина у молодых людей составляет 70–80 мм рт. ст. и не превышает в норме 90 мм рт. ст. Разница между систолическим и диастолическим давлением определяет пульсацию сосудов и называется поэтому пульсовым давлением. Энергия давления крови расходуется на преодоление сосудистого сопротивления, поэтому чем больший путь прошла кровь после выхода из сердца, тем ниже ее давление.
Особенности кровотока в венах. Венозная система принципиально отличается от артериальной. Давление крови в венах значительно ниже, чем в артериях, и в венах, расположенных в грудной полости, может быть ниже атмосферного. Давление крови в правом предсердии называется центральным венозным давлением (ЦВД). Оно измеряется в миллиметрах водного столба и составляет в норме в условиях покоя 40–120 мм вод. ст. Поскольку при вертикальном положении тела кровь по большей части вен движется, преодолевая силу тяжести, целесообразно рассмотреть факторы, обеспечивающие венозный возврат крови к сердцу: 1) разность давлений в начале и конце системы кровообращения, создаваемая энергией сердечных сокращений (основная движущая сила); 2) сокращения скелетной мускулатуры, сдавливая расположенные в ней вены, способствуют движению крови, а венозные клапаны, подобно полулунным клапанам аорты и легочного ствола, не позволяют ей двигаться в направлении «от сердца»; 3) во время вдоха давление в грудной клетке снижается, это приводит к расширению внутригрудных вен и снижению в них давления, происходит засасывание крови, что способствует ее возврату в сердце; 4) снижение давления в предсердиях и желудочках сердца во время сердечного цикла способствует присасыванию крови и поступлению ее в сердце; 5) наличие клапанов в венах, которые предупреждают обратное движение крови в венах нижней половины тела. Микроциркуляция крови. В микроциркуляторном русле осуществляется транспорт веществ через стенку микрососудов, в результате клетки органов и тканей обмениваются с кровью водой и другими веществами, образуется лимфа. Главные сосуды этого отдела – капилляры. К ним относятся микрососуды диаметром от 2 до 12 нм. Стенка капилляра состоит из одного слоя эндотелиальных клеток, расположенных на базальной мембране. В зависимости от участия в процессе кровообращения капилляры могут быть закрытыми и открытыми. В активно функционирующей скелетной мышце количество открытых капилляров может увеличиваться в 100 раз. В состоянии покоя функционирует только их часть, остальные находятся «в резерве». Это становится понятным, если вспомнить, что емкость всего капиллярного русла составляет около 7 л, тогда как общий объем крови в организме не превышает, как правило, 5 л. Как было замечено исследователем капиллярного кровообращения Крогом, капилляры поочередно открываются и закрываются – «мерцают». Механизм «мерцания» связан с расширяющим действием на просвет капилляров накапливающихся тканевых метаболитов. При усилении функции любого органа в нем интенсивно образуются метаболиты (углекислый газ, АДФ, АМФ, фосфорная и молочная кислоты и др.), повышается осмотическое давление, снижается рН в окружающей жидкости. Все эти факторы вызывают расслабление гладких мышц прекапиллярных сосудов, в результате количество открытых капилляров увеличивается и кровоток на данном участке возрастает. Транскапиллярный обмен – это обмен веществ между кровью капилляров и органами и тканями. В капиллярах создаются благоприятные условия для транскапиллярного обмена: медленное движение крови, градиент давления в артериальном и венозном отделах, высокая проницаемость стенки. Механизмы транскапиллярного обмена: 1) диффузия – это пассивный транспорт веществ через стенку капилляра по градиенту концентрации. За счет диффузии транспортируются кислород и углекислый газ, ионы, минеральные вещества; 2) фильтрация – пассивный транспорт, осуществляемый за счет разницы гидростатического давления жидкости по обе стороны стенки капилляра. Таким образом происходит движение воды и растворенных в ней веществ; 3) активный транспорт. Осуществляется с помощью переносчиков с затратой энергии. Используется для переноса аминокислот, углеводов и некоторых других веществ; 4) пиноцитоз – это микровезикулярный транспорт. Внутри клеток эндотелия есть везикулы, которые захватывают вещество у наружной поверхности клетки и транспортируют его к внутренней поверхности. Таким путем переносятся отдельные белки. За сутки через стенку капилляров в их артериальном конце фильтруется около 20 л жидкости, 18 из них возвращаются в капилляры в его венозном отделе, а 2 поступают в лимфатические капилляры и затем возвращаются в кровь через систему верхней полой вены. Фильтрационное давление является результатом взаимодействия разнонаправленных сил, одновременно способствующих и препятствующих процессу фильтрации. Способствуют фильтрации гидростатическое давление крови (Ргк), в артериальной части капилляров оно равно 32 мм рт. ст., в венозной – 15 мм, и онкотическое давление тканевой жидкости (Рот), составляющее 5 мм рт. ст. Препятствуют фильтрации онкотическое давление плазмы крови (Рок), равное 25 мм рт. ст., и гидростатическое давление тканевой жидкости (Ргт), равное 3 мм рт. ст. На артериальном конце капилляра силы, способствующие фильтрации, преобладают над силами, препятствующими ей, и эффективное фильтрационное давление составляет Рф = Ргк + Рот – (Рок + Ргт), или Рф = 32 + 5 – (25+3) = 9 мм рт. ст. На венозном конце капилляра из-за снижения гидростатического давления крови преобладают силы, препятствующие фильтрации, и создается давление реабсорбции, под которым профильтровавшаяся жидкость возвращается назад, в кровяное русло. Рреабс = 15+5 – (25 + 8) = – 8 мм рт. ст. (?), Как видно из сравнения двух уравнений, давление при фильтрации выше, чем при реабсорбции. Этим объясняется меньший объем реабсорбции по сравнению с фильтрацией.
Глава 4. Физиология дыхания Дыхание – это процесс переноса кислорода из атмосферного воздуха к клеткам и углекислого газа от клеток в окружающую среду. Этот процесс переноса кислорода в те части организма, где он поглощается клетками, происходит в несколько этапов, из которых первые четыре изучаются физиологами, а последний – биохимиками. I – внешнее дыхание (легочная вентиляция) – обмен газов между альвеолами легких и атмосферным воздухом; II – газообмен между легкими (альвеолярным воздухом) и кровью (кровью капилляров малого круга кровообращения); III – транспорт газов кровью – процесс переноса газов от легких к тканям и от тканей к легким; IV – газообмен в тканях между кровью капилляров большого круга кровообращения и тканевой жидкостью; V – внутреннее (тканевое) дыхание – биологическое окисление в митохондриях клеток. Строение легких и дыхательных путей приведено на рис. 4.1 и 4.2, а общая схема этапов дыхания представлена на рис. 4.3.

Р
Рис. 4.1. Дыхательная система (схема) Рис. 4.2. Трахея, бронхи, легкие (вид спереди): 1 – трахея; 2 – верхушка легкого; 3 – верхняя доля легкого; 4а и 4б – междолевые борозды; 5 – нижняя доля легкого; 6 – средняя доля правого легкого; 7 – сердечная вырезка левого легкого; 8 – главные бронхи; 9 – бифуркация (разделение) трахеи
Рис. 4.3. Схема этапов дыхания (I–V): 1 – легкие; 2 – малый круг кровообращения; 3 – большой круг кровообращения; 4 – ткани; 5 – тканевая жидкость Газообмен в легких и тканях В легких происходит обмен газов между воздухом, находящимся в альвеолах, и притекающей к легким по сосудам малого круга венозной кровью. При спокойном дыхании объем альвеолярного воздух соответствует ФОЕ. Если в среднем остаточный объем легких равен 1200 мл, а резервный объем выдох выдоха – 1300 мл, то в легких при спокойном вдохе и выдохе содержится 1200 + 1300 = 2500 мл воздуха. Этот воздух заполняет альвеолы и нижние дыхательные пути и составляет газовую среду организма. Каждый раз при спокойном вдохе в легкие поступает 500 мл воздуха. Из них часть заполняет анатомическое мертвое пространство (около 175 мл). Оно называется так потому, что воздух, находящийся в нем, заполняет носоглотку, трахею и бронхи; он не доходит до альвеол и не обменивается с кровью. Следовательно, до альвеол доходит около 325 мл воздуха, и всякий раз ФОЕ обновляется примерно на 1/7 часть. Этот показатель называется коэффициентом легочной вентиляции (КЛВ). Воздух по дыхательным путям поступает в альвеолы – воздушные ячейки, густо оплетенные сетью кровеносных капилляров, несущих венозную кровь; она содержит мало кислорода и относительно много углекислого газа. Газообмен в легких представляет собой процесс перехода кислорода из легочных альвеол в венозную кровь, а углекислого газа – из крови в альвеолы. В результате венозная кровь, поступившая к легким по легочной артерии, превращается в артериальную и по легочным венам направляется к сердцу. Газообмен происходит путем физической диффузии газов. Движущей силой диффузии является разность концентраций. В данном случае это будет разность парциальных давлений кислорода и углекислого газа по обе стороны аэрогематического барьера: по градиенту парциальных давлений кислород из альвеолярного воздуха переходит в венозную кровь, а углекислый газ диффундирует из крови в альвеолы.
Таблица 4.1 Газовый состав атмосферного, альвеолярного и выдыхаемого воздуха
Примечание. Содержание дано в процентах, парциальное давление (в скобках) – в мм рт. ст. Парциальное давление – это давление газа, находящегося в смеси с другими газами, пропорциональное его процентному содержанию. Градиент парциального давления кислорода и углекислого газа – это сила, с которой молекулы этих газов стремятся проникнуть через альвеолярно-капиллярную мембрану в кровь. Давление газа, растворенного в жидкости, обозначают как напряжение.
Рис. 4.5. Газообмен между альвеолами и легочными капиллярами
Парциальное давление кислорода в альвеолярном воздухе (при его процентном содержании 14,2 %) равно примерно 100 мм рт. ст., а углекислого газа (при его процентном содержании 5,5 %) – 40 мм рт. ст. Напряжение кислорода в венозной крови составляет 40 мм рт. ст., а углекислого газа – 46 мм рт. ст. Кислород по градиенту парциального давления следует из области более высокого давления (из альвеол) в область низкого и попадает венозную кровь, а углекислый газ переходит из венозной крови в альвеолы. В результате от легких оттекает артериальная кровь, насыщенная кислородом и лишенная углекислого газа (рис. 4.5). Вентиляция легких все время обновляет состав альвеолярного воздуха примерно на 1/7. Благодаря вентиляции процентное содержание кислорода и углекислого газа и, стало быть, парциальное давление этих газов, поддерживается на постоянном уровне, что, в свою очередь, обеспечивает постоянство газового состава крови, а непрерывный кровоток и диффузия газов через альвеолярно-капиллярную мембрану позволяют постоянно превращать венозную кровь в артериальную (табл. 4.1).
Транспорт газов кровью Кислород от легких к тканям и углекислый газ от тканей к легких переносится кровью. В основном эти газы находятся в крови в химически связанном состоянии. Только небольшая их часть может находиться в свободном состоянии, формируя напряжение кислорода и углекислого газа в крови. В легких кислород переходит из альвеол сначала в плазму крови легочных капилляров, а затем поступает в эритроциты, где образует с гемоглобином эритроцитов обратимое соединение – оксигемоглобин: Нв + О2 = НвО2. Данная реакция является обратимой, а равновесие может сдвигаться вправо или влево в зависимости от имеющейся концентрации кислорода и ряда других факторов. Максимальное количество кислорода, которое может связать кровь при полном насыщении гемоглобина кислородом, называется кислородной емкостью крови (КЕК). Кислородная емкость крови зависит от содержания в ней гемоглобина. Каждый грамм гемоглобина способен присоединить 1,34 мл кислорода. При содержании в крови 140 г/л гемоглобина кислородная емкость крови будет 1,34 ·140 = около 190–200 мл кислорода.. Так как в тканях кислород непрерывно расходуется, его концентрация (парциальное напряжение) там ниже, чем в артериальной крови. В результате происходит распад (диссоциация) оксигемоглобина на гемоглобин и кислород. Кислород растворяется в плазме и поступает в тканевую жидкость к клеткам тканей, а гемоглобин связывается с поступившим из тканей углекислым газом, образуя также обратимое соединение карбгемоглобин. В виде карбгемоглобина транспортируется лишь 5–15 % всего углекислого газа. Основная часть углекислого газа переносится кровью в форме бикарбонатов натрия и калия (80–90 %), причем бикарбонат калия образуется в эритроцитах, а бикарбонат натрия – в плазме крови. В легких происходит распад бикарбонатов и карбгемоглобина и образовавшийся углекислый газ поступает в альвеолы и выводится из организма в окружающую среду. Одновременно из альвеол в кровь поступает кислород, который связывается с гемоглобином. Эти отношения могут быть выражены протекающими в эритроцитах обратимыми химическими реакциями: Н2О + СО2 = Н2СО3 (реакцию ускоряет в 20 000 раз фермент карбоангидраза), КНвО2 + Н2СО3 = КНв +О2 + КНСО3-.
Газообмен в тканях. Артериальная кровь с напряжением кислорода 100 мм рт. ст. и углекислого газа 40 мм рт. ст. направляется от легких в ткани, где в результате непрерывно происходящих процессов биологического окисления используется кислород и образуется углекислый газ. В клетках тканей напряжение кислорода колеблется от 0 до 20 мм рт. ст., а напряжение углекислого газа в тканевой жидкости составляет около 60 мм рт. ст. За счет разности напряжений углекислый газ диффундирует из тканевой жидкости в кровь, а кислород переходит из крови в ткани. В результате артериальная кровь превращается в венозную и по венам поступает в легкие, где цикл обмена газов повторяется (рис. 4.6).
Рис. 4.6. Газообмен между кровью и тканями Регуляция дыхания Регуляция дыхания представляет собой процесс управления первым этапом дыхания – легочной вентиляцией путем изменения глубины и частоты дыхания. Эти параметры могут регулироваться автоматически и произвольно. Фундаментом регуляции является автоматическая регуляция дыхания. Доказательством этого служит тот факт, что ритмические дыхательные движения совершаются и во сне и при бодрствовании, не требуя участия нашего сознания. Однако человек может до определенного предела произвольно изменять характер дыхания. Автоматическая регуляция дыхания в любых условиях жизнедеятельности обеспечивает состояние «эйпноэ», т. е. «хорошего» комфортного дыхания, интенсивность которого точно соответствует метаболическим потребностям организма в кислороде и выведении углекислого газа. Регуляцию дыхания обеспечивает дыхательный центр, который генерирует (задает) дыхательный ритм, т. е организует сокращение дыхательных мышц с определенной силой и частотой так, чтобы вдох плавно переходил в выдох и чтобы частота и глубина дыханий в покое и в меняющихся условиях жизнедеятельности обеспечивали метаболические потребности организма. А это, в свою очередь, возможно при поддержании постоянства газового состава крови.
Рис. 4.7. Эфферентные связи дыхательного центра продолговатого мозга.
Дыхательный центр представляет собой совокупность нейронов, которые объединены общей функцией и расположены на разных «этажах» ЦНС (рис. 4.7). Выделяют четыре «этажа»: спинной мозг, продолговатый мозг, варолиев мост, кора больших полушарий. Каждый из перечисленных отделов выполняет определенную функцию. Спинальный уровень представлен просто двигательными нейронами передних рогов спинного мозга, аксоны которых образуют соматические нервы, иннервирующие дыхательные мышцы. Это диафрагмальный и межреберные нервы. Этот компонент не имеет самостоятельного значения, так как подчиняется импульсам из вышележащих отделов. Дыхательный центр продолговатого мозга обеспечивает последовательную смену вдоха и выдоха. Он представляет собой сложное образование, состоящее из двух отделов – центра вдоха (инспираторный отдел) и центра выдоха (экспираторный отдел). Нейроны продолговатого мозга могут самопроизвольно генерировать нервные импульсы (обладают автоматизмом). В верхней части варолиевого моста находится так называемый пневмотаксический центр, который контролирует деятельность расположенных ниже дыхательных центров вдоха и выдоха и обеспечивает нормальные дыхательные движения В процессах регуляции дыхания принимают участие также вышележащие отделы ЦНС, которые обеспечивают тонкие приспособительные изменения дыхания при различных видах деятельности организма. Важная роль в регуляции дыхания принадлежит большим полушариям головного мозга и их коре, благодаря которой произвольно осуществляется приспособление дыхательных движений при разговоре, пении, спорте, трудовой деятельности человека. Таким образом, в регуляции дыхательного процесса принимают участие различные структуры мозга, обеспечивая участие дыхательной системы в поведенческих реакциях, изменение дыхания при эмоциях, участие дыхания при речи, пении и т. д., но ведущую роль в регуляции легочной вентиляции играет дыхательный центр продолговатого мозга (рис. 4.8).
Рис. 4.8. Структура дыхательного центра Основную роль в регуляции смены вдоха и выдоха и в регуляции глубины дыхания играют потоки импульсов, поступающие в дыхательный центр от хемо- и механорецепторов. Основным регулятором активности ДЦ является информация о газовом составе крови и цереброспинальной жидкости (ликвора), которая поступает соответственно от периферических (артериальных) и центральных (мозговых) хеморецепторов. Периферические хеморецепторы находятся в каротидном и аортальном тельцах, а центральные – в продолговатом мозге, неподалеку от самого ДЦ. Они реагируют на повышение напряжения углекислого газа (СО2) и повышение концентрации водородных ионов, на понижение напряжения кислорода, но главным стимулом, управляющим дыханием, является содержание СО2 в крови и во внеклеточной жидкости мозга. Центральные хеморецепторы очень чувствительны к изменениям рН и напряжения СО2. Импульсы от нейронов дыхательного центра передаются к мотонейронам спинного мозга, управляющим наружными межреберными мышцами и диафрагмой (рис. 4.9).
Рис. 4.9. Механизм вдоха После вдоха автоматически происходит выдох. Для развития выдоха необходимо снижение активности центра вдоха и активация центра выдоха. Это происходит потому, что растяжение легочных альвеол во время вдоха вызывает раздражение рецепторов. В этом принимают участие несколько групп механорецепторов, особенно большая роль принадлежит рецепторам растяжения легких, реагирующим на растяжение стенок конечных отделов воздухоносных путей при вдохе. Возбуждение этих рецепторов возрастает при увеличении объема легких при вдохе, импульсы от них по ветвям блуждающих нервов направляются центру выдоха (экспираторным нейронам) и вызывают инспираторно-тормозящий рефлекс: вдох обрывается, и происходит выдох. Это известный рефлекс Геринга–Брейера: вдох порождает выдох. При двусторонней перерезке блуждающих нервов не происходит своевременной смены фаз дыхания: вдох становится более продолжительным (рис. 4.10).
Рис. 4.10. Изменение дыхания после двусторонней ваготомии
Схема нейронной организации дыхательного цикла представлена на рис. 4.11.
Рис. 4.11. Структура дыхательного цикла
Инспираторные нейроны получают возбуждающий импульс от центральных и периферических хеморецепторов и передают команду мотонейронам спинного мозга и через них – мышцам вдоха: происходит активный вдох. Одновременно активируются экспираторные нейроны, которые через тормозные нейроны затормаживают инспираторные нейроны, срабатывает механизм выключения вдоха, и пассивно происходит выдох. Дыхательный центр не только обеспечивает ритмическое чередование вдоха и выдоха, но и способен изменять глубину и частоту дыхательных движений, приспосабливая тем самым легочную вентиляцию к текущим потребностям организма. В осуществлении этой функции важная роль принадлежит пневмотаксическому центру, расположенному в варолиевом мосту. Активность дыхательного центра зависит от потребности организма в кислороде. В покое она невелика и увеличивается при физической работе или эмоциональном возбуждении. Чем больше в организме накапливается углекислого газа, тем активней он выводится. Таким образом, в регуляции дыхания участвуют различные как нервные, так и гуморальные механизмы, которые автоматически подбирают глубину и частоту дыхания, создавая оптимальные условия для газообмена в любых условиях. Глава 5. Пищеварение Пищеварение в полости рта В ротовой полости происходят следующие процессы: – апробация пищи. Все вещества, попадающие в ротовую полость, делятся на приемлемые (подвергаются дальнейшей переработке) и отвергаемые (выводятся вместе со слюной); – механическая и химическая обработка пищи (измельчение пищи при жевании, химическая обработка слюной, формирование пищевого комка, глотание): – возникновение специфических вкусовых ощущений; – активация деятельности других отделов ЖКТ (рефлекторно с рецепторов ротовой полости). Слюна – это секрет трех пар крупных слюнных желез (околоушных, подчелюстных, подъязычных) и множества мелких желез, локализованных на поверхности языка, слизистой оболочке неба и щек. В слюне человека содержатся: α-амилаза, мальтаза, муцин, гликопротеины, мукополисахариды, лизоцим, иммуноглобулины, антигены, совпадающие с антигенами групп крови, ионы: Na+, K+, Ca2+, CL-, J-, F-, HCO3-, H2PO4- и др. За сутки выделяется 0,5–2,0 л слюны. Муцин склеивает частицы пищи в пищевой комок, комок покрывается слизью и в таком виде легче проглатывается. Лизоцим оказывает бактерицидное действие. Ионы создают питательную среду для зубов, частично санируют полость рта и осуществляют буферные функции слюны. α-амилаза гидролизует гликоген и крахмал, превращая их в мальтозу и мальтотриозу. Мальтаза расщепляет мальтозу и сахарозу до глюкозы, которой в ротовой полости образуется небольшое количество. Регуляция выделения слюны осуществляется рефлекторно, при поступлении пищи в ротовую полость и раздражении вкусовых рецепторов языка и рецепторов слизистой. Рефлекторная реакция, возникающая в ответ на раздражение рецепторов, является безусловной, врожденной. Центр этого рефлекса расположен в продолговатом мозге. В процессе жизни вырабатываются и условные рефлексы. Так, в ответ на разговоры о еде, вид и запах знакомой пищи или в привычное для приема пищи время также выделяется слюна. Центры таких рефлексов замыкаются в коре больших полушарий мозга.
Пищеварение в желудке Желудок представляет собой расширенную часть пищеварительного тракта, которая находится между пищеводом и двенадцатиперстной кишкой (рис. 5.2). В желудке совмещаются функции пищеварительного органа и пищевого депо.

Рис. 5.2. Основные отделы желудка: 1 – пищевод; 2 – вход; 3 – малая кривизна; 4 – дно желудка; 5 – большая кривизна; 6 – пилорический отдел В желудке происходит дальнейший процесс переваривания пищи под действием желудочного сока. Кроме того, желудок в системе пищеварительного тракта выполняет функцию депо, где принятая пища находится 4–10 ч. В слизистой стенке желудка находятся многочисленные трубчатые железы, вырабатывающие компоненты желудочного сока. В состав желез входят: – главные клетки – образуют пепсиногены (неактивную форму протеолитических ферментов). Наибольшее их скопление имеется в области тела желудка, особенно в области малой кривизны; – мукоидные (добавочные клетки) – образуют муцин (слизь); – париетальные (обкладочные) клетки – образуют соляную кислоту (НСl) и внутренний фактор Кастла. Эти клетки сконцентрированы в области дна и тела желудка, в пилорической части желудка их нет. Фундальные железы вырабатывают желудочный сок, который имеет ведущее значение в желудочном пищеварении. Желудочный сок – это прозрачная бесцветная жидкость с кислой реакцией (на высоте пищеварения рН равен 1,0–1,5). За сутки выделяется 2,0–2,5 л желудочного сока, в состав которого входят: 99,4 % воды, 0,6 % сухого остатка, неорганические вещества (Nа+, Сl-,К+, Н+, СО3-,РО4-), органические вещества (белки, небелковые вещества). Основным неорганическим компонентом желудочного сока является соляная (хлористоводородная) кислота. Химическая обработка пищи в желудке включает начальные стадии гидролиза, главным образом белков, в кислой среде под действием протеолитических ферментов. Начавшийся гидролиз углеводов в полости рта может продолжаться в желудке до тех пор, пока внутри пищевой массы сохраняется щелочная или слабокислая среда. Желудочный сок обладает высокой протеолитической активностью в широком диапозоне рН (1,5–2,0 и 3,2–3,5). Протеолитические ферменты (пепсин, гастриксин, реннин) в условиях кислой среды расщепляеют сложные белковые молекулы до полипептидов, они секретируются в неактивном виде и активируются соляной кислотой. Поскольку рН желудочного содержимого зависит от количества секретируемой соляной кислоты и слизи, буферных свойств пищи, в желудочном соке имеется набор ферментов (пепсинов) максимально активных при различных значениях рН. Муцин (слизь) вырабатывается добавочными клетками желудочных желез, взаимодействует в желудке с бикарбонатами и образует слизистый слой, выстилающий желудок изнутри. Защитная функция выражается в том, что слизь предохраняет желудок от механического, химического воздействия и самопереваривания. Внутренний фактор Кастла (гастромукопротеид) – обеспечивает связывание витамина В12. В этом виде витамин В12 легко всасывается в кровь и предохраняется от разрушения. Этот витамин необходим для нормального кроветворения, поэтому внутренний фактор Кастла называют антианемическим фактором. Небелковые вещества – продукты расщепления белка (мочевина, мочевая кислота), подлежащие выведению из организма. Соляная кислота секретируется обкладочными клетками. Кислотность содержимого желудка натощак низкая (рН = 6,0 и выше), но при пищеварении рН желудочного сока достигает 1,0–1,5. Соляная кислота активирует ферменты желудочного сока, в частности пепсины, вызывает денатурацию белков, облегчая действие протеолитических ферментов, создает оптимальное значение рН для действия протеолитических ферментов, оказывает бактерицидное действие, створаживает молоко, превращая белок молока казеиноген в казеин, стимулирует секреторную и моторную деятельность желудка, способствует эвакуации содержимого желудка в двенадцатиперстную кишку, стимулирует секрецию гормона секретина, воздействуя на S-клетки проксимального отдела тонкого кишечника. Таким образом, в желудке в кислой среде осуществляется начальный гидролиз белков, в результате образуются пептиды различной сложности и небольшое количество аминокислот. Питание Оптимальное питание должно способствовать сохранению здоровья и обеспечению максимальной продолжительности жизни, поддержанию хорошего самочувствия, преодолению трудных для организма ситуаций. У взрослых людей питание обеспечивает стабильную массу тела, у детей — нормальный рост и развитие. Основные физиологические требования к рациональному питанию условно можно разделить на количественные и качественные. Так, пища должна обеспечивать достаточное поступление в организм энергии с учетом возраста, пола, физиологического состояния и вида труда, т. е. с учетом затрат данного человека. Пищевой рацион должен быть адекватно распределен в течение суток. Общая энергоемкость рациона и характер питательных веществ должны соответствовать потребностям организма. Важнейшим параметром, определяющим уровень энерготрат и калорийность пищевого рациона человека, является характер его труда. В табл.5.3 представлены средние нормативы питания для человека с массой тела около 70 кг. Таблица 5.3 Характеристика гормонов
Гормоны передней доли гипофиза. Гипофиз занимает особое положение в системе эндокринных желез. Его называют центральной железой, так как за счет его тропных гормонов регулируется деятельность других эндокринных желез. Гипофиз состоит из аденогипофиза (передней и средней долей) и нейрогипофиза (задней доли). Гормоны передней доли гипофиза делятся на две группы. К первой группе относят соматотропин и пролактин. Ко второй группе гормонов относят тропные гормоны, т. е. те, которые оказывают влияние на другие железы внутренней секреции. Гормон роста (соматотропин) принимает участие в регуляции роста, усиливая образование белка. Наиболее выражено его влияние на рост эпифизарных хрящей конечностей, за счет которых идет рост костей в длину. Нарушение соматотропной функции гипофиза приводит к различным изменениям в росте и развитии организма человека. Если имеется гиперфункция в детском возрасте, то развивается гигантизм, при гипофункции — карликовость. Гиперфункция у взрослого человека не влияет на рост в целом, но увеличиваются размеры тех частей тела, которые еще способны расти: развивается акромегалия. Пролактин способствует образованию молока в альвеолах, но только после предварительного воздействия на них женских половых гормонов (прогестерона и эстрогена). После родов увеличивается синтез пролактина и наступает лактация. Акт сосания через нервно-рефлекторный механизм стимулирует выброс пролактина. Пролактин обладает лютеотропным действием, способствует продолжительному функционированию желтого тела и выработке им прогестерона. Тропные гормоны 1) тиреотропный гормон (тиреотропин). Избирательно действует на щитовидную железу, повышает ее функцию. При сниженной выработке тиреотропина происходит атрофия щитовидной железы, при гиперпродукции — разрастание, наступают гистологические изменения, которые указывают на повышение ее активности. 2) адренокортикотропный гормон (кортикотропин). Стимулирует выработку глюкокортикоидов корой надпочечников, более слабо влияет на продукцию других гормонов этих желез. Выделяют также и вненадпочечниковые эффекты. Под влиянием кортикотропина уменьшаются размер и масса лимфоидных органов. Продукция этого гормона усиливается во время стресса. Секреция кортикотропина подвержена суточным колебаниям: в вечерние часы его содержание выше, чем утром; 3) гонадотропные гормоны (фоллитропин и лютропин). Присутствуют как у женщин, так и у мужчин. Фоллитропин (фолликулостимулирующий гормон), стимулирует рост и развитие фолликула в яичнике. Он незначительно влияет на выработку эстрогенов у женщин, у мужчин под его влиянием происходит образование сперматозоидов. Лютеинизирующий гормон (лютропин) стимулирует рост и овуляцию фолликула с образованием желтого тела. Он стимулирует образование женских половых гормонов — эстрогенов. Лютропин способствует выработке андрогенов у мужчин. Гормоны средней и задней долей гипофиза. В средней доле гипофиза вырабатывается гормон меланотропин (интермедин), который оказывает влияние на пигментный обмен. Задняя доля гипофиза тесно связана с супраоптическим и паравентрикулярным ядрами гипоталамуса. Нервные клетки этих ядер вырабатывают нейросекрет, который транспортируется в заднюю долю гипофиза по аксонам гипоталамических нейронов, постепенно созревая по мере продвижения с током аксоплазмы. В нервных клетках паравентрикулярного ядра образуется окситоцин, в нейронах супраоптического ядра — вазопрессин. Вазопрессин усиливает сокращение гладких мышц сосудов (тонус артериол повышается с последующим повышением артериального давления) и обратное всасывание воды в собирательных трубочках почек, следовательно, снижает объем выделяющейся мочи и сохраняет воду в организме (антидиуретическое действие). Уменьшение образования вазопрессина является причиной возникновения несахарного диабета (несахарного мочеизнурения). Окситоцин избирательно действует на гладкую мускулатуру матки, усиливает ее сокращение. Этот эффект особенно выражен, если матка находится под влиянием половых гормонов. Кроме того, окситоцин усиливает сокращение гладкомышечных клеток выводных протоков молочных желез, за счет чего стимулирует именно выделение молока, а не его образование. Акт сосания рефлекторно способствует выделению окситоцина. Гипоталамическая регуляция образования гормонов гипофиза. Секреция аденогипофизарных гормонов находится под регулирующим влиянием гипоталамуса – главного регулятора вегетативных функций в организме. Нейроны гипоталамуса вырабатывают нейросекреты (это медиаторы, которые выделяются в кровеносные сосуды, кровоснабжающие гипофиз). Продукты нейросекреции, которые стимулируют секрецию гормонов передней долеи гипофиза, называются либеринами, а тормозящие их образование — статинами. Поступление этих веществ в переднюю долю гипофиза происходит по кровеносным сосудам. Существует обратная связь между гипоталамусом и тропными гормонами передней доли гипофиза. Повышение концентрации в крови гормона гипофиза приводит к торможению соответствующего либерина в гипоталамусе. Гормоны щитовидной железы. Щитовидная железа расположена с обеих сторон трахеи ниже щитовидного хряща, имеет дольчатое строение. Гормоны щитовидной железы делятся на две группы: – йодированные — тироксин (Т4), трийодтиронин (Т3); – тиреокальцитонин (кальцитонин). Йодированные гормоны образуются в фолликулах железистой ткани. Основной активный йодсодержащий гормон щитовидной железы — Т4. Соотношение Т4 и Т3 составляет 4:1. Оба гормона находятся в крови в неактивном состоянии, они связаны с белками глобулиновой фракции и альбумином плазмы крови. Тироксин легче связывается с белками крови, поэтому быстрее проникает в клетку и имеет большую биологическую активность. Роль йодированных гормонов: – влияют на поглощение кислорода клетками и митохондриями, увеличивая темп окислительных процессов, выработку тепла в организме; – усиливают энергетический обмен; – стимулируют синтеза белка, следовательно, рост и развитие скелета, половых желез; – влияют на возбудимость ЦНС, частоту сердечных сокращений, дыхательных движений, повышают потоотделение; – включаются в процесс выработки условных рефлексов, дифференцировок, процессов торможения; – усиливают катаболизм белков, жиров, углеводов; – снижают способность крови к свертыванию (уменьшают образование факторов свертывания крови), повышают ее фибринолитическую активность. Тироксин угнетает способность тромбоцитов к адгезии и агрегации. Нарушение функции щитовидной железы может быть выражено в форме повышения или понижения ее гормонообразующей функции. Недостаточность выработки гормона (гипотериоз), появляющийся в детском возрасте, ведет к развитию кретинизма (задерживаются рост, половое развитие, развитие психики, наблюдается нарушение пропорций тела). Гопотиреоз у взрослых ведет к развитию микседемы, которая характеризуется резким расстройством процессов возбуждения и торможения в ЦНС, психической заторможенностью, снижением интеллекта, вялостью, сонливостью, нарушением половых функций, угнетением всех видов обмена веществ. При повышении активности щитовидной железы (гипертиреозе) возникает заболевание тиреотоксикоз. Характерные признаки: увеличение числа сердечных сокращений, повышение обмена веществ, температуры тела, увеличение потребления пищи, потеря массы тела, пучеглазие, повышенная возбудимость и раздражительность, усилен тонус симпатического отдела вегетативной нервной системы, мышечная дрожь и слабость, в некоторых случаях увеличение размеров щитовидной железы. Недостаток в воде йода приводит к снижению функции щитовидной железы со значительным разрастанием ее ткани и образованием зоба. Это действие компенсаторного механизма в ответ на снижение в крови содержания йодированных гормонов. Регуляция образования йодсодержащих гормонов осуществляется: 1) передней долей гипофиза (образованием тиреотропина); 2) вегетативной нервной системой (симпатическая — повышает продукцию гормона, парасимпатическая — снижает); 3) гипоталамусом. Тиреолиберин, образуемый гипоталамусом, стимулирует выработку тиреотропин гипофизом, который в свою очередь стимулирует продукцию гормонов. Влияние осуществляется по типу обратных связей; 4) ретикулярной формацией ствола мозга. Возбуждение ее структур повышает выработку гормонов; 5) корой головного мозга. Декортикация первоначально активизирует функцию железы, но значительно снижает ее с течением времени. Гормоны поджелудочной железы. Гормонопродуцирующей тканью поджелудочной железы служат островки Лангерганса, преимущественно расположенные в хвосте железы. Бета-клетки островков вырабатывают инсулин, альфа-клетки — глюкагон. Инсулин снижает концентрацию сахара в крови, потому что повышает проницаемость клеточных мембран для глюкозы. Попадая в клетки, глюкоза фосфориллируется и поступает в клеточный метаболизм. Инсулин способствует превращению глюкозы в гликоген в печени и мышцах. Основным фактором регуляции секреции инсулина служит содержание глюкозы в крови: гипергликемия приводит к увеличению поступления инсулина в кровь, и наоборот. Вегетативная нервная система регулирует выработку инсулина посредством блуждающего и симпатического нервов. Блуждающий нерв стимулирует выделение инсулина, а симпатический –тормозит. Глюкагон повышает концентрацию глюкозы в крови в ответ на ее снижение, потому что способствует расщеплению гликогена в печени до глюкозы. Глюкагон по действию на обмен углеводов является антагонистом инсулина. На образование глюкагона в альфа-клетках оказывает влияние уровень глюкозы в крови. При повышении содержания глюкозы в крови происходит торможение секреции глюкагона, при понижении — увеличение. При нарушении функции поджелудочной железы уменьшается секреция инсулина, что приводит к развитию caxapного диабета, основными симптомами которого являются гипергликемия, глюкозурия, полиурия (до 10 л в сутки), повышенный аппетит, повышенная жажда. Увеличение концентрации сахара в крови у больных сахарным диабетом является результатом потери способности печени синтезировать гликоген из глюкозы, а клеток — утилизировать глюкозу. У таких больных в мышцах также замедляется процесс образования и отложения гликогена, нарушаются все виды обмена. Гормоны надпочечников. Надпочечники — парные железы, расположенные над верхними полюсами почек. В корковом веществе надпочечников вырабатываются глюкокортикоиды, минералокортикоиды и половые гормоны (андрогены, эстрогены, прогестерон). Глюкокортикоиды (кортизон, гидрокортизон, кортикостерон) – гормоны, по химическому строению являющиеся стероидами, образуются из холестерина, для их синтеза необходима аскорбиновая кислота. Они влияют на обмен углеводов, белков и жиров, усиливают процесс образования глюкозы из белков, повышают отложение гликогена в печени, по своему действию являются антагонистами инсулина. Глюкокортикоиды оказывают катаболическое влияние на белковый обмен, вызывают распад тканевого белка и задерживают включение аминокислот в белки. Эти гормоны обладают противовоспалительным действием, поскольку снижают проницаемость стенок сосудов и подавляют синтез антител, тормозят реакцию взаимодействия антитела с антигеном. Они оказывают выраженное влияние на кроветворные органы: – увеличивают количество эритроцитов за счет стимуляции красного костного мозга; – приводят к обратному развитию вилочковой железы и лимфоидной ткани, что сопровождается уменьшением количества лимфоцитов. Важную роль в образовании глюкокортикоидов играет кортикотропин, вырабатываемый передней долей гипофиза. Это влияние осуществляется по принципу прямых и обратных связей: кортикотропин повышает продукцию глюкокортикоидов, а избыточное их содержание в крови приводит к торможению выработки кортикотропина в гипофизе. В ядрах переднего отдела гипоталамуса синтезируется нейросекрет кортиколиберин, который стимулирует образование кортикотропина в передней доле гипофиза, а он, в свою очередь, стимулирует образование глюкокортикоидов. Функциональное отношение «гипоталамус — передняя доля гипофиза — кора на почечников» находится в единой гипоталамо-гипофизарно-надпочечниковой системе, которая играет ведущую роль в адаптационных реакциях организма. Минералокортикоиды (альдостерон и дезоксикортикостерон) образуются в корковом веществе надпочечников, они принимают участие в регуляции минерального обмена. Они усиливают обратное всасывание ионов Na+ в почечных канальцах и уменьшают обратное всасывание ионов К+, что приводит к повышению концентрации ионов Na+ в крови и тканевой жидкости и увеличению в них осмотического давления. Это вызывает задержку воды в организме и повышение артериального давления. Минералокортикоиды способствуют проявлению воспалительных реакций за счет повышения проницаемости капилляров и серозных оболочек Синтез минералокортикоидов контролируется концентрацией ионов Na+ и К+ в крови. Повышение концентрации ионов Na+ приводит к торможению секреции альдостерона, что увеличивает выделение Na+ с мочой. Половые гормоны (андрогены, эстрогены, прогестерон) образуются в сетчатой зоне коры надпочечников. Они имеют большое значение в развитии половых признаков в детском возрасте, когда внутрисекреторная функция половых желез незначительна. Гормоны мозгового слоя надпочечников. Мозговой слой надпочечников вырабатывает два гормона – адреналин и норадреналин. Адреналин поступает в кровь при различных состояниях, сопровождающихся возбуждением симпатической нервной системы. В ситуациях, требующих повышения активности функциональных систем организма (кровопотеря, стресс, мышечная деятельность), происходит увеличение его образования и выделения в кровь. Адреналин влияет на углеводный обмен. Ускоряя расщепление гликогена в печени и мышцах, вызывает повышение уровня глюкозы в крови. Расслабляет гладкую мускулатуру бронхиол, тем самым облегчая дыхание. Повышает возбудимость и сократимость сердечной мышцы, повышает тонус кровеносных сосудов, но расширяет сосуды сердца, легких и головного мозга. Угнетает моторику желудка и кишечника и повышает тонус сфинктеров, усиливает работоспособность скелетных мышц. Норадреналин выполняет функцию медиатора симпатической нервной системы, он принимает участие в передаче возбуждения в нейронах ЦНС. Секреторная активность мозгового слоя надпочечников регулируется гипоталамусом, в задней группе его ядер расположены высшие вегетативные центры симпатического отдела. Их активация ведет к увеличению выброса адреналина в кровь. Выделение адреналина может происходить рефлекторно при переохлаждении, мышечной работе и т. д. При гипогликемии рефлекторно повышается выделение адреналина в кровь. Половые железы (семенники у мужчин, яичники у женщин) относятся к железам со смешанной функцией. Их внутрисекреторная функция проявляется в образовании и секреции половых гормонов, которые непосредственно поступают в кровь. Мужские половые гормоны — андрогены – образуются в интерстициальных клетках семенников. Основным гормоном семенников является тестостерон. Андрогены стимулируют рост и развитие полового аппарата, вторичных мужских половых признаков и появление половых рефлексов. Они контролируют процесс созревания сперматозоидов, способствуют сохранению их двигательной активности, проявлению полового инстинкта и половых поведенческих реакций, увеличивают образование белка, особенно в мышцах, уменьшают содержание жира в организме. При недостаточном количестве андрогенов в организме нарушаются процессы торможения в коре больших полушарий. Женские половые гормоны – эстрогены – образуются в растущих фолликулах яичника. Синтез эстрогенов осуществляется оболочкой фолликула, прогестерона — желтым телом яичника, которое развивается на месте лопнувшего фолликула. Эстрогены стимулируют рост матки, влагалища, труб, вызывают разрастание эндометрия, способствуют развитию вторичных женских половых признаков, проявлению половых рефлексов, усиливают сократительную способность матки, повышают ее чувствительность к окситоцину, стимулируют рост и развитие молочных желез. Прогестерон обеспечивает процесс нормального протекания беременности, способствует разрастанию слизистой эндометрия, имплантации оплодотворенной яйцеклетки в эндометрий, тормозит сократительную способность матки, уменьшает ее чувствительность к окситоцину, тормозит созревание и овуляцию фолликула за счет угнетения образования лютропина гипофиза. Образование половых гормонов находится под влиянием гонадотропных гормонов гипофиза и пролактина. У мужчин гонадотропный гормон способствует созреванию сперматозоидов, у женщин — росту и развитию фолликула. Лютропин определяет выработку женских и мужских половых гормонов, овуляцию и образование желтого тела. Пролактин стимулирует выработку прогестерона. Мелатонин тормозит деятельность половых желез. В регуляции активности половых желез принимает участие нервная система за счет образования в гипофизе гонадотропных гормонов.
Менструальный цикл Менструальный цикл включает три периода. 1. Предовуляционный (с первого по четырнадцатый день). Яичники находятся под влиянием фоллитропина, в них усиленно образуются эстрогены, которые стимулируют рост матки, разрастание слизистой оболочки и ее желез, ускоряют созревание яйцеклетки. К концу этой фазы поверхность фолликула разрывается и из него выходит яйцеклетка — происходит овуляция. 2. Овуляция (на четырнадцатый день). Начинается с выхода яйцеклетки в маточную трубу. Сокращение гладкой мускулатуры трубы способствует продвижению ее к матке, здесь может произойти оплодотворение. Оплодотворенное яйцо, попадая в матку, прикрепляется к ее слизистой, и наступает беременность. Если оплодотворение не произошло, наступает послеовуляционный период. На месте фолликула развивается желтое тело, оно вырабатывает прогестерон. 3. Послеовуляционный период. Неоплодотворенная яйцеклетка, достигая матки, погибает. Прогестерон уменьшает образование фоллитропина и снижает продукцию эстрогенов. Изменения, возникшие в половых органах женщины, исчезают. Параллельно уменьшается образование лютропина, что ведет к атрофии желтого тела. За счет уменьшения эстрогенов матка сокращается, происходит отторжение слизистой оболочки. В дальнейшем происходит ее регенерация. Послеовуляционный период продолжается с 15-го по 28-й день цикла.
Память Память — способность организма приобретать, сохранять и воспроизводить в сознании информацию и навыки. Память обеспечивает человеку возможность активной, созидательной деятельности. Стирание следов памяти также важно, так как в противном случае могла бы возникнуть информационная перегрузка мозга. За 60 лет человек воспринимает 1013–1016 бит информации, а использует 5–10 % от накопленного. Память различают: – по виду связи информации (логически-смысловая и механическая); – по способу восприятия информации (зрительная, слуховая, моторная); – по длительности хранения информации (сенсорная, кратковременная, промежуточная и долговременная). Сенсорная память. Этот вид памяти представляет собой просто сенсорный слепок окружающего мира, он является первым и необходимым этапом всякого запоминания и, по сути дела, является как бы предпамятью. Длительность хранения 0,5 с. Кратковременная память обеспечивает удержание и воспроизведение оперативной информации. Ее характерная особенность – непродолжительность. Хранение информации в кратковременной памяти длится секунды, минуты. Единой теории по поводу механизмов кратковременной памяти до сих пор не существует. Запоминание любой информации начинается с развития элементарных процессов в нейронных комплексах головного мозга: выделения различных медиаторов в синапсах, возникновения постсинаптических потенциалов. Одной из первых возникла гипотеза о реверберации (циркуляции) возбуждения по замкнутым цепочкам нейронов. Считается, что в замкнутых нейронных цепочках циркуляция длится в течение минут, сохраняя информацию в виде кода последовательности импульсов, передающихся от нейрона к нейрону. Промежуточная память — это процесс перевода кратковременной памяти в долговременную (консолидация памяти). Следы кратковременной памяти становятся устойчивыми через 3–4 ч, но еще могут быть стерты экстремальными воздействиями (наркоз и др.). На данном этапе электрофизиологические процессы с помощью вторых посредников запускаютбиохимические реакции. Поэтому данный период переработки поступившей информации и запоминания ее следует назвать нейрохимической памятью. Долговременная память. Ее основой являются структурные изменения в нейронах (синтез белка); часы–дни–месяцы–годы. Объем долговременной памяти практически безграничен. Долговременная память устойчива к мозговым нарушениям. Уже за 1 ч наблюдается хорошая консолидация памяти, причем информация запоминается лучше, если она привлекла внимание, — мозг сам ее повторяет и лучше усваивает. В становлении долговременной памяти важную роль играют синаптические процессы. Эмоции Эмоции (от лат. emoveo, emovere — потрясать, волновать) — реакции организма на внешние и внутренние раздражители, сопровождаемые ярко выраженными субъективными переживаниями. В последние годы эмоциональные переживания стали предметом углубленного анализа поскольку установлена связь между длительными отрицательными эмоциональными состояниями и многими заболеваниями. Физиологические проявления эмоций. Состояние эмоционального переживания сопровождается значительными изменениями функций почти всех органов и систем. Внутренние проявления эмоций связаны с вегетативными реакциями, внешние — с поведенческими, при этом участвует скелетная мускулатура. Вегетативные реакции сопровождаются изменениями дыхания, сердечной деятельности, потоотделения, движений кишечника и др. Внешние признаки характеризуются изменением окраски кожи (покраснение при смущении, побледнение при страхе), выразительными движениями (мимикой — сокращениями мышц лица и пантомимикой — движениями тела), голосом человека (по тембру голоса можно понять настроение человека). Внешние проявления эмоции человек может произвольно затормозить — они являются управляемыми. Внутренние проявления эмоций, зависящие от вегетативных реакций, не устраняемы и относятся к неуправляемым. Для врача эмоциональное состояние больного несет важную информацию о его здоровье, отношении к врачу, к назначаемому лечению. Механизмы положительных и отрицательных эмоций. Синтез и секреция дофамина и норадреналина играют существенную роль в возникновении положительных эмоций. При недостатке норадреналина развиваются депрессивные состояния с преобладанием тоски. Снижение уровня дофамина может вызвать депрессию с выраженным чувством тревоги. Увеличение соотношения норадреналин/серотонин ведет к повышению агрессивности. В возникновении положительных эмоций важная роль, очевидно, принадлежит также эндорфинам — эндогенным морфиноподобным веществам, вырабатываемым особыми клетками ЦНС. Наиболее убедительные данные о нейроанатомии эмоций получены в отношении тех мозговых структур, которые определяют знак эмоций. Американский невропатолог Дж. Пейпец выдвинул гипотезу о существовании единой системы, объединяющей ряд структур мозга и образующей мозговой субстрат для эмоций. Эта система представляет собой замкнутую цепь: гипоталамус — передневентральное ядро таламуса — поясная извилина — гиппокамп — мамиллярные ядра гипоталамуса, которая получила название круга Пейпеца, или лимбической системы мозга. Из всех структур круга Пейпеца наиболее тесную связь с эмоциональным поведением обнаруживают гипоталамус и поясная извилина. Кроме того, оказалось, что и другие структуры мозга, не входящие в состав круга Пейпеца, обладают сильным влиянием на эмоциональное поведение. Среди них особую роль играют лобная и височная кора головного мозга, а также миндалина. Полное развертывание эмоциональных реакций, их включение в поведенческие акты обеспечивает кора большого мозга. Поражение лобных долей приводит к глубоким нарушениям эмоциональной сферы человека. Преимущественно развиваются два синдрома: эмоциональная тупость и растормаживание примитивных эмоций и влечений. При этом в первую очередь страдают высшие эмоции, связанные с деятельностью, социальными отношениями, творчеством. Интересно, что «правополушарные» люди имеют сдвиг эмоциональной сферы в отрицательную сторону, а «левополушарные» — в положительную. Больные с поражением правого полушария эмоционально благодушны, а с поражением левого — тревожны, озабочены. Таким образом, на возникновение тех или иных эмоций влияют как подкорковые образования, так и кора головного мозга. Глава 9. Анализаторы Анализаторы ализаторы, или сенсорные системы, – это комплексы структур нервной системы, осуществляющие восприятие и анализ информации о явлениях, происходящих в окружающей организм среде и (или) внутри самого организма и формирующие специфические для данного анализатора ощущения. Термин «анализаторы» ввел в физиологическую науку И.П. Павлов. В составе анализаторов выделяют три отдела: периферический (рецепторный) отдел, проводниковую часть и центральный (корковый) отдел. Периферический отдел представлен специализированными рецепторными клетками, которые воспринимают строго определенный вид раздражителя. Проводниковую часть составляют афферентные нервные волокна и различные ядра ствола мозга, зрительных бугров, их связи друг с другом и проекции к соответствующим областям коры мозга. Центральный отдел включает области коры головного мозга, к которым поступают нервные импульсы, идущие от рецепторных отделов, – так называемые проекционные области анализаторов. Анализаторы выполняют следующие функции; 1) обнаружение и различение сигналов. Специализированные клетки или нейроны получают информацию из окружающей среды в виде химических, световых, звуковых, механических и других раздражителей – сигналов, воспринимаемых рецепторами; 2) преобразование и кодирование сигналов. Рецепторы преобразуют сигналы внешней среды в сигналы, воспринимаемые мозгом, – в нервные импульсы; 3) передача сигналов, сопоставление информации от различных анализаторов, формирование пространственно временных отношений, активация коры больших полушарий при переключении в таламусе; 4) анализ, классификация и опознание сигнала, формирование сенсорного образа, осознание сенсорного образа. Рецепторы — это специализированные образования (клетки и свободные и инкапсулированные нервные окончания), преобразующие энергию раздражителя в электрический потенциал. В основу одной из принятых классификаций рецепторов положен вид раздражителей. По этому принципу все рецепторы обычно делятся на пять групп: 1) фоторецепторы (воспринимают свет); 2) механорецепторы (воспринимают механическое воздействие – прикосновение, давление, звуковые волны); 3) терморецепторы, чувствительные к температуре (холоду и теплу); 4) хеморецепторы – воспринимают химические вещества внешней и внутренней среды (к ним относятся рецепторы, воспринимающие напряжение кислорода и углекислого газа, концентрации глюкозы в крови, а также вкусовые и обонятельные); 5) ноцицепторы (болевые) – реагируют на повреждения ткани, сопровождающиеся болью. В зависимости от того, где находится воспринимаемый ими раздражитель, рецепторы также можно подразделить на четыре группы: 1) дистантные экстерорецепторы, реагирующие на отдаленные от рецептора раздражители (зрительные, обонятельные и слуховые); 2) контактные экстерорецепторы, воспринимающие раздражения с поверхности тела (рецепторы прикосновения, давления, температурные и вкусовые); 3) интероцепторы, воспринимающие изменения во внутренних органах (растяжение, давление) и уровень химических веществ в крови; 4) проприоцепторы, сигнализирующие о положении тела в пространстве (о расположении суставов, длине мышц). Кроме того, по механизму приема сигнала сенсорные системы можно поделить на две группы: первично- и вторичночувствующие. В первичночувствующих системах первой клеткой, которая воспринимает сигнал, является нейрон, в котором и возникает нервный импульс, передающийся в кору больших полушарий. К первичночувствующим системам относятся обонятельная и тактильная системы. Во вторичночувствующих системах сигнал воспринимается специализированной рецепторной клеткой, которая может реагировать только на строго определенный сигнал – электромагнитные волны, звуковые волны, химические вещества. Клетки, как правило, снабжены большим количеством ворсинок, которые многократно увеличивают площадь их поверхности, взаимодействующей с раздражителем. В этих клетках в ответ на воздействие раздражителя определенной модальности изменяется проницаемость клеточной мембраны для ионов, что приводит к изменению мембранного потенциала и выделению медиатора. Медиатор взаимодействует с первым чувствительным нейроном, вызывая, в свою очередь, его возбуждение, которое и передается в кору больших полушарий. Вторичночувствующими являются зрительная, слуховая, вкусовая сенсорные системы. Средняя сосудистая оболочка 4 – радужная оболочка, или радужка, 5 – ресничная мышца (меняет кривизну хрусталика), 6 – сосудистая оболочка Внутренняя оболочка (сетчатка) 7 – сетчатка, 8 – желтое пятно (место наилучшего видения глаза), 9 – слепое пятно (место выхода зрительного нерва, не воспринимающее лучи света) Слуховая сенсорная система Периферическая часть слухового анализатора локализована во внутреннм ухе, расположенном в улитке. Прежде чем звуковая волна достигнет находящихся там волосковых клеток, она должна пройти через структуры наружнго и среднего уха. Ушная раковина преобразует поступающий извне акустический сигнал, отражая и направляя в наружный слуховой проход звуковые волны. В наружном слуховом проходе, выступающем в роли резонатора, изменяются свойства акустического сигнала — увеличивается интенсивность тонов частотой 2–3 кГц. Наиболее значительное преобразование звуков происходит в среднем ухе. Здесь вследствие разницы площади барабанной перепонки и основания стремени, а также благодаря рычажному механизму слуховых косточек и работе мышц барабанной полости значительно нарастает интенсивность проводимого звука при уменьшении его амплитуды. Система среднего уха обеспечивает переход колебаний барабанной перепонки на жидкие среды внутреннего уха — перилимфу и эндолимфу. При этом нивелируется в той или иной степени (в зависимости от частоты звука) акустическое сопротивление воздуха, в котором распространяется звуковая волна, и жидкостей внутреннего уха. Внутреннее ухо. Улитка образована тремя спиральными каналами, заполненными жидкостью. Это вестибулярная лестница (лестница преддверия), средняя лестница и барабанная лестница. Вестибулярная и барабанная лестницы соединяются в области дистального конца улитки посредством отверстия — геликотремы, а средняя лестница расположена между ними (рис. 9.4).
Рис. 9.4. Улитка в развернутом виде: 1 – стремечко; 2 – овальное окно; 3 – лестница преддверия; 5 – средняя лестница; 6 – Рейснерова мембрана; 7 – геликотрема; 8 – основная мембрана; 9 – барабанная лестница; 10 – круглое окно
Улитка заполнена двумя видами жидкости: в барабанной и вестибулярной лестницах содержится перилимфа, а в средней — эндолимфа. В области проксимального конца вестибулярной лестницы расположено овальное окно. При низкочастотных колебаниях перепонки овального окна в перилимфе вестибулярной лестницы возникают волны давления. Колебания жидкости, порожденные этими волнами, передаются вдоль вестибулярной лестницы и затем через геликотрему в барабанную лестницу, на проксимальном конце которой находится круглое окно. В результате распространения волн давления в барабанную лестницу колебания перилимфы передаются на круглое окно. При движениях круглого окна, играющего роль демпфирующего устройства, энергия волн давления поглощается.
Кортиев орган. Слуховыми рецепторами являются волосковые клетки (рис. 9.5).
Рис. 9.5. Поперечное сечение улитки; 1 – средняя лестница; 2 – покровная мембрана; 3 – Рейснерова мембрана; 4 – вестибулярная лестница; 5 – улитковый нерв; 6 – основная мембрана; 7 – барабанная мембрана; 8 – волосковые клетки
Эти клетки связаны с основной мембраной; в улитке человека их около 20 тыс. Апикальные поверхности клеток снабжены ресничками типа волосков, располагающимися в эндолимфе средней лестницы. Над волосками нависает особый лоскут основной мембраны — покровная (текториальная) мембрана. Преобразованные волны воспринимаются рецепторными клетками так называемого кортиевого органа, расположенного на базиллярной пластинке (мембране) улитки. Эта мембрана колеблется на различных участках, довольно строго в соответствии с частотой возбуждающей ее звуковой волны. Именно эти колебания воспринимаются ворсинками рецепторных клеток, приводят к изменению потенциала их мембраны. Возникающее возбуждение в определенных группах рецепторных клеток распространяется по волокнам слухового нерва в ядра ствола мозга, подкорковые центры, расположенные в среднем мозге, достигая слуховой зоны коры, локализующейся в височных долях, где и формируется слуховое ощущение. При этом в результате перекреста проводящих путей звуковой сигнал и из правого и из левого уха попадает одновременно в оба полушария головного мозга. Считается, что ухо человека воспринимает звуковые сигналы частотой от 16–20 Гц до 15–20 кГц. Наибольшей слуховой чувствительностью человек обладает в отношении звуков частотой 1–3 кГц. При звуках более низкой или более высокой частоты слуховая чувствительность притупляется, при этом повышается порог слышимости, характеризующийся минимальной интенсивностью звукового импульса, вызывающего слуховое ощущение. Большое значение имеет способность устанавливать расположение источника звука, что помогает человеку (и животным) ориентироваться в окружающей среде. Это явление получило название пространственного слуха, или ототопики. Механизм ототопики заключается в том, что отклонение источника звука от средней линии способствует поступлению звуковых импульсов различной интенсивности в каждое ухо и через разные промежутки времени. Болевая сенсорная система Боль — это системная реакция организма, возникающая на действие повреждающего фактора и направленная на избавление организма от него. Древние греки называли боль сторожевым псом здоровья. Системная болевая реакция проявляется комплексом таких реакций, как: · соматические (двигательные) — обеспечивают уход организма от повреждающего агента; · вегетативные — перестройка работы внутренних органов на новый уровень, изменение гемодинамики; · эмоциональные — обеспечиваются высшими отделами ЦНС. Боль — психофизиологический феномен, обеспечивающий перестройку внутри организма, меняющий его отношения с внешней средой. Как системная реакция организма боль включает: возбуждение рецепторов; проведение импульсов в ЦНС и возбуждение центральных структур; комплекс эффективных реакций, направленных на избавление организма от вредного фактора. Выделяют два вида болевой чувствительности: · протопатическую — возникает под действием любого интенсивно действующего фактора. Это «глубокая» боль, ее источник находится в глубоко расположенных тканях. Это сильная боль тянущего характера, ее трудно локализовать (больной не может точно показать место ее возникновения), не вызывает адаптации, т. е. к ней нельзя привыкнуть. Наиболее примитивный вид болевой чувствительности; · эпикритическая — появляетсят только под действием повреждающего фактора. Носит острый режущий характер, обладает точной локализацией, но к ней можно приспособиться (явление адаптации). Это «поверхностная» боль, она возникает при повреждении поверхностных тканей. Это более новый путь болевой чувствительности. Выделяют также соматическую и висцеральную боль. Висцеральная боль возникает при поражении внутренних органов — от интерорецепторов — при максимальном растяжении полых органов, действии химических веществ, нарушении гемодинамики, характеризуется свойствами протопатической болевой чувствительности. Соматическая боль возникает при повреждении поверхностных тканей, характеризуется свойствами эпикритической болевой чувствительности. Согласно предложенной Фреем (1895) теории специфичности болевые ощущения возникают при возбуждении специфических рецепторов (ноцицепторов), но по утверждению Гольдшейдера (1894), болевые ощущения могут возникать в любых рецепторах (механо-, термо-, хеморецепторах), но при действии на них очень сильных раздражителей (теория интенсивности). Обе теории считаются справедливыми, т. е. возникшие болевые ощущения возможны при возбуждении ноцицепторов и обычных рецепторов. Ноцицепторы – это свободные нервные окончания, которые могут быть расположены в любых органах и тканях и связаны с проводниками болевой чувствительности. Большинство ноцицепторов имеют двойной механизм возбуждения, т. е. могут возбуждаться под действием повреждающих и неповреждающих агентов. В организме выделены вещества, которые являются адекватными (специфическими) раздражителями для хеморецепторов: · нейропептиды – вещество Р (медиатор боли). При различных раздражениях на терминальных нервных волокнах выделяется вещество Р, которое взаимодействует с хеморецепторами и генерирует болевые импульсы; · тканевые — освобождаются при травме ткани. Это серотонин, гистамин, некоторые простагландины, Мg+, Са2+ . Эта группа веществ может воздействовать на хемоноцицепторы и генерировать импульсы в соответствующих нервах; · плазменные – находятся в плазме крови в неактивном состоянии. Активируются при травме ткани и повышают действие основного медиатора боли – вещества Р (т. е. сами боль не вызывают). Это кинины (брадикинин), калидин, XII плазменный фактор. Проводящие пути болевой чувствительности. При возбуждении импульсы поступают в ЦНС. В спинном мозге они входят в состав задних корешков. Первый нейрон располагается в спинальном ганглии. Импульсы от них поступают к нейронам задних рогов спинного мозга. В задних рогах спинного мозга различают три вида нейронов, обеспечивающих болевую чувствительность: Таким образом, первый интеграционный центр болевой чувствительности располагается на уровне задних рогов спинного мозга, второй – на уровне таламуса. От таламуса импульсы поступают в сенсорные зоны коры. · Антиноцицептивная система обеспечивает снижение болевых ощущений внутри организма, она играет роль ограничителя болевого возбуждения для того, чтобы снизить возможность развития болевого шока и предотвратить вследствие этого нарушение работы мозговых центров. В процессе нормальной жизнедеятельности организма включаются механизмы, ограничивающие потоки импульсов, поступающих от ноцицепторов. Основные принципы борьбы с болью. Помня о том, что боль является защитной реакцией организма, следует осторожно подходить к вопросу о борьбе с болью. Снимать или уменьшать болевые ощущения необходимо в следующих случаях: · причина боли известна, но не может быть немедленно устранена; · причина боли устранена, но осталось вызванное ею повреждение; · причина боли неустранима (фантомные боли, боли при неоперабельных злокачественных опухолях); · боль вызвана лечебными или диагностическими мероприятиями; · боль сама по себе оказывает повреждающее действие на организм (например, развитие болевого шока). Уменьшить болевые ощущения можно двумя путями. Снижения активности болевой системы можно добиться различными способами: · блокируя чувствительность рецепторов (местная анестезия); · блокируя проведение импульса по афферентному нервному волокну (проводниковая анестезия); · блокируя проведение импульса от спинного мозга к головному (субд- или перидуральная анестезия); · выключая сенсорные зоны коры больших полушарий или неспецифические афферентные системы мозга (наркоз). Повышение активности антиболевой системы можно вызвать: · введением опиоидных препаратов; · иглоукалыванием; · гипнотическим воздействием.
Г.Я. Двуреченская, Т.В. Перехвальская, Н.Б. Пиковская
|
Последнее изменение этой страницы: 2019-03-31; Просмотров: 597; Нарушение авторского права страницы