
|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |

|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |
Роль микоплазм в патологииСтр 1 из 14Следующая ⇒
Роль микоплазм в патологии
Род Mycoplasma включает 69 видов, наибольшую роль в патологии человека играют облигатно-патогенная M. pneumoniae и условно-патогенные M. ho - minis, M. anthritidis, M. fermentes. Респираторные инфекции, вызываемые M. pneumoniae (фарингиты, пневмонии), широко распространены во всех странах мира. Микоплазменную этиологию имеют 10–30 % пневмоний. Больной человек заразен во всех стадиях заболевания, начиная с инкубационного периода до 2 месяцев после перенесенного заболевания. При семейных вспышках больше всего страдают дети. В раннем детском возрасте респираторная микоплазменная инфекция протекает тяжело: часто наблюдается генерализация процесса с развитием патологических очагов в других внутренних органах. У взрослых иногда наблюдаются бессимптомные формы микоплазмоза. Микоплазмы стимулируют пролиферацию окружающих их клеток макроорганизма, оказывают непрямое повреждающее действие на ткани и повышают чувствительность клеток к вирусам (вирусы интенсивно размножаются именно в делящихся клетках). Поэтому нередки сочетания микоплазмоза с респираторными вирусными инфекциями. УП микоплазмы с разной частотой выделяются из органов и тканей клинически здоровых людей и само их присутствие в организме не определяет обязательного развития каких-либо патологических процессов. Однако условно-патогенные для здорового человека микоплазмы вызывают заболевания у лиц с иммунодефицитами. Таким образом, это эндогенные урогенитальные и респираторные инфекции, часто вызываемые ассоциациями микоплазм с другими микроорганизмами. Увеличение числа иммунодефицитных лиц, нарушение экологических взаимоотношений хозяина и его микрофлоры в результате применения антибиотиков широкого спектра действия, длительное применение гормональных контрацептивов увеличивают риск развития микоплазмозов. Возможна этиологическая роль микоплазм в развитии ревматоидного артрита (M. fermentes, M. artritidis, M. pneumoniae) и болезни Рейтера (M. hominis, M. artritidis). В инициации процесса ведущую роль играют микоплазмы, длительно взаимодействующие с мембраной клеток синовиальной оболочки суставов и иммунокомпетентных клеток, оказывая на них повреждающее действие. Род Ureaplasma включает УП для человека вид U. urealiticum (названный так из-за уреазной активности), вызывающий острые и хронические воспалительные процессы урогенитальной сферы. Уреаплазмы активизируются во время беременности и могут быть причиной преждевременных родов и спонтанных абортов. Влияние микоплазм и уреаплазм на репродуктивную функцию. Наиболее часто встречающиеся в половых путях микоплазмы (M. hominis, M. fermentans, M. primatum, M. genitalium и U. urealyticum) в последние 20 лет рассматривались как предполагаемая причина самопроизвольных абортов, мертворождений, преждевременных родов, гипотрофий у детей, воспалительных заболеваний малого таза, послеродовых инфекций, вторичного бесплодия. Однако предположения о том, что генитальные микоплазмозы могут быть причиной прерывания беременности, основываются на исследованиях по методу «случай–контроль», в которых более высокий уровень колонизации микоплазмами обнаруживается среди женщин с неблагоприятными исходами беременности по сравнению с теми, у которых беременность заканчивалась нормально. Как это характерно для всех исследований, проводимых таким образом, и другие, как известные, так и неизвестные факторы могли также быть при этом причиной неблагоприятного исхода беременности вне зависимости от наличия или отсутствия микоплазмоза. В любом случае не следует отрицать, что вторичное бесплодие у обоих полов связано с хроническими воспалительными процессами урогенитальной сферы различной этиологии. Часто встречаются микст-инфекции в различных сочетаниях (уреаплазмоз, хламидиоз, гонорея, трихомоноз). Описано также воздействие уреаплазм на сперматогенез и сперматозоиды: уреаплазмы адсорбируются на поверхности сперматозоидов, изменяют их подвижность и морфологию. Степень колонизации урогенитального тракта микоплазмами и уреаплазмами связана с количеством половых партнеров, возрастом, уровнем образования и доходов, семейным положением. У здоровых сексуально активных женщин уреаплазма выделяется в 40–95 %, а микоплазма — в 15–70 %. У беременных и небеременных женщин микоплазмы выявляются с одинаковой частотой. Инфицирование плода микоплазмами и уреаплазмами может происходить внутриуробно (через околоплодные воды восходящим путем из цервикального канала, гематогенным путем), а также при прохождении новорожденного через родовые пути. Внутриутробное инфицирование микоплазмами приводит к преждевременным родам, выкидышам, мертворождениям. Воздействие микоплазм на хромосомный аппарат инфицированных клеток может приводить к аномалиям развития. У недоношенных новорожденных микоплазмозы протекают тяжело: поражаются органы дыхания (врожденная пневмония), нервная система, часто наблюдается гипотрофия. У доношенных новорожденных возможна бессимптомная колонизация микоплазмами. Колонизация влагалища уреаплазмой отмечается у 1/3–1/2 новорожденных девочек, у 25 % новорожденных уреаплазмы колонизируют носоглотку, у 10 % — прямую кишку. Метод родоразрешения на частоту колонизации не влияет. При безводном промежутке в родах менее 1 ч частота колонизации снижается до 20 %. В течение первого года жизни процент колонизации прогрессивно снижается и в препубертатном периоде встречается редко. После периода полового созревания колонизация нарастает вместе с частотой половых контактов. При лечении микоплазмозов и уреаплазмозов следует помнить, что микоплазмы обладают естественной резистентностью к β -лактамным антибиотикам и другим лекарственным препаратам, подавляющим синтез КС (из-за ее отсутствия у возбудителя). Методы изучения морфологии микоплазм: В световом микроскопе в мазках, окрашенных по Романовскому–Гимзе, обнаруживаются лишь самые крупные формы микоплазм. ФКМ и ТПМ нативных препаратов для выявления нитевидных форм. Электронная микроскопия для выявления ультраструктурных компонентов микоплазм. В табл. 18 приведена сравнительная характеристика описанных выше микроорганизмов. Таблица 18 Сравнительная характеристика спирохет, актиномицетов,
Окончание табл. 18
Примечание: – отсутствует; + присутствует. ОБМЕН ВЕЩЕСТВ И ЭНЕРГИИ (МЕТАБОЛИЗМ) Для роста и размножения микроорганизмы нуждаются в веществах, используемых для построения структурных компонентов клетки и получения энергии. В основе жизнедеятельности микроорганизмов лежит непрерывный обмен веществ и энергии с окружающей средой (метаболизм). Метаболизм (от лат. metabole — изменение, превращение) — совокупность всех химических превращений в клетке, имеет две составляющих (рис. 56): анаболизм (от греч. anabole — подъем) ( конструктивный (пластический) метаболизм, ассимиляция) — биосинтез макромолекул из простых низкомолекулярных соединений и их ассимиляция (усвоение, накопление); катаболизм ( энергетический метаболизм, диссимиляция) — химический ферментативный процесс разрушения высокомолекулярных веществ до мономеров, направленный на получение энергии и ее запасы в форме АТФ.
Рис. 56. Метаболические процессы
Метаболизм у прокариот в целом протекает так же, как у высших животных и растений. Особенности метаболизма у прокариот: бактерии разнообразны по своим пищевым потребностям. Одно и то же соединение для одних микроорганизмов может быть продуктом питания, а для другого — ядовитым веществом. Известны бактерии, способные усваивать способность включать в обмен веществ любые органические и неорганические соединения; высокая интенсивность метаболизма; высокая адаптационная способность к меняющимся условиям окружающей среды; многообразие путей метаболизма, промежуточных и конечных продуктов; возможность искусственного культивирования многих микроорганизмов в бесклеточных средах; несовершенство регуляции метаболических процессов. Риккетсии — облигатные внутриклеточные паразиты (не способны синтезировать некоторые макромолекулы). Хламидии — облигатные внутриклеточные паразиты (не способны синтезировать некоторые макромолекулы) и энергетические паразиты (не способны синтезировать АТФ). Микоплазмы — мембранные паразиты (не способны синтезировать стерины для ЦПМ). Изучение процессов метаболизма у микроорганизмов необходимо для понимания механизмов патогенеза заболеваний, для идентификации микроорганизмов и этиологической диагностики заболеваний, для проведения химиотерапии, а также для получения необходимых для человека материалов с использованием биотехнологии. ХИМИЧЕСКАЯ СТРУКТУРА И ПИТАТЕЛЬНЫЕ ПОТРЕБНОСТИ Клетка — универсальная единица живой материи. По химическому составу у прокариотических и эукариотических клеток нет существенных отличий. Для осуществления биосинтетических реакций бактериям необходимы химические элементы и дополнительные факторы роста. Потребность микроорганизма в определенных химических элементах и ростовых факторах — стабильный признак, который используется для идентификации бактерий, а также при изготовлении питательных сред. Химические элементы, входящие в состав бактерий, можно разделить на три группы: биогенные химические элементы, макроэлементы и микроэлементы. I. Биогенные химические элементы(С, О, N, H ). На их долю приходится 95 % сухого остатка, в т. ч. C — 50 %, O — 20 %, N — 15 %, H — 10 %. Это основные химические элементы, необходимые для синтеза органических соединений. Кислород и водород не лимитируются, их микроорганизмы могут получать из воды и других соединений. По способности усваивать источники углерода микроорганизмы делятся на 3 группы: Аутотрофы (от греч. auto — сам, trophe — питание). Буквальный перевод «сам питаюсь». Извлекают углерод из простых неорганических соединений (обычно из СО2 или карбонатов), не нуждаются в органических соединениях и энергии. Среди автотрофов нет патогенных для человека микроорганизмов. Гетеротрофы (от греч. heteros — другой, trophe — питание). Буквальный перевод «питаемый другими». Усваивают углерод из сложных органических соединений различной химической природы (гексоз, спиртов, аминокислот, органических кислот). Гетеротрофов делят на следующие: метатрофы (гнилостные бактерии, грибы, дрожжи), усваивающие углерод из мертвых органических соединений; широко распространены в почве, играют ведущую роль при разложении органических останков; являются сапрофитами; паратрофы, усваивающие углерод в условиях живого организма, являются паразитами, среди которых различают облигатных паразитов (риккетсии, хламидии, вирусы), живущих только в живой клетке, и факультативных (большинство патогенных бактерий), которых можно выращивать на искусственных питательных средах. Миксотрофы — микроорганизмы, способные переключаться с автотрофного на гетеротрофный путь обмена веществ и энергии. Азот содержится в клетке в восстановленной форме в виде аминогрупп. Для синтеза азотсодержащих соединений (аминокислот, пуринов, пиримидинов, некоторых витаминов) микроорганизмы нуждаются в доступном источнике азота. По способности усваивать источники азота микроорганизмы делятся на Аминоаутотрофы усваивают азот из неорганических соединений: азотфиксирующие бактерии (клубеньковые) используют азот воздуха; аммонифицирующие бактерии используют соли аммония; нитрифицирующие бактерии — аммиак и его соли превращают в азотную, а затем в азотистую кислоту. Денитрофицирующие бактерии в качестве источника азота используют нитраты и нитриты, образуя из них молекулярный азот воздуха. Среди аминоаутотрофов нет патогенных для человека микроорганизмов. Аминогетеротрофы извлекают азот из органических соединений (аминокислот, пептонов, белков) или используют минеральные источники азота с добавлением несинтезируемых ими аминокислот. К этой группе принадлежат многие виды патогенных бактерий. II. Макроэлементы — сера, фосфор, калий, кальций, магний, хлор, натрий. На них приходится около 5 % сухого остатка. III. Микроэлементы (зольные элементы, следовые элементы) — марганец, молибден, цинк, медь, кобальт, никель, железо, ванадий, бор, йод, селен, кремний, вольфрам. На микроэлементы приходятся доли процента, однако они являются активаторами ферментов и имеют важное значение в обменных процессах. Большинство микроэлементов вносят в питательную среду в качестве примесей в солях макроэлементов либо попадает в питательную среду из стекла лабораторной посуды, с водой и с пылью. Химические элементы входят в состав различных органических и неорганических веществ. Синтез этих веществ контролируется генетически. Некоторые вещества бактериальная клетка может получать из окружающей среды или из организма хозяина. Органические вещества бактериальной клетки представлены белками, нуклеиновыми кислотами, углеводами, липидами. Белки составляют 40–80 % сухой массы бактерий и встречаются во всех структурных элементах клетки. Белки бактерий делятся на структурные (составляют основу структур клетки и обладают антигенными свойствами) и функциональные (их большая часть, они обладают свойствами ферментов). Белки могут быть простые (протеины) и сложные (протеиды), в чистом виде или в комплексе с липидами, углеводами, нуклеиновыми кислотами. В состав белков бактерий входят как обычные для эукариот аминокислоты, так и оригинальные — диаминопимелиновая кислота, D-аланин, D-глютанин, входящие в состав ПГ и капсул некоторых бактерий. Высокая резистентность спор связана с находящейся только в них дипиколиновой кислотой. Жгутики построены из белка флагеллина, обладающего сократительной способностью и выраженными антигенными свойствами. Фимбрии содержат особый белок — пилин. Пептидную природу имеют капсулы представителей рода Bacillus, возбудителя чумы, поверхностные антигены ряда бактерий, в т. ч. стафилококков и стрептококков. Белок А — специфический белок S. aureus. Белок М — специфический белок гемолитических стрептококков серогруппы А, позволяющий дифференцировать серовары (около 100), что имеет эпидемиологическое значение. Ряд белков содержит наружная мембрана Грам– бактерий, например, порины, образующие диффузные поры, через которые в клетку проникают мелкие гидрофильные молекулы. Нуклеиновые кислоты (ДНК и разные типы РНК) составляют около 18 % сухой массы бактерий, определяют наследственность и изменчивость. Микроорганизмы отличаются по структуре нуклеиновых кислот, содержанию азотистых оснований. Содержание нуклеиновых кислот зависит от условий культивирования, фаз роста, физиологического и функционального состояния клеток. Содержание ДНК в клетке более постоянно, чем РНК. Нуклеотидный состав ДНК не изменяется в процессе развития бактерии, видоспецифичен и используется как один из важнейших таксономических признаков. РНК находятся в одноцепочечной форме, главным образом, в рибосомах (рРНК составляют 80–85 %), в то время как т(транспортные)РНК — 10 %, м(матричные)РНК — 1–2 %. ДНК может находиться в ядерном аппарате (хромосомная ДНК) или в плазмидах (внехромосомная ДНК). Углеводы составляют около 16 % сухой массы клетки, представлены простыми (моно- и дисахаридами, полисахаридами) и комплексными соединениями. Углеводы встречаются чаще в виде полисахаридов, которые могут быть экзо- и эндоклеточными. Среди экзоклеточных полисахаридов выделяют структурные (входят в состав капсул, клеточной стенки) и истинно экзополисахариды (выходят во внешнюю среду). Эндоклеточные полисахариды — располагаются в цитоплазме, это запасные питательные вещества клетки (крахмал, гликоген и др.). Углеводы выполняют также антигенную функцию. Липиды представлены фосфолипидами, жирными кислотами, восками и глицеридами. Они выполняют антигенную и структурную функции. Липиды (фосфолипиды и стерины) входят в состав ЦПМ (липидный бислой) наружной мембраны Грам– бактерий и ЦП. Содержание липидов у большинства бактерий не более 10 %, а наибольшее количество — у микобактерий (до 40 %). В состав липидов входят различные жирные кислоты, весьма специфичные для разных групп микроорганизмов. Их определение имеет в ряде случаев диагностическое значение, например, у анаэробов, микобактерий. У микобактерий туберкулеза в составе липидов имеются кислотоустойчивые жирные кислоты — фтионовая, миколовая и др. Высокое содержание липидов и их состав определяют многие свойства микобактерий туберкулеза: их устойчивость к кислотам, щелочам и спиртам; трудную окрашиваемость красителями; высокую резистентность во внешней среде и патогенность. Тейхоевые кислоты встречаются в КС Грам+ бактерий. Представляют собой водорастворимые линейные полимеры, содержащие остатки глицерина или рибола, связанные фосфодиэфирными связями. С ТК связаны главные поверхностные антигены ряда Грам+ бактерий. Липополисахарид (один из основных компонентов КС Грам– бактерий) — соединение липида с полисахаридом. Неорганические компоненты бактериальной клетки — вода и минеральные вещества. Факторы роста бактерий близки к витаминам животных и растений, в ничтожно малых количествах входят в состав ферментов и других соединений. Факторы роста необходимы для жизнедеятельности труднокультивируемых бактерий, но сами бактерии эти факторы не синтезируют и получают извне. К ним относят аминокислоты, пуриновые и пиримидиновые основания, липиды, витамины, железопорфирины (гем) и другие соединения. Аминокислоты. Многие бактерии нуждаются в незаменимых аминокислотах (одной или нескольких), являющихся составными частями белков. Например, клостридии не могут самостоятельно синтезировать лейцин и тирозин, а стрептококки — лейцин и аргинин. Пуриновые и пиримидиновые основания (нуклеотиды: аденин, гуанин, цитозин, урацил) и их производные нуклеозиды (с фосфорной кислотой) — составные части нуклеиновых кислот. Они являются факторами роста для разных видов стрептококков, некоторые азотистые основания нужны для роста стафилококков, в нуклеотидах нуждаются некоторые виды микоплазм. Компоненты фосфолипидов — жирные кислоты — нужны для роста некоторых стрептококков, микоплазм. Все виды микоплазм ауксотрофны по холестерину и другим стеринам, что отличает их от других прокариот. Витамины, в основном группы В и К, входят в состав коферментов или их простетических групп и участвуют в каталитических функциях, поэтому они необходимы только в очень малых количествах. Многие бактерии ауксотрофны по определенным витаминам. Например, коринебактерии дифтерии, шигеллы нуждаются в никотиновой кислоте или ее амиде, который входит в состав НАД и НАДФ; золотистый стафилококк, пневмококк, бруцеллы — в тиамине, входящем в состав пирофосфата; некоторые виды стрептококков, бациллы столбняка — в пантотеновой кислоте, являющейся составной частью кофермента КоА. Факторами роста для многих бактерий являются фолиевая кислота, биотин; гемы — компоненты цитохромов — необходимы гемофильным бактериям, микобактериям туберкулеза. ПИТАНИЕ МИКРООРГАНИЗМОВ
Питание — процесс поступления в организм химических веществ, содержащих пластический материал и энергию. Для роста микроорганизмов необходимы: вода — обязательный химический компонент клеток бактерий. В вегетативных клетках она составляет около 80 % биомассы, в спорах — 18–20 %. Основная часть воды находится в свободном состоянии. Кроме свободной, имеется ионная фракция воды и вода, связанная с коллоидными веществами; питательные вещества — растворенные в воде соединения, из которых микроорганизмы строят свои клетки и получают энергию. КОНСТРУКТИВНЫЙ МЕТАБОЛИЗМ
Анаболизм — биосинтез основных соединений бактериальной клетки, необходимых для ее функционирования. Продукты, образующиеся в реакциях синтеза биомолекул, называют метаболитами. Из преметаболитов (СО2, аммония, сульфатов, фосфатов, ионов металлов) образуются прометаболиты (моносахара, аминокислоты, нуклеотиды, низкомолекулярные жирные кислоты). Прометаболиты катализируют синтез информационных молекул (ДНК и РНК) и первичных метаболитов, сходных для всех живых организмов (белков, углеводов, липидов и некоторых карбоновых кислот). В результате реакций вторичного метаболизма некоторые микроорганизмы образуют токсины и антибиотики. Биосинтез нуклеотидов. Пуриновые нуклеотиды строятся на основе фосфорибозилпирифосфата, образующегося в пентозофосфатном цикле. Двучленное пуриновое кольцо синтезируется последовательным присоединением аминогрупп и мелких углеродсодержащих групп. Пиримидиновые нуклеотиды синтезируются на основе карбоксилсодержащих веществ. Рибозофосфатный остаток присоединяется после его конденсации с аспарагиновой кислотой. Биосинтез углеводов. Микроорганизмы синтезируют моно-, олиго-, полисахариды и другие соединения, в состав которых входят углеводы. Аутотрофы синтезируют глюкозу из углекислого газа, а гетеротрофы — из углеродсодержащих соединений с длиной цепи С2–С3. В обоих случаях используются реакции гликолиза, идущие в обратном направлении. Биосинтез аминокислот. Большинство прокариот способны синтезировать все аминокислоты из пирувата, α -кетоглутарата и фумарата, образующихся в цикле трикарбоновых кислот. Источниками энергии являются АТФ. Азот вводится в молекулу предшественника на последних этапах биосинтеза реакциями аминирования и пераминирования. Из пирувата в реакциях аминирования ионами NH4 образуется аланин, а затем в реакциях пераминирования синтезируются пролин и аргинин. Глютаминовая кислота образуется из a-кетоглютарата путем аминирования. Лизин, треонин и метионин синтезируются из аспартата, образованного из фумарата. Ауксотрофные по некоторым аминокислотам прокариоты (микоплазмы, спирохеты) используют готовые аминокислоты из организма хозяина. Биосинтез липидов. Липиды микроорганизмов представлены жирными кислотами, фосфолипидами, восками, терпенами и каратиноидами, состоящими из насыщенных и ненасыщенных жирных кислот. Жирные кислоты синтезируются при участии ацетилпереносящих белков. Ненасыщенные кислоты с двойными связями формируются из насыщенных жирных кислот. Ионный обмен. Для роста и размножения микроорганизмов необходимы разнообразные минеральные элементы и соединения — ионы NH4, K+, Mg2+. Пути выхода синтезированных веществ из бактериальной клетки: фосфотрансферазная реакция происходит при фосфорилировании переносимой молекулы; контрансляционная секреция — в этом случае синтезируемые молекулы должны иметь особую лидирующую последовательность аминокислот, чтобы прикрепиться к мембране и сформировать канал, через который молекулы белка (например, токсины столбняка, дифтерии) смогут выйти в окружающую среду; почкование: молекулы, образующиеся в клетке, окружаются мембранным пузырьком, который отшнуровывается в окружающую среду. ЭНЕРГЕТИЧЕСКИЙ МЕТАБОЛИЗМ
Процесс получения энергии у прокариот — дыхание (биологическое окисление), в результате которого синтезируются молекулы АТФ. У некоторых микроорганизмов аккумулятором энергии могут быть и другие фосфаты, иногда даже неорганические. Дыхательный аппарат бактерий состоит из мезосом — инвагинаций ЦПМ, где локализованы ферменты-оксидоредуктазы, с помощью которых происходит биологическое окисление: пиридиновые дегидрогеназы (есть у всех микроорганизмов), отнимают от субстрата водород и таким образом происходит окисление. Облигатные анаэробы имеют только эти ферменты; флавиновые ферменты широко распространены и делятся на 2 группы: флавинодегидрогеназы (окисляют субстрат, отнимая у него водород) и ферменты переноса (только передают водород, забирая его у пиридиновых дегидрогеназ); железосодержащие ферменты (цитохромы) — цитохромоксидаза, пероксидаза, каталаза — сами субстрат не дегидрогенируют, а выполняют роль переносчика водорода на кислород; медьсодержащие ферменты мало распространены (фенолоксидаза). Они сами дегидрогенируют субстрат и переносят водород на кислород. Кроме ферментов, локализованых в мезосомах, у микроорганизмов есть свободные переносчики водорода (убихиноны, аскорбиновая кислота). Они вступают в действие, когда мембрана растягивается и наблюдается разрыв между локализованными ферментами. Типы биологического окисления. В зависимости от того, что является конечным акцептором электронов, выделяют три типа образования энергии у бактерий: аэробное дыхание, анаэробное дыхание и ферментацию (брожение) (рис. 57, 58). 1. Аэробный (от греч. аer — воздух и bios — жизнь) тип — окислительное фосфорилирование — совокупность экзотермических процессов ферментативного распада органических веществ (реже — неорганических), происходящих с участием свободного кислорода. Процесс дыхания у аэробов протекает по типу окислительной реакции путем отщепления от субстратов водорода (или электронов). Чаще наблюдается гликолиз — процесс ферментативного расщепления углеводов. Пировиноградная кислота, образовавшаяся в результате гликолиза, окисляется в цикле трикарбоновых кислот, который снабжает аэробов предшественниками для реакций биосинтеза. Водородные атомы передаются вдоль цепи молекул-переносчиков, которые образуют цепь переноса электронов, или «дыхательную» цепь. Водород и электроны отщепляются от субстратов с помощью пиридиновых дегидрогеназ, связанных с мембранами. Далее поток электронов направляется от системы с более низким (более отрицательным) потенциалом к системе с более высоким (более положительным) потенциалом: флавопротеидные ферменты — цитохромные ферменты — цитохромоксидаза. На последней ступени этой реакции, катализируемой цитохромоксидазой, ионы водорода связываются с молекулярным кислородом — конечным акцептором электронов. При этом образуется перекисный радикал — очень сильный окислитель. Фермент супероксиддисмутаза
Рис. 57. Типы биологического окисления
Брожение
| 
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Анаэробное дыхание
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Дыхание | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

Рис. 58. Транспорт электронов при различных типах биологического окисления:
ПН — пиридиннуклеотидные ферменты; ФП — флавопротеидные ферменты
Аэробное дыхание энергетически более эффективно. Перенос электронов вдоль дыхательной цепи сопряжен с образованием богатых энергией фосфатных связей в молекулах АТФ. Образуется также много промежуточных и конечных продуктов метаболизма, которые используются для синтеза белков, углеводов, витаминов. Филогенетически аэробное дыхание возникло позже.
Облигатным (строгим) аэробам для дыхания необходим молекулярный (атмосферный) кислород. Они не могут жить и размножаться в отсутствие молекулярного кислорода, используют только аэробный путь окисления (некоторые виды псевдомонад, холерный вибрион, туберкулезная палочка).
Для аэробов, растущих на агаре или в тонких слоях жидкости в присутствии воздуха, кислорода вполне достаточно. В жидких средах при большом объеме жидкости аэробные бактерии могут расти только на поверхности, т. к. в более глубоких слоях по мере удаления от поверхности условия приближаются к анаэробным. Для нормального роста аэробных микроорганизмов в глубоких слоях жидкой культуры требуется аэрация.
Микроаэрофилы (факультативные аэробы) нуждаются в уменьшенной концентрации (низком парциальном давлении) свободного кислорода (от 0, 01 до 0, 03 бар). При полном доступе кислорода (в воздухе парциальное давление О2 составляет 0, 2 бар) рост микроорганизмов прекращается или резко замедляется. Микроаэрофилами является большинство аэробных бактерий.
Капнофилы нуждаются в наличии в среде двуокиси углерода (до 10 %),
т. к. приспособлены к более высокому, чем в воздухе, содержанию СО2. Для этого к питательным средам добавляют бикарбонат натрия и инкубируют культуры в закрытых сосудах в атмосфере, содержащей СО3-2; можно также продувать обычный или обогащенный СО2 воздух. Капнофилами являются многие патогенные бактерии.
2. Анаэробный (от греч. an — отрицание, аer — воздух и жизнь) тип — совокупность экзотермических процессов ферментативного распада органических веществ, происходящих без участия кислорода. Анаэробы получают энергию в форме АТФ путем ускоренного, но не полного окисления (субстратного фосфорилирования) углеводов, белков, липидов.
Различия между облигатными аэробами и анаэробами касаются ферментативного обеспечения конечных этапов окисления. У анаэробов дегидрогеназы не связаны с мембранами и находятся в ЦП только в растворимой форме. Для переноса водорода анаэробы используют флавиновые ферменты, самоокисляющиеся кислородом воздуха. Реакция флавиновых ферментов с кислородом направлена на детоксикацию молекулярного кислорода. Поэтому содержание флавиновых дегидрогеназ в клетках анаэробов значительно выше, чем у аэробов.
Из-за отсутствия ряда ферментов цепи переноса электронов (цитохромов) транспорт электронов осуществляется просто и примитивно. Органические субстраты окисляются только за счет отщепления водорода. Освобождающийся водород либо присоединяется к продуктам распада того же самого органического вещества, либо выделяется в газообразном состоянии. Если у анаэробов в качестве акцепторов водорода в окислительно-восстановительных реакциях выступают неорганические вещества, происходит «анаэробное дыхание». Конечным акцептором водорода у анаэробов является связанный кислород в виде нитратов («нитратное дыхание») или сульфатов («сульфатное дыхание»).
Анаэробный путь филогенетически более ранний, чем аэробный, но он экономически невыгоден, т. к. выделяется небольшое количество энергии и образуется мало метаболитов. Из-за того что энергии выделяется мало, микроорганизмам надо использовать большое количество субстратов (сахаров, аминокислот, пуринов и пиримидинов). Многие анаэробы являются строго протеолитическими организмами, неспособными сбраживать углеводы. Протеолитическая активность у некоторых анаэробов (C. histolyticum) настолько высока, что при инфекциях, вызванных этими микроорганизмами, наблюдается расплавление мышц. Другие анаэробы обладают слабовыраженной сахаролитической активностью.
3. Если и донорами, и акцепторами водорода выступают органические соединения, происходит брожение — процесс ферментативного расщепления органических соединений, преимущественно углеводов, с образованием спиртов (этилового, пропилового, глицерина) и органических кислот (молочной, муравьиной, уксусной, масляной). Типы брожения именуются по продуктам, которые образуются: молочнокислое, уксуснокислое, спиртовое, муравьинокислое, маслянокислое, ацетонобутиловое, пропионовокислое, сукцинатное, смешанное (рис. 59).
| Gluconobacter |
 Уксусная кислота Уксусная кислота
|
 Clostridium Proteus Clostridium Proteus
|
 Масляная кислота Yeasts СО2 + Н2 Масляная кислота Yeasts СО2 + Н2
|
  Этанол Этанол
|
| Ацетоуксусная кислота Муравьиная кислота Смешанные |
  кислоты кислоты
|
   Пируват Молочная кислота Streptococcus, Escherichia, Пируват Молочная кислота Streptococcus, Escherichia,
|
 Lactobacillus Shigella Lactobacillus Shigella
|
| Щавелевоуксусная кислота Ацетил КоА |
  Ацетилметилкарбинол Ацетилметилкарбинол
|
 Янтарная кислота Уксусная кислота Янтарная кислота Уксусная кислота
|
 Acetobacterium Acetobacterium
|
| Пропионовая кислота 2, 3 бутандиол |
| Propionibacterium Enterobacter |
Рис. 59. Различные продукты ферментации пирувата
Образующиеся в процессе брожения продукты и энергия расходуются микроорганизмами для различных биосинтетических целей. Многие виды брожения используются в пищевой и микробиологической промышленности для получения спиртов и органических кислот.
Анаэробы осуществляют обмен веществ и размножаются в условиях отсутствия кислорода в среде обитания. Различают облигатных, аэротолерантных и факультативных анаэробов.
Облигатные (строгие) анаэробы (палочка маслянокислого брожения, возбудители столбняка, ботулизма) используют только анаэробный путь биологического окисления и размножаются только в анаэробных условиях. Они лишены ферментов супероксиддисмутазы и каталазы, защищающих микробную клетку от токсических продуктов окисления. Поэтому вегетативные формы облигатных анаэробов погибают от ядовитых концентраций перекиси водорода даже при кратковременном контакте с воздухом. Спорам облигатных анаэробов свойствен крайне выраженный анабиоз, поэтому они могут сохраняться в присутствии
кислорода.
Аэротолерантные микроорганизмы (молочнокислые бактерии, C. histolyticum) обладают супероксиддисмутазной активностью, но лишены каталазы и пероксидазы; они могут расти в присутствии атмосферного кислорода, но не способны его использовать; энергию получают исключительно с помощью брожения.
Факультативные анаэробы (большинство патогенных бактерий, например, Enterobacteriaceae (кишечная палочка, сальмонеллы), многие дрожжи) обладают супероксиддисмутазной и каталазной активностью. Факультативные анаэробы образуют АТФ при окислительном и субстратном фосфорилировании. Они могут изменять свой путь биологического окисления в зависимости от наличия или отсутствия кислорода. В кислородных условиях в качестве конечного акцептора водорода они используют атмосферный кислород. В бескислородных условиях в качестве конечного акцептора водорода они используют нитраты или сульфаты.
Классификация бактерий по отношению к кислороду воздуха представлена в табл. 22 и на рис. 60.
Таблица 22
Группа бактерий
РОСТ
Рост микроорганизмов — генетически контролируемое увеличение объема и массы микробной клетки, связанное с синтезом новых веществ. Рост в применении к популяции — увеличение биомассы популяции.
Стадии (фазы) роста бактериальной культуры на питательной среде (рис. 62). Каждая фаза роста культуры в питательной среде характеризуется определенным размером клеток, скоростью размножения и потребления субстрата, синтезом метаболитов.
A — фаза задержки роста (начальная стационарная) , или лаг-фаза (от англ. lag — отставание), в среднем длится 1–2 ч. Начало лаг-фазы связано с адаптацией клеток к среде обитания. Важную роль играет «предыстория» выращивания посевной культуры. Если использован инокулят из культуры с резко отличающимися условиями выращивания, то клеткам требуется время на синтез новых рибосом, РНК и адаптивных ферментов. В этом периоде увеличивается размер клеток, в 8–12 раз повышается содержание РНК. Деления клеток при этом почти не происходит. Полноценная среда, физиологически активная посевная культура, которая подготовлена к синхронному делению, способствуют короткой лаг-фазе (или ее отсутствию) и переходу ко II фазе. Синхронизации можно достичь с помощью пониженной температуры, ограничения питательных веществ, фильтрации, обеспечивающей пропускание клеток определенного размера.
Синхронизация длится 2–4 генерации, а далее наступает асинхронный рост.

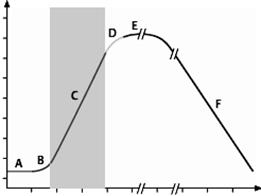
Время
Рис. 62. Фазы роста бактериальной культуры в питательной среде:
A — лаг-фаза; B — период положительного ускорения; C — лог-фаза; D — фаза отрицательного ускорения; E — стационарная фаза; F — фаза отмирания
B — короткий период положительного ускорения между фазами A и B, когда начинается деление бактерии.
C — фаза логарифмического (экспоненциального) роста начинается, когда скорость роста клеток всей популяции достигает постоянной величины, средняя продолжительность ее 5–6 ч. Скорость деления клеток максимальная, но клетки имеют наименьший размер. Популяция бактериальной культуры состоит из делящихся клеток и достаточно стандартна по своим свойствам (содержание белка, нуклеиновых кислот, наиболее выраженные видовые признаки), поэтому эта фаза удобна для определения многих параметров популяции (плотность бактерий, скорости роста и потребления субстрата, содержание биополимеров клетки). В этот период отмечено снижение резистентности к агрессивным веществам.
Несмотря на постоянную скорость роста популяции бактерий в логарифмической фазе, отдельные клетки все же находятся в разных стадиях деления. Иногда важно синхронизировать рост всех клеток популяции, то есть получить синхронную культуру. Простыми методами синхронизации являются изменение температурных условий или культивирование в условиях недостатка питательных веществ. Вначале культуру помещают в неоптимальные условия, затем сменяют их оптимальными. При этом у всех клеток популяции синхронизируется цикл деления, но синхронное деление клеток происходит обычно не более 3–4 циклов.
D — фаза замедления скорости роста (отрицательного ускорения) длится около 2 ч. Количество питательных веществ существенно уменьшается (отмечается воздействие на бактерии лимитирующих факторов), в культуральной жидкости накапливаются метаболиты, в т. ч. токсичные для бактерий (отмечается ингибирующее воздействие) и скорость деления клеток снижается.
E — стационарная фаза, или фаза максимальной концентрации (М-кон-центрация). Клетки перестают делиться. Однако количество живых клеток постоянно, т. к. количество жизнеспособных бактерий соизмеримо с количеством отмирающих. В этот период клетки переходят на эндогенные субстраты (окисляют запасные вещества, белки, углеводы, липиды). Длительность стационарной фазы различается у разных микроорганизмов. Например, у E. coli она наступает через 18–24 ч, у Azotobacter — через 72 ч с момента внесения инокулята в питательную среду.
F — фаза отмирания , характеризуется массовой гибелью бактерий. В бактериальной популяции отмечается образование инволюционных форм, аутолиз под действием собственных ферментов. У бактерий меняются морфологические и биохимические свойства. Гибель может наступить через несколько дней, недель, месяцев.
В эту фазу различают периоды ускоренной гибели (количество живых клеток начинает снижаться с увеличивающейся скоростью), логарифмической гибели (количество живых клеток убывает с максимальной скоростью), уменьшения скорости гибели (количество живых клеток убывает с уменьшающейся скоростью) и стационарную фазу минимума (количество живых клеток минимально).
Данная динамика характерна для периодических (статических) культур с постепенным истощением запаса питательных веществ и накоплением метаболитов. Таким образом, неограниченный рост в закрытой от доступа дополнительных питательных веществ периодической культуре невозможен.
Если в питательной среде создают условия для поддержания микробной популяции в экспоненциальной фазе — это хемостатные (непрерывные) культуры.
РАЗМНОЖЕНИЕ
Размножение микроорганизмов — увеличение их концентрации в единице объема среды, направленное на сохранение вида.
Для микроорганизмов характерно:
разнообразие способов размножения;
переключение с одного способа размножения на другой;
возможность одновременного использования нескольких способов;
высокая скорость размножения.
Способы размножения микроорганизмов:
I. Половой способ размножения наблюдается только у эукариот.
СТЕРИЛИЗАЦИЯ
Стерилизация (обеспложивание) (от лат. sterilis — бесплодный) — совокупность физических, химических и механических способов полного освобождения объектов внешней среды от вегетативных и покоящихся форм патогенных, УП и непатогенных микроорганизмов (табл. 23).
В медицинской практике стерилизуют медицинский инструментарий и аппаратуру, перевязочный и шовный материал, инъекционные растворы, дренажи, эндопротезы, трансплантаты, маски, халаты, белье, питательные среды, лабораторную посуду.
Таблица 23
Способы
Различают физические, химические и механические способы стерилизации.
Физические способы стерилизации. С целью стерилизации могут быть использованы различные факторы физического воздействия на микроорганизмы. Чаще используют высокую температуру, давление, радиационное и инфракрасное излучение.
I. Прокаливание в пламени горелки или спиртовки (фламбирование) в течение 30–60 с. Так стерилизуют бактериологические петли (раскаляют до красного цвета в верхней части пламени), горлышки пробирок, кончики пинцетов и ножниц, препаровальные иглы, предметные стекла. Гибель микрорганизмов происходит в результате сгорания клеток.
II. Кипячение используют для стерилизации металлических инструментов, стеклянных изделий, резиновых трубок, пробок. При 100 º С вегетативные формы микроорганизмов и большинство вирусов погибают в течение нескольких минут. Споры бацилл и клостридий выдерживают кипячение в течение нескольких часов, вирус гепатита В — около часа. Кипячение приводит к коррозии металла, острые поверхности быстро тупятся, зеркала темнеют.
III. Паровой способ самый распространенный (до 90 %) в медицинских учреждениях. Так стерилизуют медицинские инструменты, перчатки, халаты, белье, перевязочные материалы, лабораторную посуду, питательные среды для выращивания микроорганизмов.
Чаще стерилизующим агентом является водяной пар под избыточным давлением. Он глубоко проникает в стерилизуемые материалы и быстро уничтожает микроорганизмы в результате коагуляции их белковых структур. По сравнению с сухожаровой стерилизацией автоклавирование более эффективно, т. к. теплоемкость водяного пара больше теплоемкости сухого воздуха при той же температуре. Обязательным условием эффективной стерилизации является одновременное сочетание следующих факторов: температуры, давления, времени и наличия водяного пара в качестве стерилизующего агента.
Паровые стерилизаторы называются автоклавами (рис. 66).
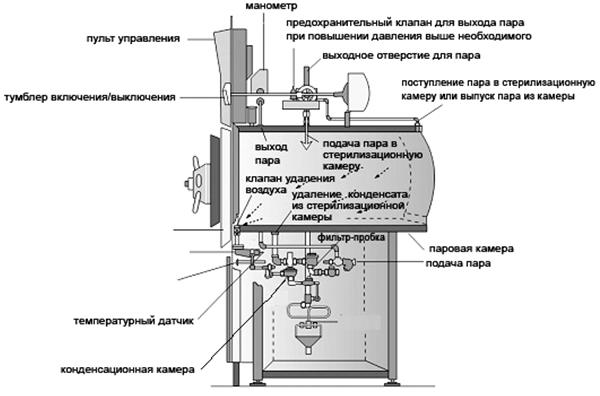
Рис. 66. Схема автоклава
Основные части автоклава:
наружный кожух для защиты автоклава от механических повреждений;
водопаровая камера из высококачественной стали для получения пара, она герметично закрывается крышкой с резиновой прокладкой;
стерилизационная камера, в которую помещается предназначенный для стерилизации материал. Стерилизационная камера снабжена краном для удаления воздуха в начале стерилизации.
Автоклав также оборудован:
манометром для измерения давления пара;
термометром для измерения температуры внутри камеры;
водомерной стеклянной трубкой для измерения уровня воды в водопаровой камере;
спускным краном для удаления конденсата из стерилизационной камеры;
предохранительным клапаном для выхода пара при повышении давления выше необходимого.
Автоклавы бывают стационарные и переносные, горизонтальные и вертикальные (рис. 67).


А б
Рис. 67. Автоклавы:
а — крупногабаритный; б — портативный
В зависимости от решаемых задач и организации процессов автоклавирования различают три типа автоклавов «N», «S» и «В».
В старых моделях автоклавов нагревательные элементы расположены непосредственно в стерилизационной камере, частично заполненной водой для производства
пара. Принцип действия этих автоклавов основан на «эффекте скороварки». Образующийся в результате кипения воды пар вытесняет воздух через клапан, который расположен в верхней части камеры. Данный способ удаления воздуха не является эффективным, поскольку воздух имеет большую молекулярную массу, чем пар, и по закону гравитации оседает внизу стерилизационной камеры и размещенных в ней предметов. Таким образом, в местах, содержащих остатки воздуха, стерилизационный эффект достигнут не будет.
Для проведения качественной стерилизации крайне важно полное удаление воздуха из стерилизационной камеры и полых стерилизуемых предметов. Стерилизация объектов со сложной структурой, имеющих внутренние каналы и полости (например, стоматологических наконечников), производится только в автоклавах класса «В».
Процесс работы автоклава класса «В»:
выбирается тип стерилизационного цикла;
перед началом работы из стерилизационной камеры автоклава откачивается воздух и создается вакуум. Это позволяет удалить воздух из внутренних каналов и полостей стерилизуемых изделий, обеспечить полный доступ к ним горячего пара в фазу стерилизации;
в камере создается необходимая температура и давление, а затем начинается стерилизационная фаза. Для получения пара используется дистиллированная (деминерализованная) вода, не оставляющая осадка. При кипячении воды пар поступает в стерилизационную камеру автоклава сверху;
по окончании стерилизационной выдержки начинается сброс давления из камеры, оставшаяся влага быстро испаряется при отрицательном давлении и высокой температуре. Затем следует этап пульсирующей вакуумной сушки, которая позволяет полностью просушить закладки. Автоклав автоматически отключается в конце цикла.
Управление всем циклом стерилизации и наглядное отображение всех параметров цикла осуществляется при помощи легкого в управлении электронного сенсорного экрана, который расположен на лицевой панели аппарата. Дисплей позволяет оператору осуществлять выбор рабочего цикла, языка, вводить в память и запоминать фамилию пользователя, настраивать контрастность экрана дисплея, переводить автоклав в режим ожидания. Оператор полностью лишен возможности допущения каких-либо ошибок, ввиду полной автоматизации цикла. Осуществляется постоянный мониторинг температуры и давления в стерилизационной камере. В случае недостаточного количества воды в камере цикл прерывается. Есть звуковое и визуальное оповещение прерывания цикла. Кроме того, электронный дисплей напоминает оператору о необходимости выполнения работ по уходу и сервисному обслуживанию аппарата, а также предлагает ему меню для проведения операций по проверке правильности работы автоклава и диагностики каких-либо отклонений в его работе.
Режим автоклавирования выражают в единицах избыточного давления и продолжительности времени (табл. 24). Выбор режима автоклавирования зависит от свойств стерилизуемого материала.
Таблица 24
Метод стерилизации
Паровой
Воздушный
Газовый
Химический
Контроль качества проведения стерилизации необходим для оценки эффективности процесса стерилизации (табл. 27).
Таблица 27
А б
Рис. 70. Индикаторы контроля критических параметров стерилизации:
а — воздушной; б — паровой
Классификация химических индикаторов. По принципу размещения индикаторов на стерилизуемых объектах различают наружные (ленты или наклейки на поверхности упаковок) и внутренние (полоски с индикаторной краской внутри упаковки) индикаторы.
В зависимости от количества контролируемых параметров стерилизационного цикла различают 4 класса химических индикаторов. Чем выше класс индикатора, тем больше параметров стерилизационного цикла он контролирует и тем выше вероятность получения стерильных материалов при его использовании.
Класс 1. Индикаторы процесса стерилизации — наружные индикаторы на индивидуальных упаковках со стерилизуемыми материалами. Они позволяют сделать заключение, что данная упаковка прошла стерилизацию.
Класс 2. Индикаторы одной переменной предназначены для контроля действия одного из факторов стерилизации.
Класс 3. Мультипараметрические индикаторы оценивают действие двух и более факторов стерилизационного цикла.
Класс 4. Интеграторы — аналог биологических индикаторов, контролируют одновременное действие всех параметров метода стерилизации. Принцип действия интеграторов: скорость плавления содержащегося в интеграторе химического вещества идентична скорости гибели споровых форм бактерий, используемых в биологических индикаторах. Биологический метод основан на гибели спор тест-культур бацилл (B. subtilis, G. stearothermophilus) и предназначен для контроля качества проведения стерилизации. Ампулы со спорами должны быть помещены в самые сложнодоступные для пара места, чтобы убедиться, что там была достигнута нужная температура. После автоклавирования ампулу разбивают, содержимое засевают на питательную среду. Посевы инкубируют при 56 º C в течение 24 ч. При эффективном автоклавировании рост на питательной среде не наблюдается.
Контроль паровой и воздушной стерилизации биологическим методом проводится еженедельно, а также при стерилизации имплантируемых материалов, при получении неудовлетворительных результатов химического метода, при выполнении ремонтных работ. Контроль газовой стерилизации биологическим методом — при проведении каждого цикла стерилизации, а также при выполнении ремонтных работ.
Бактериологический метод. При его проведении делают посевы с крупных простерилизованных объектов в тиогликолевую среду (для бактерий) и среду Сабуро (для грибов), мелкие объекты полностью погружают в эти среды. Профильтрованные среды и растворы проверяют на стерильность, помещая их микропробы в термостат при температуре 37 º С. Стерилизация считается эффективной при отсутствии роста.
Бактериологическому контролю подлежат не менее 1 % от числа одновременно простерилизованых изделий одного наименования, но не менее 2 одновременно простерилизованных изделий одного наименования. При стерилизации изделий в неупакованном виде отбор проводят в стерильные емкости, соблюдая правила асептики. При стерилизации изделий в упакованном виде в бактериологическую лабораторию направляют все изделия в упаковке, в которой осуществляли их стерилизацию.
Бактериологический самоконтроль качества стерилизации проводят бактериологические лаборатории ЛПУ не реже 1 раза в месяц. Центры гигиены и эпидемиологии осуществляют контроль стерилизации планово (1 раз в 2 года) и по эпидпоказаниям.
Хранение стерилизованных материалов. Максимальные сроки сохранения стерильности материалов представлены в табл. 28.
Таблица 28
Максимальные сроки сохранения стерильности объектов
в зависимости от вида упаковки
| Вид упаковки | Срок хранения |
| Простой бикс | 3 суток |
| Бикс с фильтром | 20 суток |
| Крафт-пакет со скрепками | 3 суток |
| Крафт-пакет заклеивающийся | 20 суток |
| Бумага, ткань на основе синтетических волокон (2 слоя) | 2 месяца |
| Комбинированные бумажно-пластиковые материалы: – при заклеивании индикаторной упаковочной лентой; – при термозапечатывании на аппаратах | 3 месяцев 6 месяца |
| Синтетические материалы в виде мешков или рулонов при термозапечатывании на аппаратах | 1–5 лет |
Медицинский инструментарий, простерилизованный в крафт-пакетах, хранят в специально выделенном шкафу.
При воздушном методе стерилизации, а также в отдельных случаях при автоклавировании, допускается стерилизация инструментов в открытых лотках в неупакованном виде. Для хранения материала, простерилизованного в открытом виде, накрывается «стерильный стол» на 1 рабочую смену (6 ч) с отметкой даты и времени накрытия.
Манипуляции, связанные с подготовкой «стерильного стола», проводят в стерильных перчатках, халате и маске. Предметы с накрытого «стерильного стола» медицинская сестра должна брать стерильным пинцетом или корнцангом. Пинцеты, корнцанги для забора стерильного материала можно хранить в сухом виде на стерильном лотке между слоями стерильной пеленки, замену их производить через каждые 1, 5 ч. Необходимо иметь стерильную упаковку с 3–4 пинцетами (корнцангами) для замены.
Пространство вокруг стерильного стола — зона ограниченного передвижения. В процессе работы медицинская сестра, имеющая доступ к стерильному столу, не соприкасается с больными. Вызов больных и их сопровождение осуществляет младший медицинский персонал.
ДЕЗИНФЕКЦИЯ
Дезинфекция (обеззараживание) (от лат. de — устранение и греч. infectio — заражение) — совокупность химических, физических и механических способов полного, частичного или селективного уничтожения потенциально патогенных для человека микроорганизмов на абиотических объектах внешней среды с целью предупреждения передачи возбудителей заболеваний от больных и микробоносителей здоровым людям (для разрыва пути передачи возбудителей).
Дезинфекция подразделяется на профилактическую и очаговую.
Профилактическая дезинфекция проводится в местах общего пользования и скопления людей независимо от эпидемической обстановки, при отсутствии выявленных больных. При ее выполнении исходят из предположения, что инфекционный больной мог быть или есть, но остался не выявленным.
Цель профилактической дезинфекции — резкое снижение численности популяций потенциально патогенных для человека микроорганизмов на объектах внешней среды.
Объекты профилактической дезинфекции: неинфекционные ЛПУ; детские учреждения; учреждения образования; места общего пользования и массового скопления людей (вокзалы, транспорт, зрелищные учреждения, общежития, гостиницы, рынки); предприятия пищевой промышленности, учреждения торговли пищевыми продуктами и общественного питания; водопроводные сооружения; парикмахерские, бани, душевые, бассейны; предприятия хранения и переработки животного сырья.
В ЛПУ особое внимание обращают на дезинфекцию инструментария, белья, предметов ухода, воздуха, выделений от больных.
Профилактическую дезинфекцию проводят либо сами организации, либо, на хоздоговорных началах, центры профилактической дезинфекции или дезинфекционные отделы территориальных ЦГЭ.
Организации проводят профилактические дезинфекционные мероприятия, когда их необходимо выполнять постоянно и непрерывно (дезинфекция питьевой воды, пастеризация молочных продуктов, обработка воды в бассейнах, вентиляция в кинотеатрах, спортзалах). Дезинфекционные учреждения санитарно-эпидемиологической службы при этом осуществляют методические и контрольные функции.
В случаях, когда профилактическая дезинфекция носит разовый или периодический характер, она проводится по договорам силами и средствами центров профилактической дезинфекции или дезинфекционных отделов территориальных ЦГЭ (например, дезинфекция производственных помещений после капитального ремонта, периодическая дезинфекция на рынках).
Очаговая дезинфекция проводится в эпидемических очагах с целью селективного уничтожения возбудителя конкретного заболевания. Очаговой дезинфекции подвергаются объекты, которые служат факторами передачи возбудителя этого заболевания.
Эпидемический очаг — место пребывания источника инфекции (больного или носителя) с окружающими его людьми и территорией, в пределах которой возможна передача возбудителя инфекционного заболевания. Размер очага определяется биологическими особенностями возбудителя.
По времени проведения и целевой установке очаговая дезинфекция подразделяется на текущую и заключительную.
Текущая очаговая дезинфекция проводится систематически, весь период нахождения инфекционного больного (носителя) в очаге и направлена на уничтожение возбудителей по мере их выделения больным (носителем) и предупреждения распространения возбудителей.
Показания для проведения текущей дезинфекции:
пребывание больного в очаге до госпитализации;
лечение инфекционного больного на дому до выздоровления;
наличие в очаге микробоносителя до его полной санации;
наличие в очаге реконвалесцентов до снятия с диспансерного учета.
Текущую дезинфекцию организует персонал ЛПУ. Участковый врач при первом посещении больного организует противоэпидемические мероприятия в очаге, инструктирует обслуживающих лиц о проведении дезинфекционных мероприятий и передает дальнейшее наблюдение за очагом среднему медицинскому персоналу, в задачу которого входит обучение методам дезинфекции и контроль за их выполнением. Мероприятия по текущей дезинфекции осуществляются на дому с момента выявления больного до его госпитализации или выздоровления лицами, ухаживающими за больным, или самим больным (носителем). В ЛПУ текущая дезинфекция проводится медицинским персоналом постоянно во время пребывания инфекционных больных.
Заключительная очаговая дезинфекция осуществляется в очаге (обычно однократно) после удаления (госпитализация, выздоровление, выезд, смерть) источника инфекции с целью полного освобождения очага от возбудителей.
В квартирах, где проживает более одного ребенка, в общежитиях, детских дошкольных учреждениях, школах, гостиницах заключительную дезинфекцию проводят центры дезинфекции или дезинфекционные отделы территориальных ЦГЭ при следующих инфекциях:
бактериальных (холере, чуме, сибирской язве, возвратном тифе, эпидемическом и рецидивном сыпном тифе, легочной форме лихорадки Ку, брюшном тифе, паратифах, туберкулезе, лепре, дифтерии, орнитозе);
вирусных (ВГЛ, полиомиелите);
грибковых заболеваниях волос, кожи и ногтей (микроспории, трихофитии, фавусе).
При других инфекционных заболеваниях заключительная дезинфекция проводится в зависимости от эпидемической ситуации по решению эпидемиолога территориального ЦГЭ.
Заявка на заключительную дезинфекцию подается в центр дезинфекции и стерилизации или в дезинфекционный отдел территориального ЦГЭ медработником, выявившим инфекционного больного или эпидемиологом.
Заключительная дезинфекция может проводиться дезинфекторами ЛПУ, а также (под руководством центра дезинфекции, работника ЦГЭ или дезинфектора лечебного учреждения) медперсоналом ЛПУ, медперсоналом детских и подростковых учреждений, населением.
При проведении очаговой дезинфекции:
выделения больного перед сливом в канализацию дезинфицируют;
белье стирают с добавлением дезинфектантов;
постельные принадлежности подвергают камерной дезинфекции;
поверхности в помещении после мытья, а также мягкую мебель и ковры обрабатывают дезинфицирующими аэрозолями;
остатки пищи дезинфицируют, посуду выдерживают в растворе дезинфектанта и моют;
медицинские инструменты стерилизуют;
воздух помещения обрабатывают бактерицидными лампами;
мусор складывают в ведро, заливают дезинфектантом или сжигают;
санитарный транспорт, использованный для перевозки инфекционных больных или трупов, дезинфицируют влажно-механическим способом на специально оборудованной площадке, имеющей сток для смывных вод.
Способы
Различают физические, химические и механические способы дезинфекции.
Химическая дезинфекция в современных условиях имеет наибольшее применение и предполагает использование химических средств дезинфекции (дезинфектантов). Сегодня используется более 400 дезинфектантов.
Требования к дезинфектантам:
Широкий спектр действия. Расширить антимикробный спектр действия дезинфектанта позволяет сочетание нескольких химических агентов в результате аддитивного или потенцирующего эффекта.
Микробицидный эффект.
Хорошая растворимость в воде и образование с ней или с воздухом стойких активных растворов, суспензий, эмульсий, аэрозолей, туманов.
Отсутствие возникновения резистентности больничной флоры к данному препарату; для этого концентрация дезинфектанта препарата должна превышать как минимум в 3 раза минимальную эффективную концентрацию, полученную
в эксперименте.
Безопасность применения для персонала и пациентов (низкая токсичность и аллергенность, отсутствие неприятного запаха, воспламеняемости и взрывоопасности). Следует помнить, что после окончания дезинфекции влажные поверхности подсыхают, органические вещества концентрируются в объеме пористых материалов и на гладких поверхностях, превращаются в тончайшую пленку и с малой интенсивностью выделяют свои молекулы в воздух помещения. Формирующийся при этом аэрозоль дезинфектанта часто не обладает запахом, что создает иллюзию его безвредности. В процессе дыхания, а также через кожу и слизистые оболочки эти молекулы попадают в организм человека и продолжают выполнять свою главную рабочую функцию — подавление жизнедеятельности клеток, но уже в организме человека.
Сохранение активности в обеззараживаемой среде определенный период времени;
Высокая скорость действия (малая экспозиция).
Температура рабочей формы дезинфектанта не ниже 20 º С.
Отсутствие повреждающего действия на обеззараживаемые объекты (не должны вызывать коррозию металлов).
Экологическая безопасность.
Длительность хранения без потери активности.
Простота в приготовлении, применении (желательна готовность к употреблению без предварительной активации или смешивания с другими компонентами) и утилизации отработанного раствора.
Невысокая стоимость.
Для бытовых дезинфектантов — потребительские качества (моющие, чистящие, отбеливающие) и возможность применения без средств защиты.
Дезинфектанты, используемые в учреждениях здравоохранения, должны быть обязательно зарегистрированы в Министерстве здравоохранения Республики Беларусь.
Следует заметить, что на сегодняшний день ни один из применяемых дезинфектантов не обладает всеми перечисленными свойствами, поэтому ведется постоянный поиск новых препаратов. Дезинфицирующие средства создают при составлении композиционных препаратов, в которые с целью направленного изменения свойств (снижения токсичности, увеличения растворимости, придания моющих свойств) включаются, кроме дезинфицирующей основы, другие ингредиенты.
На качество дезинфекции влияют следующие факторы:
концентрация дезинфектанта: при использовании хлорамина 3%-ной концентрации экспозиция составляет 10 мин, 10%-ной — 5 мин;
температура: чем она выше, тем выше скорость реакций, соответственно, быстрее действует дезинфектант;
возраст микробной культуры: старые микробные культуры имеют более толстую КС и сниженный метаболизм, поэтому погибают медленнее;
концентрация микроорганизмов: чем она выше, тем больше вероятность нахождения среди микроорганизмов резистентных особей;
вязкость: чем она больше, тем медленнее действует дезинфектант;
наличие защиты микроорганизмов: если в среде присутствует белок, то он под действием дезинфектанта коагулирует и защищает микроорганизм.
Группы химических дезинфектантов. При всем многообразии дезинфицирующих средств, количество основных действующих веществ, входящих в состав современных дезинфектантов, ограничено (табл. 30).
В зависимости от риска инфицирования, связанного с их применением, выделяют 3 категории инструментов и предметов ухода за больными:
критичные — проникающие при манипуляциях в стерильные ткани пациента, контактирующие с кровью и инъекционными препаратами; они представляют высокий риск инфицирования пациента в случае микробной контаминации этих изделий;
полукритичные — соприкасающиеся с неповрежденными слизистыми оболочками и интактной кожей;
некритичные — контактирующие только с неповрежденной кожей или находящиеся в окружении больного или персонала.
Таблица 30
Действующее вещество
Бактерии
Микобактерии
Споры
Грибы
Вирусы
Примечание:  — полная эффективность;
— полная эффективность;  — ограниченная эффективность;
— ограниченная эффективность;  — отсутствие эффективности.
— отсутствие эффективности.
В зависимости от категории медицинские инструменты и предметы ухода подлежат либо стерилизации, либо различным уровням дезинфекции (табл. 31). В зависимости от количества выживших микроорганизмов дезинфекция делится на 3 уровня: высокий (ДВУ), промежуточный (ДПУ), низкий (ДНУ). Самой жесткой является ДВУ, при которой уничтожаются все вегетативные микроорганизмы (вирусы, включая возбудителей парентеральных гепатитов и ВИЧ, бактерии, в т. ч. микобактерии туберкулеза, грибы рода Сandida и дерматофиты), а количество спор снижается.
Таблица 31
АНТИСЕПТИКА
Антисептика (от греч. anti — против, septicos — гнилостный) — совокупность химических, физических, механических и биологических способов уничтожения или подавления жизнедеятельности потенциально опасных для здоровья человека микроорганизмов на интактных (неповрежденных) или поврежденных коже, слизистых оболочках и в полостях с целью профилактики или лечения инфекционных процессов.
Профилактическая антисептика — предупреждение развития инфекционных заболеваний путем резкого снижения численности микроорганизмов на интактных или поврежденных коже, слизистых оболочках и в полостях.
Категории профилактической антисептики:
гигиеническая антисептика рук;
хирургическая антисептика рук;
антисептика операционного поля;
антисептика свежих неинфицированных ран;
антисептика пупочной раны, опрелостей и ссадин кожи новорожденных;
предупреждение послеродового мастита, микоза стоп, инфекций кожи
и слизистых оболочек.
Руки медицинских работников могут быть фактором передачи патогенных и УП микроорганизмов. Микрофлора кожи рук представлена резидентной (постоянная) и транзиторной популяциями. Резидентная микрофлора обитает в роговом слое кожи, сальных и потовых железах, волосяных фолликулах и представлена эпидермальными стафилококками, дифтероидами, пропионибактериями и др. Транзиторная микрофлора попадает на кожу в процессе работы в результате контакта с инфицированными пациентами или контаминированными объектами внешней среды и сохраняется на коже рук до 24 часов. Она представлена патогенными и УП микроорганизмами (кишечная палочка, клебсиеллы, псевдомонады, сальмонеллы, кандиды, адено- и ротавирусы и др.), характерными для определенного профиля медицинского учреждения.
Требования к проведению антисептики кожи рук:
втирать антисептик только в сухую кожу;
избегать излишков антисептика, для чего необходимо использовать локтевые настенные дозаторы;
не применять салфетки, губки, тампоны и иные предметы для нанесения препарата;
чередовать использование антисептиков, содержащих активно действующие вещества с разными механизмами антимикробного действия;
тщательно выполнять технику проведения обработки;
соблюдать последовательность действий, дозировку препарата и экспозиции обработки на каждом этапе;
использовать спиртовые антисептики на основе этанола, композиций этанола с другими спиртами (изопропанол, пропанол, бутандиол) и другими активно действующими веществами — бигуаниды, ЧАС.
В настоящее время действует инструкция по применению «Гигиеническая и хирургическая антисептика кожи рук медицинского персонала» № 113-0801, утвержденная МЗ РБ 05.09.2001, которая соответствует Европейскому стандарту обработки EN-1500. Согласно регламенту Европейского комитета по стандартизации, данной нормой руководствуются в Бельгии, Дании, Германии, Финляндии, Франции, Греции, Ирландии, Исландии, Италии, Люксембурге, Нидерландах, Норвегии, Австрии, Португалии, Швеции, Швейцарии, Испании, Чешской Республике, Великобритании.
Указанная методика является наиболее оптимальной для гигиенической и хирургической антисептики рук персонала учреждений здравоохранения и не требует постоянного бактериологического контроля эффективности ее проведения.
Инструкция устанавливает единую методику гигиенической и хирургической антисептики кожи рук медицинского персонала, а также может быть использована в фармацевтической, пищевой, коммунальной и других сферах, где необходимо поддерживать микробиологическую чистоту рук.
Гигиеническая антисептика кожи рук предусматривает удаление или уничтожение транзиторной популяции микроорганизмов.
Показания к проведению гигиенической антисептики кожи рук:
перед началом работы;
до и после контакта с больными инфекционными заболеваниями известной или предполагаемой этиологии;
контакт с выделениями больных;
до и после мануальных и инструментальных исследований и вмешательств, не связанных с проникновением в стерильные полости;
после посещения бокса в инфекционных стационарах и отделениях;
после посещения туалета;
перед уходом домой.
Этапы гигиенической антисептики кожи рук:
– вымыть руки теплой проточной водой с нейтральным мылом, тщательно высушить;
– из дозатора настенного нанести антисептик на сухие кисти рук в количестве 3 мл;
– тщательно втирать антисептик в ладонные, тыльные и межпальцевые поверхности кожи рук в течение 30–60 с до полного высыхания, строго соблюдая последовательность движений (рис. 71);
– в течение 1–2 мин наносить питательный крем-лосьон для предупреждения сушащего действия спиртов (в конце рабочей смены — обязательно).
При сильном загрязнении биоматериалами (кровь, слизь, гной и т. д.) сначала удалить загрязнения стерильным ватно-марлевым тампоном или марлевой салфеткой, смоченными антисептиком. Затем на кисти рук нанести 3 мл антисептика и втирать в кожу межпальцевых областей, ладонную и тыльную поверхности до полного высыхания, но не менее 30 секунд; вымыть руки проточной водой с мылом.
Хирургическая антисептика кожи рук предусматривает удаление или уничтожение транзиторной и снижение численности постоянной популяции микрофлоры до субинфицирующих доз.
Показания к проведению хирургической антисептики кожи рук: манипуляции, связанные с контактом (прямым или опосредованным) с внутренними стерильными средами организма (катетеризация центральных венозных сосудов, пункции суставов, полостей, хирургические вмешательства и т. д.).
Этапы хирургической антисептики кожи рук:
в течение 2 мин вымыть кисти рук и предплечья теплой проточной водой с нейтральным жидким мылом, без использования щеток; высушить стерильной салфеткой;
не менее 1 мин обрабатывать ногтевые ложа, околоногтевые валики одноразовыми стерильными деревянными палочками, смоченными антисептиком;
нанести антисептик на кисти рук и предплечья порциями по 2, 5–3 мл из дозатора настенного (расход на одну обработку — 10 мл);
в течение 5 мин втирать антисептик в кожу рук, не допуская высыхания, строго соблюдая последовательность движений (рис. 71);
руки высушить на воздухе;
надеть стерильные перчатки на сухие руки; при длительности операции более 3 ч обработку повторить.
После проведения хирургических манипуляций:
снять перчатки;
вымыть руки теплой водой с жидким мылом в течение 2 мин;
в течение 1–3 мин наносить питательный крем-лосьон для предупреждения сушащего действия спиртов.

Рис. 71. Последовательность движений при проведении антисептики кожи рук
Терапевтическая антисептика — лечение гнойно-воспалительных заболеваний кожи и слизистых путем подавления жизнедеятельности или уничтожения микроорганизмов-возбудителей с целью предупреждения развития генерализованной инфекции.
Необходимо также предупредить повторное попадание микроорганизмов в патологический очаг и развитие суперинфекции и вторичной инфекции. Занос микроорганизмов может произойти из внешней среды, других биотопов организма больного либо может наблюдаться активация эндогенной микрофлоры при снижении резистентности макроорганизма.
Важное значение имеет сохранение нормальной микрофлоры (эумикробиоза) в пораженном биотопе, а в случае изменения эумикробиоза при длительном приеме антисептика необходимо его восстановление.
Этапы терапевтической антисептики:
Очистка места нанесения антисептика от крови, пота, слизи, слущенного эпителия, грязи, пыли, инородных частиц. Некротические массы и нежизнеспособные ткани содержат инородные частицы и множество микроорганизмов, плохо кровоснабжаются и поэтому не обеспечивают защиту организма от возбудителей.
Хирургическая обработка раны, дренирование абсцессов с целью удаления из них гноя.
Внесение антисептического препарата (желательно предварительно выделить возбудителя и определить спектр его чувствительности к антисептикам).
Изоляция обработанного участка от повторного внесения микроорганизмов путем наложения повязки (ватно-марлевой или мазевой). Для улучшения местного кровообращения и экссудации применяют подогрев влажных повязок.
Вспомогательные мероприятия — иммобилизация пораженной области, создание ее приподнятого положения для обеспечения хорошего оттока венозной крови и лимфы и уменьшения воспалительного отека и боли.
Ватно-марлевые повязки используют для лечения травматических, ожоговых и операционных ран. Однако ватно-марлевая повязка не обеспечивает надежную защиту от повторного инфицирования раны и не во всех случаях снижает численность популяции возбудителя, т. к. имеет ряд недостатков:
вскоре после наложения повязка пропитывается парами воды, гноем, раневым экссудатом и становится проницаемой для микроорганизмов из внешней среды;
повязка быстро теряет адсорбционную способность, т. к. ее капилляры забиваются гноем и фибринными сгустками;
концентрация антимикробных препаратов, внесенных перед повязкой в рану, в результате резорбции и впитывания повязкой снижается до суббактерицидной;
срастание нитей повязки с грануляциями, фибринным сгустками и загустевшим гноем делает ее смену болезненной и травматичной для тканей раны;
частая смена повязки, вызванная утратой адсорбционных свойств и необходимостью слежения за динамикой процесса, несет высокий риск попадания в рану микроорганизмов и развития вторичной инфекции;
под повязкой часто создаются термостатические условия для микроорганизмов, находящихся в ране и окружающей ее коже, что приводит к резкому увеличению их численности;
фиксация повязки бинтом на некоторых участках тела ненадежна: повязка спадает, открывая рану, или ее защитно-лечебный участок сдвигается с раны на здоровые участки тела, приводя к повторному инфицированию раны;
рана под такой повязкой доступна для больных, что при появлении боли или зуда несет риск аутоинфекции.
Мазевые повязки используют для лечения инфицированных ран и гнойных очагов. Недостатки мазевых повязок:
мелкоячеистые структуры марли быстро забиваются мазью и вскоре превращаются в монолит, препятствующий транспорту из раны в повязку продуктов распада некротизированных тканей, микроорганизмов и их токсинов, ферментов, аллергенов, в результате чего эти вещества поступают в лимфу и кровь;
высокая адгезия мази к стенкам раны препятствует оттоку раневого экссудата в повязку;
в мазевых повязках затрудняется аэрация раны, сложна дозировка лекарственных веществ и высок риск микробной контаминации.
Современным направлением является обработка раневых поверхностей композиционными препаратами, в состав которых входит целлюлоза, высыхающая на воздухе и образующая на поверхности раны пленку, через которую осуществляется аэрация раны, но не могут попасть микроорганизмы из окружающей среды (диавитол).
Способы
Способы антисептики: химические, физические, механические, биологические.
Химическая антисептика (используется чаще) — уничтожение микроорганизмов с помощью различных химических веществ и препаратов, оказывающих бактерицидное действие.
Требования к антисептикам:
определенный спектр действия: широкий — при хирургической антисептике, узкий — при терапевтической (когда известен вид микроорганизма-возбу-дителя и спектр его чувствительности);
высокая противомикробная активность (действие в малых концентрациях) и быстрота достижения эффекта (в течение 30 с);
микробицидный эффект (гибель) или микробостатический (задержка роста и размножения микроорганизмов) эффект; в большинстве случаев достаточно микробостатического эффекта, микробицидный эффект нужен при антисептике рук хирурга и операционного поля, а также у иммунодефицитных пациентов;
хорошая растворимость в липидах, плохая или умеренная — в воде;
не должны снижать противомикробную активность в присутствии биоорганических субстратов, в процессе стерилизации и хранения; должны быть устойчивыми к свету и температуре;
применение комплексных и комбинированных препаратов допустимо, если совокупный эффект носит аддитивный либо потенцирующий характер, а побочное действие не усиливается. Например, при наличии в ране остатков перекиси водорода хлорофиллипт выпадает в осадок, поэтому после промывания раны перекисью водорода, рану следует промыть стерильным изотоническим раствором хлорида натрия и только после этого внести хлорофиллипт.
определенное время действия: короткое при профилактической антисептике, длительное — при хирургической;
отсутствие повреждающего действия на организм человека (общетоксического, органотропного, аллергенного, мутагенного, онкогенного, тератогенного, раздражающего, дисмикробиотического). Однако это требование не может быть соблюдено в полной мере почти ко всем антисептикам;
не должны окрашивать кожу, пачкать перевязочный материал, белье, издавать запах;
невысокая стоимость;
экологическая чистота.
Следует помнить, что антисептики при длительном хранении часто обсеменяются и сами могут служить факторами передачи, особенно псевдомонас-инфекции. Для профилактики подобного рода осложнений рекомендуется использование антисептиков, приготовленных ex tempore.
Антисептики должны быть обязательно зарегистрированы в Министерстве здравоохранения Республики Беларусь (см. табл. 34).
Фармакопея насчитывает около 30 тысяч наименований химических антисептиков. Группы химических антисептиков:
1. Галоиды (препараты йода, хлора, фтора).
Фтор в чистом виде не используется из-за ядовитости, но широко применяется для активизации других антисептиков, т. к. введенный в молекулу атом фтора значительно повышает активность препарата.
Более широко, как менее токсичные, используют препараты йода: водные 1%-ные растворы йодоната, йодинола, йодопирона; йокс; спиртовой 5%-ный раствор.
Для обработки ссадин, краев ран используют 5%-ный спиртовой раствор йода, хотя его применение ограничено из-за ожогов, особенно у детей и блондинов.
Йодинол — препарат йода с пролонгированным антисептическим действием. Присоединение йода к поливиниловому спирту замедляет выделение йода и удлиняет его взаимодействие с тканями организма, а также уменьшает раздражающее действие йода на ткани. 1%-ный йодинол применяют для полоскания зева и полости рта, для промывания уха, наложения повязок на раны, трофические язвы, ожоговые поверхности и отморожения.
Йодонат — водный раствор комплекса поверхностно-активного вещества с йодом (содержит около 4, 5 % йода), обладает бактерицидным и фунгицидным действием. Перед употреблением исходный раствор йодоната разводят в 4, 5 раза стерильной или кипяченой дистиллированной водой.
Из препаратов хлора используются водные растворы хлорамина: 0, 5%-ный — для антисептической обработки рук, промывания плевральной полости при эмпиеме плевры, 1–2%-ный — для промывания гнойных ран, 2–4%-ный — для антисептической обработки каналов корня зуба.
2. Окислители (перекись водорода и перманганат калия) особенно эффективны при анаэробных инфекциях.
Для промывания ран, полости рта, ушей, спринцеваний используют 3%-ный раствор перекиси водорода. Антисептическое действие объясняется как сильным окислительным действием, так и вспенивающим эффектом (не заливать в полости! ). При контакте с раной перекись водорода разлагается с освобождением кислорода, образуется обильная пена, которая вымывает гной и некротические ткани из ран и полостей. Сильным антисептическим действием обладает 6%-ная перекись водорода, которую используют для местного лечения только при анаэробной инфекции.
Пергидроль содержит около 30 % перекиси водорода, используется для приготовления раствора первомура.
Перманганат калия применяется только местно, т. к. отмечается высокий прижигающий и дубящий кожу эффект. Слабые растворы используют для промывания ран (0, 1%-ный раствор) и полостей (0, 01%-ный раствор).
Газообразный кислород (без избыточного давления) используют для лечения гнойных ран, трофических язв, ожогов.
При гипербарической оксигенации (с избыточным давлением кислорода в барокамере 1–3 атм) достигается активизация процессов регенерации при воспалениях и атрофических изменениях.
3. Слабые неорганические (борная) и органические (муравьиная, налидиксовая, пипемидиновая, бензойная, салициловая) кислоты.
Борная кислота (в виде 3%-ных водных и спиртовых растворов, мазей, присыпок) используется для лечения различных гнойно-воспалительных процессов, т. к. она активна против Грам– микрофлоры, особенно синегнойной палочки и протея.
Муравьиная кислота — применяется для приготовления раствора первомура.
Ацетилсалициловая кислота и ее аналоги обладают противовоспалительным действием. Местно ее используют в виде 1%-ных водных и спиртовых растворов, присыпок, 40%-ных мазей.
Н алидиксовая и пипемидиновая кислоты входят в состав многих лекарственных форм.
4. Слабые щелочи (аммиак, бура, гидрокарбонат натрия).
5. Соли тяжелых металлов: серебра (нитрат серебра, колларгол, протаргол), меди (сульфат меди), цинка (сульфат цинка), ртути (ртутная мазь), висмута (ксероформ).
Наиболее активными антисептиками являются препараты серебра. Нитрат серебра используют для промывания гнойных ран и мочевого пузыря (0, 03–0, 1%-ный водный раствор), для промывания ран, полостей, спринцеваний, наложения повязок, полоскания горла и полости рта, в офтальмологии (0, 5–1%-ный раствор), для прижигания избыточных грануляций ран (1–2%-ные растворы), для лечения гнойных ран, ожогов, отморожений (1–2%-ные мази), для обработки внутренних свищей (10%-ный раствор). При рожистых воспалениях используют 15%-ную мазь. Препараты серебра сочетаются с другими антисептиками, что делает их более активными. 0, 2 – 1%-ные растворы колларгола и протаргола используют для промывания глаз, мочевого пузыря, влагалищных спринцеваний, наложения повязок на раны и язвы.
Сульфат меди в виде 0, 25%-ного раствора применяют: в офтальмологии — для лечения конъюнктивитов, блефаритов; в урологической и гинекологической практике — при уретритах, циститах, вагинитах. При пролиферативных воспалениях препарат подводят с помощью электрофореза. Но препараты меди являются очень слабыми антисептиками и действуют, в основном, только на кокковую микрофлору.
Препараты цинка практически не обладают антисептическим действием, но имеют высокий противовоспалительный эффект. С этой целью 0, 25%-ные растворы используют в офтальмологии, оториноларингологии, урологии, гинекологии. В хирургической практике применяют мази и пасты оксида цинка для защиты кожи при свищах, лечения трофических язв, дерматитов, микозов (паста Теймурова, паста Лассара). Лечение геморроя, трещин заднего прохода проводят свечами комплексного состава («Нео-анузол»).
6. Спирты (этиловый и поливинилбутиловый).
Этиловый спирт используют для обработки краев ран, рук хирурга и операционного поля, кожи больного при инъекциях, а также для лечения заболеваний, особенно в дерматологии и оториноларингологии.
96%-ный спирт обладает дубящим действием на микроорганизмы и коагулирующим — на кожу, сохраняя микрофлору в порах кожи, поэтому его применение ограничено. 70%-ный спирт глубоко проникает в кожу, растворяя жиры в сальных железах, на микроорганизмы действует бактерицидно. Этиловый спирт применяют также с другими антисептическими добавками (фурациллин, борная кислота, ацетилсалициловая кислота, хлоргексидин и др.), что усиливает его собственные антисептические свойства.
Как и другие антисептики деструктивного типа действия, этиловый спирт обладает рядом недостатков:
повреждает ткани, в которые вносится. Образующаяся при разрушении макромолекул пленка создает непроницаемый для антисептика барьер. В результате микроорганизмы, находящиеся под пленкой или в потовых и сальных железах, волосяных фолликулах кожи, остаются жизнеспособными и могут проявить патогенное действие;
оказывает раздражающее, прижигающее действие на ткани;
при длительном применении возможно развитие дисбиоза.
Примером спиртсодержащего многокомпонентного антисептика для обработки рук является «АХД - 2000 - специаль», в котором действующим веществом является этиловый спирт с добавлением хлоргексидина биглюконата, что обеспечивает пролонгированный антимикробный эффект и расширяет спектр активности препарата. Кроме этого, в состав входят эфиры жирной полиольной кислоты, играющие роль увлажняющей добавки. В отличие от глицерина, который часто добавляется с этой же целью, эфиры полиольной кислоты действуют не только на поверхностные, ороговевшие слои кожи, но и на более глубокие, не затрудняют дыхание кожи, не приводят к отсроченной потере кожей влаги и не вызывают ее сухости. Те же цели преследует добавление в некоторые комбинированные антисептики на основе спиртов антиоксидантных комплексов (например, токоферола ацетата и масла виноградных косточек в «Клиндезин-элит»).
Поливинилбутиловый спирт (винилин, бальзам Шостаковского) — применяют в чистом виде или в форме линиментов и 20–50%-ных растворов в масле при воспалительных заболеваниях и ожогах слизистой оболочки полости рта. Препарат способствует очищению раневых поверхностей, усиливает регенераторные процессы и эпителизацию. Для усиления антимикробной активности используют в комбинации с антибиотиками: аэрозоль «Левовинизоль» (содержит хлорамфеникол, винилин, цитраль, линетол, этиловый спирт и пропеллент).
7. Альдегиды (формальдегид): уротропин, формалин, формальдегид, лизоформ.
8. Фенолы: резорцин, бесалол, деготь березовый, линимент бальзамический по Вишневскому, карболовая кислота, ихтиол.
9. Красители: бриллиантовый зеленый, метиленовый синий, этакридинлактат (риванол).
Сами красители — слабые антисептики, действуют в основном на кокковую микрофлору. Активность их усиливается за счет растворителя — 70%-ного спирта, хотя широко применяют и водные растворы. Препараты не раздражают ткани и слизистые, вызывают их подсушивание, что особенно важно при экссудативных воспалениях. Спиртовые (1–3%-ные) растворы применяют для обработки краев ран, ссадин, язв. Водные растворы используют в разведении 1: 5000.
10. Детергенты (хлоргексидин, этоний, октенидин) — сильнодействующие поверхностноактивные соединения, самые активные антисептики местного действия против всех микроорганизмов, включая вирусы и грибы. Кроме того, они обладают местным антитоксическим действием, связывая токсины стафилококка.
Хлоргексидина биглюконат (гибитан, абацил, ротерсепт). 0, 06%-ный водный раствор используют для ротовых ванночек с целью предотвращения образования зубных отложений. 0, 5%-ный водный раствор — для промывания ран и полостей. Для обработки рук, операционного поля и кожи перед инъекциями применяют 0, 5%-ный раствор хлоргексидина в 70%-ном спирте («Гибитан»), водный раствор «Дегмицида».
Последний используют также для промывания и дренирования ран, лечения язв, поверхностных гнойных процессов. На основе детергентов готовят пленкообразующие препараты («Церигель»), мази («Этоний»), которые обладают местно-анестезирующим действием и стимулируют заживление ран, язв, ссадин.
11. Димексид (диметилсульфоксид) — наружное средство для местного применения при воспалительных процессах, хорошо проникает через биологические мембраны. Оказывает анальгетическое и противовоспалительное действие.
Применяют как в неразведенном, так и в виде 10–70%-ных водных растворов.
В стоматологии используют 10%-ный раствор димексида в комбинированных пастах для наложения лечебных повязок при лечении глубокого кариеса, а также для обезболивания при препарировании кариозной полости.
12. Производные тиосемикарбазона (амбазон (фарингосепт)) обладают сильным бактериостатическим действием в отношении стрептококков и пневмококков, местным противовоспалительным и обезболивающим действием.
Их применяют в виде сублингвальных таблеток для местного лечения заболеваний полости рта и гортани (ангин, тонзиллитов, стоматитов, гингивитов, фарингитов), в послеоперационном периоде после тонзиллэктомии и экстракции зубов.
13. Фалиминт (ацетиламинонитропропоксибензен) оказывает анальгезирующее, жаропонижающее, антисептическое и слабовыраженное местноанестезирующее действие. Устраняет непродуктивный раздражающий кашель, при рассасывании создает чувство прохлады в полости рта и глотке.
Применяют при воспалительных заболеваниях дыхательных путей (тонзиллите, фарингите, ларингите); при подготовке к инструментальным исследованиям полости рта и зева, снятию слепков и примерке зубных протезов.
14. Антисептики природного происхождения обладают высокой антибактериальной активностью, противовоспалительными свойствами, дают умеренный обезболивающий эффект, активизируют регенерацию слизистых оболочек.
Используют:
продукты переработки нефти (нафталанская нефть);
минеральные масла и бальзамы (березовый деготь, ихтиол, цигерол,
цитраль);
спиртовые настойки и отвары растений (календулы, эвкалипта, прополиса): ротокан, новоиманин (из зверобоя), натрия уснинат (из лишайников), хлорофиллипт (из листьев эвкалипта). Хлорофиллипт обладает антибактериальной активностью в отношении антибиотикорезистентных штаммов стафилококков;
эфирные масла (гвоздичное, мятное);
фитонциды (чеснока, лука (аллилчеп)).
Таблица 34
Препараты НПО «БелАсептика», зарегистрированные МЗ Республики Беларусь
и рекомендованные к применению
| Препарат | Цель применения |
Дезинфектанты
Дезинфекция и предстерилизационная очистка ИМН, дезинфекция поверхностей
Антисептики
Средства для антисептики рук
Пути введения антисептиков:
Наружное — в виде порошка, мази, раствора, используют для лечения ран.
Полостное — в полости суставов, в брюшную, плевральную полости.
Энтеральное — через желудочно-кишечный тракт.
Парентеральное — подкожное, внутримышечное, внутривенное.
Эндоскопическое — через бронхоскоп в бронхи, в полость абсцесса
легкого, через фиброскоп — в пищевод, желудок, 12-перстную кишку.
Эндолимфатическое — в лимфатические сосуды и узлы.
Местное — при воспалительных процессах в гастроэнтерологии (под брюшину, в корень брыжейки) и в гинекологии.
Физическая антисептика основана на использовании текучести гноя и экссудатов, гигроскопических свойствах перевязочного материала, регенераторных способностях тканей. Антимикробная резистентность тканей усиливается под воздействием физических факторов, используемых в физиотерапии. Физическая антисептика предполагает использование следующих физических факторов:
Хирургической обработки раны — удаление патологических субстратов и иссечение нежизнеспособных тканей, которые служат питательной средой для возбудителей, содержат токсические вещества микробного и аутогенного происхождения, резко снижают эффективность антисептиков и антибиотиков, блокируют доступ противомикробных веществ к адгезированным микроорганизмам.
Сорбции с использованием гигроскопических материалов (марли, ваты) и углесодержащих сорбентов, вводимых в рану и адсорбирующих на себе токсины и микроорганизмы. Марлевый тампон сохраняет гигроскопичные свойства в ране около 8 ч, затем он становится препятствием для оттока экссудата. Тампон в рану вводится рыхло, чтобы через 8 ч отток отделяемого мог бы идти и помимо самого тампона. При тугом тампонировании тампоны подсыхают у выхода из раны и препятствуют оттоку гноя и экссудата.
Дренирования, основанное на естественной текучести гноя и на принципе сообщающихся сосудов. Дренирование применяется при лечении ран, после операций на грудной и брюшной полости. Виды дренирования:
пассивное — когда гной из раны оттекает самотеком по резиновому дренажу. Дренаж находится в нижнем углу раны, его свободный конец — ниже раны, обычно его опускают во флакон с антисептиком. На дренаже обычно делают дополнительно несколько боковых отверстий на случай закупорки основного отверстия;
активное — в области наружного конца дренажа создается отрицательное давление. Для этого к дренажам прикрепляется вакуумная груша или электрический отсос. Активное дренирование возможно, если на всем протяжении раны наложены герметичные швы;
промывное — в рану устанавливают два дренажа, по одному из них постоянно вводят антисептический раствор. Количество жидкости, оттекающей из другого дренажа, должно быть равно количеству введенной;
Использования гипертонических растворов, осмотическое давление которых выше, чем в плазме крови. Чаще используют 10%-ный раствор NaCl. При смачивании тампонов гипертоническим раствором за счет разницы осмотического давления отток жидкости из раны идет более активно.
Использования физиотерапевтических средств (ультразвука, лазера, рентгенотерапии, микроволновой и магнитотерапии, УФО, кварца, электрофореза) для стимуляции регенераторных процессов.
С помощью низкочастотного ультразвука очищают раны, бронхи, плевральную, брюшную полости от гноя, некротических масс, отложений фибрина. Среднечастотный ультразвук используют для стимуляции заживления регенерирующих гнойных ран. Звук частотой выше 20 кГц оказывает цидное действие на микроорганизмы и применяется для ультразвуковой кавитации гнойных ран. В рану наливают раствор антисептика и вводят наконечник прибора с высокочастотными ультразвуковыми колебаниями. Колебания жидкости способствуют улучшению микроциркуляции в стенках раны, быстрому отторжению некротических тканей, ионизации воды и нарушению окислительно-восстановительных процессов в микробных клетках.
Низкоэнергетическое лазерное облучение, улучшающее кровоток и микроциркуляцию, применяют в оториноларингологии, офтальмологии, пульмонологии. В хирургии для лечения гнойных ран используют высокоэнергетическое лазерное облучение и энергию плазменной струи. Их действие основано на выжигании гнойных и некротически измененных тканей высокой температурой (1500–3000 º С). После такой обработки рана становится стерильной, раневая поверхность покрывается ожоговым струпом.
Рентгенотерапия применяется для обработки небольших, глубоко расположенных гнойных очагов (например, при остеомиелите).
Микроволновую (УВЧ, дециметроволновую, сантиметровую) и магнитотерапию применяют для стимуляции регенераторных способностей тканей (только при вскрытых гнойниках). Высоким терапевтическим эффектом обладает электрофорез и синусоидальные модульные токи с антисептиками на очаг инфекции. Основное их действие заключается в улучшении микроциркуляции и рассасывании инфильтратов.
Использование факторов внешней среды при лечении ожогов: в палатах поддерживают высокую температуру и низкую влажность, это способствует быстрому образованию струпа на ожоговых ранах.
Механическая антисептика — применение механических методов, способствующих удалению из раны инородных тел, нежизнеспособных и некротизированных тканей, которые являются хорошей средой для размножения микроорганизмов.
Любая случайная рана считается инфицированной, но не каждая нагнаивается. Это связано с тем, что для развития в ране инфекции необходима определенная концентрация микроорганизмов — 105 микробных тел на 1 г ткани. Однако инфекция может развиться в ране и при меньшей бактериальной обсемененности, например, при сахарном диабете, анемии, снижении резистентности организма, использовании иммуносупрессивной терапии. Поэтому любая случайная рана должна быть обработана. Основными методами механической антисептики являются туалет раны, первичная и вторичная хирургическая обработка.
Туалет раны — очищение раневой поверхности, удаление гнойного экссудата, сгустков крови. В хирургии используют промывание ран перекисью водорода, которая является не столько химическим антисептиком, сколько механическим,
т. к. сильно вспенивается и вымывает микроорганизмы и нежизнеспособные ткани из ран и гнойников. В оториноларингологии и в офтальмологии применяют промывание полости уха или глаза струей антисептиков, полоскание горла антисептиками. В торакальной хирургии и пульмонологии отсасывают гной из бронхов и промывают бронхиальное дерево антисептиками при бронхоскопии, проводят промывное дренирование плевральной полости.
Первичная хирургическая обработка раны — комплекс мероприятий, направленных на превращение инфицированной раны в стерильную. Первичная хирургическая обработка включает следующие этапы:
ревизия раны;
рассечение;
иссечение краев, стенок и дна раны;
удаление гематом, инородных тел и очагов;
восстановление целостности поврежденных тканей.
ПХО значительно уменьшает микробную обсемененность раневой поверхности.
Вторичная хирургическая обработка — комплекс мероприятий, направленных на превращение раны, в которой уже развилась инфекция, в стерильную. К вторичной хирургической обработке относятся иссечение нежизнеспособных тканей, вскрытие и санация гнойных затеков, дренирование ран.
Механические и физические средства антисептики эффективны в период сосудистых изменений и очищения раны от некротизированных тканей, т. к. способствуют отторжению погибших тканей, эвакуации патологического содержимого, стимулируют рост грануляций, организацию рубца и эпителизацию.
Наиболее радикальным методом механической антисептики является удаление пораженного органа или участка мягких тканей: при поверхностных абсцессах — удаление их в пределах здоровых тканей; при гнойных воспалениях органов брюшной полости — их резекция (аппендэктомия, холецистэктомия); при абсцессах легкого — резекция доли легкого; при гангрене конечностей — ампутация.
Биологическая антисептика — прямое (бактериофаги, протеолитические ферменты) или опосредованное (препараты из бактерий-антагонистов) уничтожение микроорганизмов с участием биологических веществ.
Бактериофаги (бактериальные вирусы) применяют местно или перорально с профилактической и терапевтической целью. Часто используют стафилококковый, синегнойный, колифаг, протейный, сальмонеллезный, брюшнотифозный, дизентерийный, комбинированный бактериофаги. Для бактериофагов характерна высокая специфичность действия, поэтому они лишены побочных эффектов. Однако риск осложнений, связанных с введением большого количества биологического материала во внутреннюю среду организма, и высокие антигенные свойства фагов препятствуют их использованию в качестве химиотерапевтических препаратов.
Протеолитические ферменты, вырабатываемые поджелудочной железой (трипсин, химотрипсин, дезоксирибонуклеаза), а также ферменты растительного происхождения (клостридиопептидаза) оказывают некролитическое, бактерицидное, противовоспалительное действие.
Ферменты переваривают нежизнеспособные ткани, способствуя их отторжению и разжижению за счет лизиса, что облегчает выведение гноя, очищение ран и полостей. При применении энзимотерапии гнойные раны очищаются в 3–4 раза быстрее. На здоровые ткани ферменты не действуют, т. к. инактивируются ингибиторами. Ферменты могут использоваться местно (в гнойную рану, на некроз, струп) в виде мазей, присыпок, кремов. Они хорошо сочетаются с другими антисептиками, могут применяться в виде растворов (для промывания полостей суставов, бронхиального дерева, полости плевры и др.). Введение ферментов
в состав перевязочного материала увеличивает время их действия до 24–48 ч. Доставка ферментов в очаг воспаления возможна с помощью электрофореза.
Пробиотики (бактисубтил, бификол, бифидумбактерин, лактобактерин, колибактерин), полученные из бактерий-антагонистов, применяют для коррекции дисбиоза кишечника, влагалища, лечения ран. Механизм противомикробного действия этих препаратов связан с продукцией бактериями-антагонистами бактериоцинов и кислот (молочной, муравьиной, уксусной).
Требования, предъявляемые к препаратам из бактерий-антагонистов:
штаммы, из которых изготавливаются бактериальные препараты, должны относиться к непатогенным или стабильно авирулентным вариантам УП видов бактерий;
вносимый штамм должен обладать свойством приживаться в биотопе и размножаться в нем;
штамм, из которого готовят антибактериальный препарат, должен обладать стабильно высокой конкурентной активностью к патогенным и УП микроорганизмам;
в биотопе, в который вносится штамм-антагонист, должны быть оптимальные условия для его обитания;
эти препараты изготавливают из продуцентов, обладающих высокой резистентностью к антибиотикам, поэтому они могут использоваться в сочетании с антибиотиками;
кишечные заболевания часто сопровождаются ферментативной недостаточностью, поэтому предпочтительно использовать штаммы бактерий, которые обладают не только антисептической, но и ферментативной активностью (бактисубтил).
Смешанная антисептика — сочетание нескольких способов антисептики. Сочетают методы местного воздействия, например, вскрытие гнойника (механическая антисептика), дренирование его (физическая антисептика) турундой с диоксидиновой мазью (химическая антисептика), предварительно присыпав дно трипсином (биологическая антисептика).
Применение одного способа, как правило, оказывается малоэффективным, поэтому основное направление взято на комплексное использование всех методов антисептики.
Особенности применения антисептиков
в стоматологической практике
При применении антисептиков в стоматологической практике следует соблюдать следующее:
Большинство стоматологических заболеваний — местные процессы, поэтому антисептики предпочтительнее антибиотиков: они позволяют создать большую концентрацию в очаге, обеспечить более щадящее лечение с минимальным воздействием на внутренние органы, т. к. благодаря липофильности антисептики слабо всасываются.
Необходимо учитывать особенности фармакодинамики: подбирать антисептики с минимальным всасыванием, т. к. полость рта обладает высокой всасывающей способностью водорастворимых соединений и при всасывании из полости рта препарат минует печень.
В стоматогенных воспалительных процессах ведущую роль играют микробные ассоциации (Грам+ и Грам– микроорганизмы), поэтому предпочтительнее антисептики широкого спектра действия. Однако, если эффективен антисептик узкого спектра действия, ему следует отдать предпочтение (обычно антисептики узкого спектра действия менее токсичны).
Микробостатические препараты предпочтительнее (менее токсичны), при катаральном воспалении иногда достаточно применения растительных антисептиков (ромашка, кора дуба). Однако, если имеется иммунодефицитное состояние и планируется оперативное вмешательство, необходимо использовать микробицидный антисептик.
Необходимо минимализировать побочное действие антисептика на органы и ткани (например, при закладывании антисептика в полость зуба не допускать его попадания на слизистые во избежание ожога).
Антисептик в полости рта может частично разводиться слюной, поэтому нужно исходно брать более высокие дозы с учетом разведения и применять антисептик чаще.
Задержку антисептиков в полости рта обеспечивает их добавление в пломбировочные материалы.
Для предупреждения аллергических реакций на антисептики обязательно следует собрать аллергологический анамнез у пациента.
Из нескольких возможных вариантов антисептиков с одинаковой эффективностью следует выбирать более дешевый препарат.
Для профилактики ятрогенных инфекций необходим периодический бактериологический контроль растворов антисептиков, т. к. в растворах антисептиков могут присутствовать и даже размножаться некоторые микроорганизмы (синегнойная палочка, стафилококк). Оптимальным является удобная фасовка (для одного пациента) и быстрое использование стерильных растворов антисептиков.
АСЕПТИКА
Асептика (от греч. а — отрицание и septicos — гнойный) — совокупность противомикробных мероприятий, направленных на предупреждение развития инфекционного заболевания во время медицинских вмешательств или нарушений технологического процесса при микробиологических исследованиях и производстве различных материалов (табл. 35).
Таблица 35
Методы асептики
Методы асептики
Прямые
Косвенные
направленные
на объекты
внешней среды
направленные
на живые
организмы
Разделительные
ПРОТИВОМИКРОБНЫЙ РЕЖИМ
Противомикробный режим — совокупность строго регламентированных техническими нормативными правовыми актами (Санитарными правилами, приказами Министерства здравоохранения) и обязательных для выполнения противомикробных мероприятий в лечебных, детских или иных учреждениях и производствах.
Ответственность за организацию и проведение санитарно-гигиеничес-ких мероприятий возлагается на руководителя учреждения (главного врача ЛПУ, заведующего ДДУ, директора школы, директора производства). Контролирующая функция по его соблюдению осуществляется врачом-эпидемиологом или врачом по коммунальной гигиене территориального центра гигиены и эпидемиологии. В штатной структуре крупных ЛПУ есть врач-эпидемиолог, осуществляющий вспомогательно-контролирующие функции.
В приемном отделении ЛПУ противомикробный режим предусматривает:
исключение встречных потоков больных;
осмотр кожных покровов и зева, термометрию поступающих больных для своевременного выявления подозрительных на инфекционные заболевания; в случае обнаружения больного с подозрением на инфекционное заболевание мебель, предметы и помещение дезинфицируют;
полную санитарную обработку поступающего пациента (душ или ванна с продезинфицированной мочалкой, подстригание ногтей);
маркировку инвентаря, кушетка должна быть покрыта клеенкой;
уборку не реже 2 раз в день влажным способом с применением дезинфектантов.
В отделениях ЛПУ противомикробный режим предусматривает:
наличие индивидуальных предметов ухода у каждого пациента;
гигиеническую ванну (душ) не реже 1 раза в 7–10 дней;
смену постельного и нательного белья не реже 1 раза в 7–10 дней, для послеоперационных больных, для пациенток послеродовых палат — ежедневно, для новорожденных — несколько раз в сутки по мере необходимости;
проветривание палат не реже 4 раз в день;
камерную дезинфекцию одежды перед передачей от одного больного другому; с разрешения главного врача пациент может пользоваться собственным бельем со сменой его по графику;
больничную обувь протирают тампоном, смоченным 25%-ным формалином или 40%-ной уксусной кислотой, помещают в полиэтиленовый пакет на 3 ч, вынимают и проветривают 10–12 ч до исчезновения запаха препарата;
проведение внеочередного медосмотра всего медперсонала при появлении случая ВБИ.
ГЕНЕТИКА БАКТЕРИЙ
Генетика бактерий — наука о наследственности и изменчивости бактерий.
НАСЛЕДСТВЕННОСТЬ БАКТЕРИЙ
Наследственность бактерий — способность бактерий сохранять и передавать дочерним клеткам родительские признаки.
Бактерии обладают рядом важных преимуществ перед другими организмами и являются удобным материалом для генетики, т. к.:
имеют короткий период генерации: многие бактерии делятся каждые
20–40 мин и быстро накапливают биомассу;
многие из них легко культивируются в лабораторных условиях на сравнительно простых питательных средах;
малые размеры микроорганизмов позволяют получать в одной пробирке или чашке и исследовать массовые популяции, состоящие из 108–1010 отдельных клеток, и благодаря этому выявлять такие редкие события, как мутация или передача приобретенного признака, без сложных вспомогательных средств и довольствуясь малым пространством;
они гаплоидны (имеют один набор генов), что исключает доминантность признаков;
обладают высокой частотой рекомбинаций и мутаций;
генетический обмен выходит за пределы вида;
некоторые имеют половую дифференциацию в виде донорских и реципиентных клеток;
имеют различные интегрированные в хромосомы и обособленные фрагменты ДНК.
Роль микоплазм в патологии
| Вид | Патология |
| M. pneumoniae | Заболевания дыхательных путей, в т. ч. атипичные пневмонии |
| M. hominis | Заболевания урогенитальной сферы (уретриты, пиелонефриты, простатиты, кольпиты, эндоцервициты, сальпингиты, оофориты) |
| M. fermentans | Вульвовагиниты, ревматоидный артрит, фарингиты, ОРЗ |
| M. arthritidis | Ревматоидный артрит |
| U. urealyticum | Острые и хронические воспалительные процессы урогенитальной сферы (уретриты, циститы, гломерулонефриты) |
Род Mycoplasma включает 69 видов, наибольшую роль в патологии человека играют облигатно-патогенная M. pneumoniae и условно-патогенные M. ho - minis, M. anthritidis, M. fermentes.
Респираторные инфекции, вызываемые M. pneumoniae (фарингиты, пневмонии), широко распространены во всех странах мира. Микоплазменную этиологию имеют 10–30 % пневмоний. Больной человек заразен во всех стадиях заболевания, начиная с инкубационного периода до 2 месяцев после перенесенного заболевания. При семейных вспышках больше всего страдают дети. В раннем детском возрасте респираторная микоплазменная инфекция протекает тяжело: часто наблюдается генерализация процесса с развитием патологических очагов в других внутренних органах. У взрослых иногда наблюдаются бессимптомные формы микоплазмоза.
Микоплазмы стимулируют пролиферацию окружающих их клеток макроорганизма, оказывают непрямое повреждающее действие на ткани и повышают чувствительность клеток к вирусам (вирусы интенсивно размножаются именно в делящихся клетках). Поэтому нередки сочетания микоплазмоза с респираторными вирусными инфекциями.
УП микоплазмы с разной частотой выделяются из органов и тканей клинически здоровых людей и само их присутствие в организме не определяет обязательного развития каких-либо патологических процессов. Однако условно-патогенные для здорового человека микоплазмы вызывают заболевания у лиц с иммунодефицитами. Таким образом, это эндогенные урогенитальные и респираторные инфекции, часто вызываемые ассоциациями микоплазм с другими микроорганизмами. Увеличение числа иммунодефицитных лиц, нарушение экологических взаимоотношений хозяина и его микрофлоры в результате применения антибиотиков широкого спектра действия, длительное применение гормональных контрацептивов увеличивают риск развития микоплазмозов.
Возможна этиологическая роль микоплазм в развитии ревматоидного артрита (M. fermentes, M. artritidis, M. pneumoniae) и болезни Рейтера (M. hominis, M. artritidis). В инициации процесса ведущую роль играют микоплазмы, длительно взаимодействующие с мембраной клеток синовиальной оболочки суставов и иммунокомпетентных клеток, оказывая на них повреждающее действие.
В дальнейшем развитии заболевания решающую роль играет аутоиммунный компонент: активация реакций клеточного и гуморального иммунитета и процессы, связанные с образованием иммунных комплексов.
Род Ureaplasma включает УП для человека вид U. urealiticum (названный так из-за уреазной активности), вызывающий острые и хронические воспалительные процессы урогенитальной сферы. Уреаплазмы активизируются во время беременности и могут быть причиной преждевременных родов и спонтанных абортов.
Влияние микоплазм и уреаплазм на репродуктивную функцию. Наиболее часто встречающиеся в половых путях микоплазмы (M. hominis, M. fermentans, M. primatum, M. genitalium и U. urealyticum) в последние 20 лет рассматривались как предполагаемая причина самопроизвольных абортов, мертворождений, преждевременных родов, гипотрофий у детей, воспалительных заболеваний малого таза, послеродовых инфекций, вторичного бесплодия. Однако предположения о том, что генитальные микоплазмозы могут быть причиной прерывания беременности, основываются на исследованиях по методу «случай–контроль», в которых более высокий уровень колонизации микоплазмами обнаруживается среди женщин с неблагоприятными исходами беременности по сравнению с теми, у которых беременность заканчивалась нормально. Как это характерно для всех исследований, проводимых таким образом, и другие, как известные, так и неизвестные факторы могли также быть при этом причиной неблагоприятного исхода беременности вне зависимости от наличия или отсутствия микоплазмоза.
В любом случае не следует отрицать, что вторичное бесплодие у обоих полов связано с хроническими воспалительными процессами урогенитальной сферы различной этиологии. Часто встречаются микст-инфекции в различных сочетаниях (уреаплазмоз, хламидиоз, гонорея, трихомоноз). Описано также воздействие уреаплазм на сперматогенез и сперматозоиды: уреаплазмы адсорбируются на поверхности сперматозоидов, изменяют их подвижность и морфологию.
Степень колонизации урогенитального тракта микоплазмами и уреаплазмами связана с количеством половых партнеров, возрастом, уровнем образования и доходов, семейным положением. У здоровых сексуально активных женщин уреаплазма выделяется в 40–95 %, а микоплазма — в 15–70 %. У беременных и небеременных женщин микоплазмы выявляются с одинаковой частотой.
Инфицирование плода микоплазмами и уреаплазмами может происходить внутриуробно (через околоплодные воды восходящим путем из цервикального канала, гематогенным путем), а также при прохождении новорожденного через родовые пути.
Внутриутробное инфицирование микоплазмами приводит к преждевременным родам, выкидышам, мертворождениям. Воздействие микоплазм на хромосомный аппарат инфицированных клеток может приводить к аномалиям развития. У недоношенных новорожденных микоплазмозы протекают тяжело: поражаются органы дыхания (врожденная пневмония), нервная система, часто наблюдается гипотрофия. У доношенных новорожденных возможна бессимптомная колонизация микоплазмами.
Колонизация влагалища уреаплазмой отмечается у 1/3–1/2 новорожденных девочек, у 25 % новорожденных уреаплазмы колонизируют носоглотку, у 10 % — прямую кишку.
Метод родоразрешения на частоту колонизации не влияет. При безводном промежутке в родах менее 1 ч частота колонизации снижается до 20 %. В течение первого года жизни процент колонизации прогрессивно снижается и в препубертатном периоде встречается редко. После периода полового созревания колонизация нарастает вместе с частотой половых контактов.
При лечении микоплазмозов и уреаплазмозов следует помнить, что микоплазмы обладают естественной резистентностью к β -лактамным антибиотикам и другим лекарственным препаратам, подавляющим синтез КС (из-за ее отсутствия у возбудителя).
Методы изучения морфологии микоплазм:
В световом микроскопе в мазках, окрашенных по Романовскому–Гимзе, обнаруживаются лишь самые крупные формы микоплазм.
ФКМ и ТПМ нативных препаратов для выявления нитевидных форм.
Электронная микроскопия для выявления ультраструктурных компонентов микоплазм.
В табл. 18 приведена сравнительная характеристика описанных выше микроорганизмов.
Таблица 18
Сравнительная характеристика спирохет, актиномицетов,
риккетсий, хламидий, микоплазм
| Признак | Спирохеты | Актиномицеты | Риккетсии | Хламидии | Микоплазмы |
| Тип строения КС | Грам– | Грам+ | Грам– | Грам– | Не имеют КС, подобны Грам– |
| Методы изучения морфологии | Окраска по Романовскому–Гимзе, серебрение по Морозову, ТПМ или ФКМ | Простые методы, окраска по Граму | По методу Здродовского, по Граму, электронная микроскопия | Окраска мазков-соскобов по Романовскому–Гимзе | ФКМ, электронная микроскопия, окраска по Романовскому–Гимзе для выявления нитевидных форм |
| Морфология | Тонкие спирально извитые нити, изогнутые вокруг центральной оси, до 50 мкм. Трепонемы — 8–20 завитков, боррелии — 3–10 завитков, лептоспиры — 12–30 завитков | Нитевидные ветвистые клетки, имеющие вид палочки | Мелкие полиморфные бактерии кокковидной, палочковидной, реже — нитевидной формы | Элементарные тельца сферической формы (вне организма человека) и ретикулярные тельца (внутриклеточные) | Мелкие или крупные сферические, овоидные или нитевидные клетки |
Окончание табл. 18
| Признак | Спирохеты | Актиномицеты | Риккетсии | Хламидии | Микоплазмы |
| Особенности ультрастуктуры | экзо-споры | – | + как способ размножения | – | – | – |
| жгутики | Осевые фибриллы (периплазматические жгутики) | – | – | – | – | |
| капсула | – | – | Микрокапсулу образуют в клетках хозяина | – | Капсулоподобный слой | |
| КС | Типичной нет (слабо выражен пептидогликановый слой) | В составе есть сахара, отсутствующие у истинных бактерий, миколовые и жирные кислоты | + | + | – | |
| Представители | Сапрофитные и патогенные: трепонемы, боррелии, лептоспиры | Большинство — сапрофиты, патогенные: роды актиномицеты и нокардии | Облигатные внутриклеточные паразиты | Облигатные внутриклеточные паразиты | Патогенные и сапрофитные | |
| Роль в патологии | Сифилис и бытовые трепонематозы, возвратные тифы (эпидемический и эндемический), болезнь Лайма, лептоспироз | Актиномикоз (шейно-челюстно-лицевой, органов дыхания, ЖКТ) | Сыпной тиф и болезнь Бриля–Цинссера, эндемический клещевой риккетсиоз | Трахома, паховый лимфогранулематоз, урогенитальные хламидиозы, синдром Рейтера, пневмонии, орнитоз, атеросклероз | Респираторные и урогенитальные инфекции | |
Примечание: – отсутствует; + присутствует.
ОБМЕН ВЕЩЕСТВ И ЭНЕРГИИ (МЕТАБОЛИЗМ)
У ПРОКАРИОТ
Для роста и размножения микроорганизмы нуждаются в веществах, используемых для построения структурных компонентов клетки и получения энергии. В основе жизнедеятельности микроорганизмов лежит непрерывный обмен веществ и энергии с окружающей средой (метаболизм).
Метаболизм (от лат. metabole — изменение, превращение) — совокупность всех химических превращений в клетке, имеет две составляющих (рис. 56):
анаболизм (от греч. anabole — подъем) ( конструктивный (пластический) метаболизм, ассимиляция) — биосинтез макромолекул из простых низкомолекулярных соединений и их ассимиляция (усвоение, накопление);
катаболизм ( энергетический метаболизм, диссимиляция) — химический ферментативный процесс разрушения высокомолекулярных веществ до мономеров, направленный на получение энергии и ее запасы в форме АТФ.

Рис. 56. Метаболические процессы
Метаболизм у прокариот в целом протекает так же, как у высших животных и растений.
Особенности метаболизма у прокариот:
бактерии разнообразны по своим пищевым потребностям. Одно и то же соединение для одних микроорганизмов может быть продуктом питания, а для другого — ядовитым веществом. Известны бактерии, способные усваивать
фенол, парафин, уксусную кислоту, антибиотики;
способность включать в обмен веществ любые органические и неорганические соединения;
высокая интенсивность метаболизма;
высокая адаптационная способность к меняющимся условиям окружающей среды;
многообразие путей метаболизма, промежуточных и конечных продуктов;
возможность искусственного культивирования многих микроорганизмов в бесклеточных средах;
несовершенство регуляции метаболических процессов.
Риккетсии — облигатные внутриклеточные паразиты (не способны синтезировать некоторые макромолекулы).
Хламидии — облигатные внутриклеточные паразиты (не способны синтезировать некоторые макромолекулы) и энергетические паразиты (не способны синтезировать АТФ).
Микоплазмы — мембранные паразиты (не способны синтезировать стерины для ЦПМ).
Изучение процессов метаболизма у микроорганизмов необходимо для понимания механизмов патогенеза заболеваний, для идентификации микроорганизмов и этиологической диагностики заболеваний, для проведения химиотерапии, а также для получения необходимых для человека материалов с использованием биотехнологии.
ХИМИЧЕСКАЯ СТРУКТУРА И ПИТАТЕЛЬНЫЕ ПОТРЕБНОСТИ
БАКТЕРИЙ
Клетка — универсальная единица живой материи. По химическому составу у прокариотических и эукариотических клеток нет существенных отличий. Для осуществления биосинтетических реакций бактериям необходимы химические элементы и дополнительные факторы роста. Потребность микроорганизма в определенных химических элементах и ростовых факторах — стабильный признак, который используется для идентификации бактерий, а также при изготовлении питательных сред.
Химические элементы, входящие в состав бактерий, можно разделить на три группы: биогенные химические элементы, макроэлементы и микроэлементы.
I. Биогенные химические элементы(С, О, N, H ). На их долю приходится 95 % сухого остатка, в т. ч. C — 50 %, O — 20 %, N — 15 %, H — 10 %. Это основные химические элементы, необходимые для синтеза органических соединений. Кислород и водород не лимитируются, их микроорганизмы могут получать из воды и других соединений.
По способности усваивать источники углерода микроорганизмы делятся на 3 группы:
Аутотрофы (от греч. auto — сам, trophe — питание). Буквальный перевод «сам питаюсь». Извлекают углерод из простых неорганических соединений (обычно из СО2 или карбонатов), не нуждаются в органических соединениях и энергии. Среди автотрофов нет патогенных для человека микроорганизмов.
Гетеротрофы (от греч. heteros — другой, trophe — питание). Буквальный перевод «питаемый другими». Усваивают углерод из сложных органических соединений различной химической природы (гексоз, спиртов, аминокислот, органических кислот). Гетеротрофов делят на следующие:
метатрофы (гнилостные бактерии, грибы, дрожжи), усваивающие углерод из мертвых органических соединений; широко распространены в почве, играют ведущую роль при разложении органических останков; являются сапрофитами;
паратрофы, усваивающие углерод в условиях живого организма, являются паразитами, среди которых различают облигатных паразитов (риккетсии, хламидии, вирусы), живущих только в живой клетке, и факультативных (большинство патогенных бактерий), которых можно выращивать на искусственных питательных средах.
Миксотрофы — микроорганизмы, способные переключаться с автотрофного на гетеротрофный путь обмена веществ и энергии.
Азот содержится в клетке в восстановленной форме в виде аминогрупп. Для синтеза азотсодержащих соединений (аминокислот, пуринов, пиримидинов, некоторых витаминов) микроорганизмы нуждаются в доступном источнике азота. По способности усваивать источники азота микроорганизмы делятся на
2 группы:
Аминоаутотрофы усваивают азот из неорганических соединений: азотфиксирующие бактерии (клубеньковые) используют азот воздуха; аммонифицирующие бактерии используют соли аммония; нитрифицирующие бактерии — аммиак и его соли превращают в азотную, а затем в азотистую кислоту. Денитрофицирующие бактерии в качестве источника азота используют нитраты и нитриты, образуя из них молекулярный азот воздуха. Среди аминоаутотрофов нет патогенных для человека микроорганизмов.
Аминогетеротрофы извлекают азот из органических соединений (аминокислот, пептонов, белков) или используют минеральные источники азота с добавлением несинтезируемых ими аминокислот. К этой группе принадлежат многие виды патогенных бактерий.
II. Макроэлементы — сера, фосфор, калий, кальций, магний, хлор, натрий. На них приходится около 5 % сухого остатка.
III. Микроэлементы (зольные элементы, следовые элементы) — марганец, молибден, цинк, медь, кобальт, никель, железо, ванадий, бор, йод, селен, кремний, вольфрам. На микроэлементы приходятся доли процента, однако они являются активаторами ферментов и имеют важное значение в обменных процессах. Большинство микроэлементов вносят в питательную среду в качестве примесей в солях макроэлементов либо попадает в питательную среду из стекла лабораторной посуды, с водой и с пылью.
Химические элементы входят в состав различных органических и неорганических веществ. Синтез этих веществ контролируется генетически. Некоторые вещества бактериальная клетка может получать из окружающей среды или из организма хозяина.
Органические вещества бактериальной клетки представлены белками, нуклеиновыми кислотами, углеводами, липидами.
Белки составляют 40–80 % сухой массы бактерий и встречаются во всех структурных элементах клетки. Белки бактерий делятся на структурные (составляют основу структур клетки и обладают антигенными свойствами) и функциональные (их большая часть, они обладают свойствами ферментов). Белки могут быть простые (протеины) и сложные (протеиды), в чистом виде или в комплексе с липидами, углеводами, нуклеиновыми кислотами.
В состав белков бактерий входят как обычные для эукариот аминокислоты, так и оригинальные — диаминопимелиновая кислота, D-аланин, D-глютанин, входящие в состав ПГ и капсул некоторых бактерий. Высокая резистентность спор связана с находящейся только в них дипиколиновой кислотой. Жгутики построены из белка флагеллина, обладающего сократительной способностью и выраженными антигенными свойствами. Фимбрии содержат особый белок — пилин.
Пептидную природу имеют капсулы представителей рода Bacillus, возбудителя чумы, поверхностные антигены ряда бактерий, в т. ч. стафилококков и стрептококков. Белок А — специфический белок S. aureus. Белок М — специфический белок гемолитических стрептококков серогруппы А, позволяющий дифференцировать серовары (около 100), что имеет эпидемиологическое значение.
Ряд белков содержит наружная мембрана Грам– бактерий, например, порины, образующие диффузные поры, через которые в клетку проникают мелкие гидрофильные молекулы.
Нуклеиновые кислоты (ДНК и разные типы РНК) составляют около 18 % сухой массы бактерий, определяют наследственность и изменчивость. Микроорганизмы отличаются по структуре нуклеиновых кислот, содержанию азотистых оснований. Содержание нуклеиновых кислот зависит от условий культивирования, фаз роста, физиологического и функционального состояния клеток. Содержание ДНК в клетке более постоянно, чем РНК. Нуклеотидный состав ДНК не изменяется в процессе развития бактерии, видоспецифичен и используется как один из важнейших таксономических признаков.
РНК находятся в одноцепочечной форме, главным образом, в рибосомах (рРНК составляют 80–85 %), в то время как т(транспортные)РНК — 10 %, м(матричные)РНК — 1–2 %. ДНК может находиться в ядерном аппарате (хромосомная ДНК) или в плазмидах (внехромосомная ДНК).
Углеводы составляют около 16 % сухой массы клетки, представлены простыми (моно- и дисахаридами, полисахаридами) и комплексными соединениями. Углеводы встречаются чаще в виде полисахаридов, которые могут быть экзо- и эндоклеточными. Среди экзоклеточных полисахаридов выделяют структурные (входят в состав капсул, клеточной стенки) и истинно экзополисахариды (выходят во внешнюю среду). Эндоклеточные полисахариды — располагаются в цитоплазме, это запасные питательные вещества клетки (крахмал, гликоген и др.). Углеводы выполняют также антигенную функцию.
Липиды представлены фосфолипидами, жирными кислотами, восками и глицеридами. Они выполняют антигенную и структурную функции. Липиды (фосфолипиды и стерины) входят в состав ЦПМ (липидный бислой) наружной мембраны Грам– бактерий и ЦП. Содержание липидов у большинства бактерий не более 10 %, а наибольшее количество — у микобактерий (до 40 %).
В состав липидов входят различные жирные кислоты, весьма специфичные для разных групп микроорганизмов. Их определение имеет в ряде случаев диагностическое значение, например, у анаэробов, микобактерий. У микобактерий туберкулеза в составе липидов имеются кислотоустойчивые жирные кислоты — фтионовая, миколовая и др. Высокое содержание липидов и их состав определяют многие свойства микобактерий туберкулеза: их устойчивость к кислотам, щелочам и спиртам; трудную окрашиваемость красителями; высокую резистентность во внешней среде и патогенность.
Тейхоевые кислоты встречаются в КС Грам+ бактерий. Представляют собой водорастворимые линейные полимеры, содержащие остатки глицерина или рибола, связанные фосфодиэфирными связями. С ТК связаны главные поверхностные антигены ряда Грам+ бактерий.
Липополисахарид (один из основных компонентов КС Грам– бактерий) — соединение липида с полисахаридом.
Неорганические компоненты бактериальной клетки — вода и минеральные вещества.
Факторы роста бактерий близки к витаминам животных и растений, в ничтожно малых количествах входят в состав ферментов и других соединений. Факторы роста необходимы для жизнедеятельности труднокультивируемых бактерий, но сами бактерии эти факторы не синтезируют и получают извне. К ним относят аминокислоты, пуриновые и пиримидиновые основания, липиды, витамины, железопорфирины (гем) и другие соединения.
Аминокислоты. Многие бактерии нуждаются в незаменимых аминокислотах (одной или нескольких), являющихся составными частями белков. Например, клостридии не могут самостоятельно синтезировать лейцин и тирозин, а стрептококки — лейцин и аргинин.
Пуриновые и пиримидиновые основания (нуклеотиды: аденин, гуанин, цитозин, урацил) и их производные нуклеозиды (с фосфорной кислотой) — составные части нуклеиновых кислот. Они являются факторами роста для разных видов стрептококков, некоторые азотистые основания нужны для роста стафилококков, в нуклеотидах нуждаются некоторые виды микоплазм.
Компоненты фосфолипидов — жирные кислоты — нужны для роста некоторых стрептококков, микоплазм. Все виды микоплазм ауксотрофны по холестерину и другим стеринам, что отличает их от других прокариот.
Витамины, в основном группы В и К, входят в состав коферментов или их простетических групп и участвуют в каталитических функциях, поэтому они необходимы только в очень малых количествах. Многие бактерии ауксотрофны по определенным витаминам. Например, коринебактерии дифтерии, шигеллы нуждаются в никотиновой кислоте или ее амиде, который входит в состав НАД и НАДФ; золотистый стафилококк, пневмококк, бруцеллы — в тиамине, входящем в состав пирофосфата; некоторые виды стрептококков, бациллы столбняка — в пантотеновой кислоте, являющейся составной частью кофермента КоА. Факторами роста для многих бактерий являются фолиевая кислота, биотин; гемы — компоненты цитохромов — необходимы гемофильным бактериям, микобактериям туберкулеза.
ПИТАНИЕ МИКРООРГАНИЗМОВ
Питание — процесс поступления в организм химических веществ, содержащих пластический материал и энергию.
Для роста микроорганизмов необходимы:
вода — обязательный химический компонент клеток бактерий. В вегетативных клетках она составляет около 80 % биомассы, в спорах — 18–20 %. Основная часть воды находится в свободном состоянии. Кроме свободной, имеется ионная фракция воды и вода, связанная с коллоидными веществами;
питательные вещества — растворенные в воде соединения, из которых микроорганизмы строят свои клетки и получают энергию.
Последнее изменение этой страницы: 2019-04-09; Просмотров: 449; Нарушение авторского права страницы