
|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |

|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |
Часть 1. Качественный анализ неорганических веществСтр 1 из 14Следующая ⇒
ХИМИЧЕСКИЙ АНАЛИЗ Часть 1. Качественный анализ неорганических веществ Учебное пособие
Допущено учебно-методическим объединением высших учебных заведений Российской Федерации по образованию в области материаловедения, технологии материалов и покрытий в качестве учебного пособия для студентов, обучающихся по направлениям 150600 “Материаловедение и технология новых материалов” и 150500 “Материаловедение, технология материалов и покрытий”.
Москва 2009
Авторы: В.С.Клементьева, И.В.Соловьева, Т.Я.Максина, С.А.Пиункова
Рецензенты:
Директор естественно-экологического института Московского государственного областного университета, доктор биологических наук, профессор А.С.Коничев
Заведующий кафедрой неорганической и аналитической химии МГПУ, доктор биологических наук, профессор Горичев И.Г. Химический анализ. Часть 1. Качественный анализ неорганических веществ / В.С.Клементьева, И.В.Соловьева, Т.Я.Максина, С.А.Пиункова – М.: 11-й Формат, 2009. – 79 с.
В учебном пособии приводятся сведения, относящиеся к изучению химических методов качественного анализа. Рассмотрены методы и условия проведения качественного химического анализа веществ, состоящих из наиболее часто встречающихся в реальной практике катионов и анионов. В основу качественного анализа положена кислотно-основная классификация катионов. В пособие включен необходимый минимум теоретического материала, перечислены стадии химического анализа, требования, предъявляемые к аналитическим реакциям. Основная часть пособия посвящена классификации катионов и анионов и химическим реакциям, используемым для идентификации ионов в качественном анализе. В конце главы приведены контрольные вопросы по изучаемой теме. Учебное пособие предназначено для подготовки бакалавров и магистров по направлениям 150100 «Металлургия», 150600 “Материаловедение и технология новых материалов”, 150500 “Материаловедение, технология материалов и покрытий”, 286200 “Защита окружающей среды”, 280100 «Безопасность жизнедеятельности» и составлено в соответствии с программой дисциплины «Неорганическая и аналитическая химия» и планам учебных занятий по аналитической химии. Введение
Аналитическая химия – это раздел химии, посвященный разработке методов изучения химического состава вещества. В зависимости от характера анализируемых объектов, аналитическую химию делят на анализ неорганических веществ и анализ органических веществ. Цель аналитической химии - установление качественного и количественного состава вещества или смеси веществ. В соответствии с этим аналитическая химия делится на качественный и количественный анализ.Задачей качественного анализа является выяснение качественного состава анализируемого объекта. Задачей количественного анализа является определение точного содержания отдельных элементов или их соединений в анализируемом объекте.Различают макрокомпоненты и микрокомпоненты, или примеси. В качественном анализе применяют термины «обнаружение», или «открытие»; в количественном – «определение». В качественном и количественном анализах используют самые разнообразные химические реакции, применяют широкий спектр химических, физических, физико-химических, биологических методов, разрабатывают новые методы анализа и совершенствуют уже существующие. Число методов аналитической химии чрезвычайно велико и постоянно растет. Химический анализ внедряется в различные области науки. Поэтому аналитическая химия тесно связана с другими дисциплинами: химики-аналитики пользуются достижениями других разделов химии, а также математики, физики, биологии и многих областей техники. Различные методы исследования, применяемые в качественном и в количественном анализах, можно разделить на три основные группы методов:
- химические, где используются химические реакции, результат которых определяют визуально; - физические, основанные на измерении каких-либо физических характеристик вещества, являющихся функцией его химического состава; - физико-химические, основанные на наблюдении за изменением физических свойств веществ (оптической плотности, электропроводности, теплопроводности и др.), которые происходят в результате химической реакции.
Так как в физических и физико–химических методах используются приборы, эти методы часто объединяют под названием инструментальных методов.
В аналитическую химию очень широко внедряются компьютерные методы расчетов, например, при статистической обработке результатов анализа, при планировании эксперимента и нахождении оптимальных условий проведения анализа, при автоматизации методов анализа. Эта проблема особенно актуальна для контроля производства вообще и, в частности, при работе с особо вредными веществами. Для автоматизации больше всего подходят физические или физико–химические методы анализа.
Реакции катиона лития 1. Окрашивание пламени. Летучие соединения лития окрашивают бесцветное пламя горелки в карминово-красный цвет. Реакция весьма чувствительна. Определению мешают ионы натрия. Желтую окраску ионов Na+ маскируют, используя индиговую призму или кобальтовое стекло, не пропускающее желтых лучей. Методика проведения реакции. С помощью металлической петли из флакона берется небольшое количество соли и вносится в пламя спиртовки. Пламя окрашивается в карминово-красный цвет.
2. Реакция с фторидом аммония NH4 F. При нагревании смеси растворов соли лития и фторида аммония выделяется белый аморфный осадок фторида лития, растворимый в уксусной кислоте.
Li+ + F- = LiF(тв).
Методика проведения реакции. В пробирку помещают 2-3 капли раствора, содержащего ионы лития, и 2-3 капли раствора фторида аммония или калия. Смесь нагревают до кипения, при этом медленно выделяется белый аморфный осадок. Определению мешают ионы Mg2+, которые можно замаскировать, проводя реакцию в присутствии аммиака при рН 9-10.
+++2.1.2. Реакции катиона аммония 1. Реакция со щелочами. При нагревании растворов солей аммония со щелочами образуется гидрат аммиака, который разлагается с выделением аммиака, имеющего характерный запах нашатырного спирта.
NH4+ + OH- ↔ NH3 × Н2О ↔ NH3(г) + H2O.
Выделение аммиака можно зафиксировать с помощью лакмусовой или универсальной индикаторной бумаги, смоченной водой и внесенной в пары. При выделении аммиака лакмусовая бумага синеет. Методика проведения реакции . В пробирку вносят 5 капель раствора, содержащего ионы аммония, и добавляют 5 капель щелочи. Пробирку слегка подогревают и к верхней части подносят влажную индикаторную бумагу. В присутствии ионов аммония индикаторная бумага синеет.
2. Реакция с гидротартратом натрия NaHC4H4O6. Образуется белый кристаллический осадок гидротартрата аммония, растворимый в кислотах и щелочах. Кристаллы имеют характерную форму.
NH4+ + HC4H4O6- = NH4HC4H4O6(тв). Методика проведения реакции . На предметное стекло наносят капилляром 1-2 капли анализируемого раствора, рядом наносят 1-2 капли гидротартрата натрия. Капли соединяют стеклянной палочкой и перемешивают. Стекло охлаждают, и через несколько минут наблюдают в микроскоп форму образовавшихся кристаллов. Определению мешают ионы калия.
3. Реакция с реактивом Несслера (K2[HgI4]+KOH). Реактив Несслера (смесь тетраиодомеркурата(II) калия с гидроксидом калия) взаимодействует с ионом NH4+, образуя красно-бурый осадок иодида меркураммония [OHg2NH2]I, растворимый в кислотах и щелочах.
Методика проведения реакции . К одной капле раствора, содержащего ионы аммония, прибавляют 1 каплю реактива Несслера. Реакцию удобнее всего проводить на предметном стекле.
4. Реакция с гексанитрокобальтатом(III) натрия Na3[Co(NO2)6]: 2NH4+ + Na3[Co(NO2)6] = (NH4)2Na[Co(NO2)6](тв) + 2Na+.
Образуется осадок желтого цвета, растворимый в воде при нагревании. Методика проведения реакции. В пробирку помещают 3 капли анализируемого раствора, содержащего ионы NH4+, и 3 капли раствора гексанитрокобальтата(III) натрия. После появления осадка проверяют его растворимость в кислотах или щелочах. Определению мешают ионы калия. Реакции катиона натрия
1. Окрашивание пламени. Летучие соединения натрия окрашивают пламя горелки в желтый цвет. Методика проведения реакции . Нихромовую проволоку почистить наждачной бумагой, подержать в концентрированной соляной кислоте и прокалить в пламени горелки. При этом не должно получаться ярко-желтого окрашивания. Подготовленную проволоку опустить в раствор соли натрия (хлорида или нитрата) и снова прокалить в пламени горелки. Яркое желтое окрашивание пламени в течение нескольких секунд говорит о наличии натрия. 2. Реакция с дигидроантимонатом калия KH2SbO4. При взаимодействии катионов натрия с дегидроантимонатом калия образуется белый мелкокристаллический осадок дигидроантимоната натрия, растворимый в щелочах и кислотах.
Na+ + KH2SbO4 = NaH2SbO4(тв) + K+.
Методика проведения реакции . В пробирку помещают 5 капель раствора, содержащего ионы натрия, и добавляют 5 капель раствора KH2SbO4. Для ускорения выпадения осадка стенки пробирки потирают стеклянной палочкой. Проведению реакции мешают ионы лития. 3. Реакция с цинкуранилацетатом ZnH(UO2)3(CH3COO)9: Na+ + ZnH(UO2)3(CH3COO)9 = NaZn(UO2)3(CH3COO)9 + Н+.
Образуется мелкокристаллический осадок цинкуранилацетата натрия лимонно-желтого цвета, имеющий характерное строение. Осадок растворим в щелочах и кислотах. Методика проведения реакции. На предметное стекло наносят каплю раствора, содержащего ионы натрия, и высушивают на плитке. Охлаждают стекло и на место высохшей капли помещают каплю раствора цинкуранилацетата. Форму образовавшихся кристаллов наблюдают в микроскоп. Проведению реакции мешают ионы лития. Реакции катиона калия
1. Окрашивание пламени. Соли калия окрашивают пламя горелки в фиолетовой цвет. Методика проведения реакции . Прокаливают платиновую проволоку в пламени горелки, смачивают ее раствором соли калия и вносят в пламя. Соединения калия окрашивают бесцветное пламя горелки в фиолетовой цвет. 2. Реакция с гидротартратом натрия NaHC4H4O6.
K+ + HC4H4O6- = KHC4H4O6(тв).
Образуется белый мелкокристаллический осадок гидротартрата калия, растворимый в кислотах и щелочах. Кристаллы осадка имеют характерную форму. Методика проведения реакции . На предметное стекло наносят капилляром 1-2 капли анализируемого раствора, рядом наносят 1-2 капли гидротартрата натрия. Капли соединяют стеклянной палочкой и перемешивают. Стекло охлаждают, и через несколько минут наблюдают в микроскоп форму образовавшихся кристаллов. Определению мешают ионы аммония.
3. Реакция с гексанитрокобальтатом(III) натрия Na3[Co(NO2)6]. 2K+ + Na3[Co(NO2)6] = NaK2[Co(NO2)6](тв) + 2Na+.
Реакцию ведут в нейтральной или уксуснокислой среде. Образуется желтый кристаллический осадок двойной соли калия и натрия, растворимый в кислотах и щелочах, нерастворимый в уксусной кислоте. Методика проведения реакции. В пробирку помещают 3 капли анализируемого раствора, содержащего ионы K+ и 3 капли раствора гексанитрокобальтата(III) натрия. После появления осадка проверяют его растворимость в кислотах или щелочах. Определению мешают ионы аммония.
4. Реакция с гексанитрокупратом(II) свинца и натрия Na 2 Pb [ Cu ( NO 2 )6].
2K+ + Na2Pb[Cu(NO2)6] = K2Pb[Cu(NO2)6](тв) + 2Na+.
Образуется осадок черного цвета, содержащий кристаллы характерной формы. Осадок растворим в кислотах и щелочах. Методика проведения реакции . Каплю раствора, содержащего ионы калия, помещают на предметное стекло и высушивают на плитке. Добавляют каплю раствора гексанитрокупрата(II) свинца и наблюдают под микроскопом форму образовавшихся кристаллов. Проведению реакции мешают катионы аммония.
Некоторые реакции катионов первой аналитической группы приведены в табл. 5.
Таблица 5
Сводная таблица реакций катионов первой аналитической группы
Катионы | ||||||
| Na + | K + | NH4+ | ||||
| NaOH | -- | -- | NH3 ↑ при кипячении | |||
| KH2SbO4 | NaH2SbO4↓ Белый, растворим в NaOH и HCl | -- | H2SbO4↓ Белый, растворим в NaOH и HCl | |||
|
NaHC4H4O6 |
-- | КHC4H4O6↓ | NН4HC4H4O6↓ | |||
|
Белый кристаллический осадок, растворим в щелочах и кислотах
| ||||||
|
Na3[Co(NO2)6] |
-- | К2Na [Co(NO2)6] ↓ | (NH4)2Na[Co(NO2)6]↓ | |||
|
Желтый кристаллический осадок, растворим в кислотах | ||||||
|
H2[PtCl6] | -- | К2[PtCl6] ↓ | (NH4)2[PtCl6] ↓ | |||
|
Желтый кристаллический осадок | ||||||
| UO2(CH3COO)2 | NaUO2(CH3COO)3↓ Зеленовато-желтые кристаллы | --- | --- | |||
| K2[HgI4] + KOH | -- | --- | [Hg2ONH2]I↓ Красно-бурый | |||
| Окрашивание пламени | Желтое | Фиолетовое | --- | |||
Реакции катиона серебра
+++1. Реакции с галогенидами щелочных металлов.
Ag+ + Cl- = AgCl(тв) (белый осадок),
Ag+ + Br- = AgBr(тв) (бледно-желтый осадок),
Ag+ + I- = AgI(тв) (светло-желтый осадок).
С увеличением концентрации галогенид-ионов увеличивается растворимость галогенидов серебра в аммиаке из-за образования хорошо растворимых комплексных ионов [AgX2]- и [AgX4]3-. Причем, растворимость в водном растворе аммиака уменьшается в ряду AgCl, AgBr, AgI, что соответствует уменьшению величины произведения растворимости.
Методика проведения реакции. В три пробирки помещают по 3-4 капли раствора, содержащего ионы Ag+, добавляют по 2-3 капли 2 н. раствора HNO3. В первую пробирку добавляют 3-4 капли 2 н. HCl, во вторую - 3-4 капли раствора KBr, в третью - 3-4 капли раствора KI. Отмечают цвет образовавшихся осадков. Проверяют растворимость осадков в растворе гидроксида аммония.
2. Растворение галогенидов серебра в растворах KCN или Na2S2O3 за счет образования цианидных или тиосульфатных комплексов, более устойчивых по сравнению с аммиачными комплексами.
AgI + S2O32- = [AgS2O3]- + I-,
AgBr + 3CN- = [Ag(CN)3]2- + Br-.
+++3. Реакция с хроматом калия K 2 CrO4.
2Ag+ + CrO42- = Ag2CrO4(тв.).
Образуется кирпично-красный осадок хромата серебра, растворимый в азотной кислоте и гидроксиде аммония.
Методика проведения реакции . К 3 каплям раствора, содержащего ионы серебра, добавляют 3 капли раствора хромата калия. Наблюдают цвет образовавшегося осадка.
4. Реакция восстановления до металлического серебра при действии формальдегида на аммиачный раствор соли серебра. Ионы серебра в присутствии восстановителей (формальдегид, Mn2+, Sn2+) легко восстанавливаются до металлического серебра:
2[Ag(NH3)2]+ + НСНО + H2O = 2Ag + 3NH4+ + НСОО- + NH3.
При проведении реакции с формальдегидом на стенках пробирки образуется блестящий налет металлического серебра (реакция " серебряного зеркала" ).
Методика проведения реакции. В пробирки помещают 3 капли раствора, содержащего ионы Ag+, 3 капли раствора NH4OH, добавляют 3 капли 10%-ного раствора формальдегида и погружают пробирку в теплую воду. Наблюдают образование зеркала металлического серебра.
5. Реакция с дитизоном (С6 H 5 )2 CSN 4 H 2. Дитизон образует с ионом Ag+ внутрикомплексное соединение, окрашенное в желтый цвет и экстрагируемое хлороформом или четыреххлористым углеродом:
 .
.
Методика проведения реакции. К 1-2 каплям анализируемого раствора добавляют 2-3 капли 2 н. раствора H2SO4 и экстрагируют 0, 002%-ным раствором дитизона в CCl4. В присутствии ионов серебра органический слой окрашивается в желтый цвет. Определению мешают ионы Hg2+ и Cu2+, которые можно замаскировать, прибавив перед началом выполнения реакции раствор ЭДТА.
2.2.2. Реакции катиона диртути 2+
1. Реакции восстановления [ Hg 2 ]2+ до металлической ртути. Катион диртути 2+ способен восстанавливаться в присутствии восстановителей (SnCl2, Cu) до металлической ртути.
Hg22+ + Sn2+ = 2Hg (тв) + Sn4+;
Hg22+ + Cu = 2Hg (тв) + Cu2+.
Методика проведения реакций . а) К 2 каплям анализируемого раствора добавляют 2 капли раствора хлорида олова (II). Через минуту добавляют еще 2 капли реагента. Наблюдают выпадение осадка черного цвета. б) На медную пластинку наносят 2 капли раствора, содержащего ионы Hg22+. Через несколько минут пластинку промывают водой, протирают и наблюдают блестящее пятно ртути.
2. Реакция с иодидом калия KI.
Hg22+ + 2I- = Hg2I2 (тв).
Образуется грязно-зеленый осадок Hg2I2, растворимый в избытке реагента с образованием тетраиодомеркурата(II) калия и черного осадка металлической ртути:
Hg2I2 + 2KI = K2[HgI4] + Hg(тв).
Методика проведения реакции . К 3 каплям анализируемого раствора добавляют 3 капли раствора иодида калия. После образования грязно-зеленого осадка добавляют еще 5 капель иодида калия и наблюдают растворение зеленого и появление черного осадка.
3. Реакция со щелочами.
Hg22+ + 2OH- = HgO + Hg + H2O.
В результате реакции катион Hg22+ диспропорционирует на оксид ртути(II) и дисперсную ртуть черного цвета.
Методика проведения реакции . К 3 каплям раствора, содержащего ионы Hg22+, добавляют 3 капли раствора щелочи и наблюдают выпадение черного осадка.
4. Реакция с хроматом калия K 2 CrO4.
Hg22+ + CrO42- = Hg2CrO4(тв).
Образуется осадок хромата ртути красного цвета, растворимый в азотной кислоте.
5. Реакция с соляной кислотой (люминесцентная реакция). Для обнаружения ртути (I) можно использовать реакцию образования каломели Hg2Cl2, способной люминесцировать оранжево-красным светом в ультрафиолетовом свете.
Методика проведения реакции. На предметное стекло наносят каплю раствора, содержащего ионы ртути (I), и каплю 2 н. HCl. Наблюдают оранжево-красное свечение в ультрафиолетовом свете.
Реакции катиона свинца(II)
+++1. Реакция с хроматом K 2 CrO4 или дихроматом K 2 Cr 2 O 7 калия
2Pb2+ + Cr2O72- + 2CH3COO- + H2O ↔ 2PbCrO4(тв) + 2CH3COOH,
в результате которой образуется желтый осадок хромата свинца, нерастворимый в NH4ОН, в отличие от хромата серебра. Осадок хромата свинца растворим в растворе щелочи по реакции:
PbCrO4 (тв) + 4OH- ↔ [Pb(OH)4] 2- + CrO42-.
Методика проведения реакции . К 2-3 каплям раствора, содержащего ионы свинца, добавляют 2-3 капли раствора CH3COOH или CH3COONa и 2-3 капли K2Cr2O7. Образуется желтый осадок. Пробу центрифугируют, отделяют осадок от раствора и к осадку добавляют 3-5 капель 2 н. NaOH. Наблюдают растворение осадка. Мешают определению ионы: Ba2+, Sr2+, Bi(III), Hg2+, Ag+.
+++2. Реакция со щелочами.
Pb2+ + 2OH- ↔ Pb(OH)2 (тв).
Образуется белый осадок гидроксида свинца, растворимый в избытке реагента:
Pb(OH)2 (тв) + 2OH- = [Pb(OH)4]2-.
Методика проведения реакции . К 3 каплям раствора, содержащего ионы Pb2+, добавляют 3 капли раствора щелочи. После образования белого осадка добавляют еще несколько капель реагента и наблюдают растворение осадка.
3. Реакция с дитизоном ( C 6 H 5 )2 CSN 4 H 2. В нейтральных и слабощелочных растворах дитизон реагирует с ионами свинца, образуя внутрикомплексное соединение красного цвета. Дитизонат свинца нерастворим в воде, но растворим в органических соединениях (CHCl3, CCl4):
 .
.
Проведению реакции мешают другие катионы, поэтому целесообразно отделить катионы свинца от других, используя хорошую растворимость в горячей воде хлорида свинца.
Методика проведения реакции . В пробирку помещают 2-3 капли исследуемого раствора, добавляют 2 н. раствора NH4OH, доводя рН до 8-10, и 2-3 капли дитизона в CCl4. Смесь сильно встряхивают в течение 30 с. В присутствии свинца зеленая окраска реагента переходит в красную.
Некоторые реакции катионов второй аналитической группы приведены в табл. 6.
Таблица 6
Сводная таблица реакций катионов второй аналитической группы
| Реактив | Ag+ | Hg22+ | Pb2+ |
| HCl | AgCl ↓ белый осадок, растворим в NH4OH, Na2S2O3 | Hg2Cl2↓ белый осадок, при действии NH4OH чернеет | PbCl2↓ белый осадок, растворим в горячей воде |
| KI | AgI ↓ желтый осадок, растворим в Na2S2O3 | Hg2I2↓ зеленый осадок, растворим в избытке KI | PbI2 ↓ золотисто-желтый осадок, растворим в избытке KI, CH3COOH |
| K2CrO4 | Ag2CrO4 ↓ красно-бурый осадок, растворим в HNO3, NH4OH | Hg2CrO4 ↓ красный осадок, растворим в HNO3 | PbCrO4 ↓ желтый осадок, растворим в NaOH, HNO3 |
| Дитизон | Желтое окрашивание хлороформного слоя (рН=7) | - | Красное окрашивание хлороформного слоя (рН > 7) |
| NaOH | Ag2O – буро-черный осадок, растворим в HNO3, NH4OH | Hg – черный осадок, растворим в HNO3 | Pb(OH)2 – белый осадок, растворим в NaOH, HNO3 |
| H2SO4 | Ag2SO4 ↓ растворим в горячей воде | Hg2SO4 ↓ растворим в царской водке | PbSO4 ↓ растворим в NaOH, HCl, H2SO4 |
| Восстано-вители | Ag ↓ черный осадок | Hg ↓ черный осадок | Pb ↓ черный осадок |
| Окислители | - | Hg2+ | Pb4+ |
Реакции катиона кальция
1. Окрашивание пламени. Пламя горелки при внесении солей кальция окрашивается в кирпично-красный цвет.
2. Реакция с оксалатом аммония ( NH 4 )2C2O4.
Ca2+ + C2O42- = CaC2O4(тв).
Оксалат аммония образует с ионами кальция кристаллический осадок CaC2O4 ∙ 5H2O. Осадок растворяется в сильных кислотах, но нерастворим в уксусной кислоте (в отличие от оксалатов стронция и бария).
Методика проведения реакции . К 2-3 каплям раствора, содержащего ионы кальция, добавляют 2-3 капли раствора оксалата аммония. Выпадает белый кристаллический осадок. Растворимость осадка проверяют в уксусной, а затем в соляной кислотах.
+++3. Реакция с гексацианоферратом(II) калия K 4 [ Fe ( CN )6].
Ca2+ + [Fe(CN)6]4- + 2NH4OH = Ca(NH4)2[Fe(CN)6] (тв) + 2OH-.
В слабощелочной среде (рН  9) образуется белый кристаллический осадок смешанной кальций-аммонийной соли, растворимой в минеральных кислотах, но нерастворимой в уксусной кислоте. Реакцию проводят в присутствии аммиачной буферной смеси. Ионы Sr2+ этим реактивом не осаждаются. Ионы Ba2+ должны быть предварительно удалены.
9) образуется белый кристаллический осадок смешанной кальций-аммонийной соли, растворимой в минеральных кислотах, но нерастворимой в уксусной кислоте. Реакцию проводят в присутствии аммиачной буферной смеси. Ионы Sr2+ этим реактивом не осаждаются. Ионы Ba2+ должны быть предварительно удалены.
Методика проведения реакции . На предметном стекле перемешивают 2-3 капли раствора, содержащего ионы кальция, с 2-3 каплями раствора NH4OH, нагревают до 60-700С и добавляют 3 капли раствора гексацианоферрата(II) калия.
4. Микрокристаллоскопическая реакция с серной кислотой H 2 SO 4. В разбавленных растворах ион кальция образует с серной кислотой характерные игольчатые кристаллы CaSO4 . 2H2O. Мешают проведению реакции ионы Pb2+, Ba2+, Sr2+, если они присутствуют в 10-кратном по отношению к ионам кальция избытке.
Методика проведения реакции . На предметное стекло помещают каплю раствора соли кальция, рядом помещают каплю H2SO4 (1: 4). Стеклянной палочкой соединяют капли, дают постоять и рассматривают под микроскопом кристаллы, образовавшиеся по краям капли.
Реакции катиона стронция
1. Окрашивание пламени. Летучие соли стронция окрашивают пламя горелки в карминово-красный цвет.
2. Реакция с родизонатом натрия Na 2 C 6 O 6.
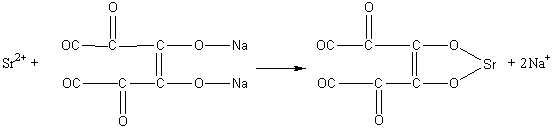
При проведении этой реакции на фильтровальной бумаге образуется красно-бурое окрашивание осадка родизоната стронция, исчезающее в присутствии соляной кислоты. Если в растворе присутствуют ионы бария, то реакцию проводят, предварительно добавляя хромат-ионы.
Методика проведения реакции. На фильтровальную бумагу наносят каплю раствора хромата калия, затем каплю исследуемого раствора, содержащего ионы стронция. Выдерживают бумагу в течение 2-3 минут и добавляют каплю раствора родизоната натрия. В присутствии ионов стронция бумага окрашивается в буро-красный цвет, при их отсутствии остается желтой.
Некоторые реакции катионов третьей аналитической группы приведены в табл. 7.
Таблица 7
Сводная таблица реакций катионов третьей аналитической г руппы
| Реактив | Ca2+ | Sr2+ | Ba2+ |
| H2SO4 | CaSO4 ↓ белый осадок, растворим в (NH4)2SO4 | SrSO4 ↓ белый осадок, растворим в конц. H2SO4 | BaSO4 ↓ белый осадок, растворим в конц. H2SO4 |
| K2CrO4 | - | SrCrO4 ↓ желтый осадок, растворим в HCl, HNO3, CH3COOH | BaCrO4 ↓ желтый осадок, растворим в HNO3, HCl, нерастворим в CH3COOH |
| K2Cr2O7 | - | - | BaCrO4 ↓ желтый осадок, растворим в HNO3, HCl |
| (NH4)2C2O4 | CaC2O4 ↓ белый осадок, растворим в HCl, HNO3 , нераств. в CH3COOH (гор.) | SrC2O4 ↓ белый осадок, растворим в HCl, HNO3, CH3COOH (гор.) | BaC2O4 ↓ белый осадок, растворим в HCl, HNO3, CH3COOH (гор.) |
| Na2HPO4 | CaHPO4 ↓ белый осадок, растворим в HCl, HNO3, CH3COOH | SrHPO4 ↓ белый осадок, растворим в HCl, HNO3, CH3COOH | BaHPO4 ↓ белый осадок, растворим в HCl, HNO3, CH3COOH |
| (NH4)2CO3 | CaCO3 ↓ белый осадок, растворим в HCl, HNO3, CH3COOH | SrCO3 ↓ белый осадок, растворим в HCl, HNO3, CH3COOH | BaCO3 ↓ белый осадок, растворим в HCl, HNO3, CH3COOH |
| CaSO4 | - | SrSO4 ↓ белый осадок | BaSO4 ↓ белый осадок |
| K4[Fe(CN)6] | CaK2[Fe(CN)6] ↓ белый осадок, растворим в HCl, HNO3 | - | BaK2[Fe(CN)6] ↓ белый осадок, растворим в HCl, HNO3 |
| Родизонат натрия | CaC6O6.Ca(OH)2 ↓ фиолетовый осадок, растворим в HCl | SrC6O6 ↓ красно-бурый осадок, растворим в HCl | BaC6O6 ↓ красно-бурый осадок, краснеет в HCl |
| Окрашивание пламени | Кирпично-красный цвет | Карминово-красный цвет | Желто-зеленый цвет |
Реакции катиона алюминия
1. Реакция с ализарином C 14 H 6 O 2 ( OH )2. Ион Аl3+ открывают реакцией с ализарином (1, 2-диоксиантрахиноном), который в аммиачной среде образует с катионом Аl3+ ярко окрашенный комплекс красного цвета ализаринат алюминия - " алюминиевый лак".

Открытию мешают катионы Cr3+, Zn2+, Sn2+.
Методика проведения реакции . На фильтровальную бумагу наносят каплю раствора, содержащего ионы алюминия, выдерживают ее над парами аммиака и добавляют каплю спиртового раствора ализарина. Бумагу подсушивают, и наблюдают появление красного пятна.
+++2. Реакция с алюминоном [ C 22 H 11 O 9 ( NH 4 )3]. Алюминон - аммонийная соль ауринтрикарбоновой кислоты образует с катионом алюминия комплексное соединение красного цвета.
Методика проведения реакции . К 2-3 каплям раствора, содержащего ионы алюминия, добавляют 1-2 капли алюминона и нагревают на водяной бане. Затем добавляют раствор аммиака до появления запаха и 2-3 капли раствора карбоната аммония. Образуются хлопья алюминиевого лака.
???? 3. Реакция с нитратом кобальта Co ( NO 3 )2.
2Al2(SO4)3 + 2Co(NO3)2 = 2Co(AlO2)2 + 6SO3 (г) + 4NO2 (г) + O2 (г).
Методика проведения реакции. Реакция проводится на фильтровальной бумаге, которая смачивается раствором соли алюминия, азотной кислотой, подсушивается и после смачивания разбавленным раствором нитрата кобальта сжигается. Полученный пепел окрашен в синий цвет вследствие образования алюмината кобальта - тенаровой сини Co(AlO2)2. Проведению реакции мешают катионы Zn2+, Cr3+, Cu2+, Ni2+.
4. Реакция с 8-оксихинолином C 9 H 6 N (ОН). 8-оксихинолин образует с алюминием при рН =4, 5-10 внутрикомплексное соединение:

Оксихинолинат алюминия малорастворим в воде, хорошо экстрагируется органическими растворителями (CHCl3, CCl4, спирты, кетоны). Экстракты окрашены в желтый цвет и интенсивно флуоресцируют зеленым светом. Мешают определению ионы Ca2+, Mg2+, Sr2+, Ba2+, Zn2+, Cd2+, Zr(IV), Sn2+, оксихинолинаты которых также флуоресцируют.
Методика проведения реакции . На фильтровальную бумагу наносят каплю раствора, содержащего ионы алюминия, каплю ацетатного буферного раствора (рН = 6, 5-9, 5) и каплю 0, 03%-ного спиртового раствора оксихинолина. В присутствии ионов алюминия влажное пятно в ультрафиолетовом свете имеет зеленое свечение.
Реакции катиона цинка
1. Реакция с тетрароданомеркуратом аммония (N H 4 )2[Hg(SCN)4]. В присутствии соли кобальта выпадает голубой осадок, состоящий из смеси солей Co[Hg(SCN)4] и Zn[Hg(SCN)4]:
Co2+ + [Hg(SCN)4]2- = Co[Hg(SCN)4] (тв) - голубой
Zn2+ + [Hg(SCN)4]2- = Zn[Hg(SCN)4] (тв) - белый
Методика проведения реакции . К 2-3 каплям (NH4)2[Hg(SCN)4] прибавить одну каплю очень разбавленного (0, 02%) раствора СоС12. Затем в ту же пробирку добавить 1-2 капли раствора соли цинка и потереть палочкой стенки пробирки. Быстро выпадает осадок, состоящий из смеси солей Co[Hg(SCN)4] голубого цвета и Zn[Hg(SCN)4] белого цвета.
Роль цинка заключается в том, что образуемый им белый осадок как затравка ускоряет выпадение синего осадка соли кобальта. Реакция проводится в слабокислом растворе.
+++2. Реакция с гексацианоферратом( II ) калия (желтой кровяной солью) K 4 [ Fe ( CN )6]. При проведении реакции в нейтральной или кислой среде образуется осадок двойной соли белого цвета:
Zn2+ + K4[Fe(CN)6] = K2Zn[Fe(CN)6](тв) + 2K+
Методика проведения реакции . В пробирку помещают 3 капли раствора соли цинка, 3 капли раствора гексацианоферрата(II) калия, нагревают и наблюдают образование белого осадка.
3. Реакция с дифенилтиокарбазоном (дитизоном) ( C 6 H 5 )2 CSN 4 H 2. При добавлении раствора дитизона в хлороформе CHCl3 к водному раствору, содержащему ионы цинка, образуется дитизонат цинка, окрашивающий в щелочной среде хлороформный и водный слой в красный цвет. Мешают определению ионы Ag+, Hg2+, Pb2+, Cu2+, Cd2+, Co2+, Ni2+, Bi3+.

Методика проведения реакции . К 3-4 каплям раствора, содержащего ионы цинка, прибавляют 3-4 капли 2 н. раствора NaOH. Каплю полученного щелочного раствора наносят капилляром на фильтровальную бумагу. Пятно обводят по периферии капилляром с раствором дитизона в CCl4. Образуется характерное красное кольцо, которое сравнивают с контрольным опытом. Для этого рядом помещают на бумагу каплю 2 н. NaOH и также обводят ее капилляром с раствором дитизона в CCl4. Образуется оранжевое пятно.
Реакции катиона магния
1. Реакция с гидрофосфатом натрия Na2HPO4. Реакцию проводят в присутствии NH4Cl, который препятствует образованию аморфного осадка Mg(OH)2, растворяющегося в присутствии NH4Cl. В результате реакции образуется белый кристаллический осадок двойной соли фосфата магния-аммония. Осадок имеет характерное строение.
Mg2+ + HPO42- + NH4OH = MgNH4PO4(тв)+ H2O.
Методика проведения реакции . К 3 каплям раствора соли магния добавляют 4 капли раствора Na2HPO4, 3 капли раствора HCl и по каплям медленно добавляют раствор гидроксида аммония до образования кристаллического осадка. Реакцию можно проводить на предметном стекле и наблюдать в микроскоп форму образовавшихся кристаллов.
2. Реакция с 8-оксихинолином C 9 H 6 N (ОН). В присутствии аммиака образуется зеленовато-желтый кристаллический осадок оксихинолята магния. Реакция выполняется при нагревании. Мешают катионы других групп, кроме II и III.
 .
.
Методика проведения реакции. К 3 каплям раствора соли магния добавляют каплю раствора фенолфталеина и по каплям 2 н. раствора NH4OH до появления розовой окраски, затем нагревают до кипения и добавляют 3-4 капли раствора 8-оксихинолина.
3. Реакция с магнезоном I C 12 H 7 N 2 NO 2 ( OH )2. Магнезон I (п-нитробензолазорезорцин) способен адсорбироваться на осадке гидроксида магния, меняя при этом красную окраску на синюю. Осадок гидроксида магния окрашивается в синий цвет (в случае малых количеств магния синюю окраску приобретает раствор). Реакции мешают катионы Ni2+, Cd2+, Co2+, гидроксиды которых также окрашиваются магнезоном.

Методика проведения реакции . На предметное стекло наносят каплю раствора соли магния и каплю щелочного раствора магнезона. Появляется синяя окраска или синий осадок.
Реакции катиона сурьмы( V )
1. Реакция восстановления ионов Sb5+ до металлической сурьмы. В присутствии металлов, стоящих в ряду напряжений до сурьмы (Zn, Fe, Al и др.), катион Sb(III) восстанавливается до металлической сурьмы:
3Sb5+ + 5Al = 3Sb + 5Al3+.
Реакцию проводят на металлической пластинке в кислой среде. Пластинка чернеет вследствие выделения металлического висмута.
Методика проведения реакции. На очищенную металлическую пластинку (Zn, Fe, Al и др.) наносят каплю раствора соли Sb(III или V) и каплю раствора HCl. Пластинку оставляют на 2-3 минуты.
2. Реакция с родамином С. Родамин С и другие основные трифенилметановые красители в солянокислом растворе образуют с хлоридным комплексом сурьмы (V) малорастворимый в воде, окрашенный в фиолетовый цвет ионный ассоциат:
 .
.
Методика проведения реакции . Реакцию одновременно проводят в двух пробирках. В одну пробирку помещают каплю раствора, содержащего ионы сурьмы (III или V), в другую - каплю 2 н. HCl. В обе пробирки добавляют по 2 капли концентрированной HCl, немного твердого нитрита натрия для окисления сурьмы (III) до сурьмы (V), по капле раствора родамина С и по 5-7 капель бензола. Пробирки закрывают пробками и встряхивают 2-3 минуты. В присутствии сурьмы органическая фаза окрашивается в красно-фиолетовый цвет. В пробирке с контрольным опытом окраска бензольного слоя бледно-розовая.
Некоторые реакции катионов пятой аналитической группы приведены в табл. 9.
Таблица 9
Сводная таблица реакций катионов пятой аналитической группы
Реагент
Катионы
Растворимы в кислотах
H2O
----
----
----
----
BiOCl ↓
белый, нераст-ворим в винной кислоте
Белые, растворимы в винной кислоте
Реакции катиона меди ( II )
Растворы солей меди имеют характерную голубую окраску.
1. Окрашивание пламени. Бесцветное пламя горелки окрашивается солями меди(II) в зеленый цвет.
+++ 2. Реакция с раствором гидроксида аммония NH 4 OH. В избытке гидроксида аммония соли меди образуют аммиачный комплекс интенсивной сине-фиолетовой окраски. С помощью данной реакции можно открыть ионы Cu2+ в присутствии других катионов.
CuSO4 + 4NH4OH = [Cu(NH3)4]SO4 + 4H2O.
Методика проведения реакции . К 1-2 каплям раствора соли меди в пробирке добавляют по каплям раствор аммиака. Выпавший вначале голубой осадок гидроксида меди растворяется в избытке аммиака с образованием комплексного иона ярко-василькового цвета.
3. Реакция с тиосульфатом натрия Na 2 S 2 O 3. При взаимодействии катиона Cu2+ в кислой среде при нагревании с избытком реагента образуется смешанный осадок сульфида меди(I) и серы темно-бурого цвета, растворимый в азотной кислоте:
2Cu2+ + 2S2O32- + 2H2O = Cu2S(тв) + S(тв) + 4H+ + 2SO42-.
Методика проведения реакции . К 3 каплям раствора соли меди добавляют 4 капли воды, 3 капли раствора серной кислоты, 3 кристаллика тиосульфата натрия и нагревают.
4. Реакция восстановления до металлической меди. Металлы, стоящие в ряду напряжения до меди (железо, цинк, алюминий), способны восстанавливать Cu2+ до элементарной меди.
Cu2+ + Zn(тв) = Cu(тв) + Zn2+.
Методика проведения реакции . На очищенную металлическую пластинку (алюминиевую, железную, цинковую) наносят каплю раствора меди, каплю серной кислоты и оставляют на 2-3 минуты. Наблюдают появление красного пятна металлической меди.
+++ 5. Реакция с гексацианоферратом(II) калия K 4 [ Fe ( CN )6].
2Cu2+ + [Fe(CN)6]4- = Cu2[Fe(CN)6] (тв).
Образуется красно-бурый осадок гексацианоферрата(II) меди, нерастворимый в разбавленных кислотах. В гидроксиде аммония осадок растворяется с образованием гидроксида тетрааминмеди (II):
Cu2[Fe(CN)6] + 12NH4OH = (NH4)4[Fe(CN)6] + 2[Cu(NH3)4](OH)2 + 8H2O.
Определению мешают ионы Fe3+, Ni2+, Co2+.
Методика проведения реакции . К 3 каплям раствора соли меди добавляют 3 капли раствора гексацианоферрата(II) калия. Проверяют растворимость образовавшегося осадка в гидроксиде аммония.
6. Реакция с дитизоном (С6 H 5 )2 CSN 4 H 2. Дитизон при рН = 1-4 образует с катионом Cu2+ внутрикомплексное соединение красно-фиолетового цвета, экстрагируемое CHCl3 и CCl4. Определению мешают ионы Hg2+, Ag+. Если в качестве маскирующего реагента использовать KI при рН 1-2, то медь можно определять без помех со стороны других ионов.

Методика проведения реакции. К 1-2 каплям анализируемого раствора с рН 1-2 прибавляют 5-6 капель 5%-ного раствора KI и экстрагируют 0, 02%-ным раствором дитизона в четыреххлористом углероде. В присутствии меди органический слой окрашивается в красно-фиолетовый цвет.
Реакции катиона ртути( II )
1. Реакция с иодидом калия KI. С иодидом калия соли ртути(II) образуют осадок иодида ртути, который растворяется при дальнейшем добавлении реактива:
Hg2+ + 2 KI = HgI2 (тв),
HgIi2 (тв) + 2 KI = K2[HgI4].
Методика проведения реакции. На полоску фильтровальной бумаги наносят каплю разбавленного раствора иодида калия, затем каплю раствора соли Hg2+ и наблюдают появление красного пятна иодида ртути.
2. Реакция с дифенилкарбазидом (С6H5)2 N 2 H 4 CO. Этот органический реактив

в присутствии азотной кислоты образует с катионом Hg2+ комплексное соединение, окрашенное в фиолетовый или синий цвет.
Методика проведения реакции. В пробирку помещают 2-3 капли раствора соли Hg2+, одну каплю разбавленной азотной кислоты, 3 капли раствора дифенилкарбазида и наблюдают образование синего осадка.
Некоторые реакции катионов шестой аналитической группы приведены в табл. 10.
Таблица 10
Сводная таблица реакций катионов шестой аналитической группы
Реагент
Катионы
Контрольные вопросы к разделу 2.1
1. Какими общими свойствами обладают катионы первой аналитической группы?
2. Чем отличается первая группа катионов от других аналитических групп?
3. Осаждаются ли катионы первой группы щелочами и кислотами?
4. Что представляет собой реактив Несслера?
5. Каким образом можно удалить из раствора ионы аммония?
6. Какими реакциями можно обнаружить в растворе ионы калия?
7. Какими реакциями можно обнаружить в растворе ионы натрия?
8. Как различаются соединения натрия и калия по способности окрашивать бесцветное пламя горелки?
Контрольные вопросы к разделу 2.2
1. Какие катионы входят во вторую аналитическую группу?
2. Какими общими свойствами обладают катионы второй аналитической группы?
3. Какое соединение является групповым реактивом на катионы второй аналитической группы?
4. Как взаимодействуют катионы второй аналитической группы с групповым реактивом? Напишите уравнения реакций.
5. В чем можно растворить осадки AgCl, PbCL2, Hg2Cl2?
Контрольные вопросы к разделу 2.3
1. Какие катионы входят в третью аналитическую группу?
2. Какое соединение является групповым реактивом на катионы третьей аналитической группы?
3. Как взаимодействует групповой реактив с катионами третьей аналитической группы? Напишите уравнения реакций.
4. В чем можно растворить карбонаты, оксалаты, сульфаты Ca, Sr и Ва? Каковы причины растворения осадков?
5. В какой последовательности будут осаждаться катионы третьей группы, если в раствор, содержащий одинаковые концентрации ионов, постепенно добавлять:
а) сульфат натрия; б) оксалат натрия; в) карбонат натрия?
Контрольные вопросы к разделу 2.4
1. Какие катионы входят в четвертую аналитическую группу?
2. Какими свойствами обладают гидроксиды элементов, катионы которых образуют четвертую аналитическую группу?
3. Какими общими химическими свойствами обладают катионы четвертой аналитической группы?
4. Какое соединение является групповым реактивом на катионы четвертой аналитической группы?
5. Как взаимодействует групповой реактив с катионами четвертой аналитической группы? Напишите уравнения реакций с эквивалентным количеством и с избытком реактива.
Контрольные вопросы к разделу 2.5
1. Какими общими химическими свойствами обладают катионы пятой аналитической группы?
2. Какое соединение является групповым реактивом на катионы пятой аналитической группы?
3. Как взаимодействует групповой реактив с катионами пятой аналитической группы? Напишите уравнения реакций.
4. Как можно открыть катионы Fe2+ и Fe3+ в присутствии других ионов? Напишите уравнения реакций.
5. Как выполнить анализ смеси катионов пятой аналитической группы? Составьте схему систематического анализа.
Контрольные вопросы к разделу 2.6
1. Какими общими химическими свойствами обладают катионы шестой аналитической группы?
2. Какое соединение является групповым реактивом на катионы шестой аналитической группы?
3. Как взаимодействует групповой реактив с катионами шестой аналитической группы? Напишите уравнения реакций с эквивалентным количеством и с избытком реактива.
4. Растворы каких катионов шестой группы имеют характерную окраску?
5. С помощью какого реактива можно определить присутствие в растворе ионов меди?
Реакции бромид-иона
1. Реакция с хлорной водой Cl2. При действии хлорной воды (водного раствора хлора) бромид-ион окисляется до элементарного брома.
Cl2 (г) + 2 Br- = 2 Cl- + Br2.
Раствор приобретает бурую окраску вследствие образования свободного брома. Органические растворители CHCl3, CCl4, C6H6 экстрагируют Br2, при этом органическая фаза окрашивается в оранжевый цвет. При большом избытке хлорной воды бром окисляется дальше до гипобромид-аниона BrO-, а окраска хлороформного слоя становится лимонно-желтой.
Методика проведения реакции . К смеси 3 капель раствора, содержащего ионы Br -, и 3 капель серной кислоты прибавляют 6 капель CCl4 или CHCl3 и при энергичном встряхивании прибавляют по каплям хлорную воду.
2. Реакция с фуксин-сернистой кислотой. Фуксин при действии солей сернистой кислоты в кислой среде образует бесцветный продукт присоединения - фуксин-сернистую кислоту. При действии свободного брома на фуксин-сернистую кислоту образуется бромпроизводное фуксин-сернистой кислоты, имеющее красно-фиолетовый цвет. Реакция специфична и позволяет определять очень малые количества бромид-иона в присутствии хлоридов и иодидов.
Методика проведения реакции. Смешивают 5 капель раствора, содержащего бромид-ионы, с 4 каплями раствора KMnO4 и 4 каплями H2SO4. Смесь нагревают и в верхнюю часть пробирки опускают фильтровальную бумагу, смоченную фуксин-сернистой кислотой (фильтровальную бумагу пропитывают раствором фуксина, обесцвеченного смесью Na2SO3 + H2SO4).
Реакции иодид-иона
+++ 1. Реакция с солями свинца.
Pb2+ + 2I- = PbI2 (тв).
Образуется желтый осадок иодида свинца, растворяющийся при нагревании в воде.
Методика проведения реакции . К 2-3 каплям раствора, содержащего иодид-ионы, добавляют 2-3 капли раствора нитрата свинца. К образовавшемуся раствору с осадком добавляют небольшое количество дистиллированной воды и нагревают на водяной бане.
2. Реакция с серной кислотой H 2 SO 4. Концентрированная серная кислота окисляет иодистоводородную кислоту до свободного иода, который окрашивает раствор в бурый цвет.
I- + H+ = HI,
8HI + H2SO4 = 4I2 + 4H2O + H2S.
При нагревании смеси иод улетучивается в виде фиолетовых паров. Если к реакционной смеси добавить эфир или хлороформ, происходит окрашивание слоя органического растворителя в фиолетовый цвет.
Методика проведения реакции . К 3 каплям раствора, содержащего иодид-ионы, добавляют 5-7 капель концентрированной серной кислоты и 5 капель CHCl3. Смесь встряхивают и наблюдают фиолетовое окрашивание органической фазы.
3. Реакция окисления нитритом натрия:
2 I- + NO2- + H2O = I2 + NO3- + 2 H+
Методика проведения реакции . В пробирку прилить 3-4 капли исследуемого раствора, подкислить кислотой до рН < 7 и бросить несколько кристалликов NaNO2. Выделяется свободный иод, который окрашивает иод-крахмальную бумагу в синий цвет.
Реакции сульфид-иона
+++ 1. Реакция с нитратом серебра AgNO3. Нитрат серебра образует с сульфид-ионом черный осадок сульфида серебра, нерастворимый в NH4OH, Na2S2O3 и KCN, но растворимый при нагревании в 2 н. HNO3 в отличие от других солей анионов первой аналитической группы.
S2- + 2 Ag+ = Ag2S (тв).
Методика проведения реакции . К 1-2 каплям раствора, содержащего сульфид-ионы, прибавляют 1-2 капли раствора AgNO3. Наблюдают появление черного осадка. Проверяют растворимость осадка в 2 н. HNO3 при нагревании.
+++ 2. Реакция с кислотами. Соляная и серная кислоты при действии на сульфиды разлагают их с выделением сероводорода:
Na2S + H2SO4 = H2S(г) + Na2SO4.
Выделение сероводорода легко обнаружить по запаху или по почернению фильтровальной бумаги, смоченной раствором ацетата свинца:
Pb(CH3COOH)2 + H2S = PbS (тв) + 2 CH3COOH.
Методика проведения реакции . К 3 каплям раствора, содержащего сульфид-ионы, добавить 3 капли раствора серной или хлороводородной кислоты. К отверстию пробирки поднести фильтровальную бумагу, смоченную раствором ацетата свинца.
+++ 3. Реакция с нитратом кадмия Cd ( NO 3 )2. При добавлении к раствору, содержащему сульфид-ион, солей кадмия образуется желтый осадок сульфида кадмия.
Na2S + Cd(NO3)2 = CdS (тв) + 2NaNO3.
Методика проведения реакции . К 3 каплям раствора, содержащего сульфид-ионы, добавить 3 капли раствора соли кадмия.
4. Реакция с нитропруссидом натрия Na 2 [ Fe ( CN )5 NO ]. Раствор окрашивается в красно-фиолетовый цвет вследствие образования комплекса.
Na2S + Na2[Fe(CN)5NO] = Na4[Fe(CN)5NOS].
Методика проведения реакции . На часовом стекле смешивают каплю сульфида натрия, каплю 2 н. раствора NaOH и каплю 1%-ного раствора нитропруссида натрия.
5. Реакция с гидроксокомплексом свинца [Pb(OH)4 ]2-:
Pb2+ + 2OH- = Pb(OH)2 (тв),
Pb(OH)2(тв) + 2OH- = Pb(OH)42-,
S2- + Pb(OH)42- = PbS (тв) + 4OH-.
Гидроксокомплекс свинца образует с сульфид-ионом черный осадок PbS, растворимый при нагревании в 2 н. HNO3:
3PbS (тв) + 8HNO3 = 3Pb(NO3)2 + 3S (тв) + 2NO (г) + 4H2O.
Предел обнаружения сульфида 1, 8 мкг. Определение возможно в присутствии всех анионов.
Методика проведения реакции . В отдельной пробирке готовят раствор гидроксокомплекса свинца, для чего к 2-3 каплям раствора соли свинца Pb(NO3)2 добавляют раствор NaOH до полного растворения осадка. Каплю полученного раствора наносят на фильтровальную бумагу и на нее наносят каплю раствора, содержащего сульфид-ионы. В присутствии сульфид-ионов пятно становится черным или темно-бурым.
Некоторые реакции анионов первой аналитической группы приведены в табл. 11.
Таблица 11
Реакции сульфит-иона
1. Реакция с кислотами. При взаимодействии солей сернистой кислоты с минеральными кислотами образуется сернистая кислота, разлагающаяся на сернистый газ (SO2) и воду:
SO32- + 2H+ = H2SO3,
H2SO3 → H2O + SO2(г).
Выделение диоксида серы можно обнаружить по запаху горящей серы или по обесцвечиванию раствора иода и перманганата калия:
SO2 (г) + I2 + 2 H2O = 2HI + H2SO4;
5SO2 (г) + 2MnO4- + 2H2O = 2Mn2+ + 5SO42- + 4H+.
Методика проведения реакции 1. К 4 каплям раствора, содержащего сульфит-ионы, добавляют 5 капель раствора H2SO4 и 2 капли раствора иода. Наблюдают исчезновение желтой окраски иода.
Методика проведения реакции 2 . В пробирку наливают 5 капель соляной кислоты, 5 капель раствора, содержащего сульфит-ионы. В верхнюю часть пробирки помещают полоску фильтровальной бумаги, смоченную каплей раствора крахмала и разбавленным раствором иода. Пробирку нагревают и наблюдают обесцвечивание индикаторной бумаги.
2. Реакция восстановления до сероводорода H2 S. В сильнокислой среде сульфиты восстанавливаются цинком до сероводорода. Обнаружить выделение H2S можно по запаху тухлых яиц или по почернению фильтровальной бумаги, смоченной ацетатом свинца:
SO32- + 2H+ = H2O + SO2 (г),
SO2 (г) + 3Zn + 6H+ = 3Zn2+ + 2H2O + H2S(г),
H2S + Pb2+ = PbS(тв).
Методика проведения реакции . К 5 каплям раствора, содержащего сульфит-ионы, добавляют 10 капель 2 н. раствора HCl и кусочек цинка. В верхнюю часть пробирки помещают полоску фильтровальной бумаги, смоченную каплей раствора ацетата свинца.
Реакции карбонат-иона
+++ 1. Реакция с кислотами. При взаимодействии карбонат-ионов с минеральными кислотами образуется угольная кислота, разлагающаяся на углекислый газ и воду:
CO32- + 2H+ = H2CO3,
H2CO3 → H2O + CO2 (г).
Выделение углекислого газа легко обнаружить по помутнению насыщенного раствора Са(ОН)2 (известковой воды) в результате образования карбоната кальция:
Ca(OH)2 + CO2 (г) = CaCO3 (тв) + H2O.
Определению мешают сульфит-ионы, так как при действии кислот может образоваться диоксид серы SO2, также дающий осадок при пропускании через известковую воду. Перед проведением реакции целесообразно провести предварительное окисление компонентов раствора, например, пероксидом водорода:
SO32- + H2O2 = SO42- + H2O.
Методика проведения реакции . В пробирку вносят 5-6 капель исследуемого раствора и 5-6 капель 2 н. HCl. Пробирку закрывают пробкой, в которую вставлена газоотводная трубка. Конец трубки опускают в пробирку с известковой водой. Раствор подогревают и наблюдают помутнение раствора.
Реакции фосфат-иона
1. Реакция с молибдатом аммония ( NH 4 )2 MoO 4 (молибденовой жидкостью). Молибдат аммония в присутствии азотной кислоты образует с фосфат-ионами желтый кристаллический осадок фосформолибдата аммония по реакции:
PO43- + 3NH4+ + 12MoO42- + 24H+ = (NH4)3 [P(Mo3O10)4] (тв) + 12H2O,
растворимый в избытке фосфата, в щелочах и в гидроксиде аммония:
(NH4)3P(Mo3O10)4 + 24NH3 + 12H2O = (NH4)3PO4 + 12(NH4)2MoO4.
Определению мешают анионы-восстановители, которые восстанавливают молибдат и фосформолибдат до молибденовой сини. Для устранения мешающего влияния исследуемый раствор перед проведением реакции кипятят с азотной кислотой.
Методика проведения реакции . К 1-2 каплям раствора, содержащего фосфат-ионы, добавляют 3-5 капель молибденовой жидкости и слегка подогревают. Образуется желтый кристаллический осадок.
2. Реакция с магнезиальной смесью ( MgCl 2 + NH4OH + NH4 Cl ). При взаимодействии солей фосфорной кислоты с гидроксидом аммония и хлоридом магния в присутствии NH4Cl образуется белый кристаллический осадок фосфата магния–аммония:
HPO42- + NH4OH + Mg2+ = MgNH4PO4 (тв) + H2O,
растворимый в кислотах, но нерастворимый в аммиаке. Определению мешают арсенат-ионы.
Методика проведения реакции . К 2-3 каплям раствора, содержащего фосфат-ионы, прибавляют 4-5 капель магнезиальной смеси и перемешивают. Образуется белый кристаллический осадок.
3. Реакция с нитратом серебра AgNO 3. При взаимодействии гидрофосфатов с нитратом серебра образуется желтый осадок фосфата серебра, растворимый в азотной кислоте.
3Ag+ + HPO42- = Ag3PO4 (тв) + H+.
Методика проведения реакции. К 3 каплям раствора, содержащего фосфат-ионы, приливают 3 капли раствора нитрата серебра. После образования осадка проверяют его растворимость в азотной кислоте.
Реакции тиосульфат-иона
1. Реакция с кислотами. При взаимодействии тиосульфатов с кислотами образуется тиосерная кислота H2S2O3, которая разлагается на воду, диоксид серы и серу. Сера выпадает в осадок, и раствор мутнеет.
S2O32- + 2H+ = H2S2O3,
H2S2O3 → H2O + S (тв) + SO2 (г).
Методика проведения реакции . К 2-3 каплям раствора, содержащего тиосульфат-ионы, прибавляют 2-3 капли 2 н. HCl. Раствор мутнеет вследствие выделения серы.
2. Реакция с иодом I 2. Тиосульфат-ионы обесцвечивают раствор иода с образованием солей тетратионовой кислоты. Обнаружению мешают SO32- и S2-.
2S2O32- + I2 = S4O62- + 2I-.
Методика проведения реакции . К 2-3 каплям раствора I2 прибавляют 1 каплю крахмала и 3-5 капель раствора, содержащего тиосульфат-ионы. Синий раствор обесцвечивается.
3. Реакция с нитратом серебра AgNO 3. Нитрат серебра образует с солями тиосерной кислоты белый осадок тиосульфата серебра, который разлагается до сульфида серебра черного цвета.
2Ag+ + S2O32- = Ag2S2O3 (тв),
Ag2S2O3 (тв) + H2O = Ag2S(тв) + H2SO4.
При избытке тиосульфата осадок тиосульфата серебра растворяется с образованием комплексной соли:
Ag2S2O3 (тв) + 3 S2O32- = 2 [Ag(S2O3)2].
Методика проведения реакции . К 3 каплям раствора тиосульфата добавляют 2-3 капли раствора нитрата серебра. Смесь нагревают и перемешивают. Выпавший белый осадок постепенно желтеет, буреет и становится черным.
Реакции силикат-иона
+++ 1. Реакция с кислотами. При медленном добавлении к раствору, содержащему силикаты разбавленных кислот, выпадает белый студенистый осадок (гель) кремниевых кислот nSiO2.mH2O. При быстром добавлении кислоты осадок образуется не сразу. Для полного осаждения кремниевых кислот раствор несколько раз выпаривают досуха с концентрированной HCl. При этом кремниевая кислота переходит в практически нерастворимое в кислотах состояние, при обработке раствором кислоты осаждается. Таким образом, силикат-ионы можно обнаружить в присутствии всех анионов.
SiO32- + 2 H+ = H2SiO3 (тв).
Методика проведения реакции . К 2-3 каплям раствора, содержащего силикат-ионы, прибавляют по каплям 2 н. HCl и нагревают. Образуется белый студенистый осадок.
2. Реакция с хлоридом аммония NH4Cl. Соли аммония выделяют из растворов кремниевую кислоту:
SiO32- + 2 NH4+ = 2 NH3 (г) + H2SiO3(тв).
Методика проведения реакции . К 4-5 каплям раствора, содержащего силикат-ионы, прибавляют 3 капли раствора NH4Cl и нагревают. Образуется белый студенистый осадок.
Реакции борат-иона
1. Окрашивание пламени. В присутствии серной кислоты и этилового спирта борат-ионы образуют этиловый эфир борной кислоты, который окрашивает пламя горящего спирта в зеленый цвет.
Na2B4O7 + H2SO4 + 5H2O = Na2SO4 + 4H3BO3,
H3BO3 + 3C2H5OH = (C2H5O)3B + 3H2O,
Методика проведения реакции. В тигель наливают 10 капель раствора тетрабората натрия, выпаривают досуха, охлаждают, добавляют 2 капли концентрированной H2SO4, 10-20 капель этилового спирта, смесь поджигают и наблюдают зеленое пламя.
Некоторые реакции анионов второй аналитической группы приведены в табл. 12.
Таблица 12
Реагент
Ион
Осадки белого цвета
Осадки белого цвета
Реакции нитрат-иона
1. Реакция с дифениламином ( C 6 H 5 )2 NH. Нитрат-ион в кислой среде окисляет дифениламин с образованием интенсивно окрашенного синего соединения:
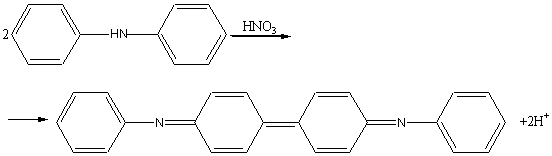
Проведению реакции мешают ионы NO2-, CrO42- и другие ионы - окислители.
Методика проведения реакции. На предметное стекло помещают 1 каплю раствора, содержащего нитрат-ионы, и 2 капли раствора дифениламина в концентрированной серной кислоте. Бесцветный раствор синеет.
??? 2. Реакция восстановления алюминием и цинком. При восстановлении солей азотной кислоты алюминием или цинком в щелочной среде образуется аммиак, выделение которого можно открыть по посинению влажной лакмусовой бумаги.
3NO3- + 8Al + 5OH- + 18H2O = 8[Al(OH)4]2- + 3NH3 (г).
Методика проведения реакции . К 5 каплям раствора, содержащего нитрат-ионы, добавляют 5 капель 6 н. раствора NaOH и кусочек металлического цинка или алюминия. Пробирку нагревают на водяной бане. К отверстию пробирки подносят влажную лакмусовую бумагу и наблюдают ее посинение.
+++ 3. Реакция с сульфатом железа(II) FeSO 4. При взаимодействии сульфата железа(II) в кислой среде с нитрат-ионами происходит восстановление азотной кислоты и ее солей до оксида азота NO, который образует с ионами Fe2+ комплексное соединение бурого цвета.
3Fe2+ + NO3- + 4H+ = 3Fe3+ + NO(г) + 2H2O,
Fe2+ + NO = [FeNO]2+.
Предел обнаружения - 2, 5 мкг. Определению мешают ионы NO2-, I-, Br-, SCN-, IO3-, ClO3-, SO32-, S2O32-, S2-.
Методика проведения реакции 1. К 2 каплям раствора, содержащего нитрат-ионы, добавляют 5 капель насыщенного раствора FeSO4 и осторожно, по стенке пробирки, 5 капель концентрированной серной кислоты. Наблюдают образование бурого кольца.
Методика проведения реакции 2 . На предметное стекло помещают каплю раствора, содержащего нитрат-ионы, кристаллик FeSO4 и осторожно каплю концентрированной серной кислоты. Вокруг кристаллика образуется бурое кольцо.
Реакции нитрит-иона
1. Реакция с кислотами. В присутствии кислот соли азотистой кислоты разлагаются с выделением диоксида и оксида азота. Обнаружить присутствие диоксида азота можно по выделению бурого газа, хорошо заметного на белом фоне.
NO2- + H+ = HNO2,
2HNO2 = NO2 (г) + NO (г) + H2O.
Методика проведения реакции. К 4 каплям раствора, содержащего нитрит-ионы, прибавить 4 капли концентрированной серной кислоты.
Предварительные испытания
Вещество поступает на анализ в сухом виде или в растворе. Прежде чем приступить к систематическому или дробному анализу, проводят предварительные наблюдения и испытания (табл. 15). В частности, исследуют цвет вещества или раствора, растворимость в различных растворителях, поведение вещества при внесении в пламя горелки и при нагревании в пробирке, запах, форму кристаллов, однородность состава и др.
Прежде всего, следует внимательно рассмотреть небольшую пробу сухого вещества. Если проба состоит из однородных бесцветных или белых кристаллов, это может говорить об отсутствии в пробе окрашенных катионов и анионов; синие кристаллы указывают на возможное присутствие солей меди, розовые - солей кобальта, зеленые - железа (II) или солей никеля, желтые - хроматов, оранжевые - бихроматов. Вещество может представлять собой смесь кристаллов различных типов, поэтому внимательное рассмотрение смеси невооруженным глазом поможет сделать предварительные выводы о том, сколько веществ ориентировочно содержится в смеси. При этом нужно учитывать форму кристаллов и их цвет.
Далее проводят испытания в пламени газовой горелки. Для этого небольшую пробу помещают в петлю из платиновой проволоки и вносят в пламя. Поведение пробы и окраска пламени могут дать информацию о составе анализируемого вещества. Если оно содержит органические вещества, происходит обугливание. Соли аммония сразу улетучиваются из пламени.
Многие катионы окрашивают пламя в характерные цвета (табл. 14). Следует иметь в виду, что катион натрия интенсивно окрашивает пламя в желтый цвет, что маскирует окраску, вызываемую другими катионами.
Затем испытывают вещество на растворимость. Растворимость веществ в воде определяют вначале «на холоду», затем при нагревании. Если вещество нерастворимо в воде, пробуют растворять его в разбавленных и концентрированных кислотах и щелочах. Из кислот целесообразно использовать серную кислоту.
Если при растворении в кислотах выделяются газы, определяют по запаху и свойствам характер выделяющегося газа, по которому можно сделать вывод о составе вещества.
Если вещество не растворяется в разбавленных кислотах, испытывают его растворимость в концентрированных кислотах и царской водке. Нерастворимость в кислотах и царской водке указывает на присутствие сульфатов Sr, Ba, Pb, галогенидов серебра, оксида алюминия, хрома кремния, силикатов. Эти вещества переводят в растворимое состояние сплавлением с щелочами, карбонатами или гидросульфатами щелочных металлов.
Таблица 14
Предварительные испытания неизвестного вещества
| Испытание | Результат | Присутствие иона (элемента) |
| Окраска пламени горелки | Желтая | Na+ |
| Карминово-красная | Sr2+ | |
| Кирпично-красная | Ca2+ | |
| Желто-зеленая | Ba2+ | |
| Зеленая | Cu2+, Bi3+ | |
| Светло-голубая | Pb2+, As3+, Sb3+ | |
| Фиолетовая | K+ | |
| Растворимость | Нерастворимы в кислотах и царской водке | AgCl, AgBr, AgI, BaSO4, SrSO4, PbSO4, Al2O3, SiO2 |
| Растворимы в HCl | Отсутствуют Ag+, Hg22+ | |
| Растворимы в H2SO4 | Отсутствуют Ca2+, Sr2+, Ba2+, Pb2+ | |
| Выделение газов при добавлении кислот | CO2 (помутнение известковой воды) | CO32-, HCO3- |
| SO2 (запах горящей серы) | SO32-, S2O32- | |
| NO2 (красно-бурые пары) | NO2- | |
| H2S (запах тухлых яиц) | S2-, SO32-, S2O32- | |
| CH3COOH (запах уксуса) | CH3COO- | |
| Br2 (красно-бурые пары) | Br- (с окислителем) | |
| HCl (помутнение раствора AgNO3, удушливый газ) | Cl- | |
| I2 (фиолетовые пары) | I- (с окислителем) |
Если вещество растворимо в воде, ценные сведения о его составе может дать значение рН среды. Кислая реакция среды указывает на присутствие свободных кислот, солей сильных кислот и слабых оснований или кислых солей. Щелочная реакция среды говорит о присутствии щелочей, солей сильных оснований и слабых кислот или основных солей.
Иногда часть вещества растворима в воде, часть - в разбавленных кислотах, часть - в концентрированных кислотах или щелочах. В этом случае целесообразно провести дробное растворение (добавить к веществу воду, отделить водный раствор, добавить разбавленную кислоту, отделить жидкость и т.д.). Так можно получить ряд фракций - растворов, содержащих различные катионы и анионы. Установив подходящий растворитель, готовят растворы для анализа на катионы и анионы, нейтрализуют растворы и приступают к анализу.
Окончательное заключение о составе вещества можно сделать, только проведя качественные реакции на катионы и анионы. Определив катионы и анионы в анализируемой смеси, делают вывод о содержащихся в ней веществах.
При анализе неизвестного вещества часто не ограничиваются приемами качественного химического анализа, а используют также методы инструментального физико-химического анализа.
Анализ индивидуальной соли
Задача может быть в виде раствора или в виде сухой соли.
Анализ раствора. Обратить внимание на окраску раствора, определить рН и сделать соответствующие выводы. Исследуемый раствор делят на 3 части. В первой из них с помощью групповых и специфических реактивов открывают катионы приемами систематического анализа смеси катионов шести аналитических групп. Во второй части раствора открывают анионы с помощью групповых и специфических реактивов приемами систематического анализа смеси анионов трех аналитических групп. Третья часть раствора остается для контрольных анализов.
4.2.1. Проба на катионы первой группы. К двум каплям задачи (рН=7) прилить две капли Na2CO3. Если нет осадка или мути - могут присутствовать только катионы первой группы. В этом случае по очереди открывают ионы NH4+, К+ и Na+ в исследуемом растворе.
4.2.2. Проба на катионы второй группы. К двум каплям задачи прибавить две капли НСl. Если образуется муть, осадок — есть катионы второй группы. Тогда последовательно открывают катионы Pb2+, Hg2+, Ag+.
4.2.3. Проба на катионы третьей группы. К двум каплям задачи прилить две капли H2SO4. Если через 5-10 минут образуется муть, осадок, то есть катионы третьей группы. Тогда открывают ионы Ва2+, Sr2+ и Са2+.
4.2.4. Проба на катионы четвертой группы. К двум каплям задачи прибавить по каплям NaOH до сильно щелочной среды рН> 10. Если ранее образовавшийся осадок растворился, то есть катионы четвертой группы. Тогда последовательно открывают катионы четвертой группы, отбирая каждый раз по две капли исследуемого раствора.
4.2.5. Проба на катионы пятой группы. Если образовавшийся в п. 4.2.4 осадок не растворился, то есть катионы пятой группы. Тогда последовательно открывают катионы пятой группы, отбирая каждый раз по две капли исследуемого раствора.
4.2.6. Проба на катионы шестой группы. К двум каплям задачи прибавить по каплям концентрированный раствор аммиака до сильного запаха. Если ранее появившийся осадок растворяется, то присутствуют катионы шестой группы. Все катионы шестой группы, кроме ионов кадмия, можно открыть дробным методом. Предварительно обратить внимание на окраску раствора и определить рН.
Если все предыдущие пробы дали отрицательный результат, считают, что присутствуют катионы первой группы. По очереди открывают катионы первой группы, применяя специфические реактивы.
4.2.7. Обнаружение аниона соли. Открыв катион соли и учитывая растворимость солей в воде, кислотах, не трудно определить, к какой группе может относиться анион. Неплохо воспользоваться групповыми реактивами для обнаружения первой и второй групп анионов. Обнаружение анионов, как правило, ведут дробным методом. По очереди открывают анионы данной группы, используя специфические реакции.
Анализ сухой соли начинают с подбора растворителя: взять для пробы минимальное количество сухой соли (1-2 кристаллика) и растворителя — около 10 капель. Добившись растворения, готовят раствор (примерно 10 %) и анализируют, как указано в 4.2.1. ¸ 4.2.7.
Список литературы
1. Михалева М.В., Мартыненко Б.В. Практикум по качественному полумикроанализу: учебное пособие для вузов. – М.: Дрофа, 2007.
2. Васильев В.П., Морозова Р.П., Кочергина Л.А. Аналитическая химия. Лабораторный практикум / Под ред. В.П.Васильева. – М.: Дрофа, 2006.
3. Харитонов Ю.Я. Аналитическая химия. В 2 кн. Кн.1. Общие теоретические основы. Качественный анализ. – М.: Высшая школа, 2001.
4. У.Кунце, Г.Шведт. Основы качественного и количественного анализа. - М.: 1997
5. Пискарева С.К. Аналитическая химия. – М.: Высш. шк., 1994.
6. Лурье Ю.Ю. Справочник по аналитической химии. – М.: Химия, 1989.
7. Гурвич Я.А. Химический анализ. – М.: Высш. шк., 1985.
8. Алексеев В.Н. Курс качественного химического полумикроанализа. – М.: Химия, 1973.
ОГЛАВЛЕНИЕ
| Введение......................................................................................................... | 3 |
| 1. Качественный анализ неорганических веществ………………….. | 4 |
| 1.1. Методы и условия проведения качественного химического анализа ……………………………………………………………………... | 4 |
| 1.2. Качественные аналитические реакции и аналитические признаки…………………………………………………………………….. | 8 |
| 1.3. Реактивы, применяемые в качественном анализе……………….. | 10 |
| 1.4. Аналитическая классификация ионов в качественном анализе… | 12 |
| 2. Кислотно-основная аналитическая классификация катионов….. | 15 |
| 2.1. Первая аналитическая группа катионов………………………….. 2.1.1. Реакции катиона лития….………............................................ 2.1.2. Реакции катиона аммония ………………………………....... 2.1.3. Реакции катиона натрия……………………………….…….. 2.1.4. Реакции катиона калия………………………………………. | 15 15 15 17 17 |
| 2.2. Вторая аналитическая группа катионов...……………………….. 2.2.1. Реакции катиона серебра......................................................... 2.2.2. Реакции катиона диртути 2+………………………………… 2.2.3. Реакции катиона свинца (II)……………………………........ | 15 21 22 23 |
| 2.3. Третья аналитическая группа катионов….…………………........ 2.3.1. Реакции катиона бария………………………………………2.3.2. Реакции катиона кальция…………………………………… 2.3.3. Реакции катиона стронция………………………………….. | 26 27 27 28 |
| 2.4. Четвёртая аналитическая группа катионов...…………………… 2.4.1. Реакции катиона алюминия………………………………… 2.4.2. Реакции катиона хрома(III)……..………………………....... 2.4.3. Реакции катиона цинка……………………………………… 2.4.4. Реакции катионов олова (II) и (IV)………………………… | 30 31 32 33 35 |
| 2.5. Пятая аналитическая группа катионов……................................... 2.5.1. Реакции катиона железа (II)…………………………............ 2.5.2. Реакции катиона железа (III)……………………………...... 2.5.3. Реакции катиона марганца (II)……………………………… 2.5.4. Реакции катиона магния…………………………………….. 2.5.5. Реакции катиона висмута (III)………………………………. 2.5.6. Реакции катиона сурьмы (III)……………………………….. 2.5.7. Реакции катиона сурьмы (V)……………………………....... | 37 38 38 39 40 41 42 43 |
| 2.6. Шестая аналитическая группа катионов………………………… 2.6.1. Реакции катиона меди (II)………………………………........ 2.6.2. Реакции катиона никеля (II)……...…………………………. 2.6.3. Реакции катиона кобальта (II)………………………………. 2.6.4. Реакции катиона кадмия……………………………………. 2.6.5. Реакции катиона ртути (II)………………………………….. | 45 45 47 48 48 49 |
| 3. Аналитическая классификация анионов………………………….. | 53 |
| 3.1. Анионы первой аналитической группы.…………………………. 3.1.1. Реакции хлорид - иона………………………………………. 3.1.2. Реакции бромид-иона……………………………………....... 3.1.3. Реакции иодид-иона…………………………………………. 3.1.4. Реакции сульфид-иона………………………………………. | 53 53 54 55 56 |
| 3.2. Анионы второй аналитической группы..……………………….. 3.2.1. Реакции сульфат-иона………………………………………. 3.2.2. Реакции сульфит-иона………………………………………. 3.2.3. Реакции карбонат-иона……………………………………… 3.2.4. Реакции фосфат-иона………………………………............... 3.2.5. Реакции тиосульфат-иона…………………………… 3.2.6. Реакции силикат-иона……………………………………….. | 59 60 60 61 62 63 64 |
| 3.3. Анионы третьей аналитической группы ………………………… 3.3.1. Реакции нитрат-иона…………………………………………. 3.3.2. Реакции нитрит-иона………………………………………… 3.3.3. Реакции ацетат-иона…………………………………………. | 66 66 67 68 |
| 4. Качественный анализ неизвестного вещества.................................. | 71 |
| 4.1. Предварительные испытания……………………………………... | 71 |
| 4.2. Анализ индивидуальной соли…………………………………….. | 73 |
| 4.3. Систематический анализ смеси катионов……………………… | 74 |
| 5. Список литературы…………………………………………………… | 77 |
Министерство образования и науки Российской Федерации
Государственное образовательное учреждение высшего профессионального образования
“МАТИ” ─ Российский Государственный Технологический
Университет им. К.Э. Циолковского
Кафедра «ОХ, Ф и ХКМ»
ХИМИЧЕСКИЙ АНАЛИЗ
ХИМИЧЕСКИЙ АНАЛИЗ
Часть 1. Качественный анализ неорганических веществ
Учебное пособие
Допущено учебно-методическим объединением высших учебных заведений Российской Федерации по образованию в области материаловедения, технологии материалов и покрытий в качестве учебного пособия для студентов, обучающихся по направлениям 150600 “Материаловедение и технология новых материалов” и 150500 “Материаловедение, технология материалов и покрытий”.
Москва 2009
Авторы: В.С.Клементьева, И.В.Соловьева, Т.Я.Максина, С.А.Пиункова
Рецензенты:
Директор естественно-экологического института Московского государственного областного университета,
доктор биологических наук, профессор А.С.Коничев
Заведующий кафедрой неорганической и аналитической химии МГПУ, доктор биологических наук, профессор Горичев И.Г.
Химический анализ. Часть 1. Качественный анализ неорганических веществ / В.С.Клементьева, И.В.Соловьева, Т.Я.Максина, С.А.Пиункова – М.: 11-й Формат, 2009. – 79 с.
В учебном пособии приводятся сведения, относящиеся к изучению химических методов качественного анализа.
Рассмотрены методы и условия проведения качественного химического анализа веществ, состоящих из наиболее часто встречающихся в реальной практике катионов и анионов. В основу качественного анализа положена кислотно-основная классификация катионов.
В пособие включен необходимый минимум теоретического материала, перечислены стадии химического анализа, требования, предъявляемые к аналитическим реакциям. Основная часть пособия посвящена классификации катионов и анионов и химическим реакциям, используемым для идентификации ионов в качественном анализе. В конце главы приведены контрольные вопросы по изучаемой теме.
Учебное пособие предназначено для подготовки бакалавров и магистров по направлениям 150100 «Металлургия», 150600 “Материаловедение и технология новых материалов”, 150500 “Материаловедение, технология материалов и покрытий”, 286200 “Защита окружающей среды”, 280100 «Безопасность жизнедеятельности» и составлено в соответствии с программой дисциплины «Неорганическая и аналитическая химия» и планам учебных занятий по аналитической химии.
Введение
Аналитическая химия – это раздел химии, посвященный разработке методов изучения химического состава вещества. В зависимости от характера анализируемых объектов, аналитическую химию делят на анализ неорганических веществ и анализ органических веществ.
Цель аналитической химии - установление качественного и количественного состава вещества или смеси веществ. В соответствии с этим аналитическая химия делится на качественный и количественный анализ.Задачей качественного анализа является выяснение качественного состава анализируемого объекта. Задачей количественного анализа является определение точного содержания отдельных элементов или их соединений в анализируемом объекте.Различают макрокомпоненты и микрокомпоненты, или примеси. В качественном анализе применяют термины «обнаружение», или «открытие»; в количественном – «определение».
В качественном и количественном анализах используют самые разнообразные химические реакции, применяют широкий спектр химических, физических, физико-химических, биологических методов, разрабатывают новые методы анализа и совершенствуют уже существующие. Число методов аналитической химии чрезвычайно велико и постоянно растет.
Химический анализ внедряется в различные области науки. Поэтому аналитическая химия тесно связана с другими дисциплинами: химики-аналитики пользуются достижениями других разделов химии, а также математики, физики, биологии и многих областей техники.
Различные методы исследования, применяемые в качественном и в количественном анализах, можно разделить на три основные группы методов:
- химические, где используются химические реакции, результат которых определяют визуально;
- физические, основанные на измерении каких-либо физических характеристик вещества, являющихся функцией его химического состава;
- физико-химические, основанные на наблюдении за изменением физических свойств веществ (оптической плотности, электропроводности, теплопроводности и др.), которые происходят в результате химической реакции.
Так как в физических и физико–химических методах используются приборы, эти методы часто объединяют под названием инструментальных методов.
В аналитическую химию очень широко внедряются компьютерные методы расчетов, например, при статистической обработке результатов анализа, при планировании эксперимента и нахождении оптимальных условий проведения анализа, при автоматизации методов анализа. Эта проблема особенно актуальна для контроля производства вообще и, в частности, при работе с особо вредными веществами. Для автоматизации больше всего подходят физические или физико–химические методы анализа.
Последнее изменение этой страницы: 2019-04-10; Просмотров: 379; Нарушение авторского права страницы