
|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |

|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |
МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ. ЗАГАЛЬНА ХІМІЯСтр 1 из 6Следующая ⇒
МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ Національний технічний університет України «Київський політехнічний інститут»
ЗАГАЛЬНА ХІМІЯ «БУДОВА РЕЧОВИНИ»
НАВЧАЛЬНИЙ ПОСІБНИК ДЛЯ СТУДЕНТІВ ТЕХНІЧНИХ НАПРЯМІВ ПІДГОТОВКИ
Київ НТУУ «КПІ» 2010 МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ Національний технічний університет України «Київський політехнічний інститут»
ЗАГАЛЬНА ХІМІЯ «БУДОВА РЕЧОВИНИ»
НАВЧАЛЬНИЙ ПОСІБНИК ДЛЯ СТУДЕНТІВ ТЕХНІЧНИХ НАПРЯМІВ ПІДГОТОВКИ
Рекомендовано Методичною радою НТУУ «КПІ» 18 лютого 2010 р., протокол №6
Київ НТУУ «КПІ» 2010 Загальна хімія. «Будова речовини». Навчальний посібник навчальної дисципліни «Загальна хімія» для студентів технічних напрямів підготовки / Уклад.: А.В. Підгорний, Т.М. Назарова, Н.А. Гуц – К.: НТУУ «КПІ», 2010. – 66 с.
УДК 541.6 (75.8) Гриф надано Методичною радою НТУУ «КПІ» (Протокол № 6 від 18 лютого 2010 р.)
Навчальне видання
ЗАГАЛЬНА ХІМІЯ «БУДОВА РЕЧОВИНИ» Навчальний посібник для студентів технічних напрямів підготовки
У навчальному виданні розглянуті основні положення електронної будови атомів, зв’язок властивостей елементів з їх розміщенням у Періодичній системі, квантово-механічних уявлень про утворення хімічних зв’язків та структуру молекул, типів міжмолекулярних зв’язків, особливостей кристалічного стану речовини. Видання призначене для студентів технічних напрямів підготовки. УДК 541.6 (75.8)
Укладачі: Підгорний Андрій Вадимович Назарова Тамара Максимівна Гуц Неля Анатоліївна
Відповідальний редактор О. О. Андрійко, док. хім. наук, проф.
Рецензенти Ю. О. Тітов, док. хім. наук, ст. наук. спів. КНУ ім. Т. Шевченка В. І. Лисін, канд. хім. наук, доц. КНУТД
За редакцією укладачів
ЗМІСТ ВСТУП........................................................................................................... 4 1. ОСНОВНІ ВІДОМОСТІ ПРО БУДОВУ АТОМА................................... 5 1.1. Стан електрона в атомі. Постулати квантової механіки................ 6 1.2. Електронна оболонка атомів. Правила розподілу електронів на енергетичних рівнях і підрівнях..................................................................................... 12 1.2.1. Електронні формули атомів. Валентність у стаціонарному і збудженому станах 14 1.3. Періодичний закон Д. І. Менделєєва............................................ 15 1.3.1. Характеристика елемента за електронною формулою........... 18 1.4. Закономірності зміни властивостей елементів у періодах і групах 21 1.4.1. Електронегативність................................................................... 24 2. ХІМІЧНИЙ ЗВ’ЯЗОК............................................................................. 26 2.1. Квантово-механічні аспекти опису хімічного зв’язку..................... 27 2.2. Основні характеристики хімічного зв’язку..................................... 29 2.3 Метод валентних зв’язків. Полярність............................................. 30 2.4. Властивості ковалентних зв’язків.................................................... 34 2.4.1 Просторова будова молекул з одинарними зв’язками. Полярність молекул. Теорія гібридизації атомних орбіталей.............................................. 38 2.4.2. Молекули з кратними зв’язками............................................... 52 2.5. Іонний зв’язок................................................................................... 55 2.6. Металічний зв’язок........................................................................... 56 2.7. Міжмолекулярна взаємодія.............................................................. 58 2.7.1. Ван-дер-ваальсові зв’язки......................................................... 58 2.7.2 Гідрогенний зв’язок.................................................................... 60 2.8. Особливості кристалічного стану речовини. Залежність властивостей кристалічних структур від природи частинок, що їх утворюють......... 62 ЛІТЕРАТУРА.............................................................................................. 66 ВСТУП
Мета даного навчального посібника - забезпечити якісне подання програмного матеріалу, що пов’язане з накопиченням сучасних відомостей та уявлень про будову речовини відповідно до навчальних робочих програм вищої школи. Теоретичний матеріал ілюструє велику кількість різних прикладів, які дозволяють студентам самостійно засвоювати зазначений матеріал дисципліни. Посібник призначено для студентів денної форми навчання технічних спеціальностей. Його використання сприятиме опрацюванню основних положень навчальної програми, активізуватиме самостійне опрацювання матеріалу та допоможе підготуватися до екзамену. Сучасне наукове обґрунтування головних розділів дисципліни «Загальна хімія» базується на використанні фундаментальних принципів квантово-механічної теорії будови атомів та молекул. Розгляд теми «Будова атомів. Теорія хімічного зв’язку» формує цілісну картину матеріального світу, узагальнює основні закони природознавства, пояснює закономірності фізико-хімічних процесів та взаємозв’язок властивостей речовин і конструкційних матеріалів з особливостями їх будови. Механіки
Електрони постійно рухаються у просторі навколо ядра та зазнають впливу його силових полів. Характер руху електрона описує квантова механіка - це розділ фізики, що вивчає поведінку мікрооб’єктів у зовнішніх силових полях. 1. Постулат М. Планка (1900 р.): «Енергія випромінюється, розповсюджується та поглинається не безперервно, а окремими порціями - квантами». Значення кванта енергії обчислюють за співвідношенням, яке називають рівнянням Планка: Е = h n, ( 1 ) де Е - кількість енергії; n – частотою коливань; h - універсальна стала Планка, що дорівнює 6,626×10- 34 Дж×с. Атом у стаціонарному стані має мінімально можливий запас енергії. Поглинаючи енергію він витрачає її на зміну енергетичного стану та переходить в один із можливих збуджених станів. 2. Постулат де Бройля (корпускулярно-хвильовий дуалізм) «Будь-яка частинка матерії у стані руху одночасно виявляє властивості хвилі і частинки з масою спокою». Таким чином, електрон, що рухається в атомі, виявляє хвильові властивості. Основним рівнянням хвильової механіки є рівняння де Бройля:
де l е – довжин хвилі, м; h – стала Планка, Дж×с; m – маса частинки, кг; u – швидкість руху, м/с. Довжина електронної хвилі l е, що супроводжує рух електрона співрозмірна з розміром атома, тому не можна нехтувати хвильовими властивостями електрону, описуючи його поведінку. Гіпотезу де Бройля щодо двоїстої природи руху електрона у 1927 р. було експериментально підтверджено К. Девіссоном, Л. Джермером і також Дж. Томпсоном, П. Тартаковським. Вони виявили дифракцію електронів під час їх руху із великою швидкістю на кристалічній ґратці металів, схожу на дифракцію рентгенівського випромінювання. Окрім електронів, явище дифракції було виявлено для пучків нейтронів, атомів гелія, молекул водню. Таким чином, була доведена чинність гіпотези щодо універсальності хвильових властивостей під час опису частинок у стані руху. Проте, слід відзначити, що хвилі де Бройля не є дійсною реальністю, а більшою мірою являють адекватний (вдалий) математичний спосіб, що описує закон руху мікрочастинок. 3. Постулат В. Гейзенберга (1927 р.): «Неможливо одночасно з великою точністю визначити місцезнаходження електрона і його швидкість руху в атомі». Добуток похибок у результатах одночасного визначення координати електрона та швидкості його руху в атомі не може бути меншим, за той, що визначають співвідношенням: Dх×Du е ³ де D - похибки у вимірюванні координати і швидкості; uе – швидкість руху електрона, м/с; Із співвідношення невизначеності випливає, що чим точніше визначено швидкість руху електрона (D uе ® min) в атомі, тим більшою буде невизначеність в оцінці його координати Dх. До того ж для мікрооб’єктів похибки у визначенні фізичних величин Dх, D uе стають співставними із значеннями самих величин х та p. Як наслідок, набувають сили квантові закони, які дають не однозначні результати, а ймовірні, і тому закони класичної механіки мають обмежене застосування для опису поведінки мікрооб’єктів. Отже, як точні фізичні величини, координата та імпульс мікрооб’єктів сумісно не існують. Тому, траєкторію руху електрона задавати неможливо, а можна тільки обговорювати ймовірність його перебування у різних точках навколоядерного простору. У зв’язку з наявністю хвильових властивостей у електрона поведінка його повинна описуватись хвильовим рівнянням, як і поведінка звукових та світлових хвиль. Австрійський вчений Ервін Шредінгер ввів хвильову функцію y (х, у, z) [псі-функція] як модель хвильового процесу, що пов’язаний з рухом електрона в атомі водню. Хвильова функція згідно з квантово-механічними уявленнями являє собою одну з основних характеристик електрона під час його руху. За своїм змістом y-функція визначає закон зміни амплітуди просторового хвильового руху стоячої хвилі. Під час розповсюдження таких хвиль у обмеженому об’ємі простору залишається незмінною енергія системи, що задовольняє опису стаціонарного стану атома. За допомогою y-функції розрахунковими методами одержують інформацію про можливий енергетичний стан електрона в атомі водню та оцінюють ймовірність його перебування в різних точках навколо ядра. Ймовірність (W) перебування електрона в елементі об’єму навколо ядра dv пропорційна квадрату модуля хвильової функції: W ~ |y|2 dv (4) Наочний розподіл ймовірних місць перебування електрона у просторі навколо ядра створює квантово-механічну модель його стану - електронну хмару. Основним рівнянням квантової механіки є хвильове рівняння Шредінгера: де Ĥ - оператор Гамільтона - послідовність математичних операцій, здійснення яких дозволяє одержати дозволені енергетичні стани електрона в атомі водню; Еі - дискретні значення енергії електрона (власні значення оператора Гамільтона); ynl Атомні орбіталі - це рішення хвильового рівняння з вказаним набором трьох квантових чисел. Схематично АО позначають символом . АО @ y n l АО описують граничну поверхню навколо ядра, в межах якої зосереджено не менше 95% електричного заряду електрону як хвилі та ймовірність зустрічі з електроном як з частинкою складає не менше 95%. Головними характеристиками АО є енергія, форма, просторова орієнтація, які визначають переліком можливих комбінацій трьох квантових чисел. Інформативність кожного квантового числа та їх можливі значення наведені у Табл. 2, 3, 4. Атомні орбіталі з приблизно однаковим запасом енергії і однаковим значенням n утворюють енергетичний рівень. Кожний енергетичний рівень складається з набору енергетичних підрівнів. Енергетичний підрівень - це сукупність орбіталей з однаковою енергією, формою, тобто певними сталими значеннями n і l. Число АО підрівня за певного значення l визначають набором значень ml. Кожне значення ml задає варіант просторового розміщення АО
Рис. 1. Електроння хмара Гідрогену з нерівномірною густиною.
Таблиця 2. Квантові числа
Таблиця 3. Орбітальне квантове число
Таблиця 4. Магнітне квантове число
Рис. 2. Форми і просторова орієнтація s- та p-орбіталей. Приклад. Для тричі виродженого р-підрівня згідно з правилом Гунда для трьох електронів заповнимо АО:
Послідовність заповнення енергетичних підрівнів електронами у багатоелектронному атомі відповідає виконанню принципу найменшої енергії: доки не заповниться підрівень з меншим запасом енергії, доти не буде заповнюватись підрівень з більшим енергетичним запасом. Послідовность підрівнів у порядку зростання енергій для атома водню та багатоелектронних атомів, яку визначають за правилом Клечковського наведено в Табл. 5.
Таблиця 5. Розташування рівнів та підрівнів у порядку
1.2.1. Електронні формули атомів. Електронна формула відображає розподіл електронів на орбіталях в атомі:
Валентність у стаціонарному стані (стан з мінімальною енергією) визначають за кількістю неспарених електронів на зовнішньому енергетичному рівні. Найвищу валентність атом виявляє під час збудження. Збудження - це поглинання квантів енергії, роз’єднання спарених валентних електронів та перехід їх на вільні від електронів АО того ж самого енергетичного рівня.
Приклад. Записати електронні формули атомів Алюмінію і Сульфуру в стаціонарному та збудженому станах, а також визначити їх валентність.
Малі періоди | I | II | III | IV | V | VI | VII | VIII | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ns1 | ns2 | ns2 np1 | ns2 np2 | ns2 np3 | ns2 np4 | ns2 np5 | ns2 np6 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Номер групи | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
| I | II | III | IV | V | VI | VII | VIII | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Головні підгрупи | Побічні підгрупи | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ns1 | ns2 | ns2 (n-1)d1 | ns2 (n-1)d2 | ns2 (n-1)d3 | ns2 (n-1)d 4 | ns2 (n-1)d 5 | ns2 (n-1)d 6 - 8 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Побічні підгрупи | Головні підгрупи | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ns2(n-1)d9 | ns2(n-1)d 10 | ns2 np1 | ns2 np 2 | ns2 np 3 | ns2 np 4 | ns2 np 5 | ns2 np6 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Елементів хімічних аналогів
Аналог з ІІІ періоду: …3s2 3p4
Елемент № 34: ...4s2 3d10 4p4
Аналог з V періоду: … 5s2 4d10 5p4
Електронегативність
Електронегативність (ЕН) - це здатність зв’язаного атома притягувати електрони і набувати негативного заряду в хімічній сполуці. Електронегативність визначають як півсуму енергії іонізації і енергії спорідненості до електрона:

Для зручності часто користуються відносними значеннями електронегативності (ВЕН), причому електронегативність атома Літію взято за одиницю. Значення ВЕН для різних елементів наведено в таблиці 9.
Табл. 9 Відносна електронегативність атомів
| I | II | III | IV | V | VI | VII | VIII | ||
| H 2,1 | |||||||||
| Li 1,0 | Be 1,5 | B 2,0 | C 2,5 | N 3,0 | O 3,5 | F 4,0 | |||
| Na 0,9 | Mg 1,2 | Al 1,5 | Si 1,8 | P 2,1 | S 2,5 | Cl 3,0 | |||
| K 0,8 | Ca 1,0 | Sc 1,3 | Ti 1,3 | V 1,6 | Cr 1,6 | Mn 1,6 | Fe 1,6 | Co 1,7 | Ni 1,8 |
| Cu 1,9 | Zn 1,6 | Ga 1,6 | Ge 2,0 | As 2,0 | Se 2,4 | Br 2,8 | |||
| Rb 0,8 | Sr 1,0 | Y 1,3 | Zr 1,4 | Nb 1,6 | Mo 1,8 | Tc 1,9 | Ru 2,0 | Rh 2,1 | Pd 2,1 |
| Ag 1,9 | Cd 1,7 | In 1,7 | Sn 1,8 | Sb 1,8 | Te 2,1 | I 2,6 | |||
| Cs 0,75 | Ba 0,9 | La 1,2 | Hf 1,3 | Ta 1,5 | W 1,7 | Re 1,9 | Os 2,1 | Ir 2,1 | Pt 2,1 |
| Au 2,4 | Hg 1,8 | Tl 1,8 | Pb 1,8 | Bi 1,9 | Po 2,0 | At 2,2 | |||
| Fr 0,7 | Ra 0,9 | ||||||||
Чим більші значення ЕН, тим яскравіше виражені неметалічні властивості. У періодах ЕН зростає зліва направо; у головних підгрупах ЕН збільшується знизу вгору, так як це показано на рис. 5:

Рис. 5. Зміна ВЕН у періодах і у групах.
2. ХІМІЧНИЙ ЗВ’ЯЗОК
Програмні питання
Природа хімічного зв’язку. Енергія та довжина зв’язку. Електронегативність. Типи хімічних зв’язків. Ковалентний зв’язок та його властивості: насиченість, напрямленість, полярність, поляризованість. Ефективний заряд атомів. Механізми утворення ковалентного зв’язку. Способи перекривання атомних орбіталей атомів: σ- та π- зв’язки. Кратний зв’язок. Валентність елементів у стаціонарному та збудженому станах. Гібридизація атомних орбіталей.
Просторова структура молекул. Валентні кути. Типи ковалентних молекул: полярні та неполярні молекули. Електричні моменти диполів молекул.
Міжмолекулярна взаємодія: орієнтаційна, індукційна, дисперсійна. Гідрогенний зв’язок. Енергія міжмолекулярної взаємодії.
Типи кристалічних ґраток. Поняття про металічний зв’язок. Залежність фізичних властивостей речовини в кристалічному стані від характеру зв’язку між частинками, які розташовані у вузлах кристалічної ґратки.
Вчення про хімічний зв’язок займає центральне місце у сучасній хімії, оскільки дозволяє зрозуміти механізм утворення хімічних сполук, їх склад та реакційну здатність. Термін “хімічний зв’язок” включає усі види ти типи сил взаємодії, що зумовлюють існування молекул, іонних, металічних чи атомних кристалів.
Природа хімічного зв’язку за сучасним уявленням – єдина: дія сили електростатичної взаємодії ядер та електронів доповнюється квантово-механічною взаємодією валентних електронів реагуючих атомів.
Утворення хімічного зв’язку супроводжується такими явищами:
- зниження енергії багатоатомної системи порівняно з енергією ізольованих атомів;
- атоми сумісно використовують свої валентні електрони;
- суттєво перерозподіляється електронна густина у області хімічного зв’язку порівняно з простим накладанням електронної густини атомів, що зблизилися на відстань зв’язку.
Іонний зв’язок
Іонний тип зв’язку здійснюється за рахунок утворення та електростатичної взаємодії позитивних та негативних іонів. Іони утворюються за умови взаємодії двох атомів, що мають значну різницю ЕН (ΔЕН>1,9), тоді спільна електронна пара може майже цілком зміститися до більш електронегативного атома. Тому іонний зв’язок розглядають як граничний випадок поляризації ковалентного зв’язку.
Основною особливістю іонів є їх структура: всі іони мають форму шару (на відміну від атомів, орбіталі яких можуть мати різну конфігурацію). Взаємодія іонів протилежних знаків описують дією класичних сил електростатичної взаємодії. Оскільки іони розглядають як заряджені кулі, які не деформуються, то кожний іон може притягнути іони протилежного знаку у будь-якому напрямку – це обумовлює таку властивість зв’язку як ненапрямленість.
Іншою властивістю іонного зв’язку є його ненасиченість. В іонних асоціатах не існує окремих молекул. Кожний іон одночасно взаємодіє з позитивними та негативними іонами, які знаходяться на різних відстанях від нього. Іони знаходяться у вузлах кристалічної ґратки, утворюючи асоціативну структуру.
Структуру іонного кристалу визначає співвідношення геометричних розмірів іонів. Вони упаковуються найщільнішим способом: позитивні іони оточують негативні та навпаки – досягається стан з найбільшою енергією електростатичного притягання. Іонні структури утворюються взаємодією атомів типових металів з атомами типових неметалів. Наприклад, утворення іонного зв’язку в кристалі NaCl пояснюється утворенням спільної пари електронів під час перекривання атомних орбіталей атомів Натрію та Хлору з наступним переміщенням цієї пари до більш електронегативного атома Хлору. Ефективні заряди на атомах становлять Na+0,87, Cl-0,87. Тобто повного переміщення спільної пари зв’язку до атома Хлору не відбувається, проте атоми вже розглядають як іони з цілочисловими зарядами Na+1 Cl-1. Фактично, атом лужного металу натрію звільнює свій зовнішній електронний шар і набуває стійкої конфігурації, такої як у атомах найближчого до нього в періодичній системі інертного газу – неону. Кажуть, що іон Na+ має ізоелектронну структуру з атомом Ne.
11Na [10Ne] 3s1 Na+1 {1s22s22p6}
конфігурація атома Натрію конфігурація іону натрію
Атом галогену Хлору доповнює свій зовнішній шар до восьми електронів за рахунок переміщення до нього спільної пари зв’язку та набуває конфігурації негативного іону Cl–, яка є такою самою, як у атомів інертного газу аргону (Ar).
17Cl [10Ne] 3s23p5 Cl-1 [Ne10] {3s23p6}
конфігурація атома Хлору конфігурація іону Cl-
Хімічна формула хлориду натрію, що знаходиться у кристалічному стані, має записуватись як {Na+Cl-}х, де х – число, що визначає кількість усіх іонів залежно від розміру кристала.
Формула структурних ланок іонних асоціатів відображає лише співвідношення числа іонів у кристалах.
Наприклад, у K2S: співвідношення іонів калію до іонів S-2 становить 2:1; формула кристала (K2S)x.
Металічний зв’язок
Метали відзначаються специфічними механічними властивостями (пластичність, ковкість) та здатністю проводити електрику і тепло. Ці властивості – результат особливої природи металічного зв’язку. Відмінна властивість металів: число валентних електронів завжди менше числа валентних орбіталей; атоми у кристалі розташовуються дуже щільно: кожний атом має по 6, 8 або 12 атомів-партнерів у найближчому оточенні, розміщених певним упорядкованим способом у тривимірному просторі.
Неможливо використати підхід методу валентних зв’язків і пояснити металічний зв’язок утворенням локалізованих електронних пар між атомами-партнерами.
Сучасні уявлення про металічний зв’язок сформувалися на основі зонної теорії, яка детально розглядається квантовою механікою. Ми будемо брати до уваги загальні висновки з цієї теорії, що конкретно пояснюють виникнення металічних кристалів:
- кристал розглядають як одну гігантську молекулу;
- атоми в кристалах металів розташовуються близько один від одного: це означає, що спостерігається значне перекривання зовнішніх орбіталей усіх атомів, що утворюють кристал; формується енергетична зона доступна для розміщення валентних електронів; зона лише частково заповнена електронами;
- делокалізовані електрони, що здійснюють зв’язок вільно переміщуються по всьому кристалу, а каркас кристалічної ґратки фактично утворюється позитивно зарядженими іони металів;
- міцність металів та їх висока густина пояснюється інтенсивністю сил притягання атомів завдяки делокалізованій взаємодії; електрона густина рівномірно розміщена по всьому кристалу;
- висока тепло- та електропровідність металів забезпечується рухомістю делокалізованих електронів по вільних енергетичних станах зони.
Міжмолекулярна взаємодія
Ван-дер-ваальсові зв’язки
До проблем теорії хімічного зв’язку традиційно відносять такі, що пов’язані з взаємодією молекул, які розташовані на близьких відстанях. Саме завдяки такій взаємодії можна пояснити існування в рідкому чи кристалічному стані речовин з молекулярною структурою та конденсацію газів за певних умов.
Існування сил міжмолекулярної взаємодії вперше взяв до уваги нідерландський вчений Ван дер Ваальс. Ці сили виникають внаслідок електростатичного притягання різнойменно заряджених ділянок сусідніх молекул та здійснюють фізичну взаємодію у речовинах. Дія цих сил не спричиняє перерозподіл валентних електронів, тобто не порушує структуру хімічних зв’язків, тому ці сили називають невалентною взаємодією. Вони виявляються на відстанях, що значно перевищують радіус дії сил хімічного зв’язку (для сил міжмолекулярної взаємодії – рівноважна відстань між молекулами 4…7 Å; довжина хімічного зв’язку 1,2…2Å).
Порівняно з хімічним зв’язком міжмолекулярна взаємодія дуже слабка. Наприклад, енергія атомізації молекул хлору Cl2 (енергія зв’язку Cl–Cl) становить 243 кДж/моль, тоді як енергія сублімації кристалів хлору, які складаються з молекул Cl2, майже в 10 разів менша (25 кДж/моль), хоча кожна молекула взаємодіє з кількома іншими молекулами хлору.
Залежно від полярності молекул їх взаємодію характеризують різною енергією, яку можна представити у вигляді суми трьох складових: орієнтаційної Еор, індукційної Еінд та дисперсійної Едисп.
Орієнтаційна взаємодія (диполь-диполь) здійснюється між полярними молекулами. Полярні молекули орієнтуються одна відносно іншої так, що притягуються протилежно зарядженими полюсами диполів (рис. 13а).
Індукційна взаємодія (диполь-наведений диполь) здійснюється між полярними та неполярними молекулами. Під дією електричного поля полярної молекули неполярна молекула змінюється на полярну та набуває електричного дипольного моменту, що має назву індукційного. Індукційний диполь притягується до відповідного полюсу диполя полярної молекули (рис. 13б).
Крім того, завжди незалежно від полярності молекул здійснюється дисперсійна взаємодія молекул, пояснення природи якої запропонував
Ф. Лондон (1930 р.).
Дисперсійна взаємодія пов’язана з довільним виникненням миттєвих диполів. Внаслідок хаотичного руху електронів та коливання ядер атомів порушується симетрія розподілу заряду молекули, що приводить до самовільної пульсації (флуктуації) електронної густини (рис. 13в). Миттєвий диполь однієї молекули викликає відповідний наведений диполь у сусідній молекулі. Надалі реалізується синхронна поява диполів у межах усієї системи, здійснюється притягання миттєвих диполів. Через деякий час одні миттєві диполі зникають і одразу утворюються нові.
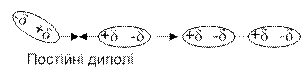
а)

б)
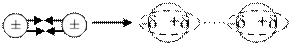
в)
Рис. 13. Схематичне зображення орієнтаційної (а), індукційної (б) та дисперсійної (в) взаємодії між молекулами.
Завдяки дисперсійній взаємодії стає можливим перехід речовин, що складаються з неполярних молекул (водень, азот, кисень, метан) та атомів (благородні гази) у рідкий стан. Дисперсійні сили притягання між неполярними молекулами чи атомами благородних газів легко порушуються тепловим рухом частинок, тому такі речовини мають низькі температури скраплювання (конденсації) та кристалізації. Під час міжмолекулярної взаємодії за участю полярних молекул частка орієнтаційної та індукційної взаємодії між ними збільшується, що суттєво позначається на температурах кипіння речовин (таблиця 10).
Таблиця 11. Характеристика сил.
| Молекула | Електричний дипольний момент μ·1029, Кл·м | Еор | Еінд | Едисп | ∑Е | Ткип, К |
| H2 | 0 | 0 | 0 | 1,7 | 1,7 | 20 |
| CH4 | 0 | 0 | 0 | 17,6 | 17,6 | 112 |
| CO | 0,12 | 0,4 | 0,8 | 8,8 | 10,0 | 81 |
| HCl | 1,03 | 2,8 | 0,8 | 15,8 | 19,4 | 188 |
| NH3 | 1,46 | 12,6 | 1,5 | 14,0 | 28,1 | 239,6 |
| H2O | 1,84 | 36,3 | 1,9 | 8,8 | 47,0 | 373,1 |
Гідрогенний зв’язок
Гідрогенний зв’язок – особливий тип взаємодії між молекулами. Це трицентрова взаємодія за участю двох електронегативних атомів X та Y та атома Гідрогену, який ковалентним зв’язком з’єднаний з одним із цих атомів.
Найчастіше участь в утворенні гідрогенного зв’язку беруть такі електронегативні атоми як F, О, N, рідше – Cl, Br, S.
Атом Гідрогену, що зв’язаний з сильно електронегативним атомом Х набуває значного позитивного ефективного заряду: внаслідок поляризації зв’язку  . Якщо поряд із молекулою НХ знаходиться інша полярна молекула, у якій центр негативного ефективного заряду зосереджений на електронегативному атомі Y, в електронній оболонці якого є одна чи декілька НЕП, то відразу здійснюється орієнтаційна взаємодія двох молекул.
. Якщо поряд із молекулою НХ знаходиться інша полярна молекула, у якій центр негативного ефективного заряду зосереджений на електронегативному атомі Y, в електронній оболонці якого є одна чи декілька НЕП, то відразу здійснюється орієнтаційна взаємодія двох молекул.
Стан позитивного поляризованого атома Гідрогену наближається до стану протону Н+, який має унікальні властивості. Протон не має електронної оболонки (спільна пара зв’язку Н-Х майже цілком зміщена до атому Х), внаслідок чого зазнає притягання до інших атомів. До того ж іон Н+ має дуже малий розмір (у тисячі разів менший зі інші іони), а тому може проникати до електронних оболонок електронегативного атому Y в іншій молекулі, наближуючись на відстань до 2Å, тобто на відстань близьку до довжин хімічного зв’язку. У цей момент протон виявляє властивості акцептора і розміщує НЕП електронегативного атома Y (донора) на своїй вільній атомній орбіталі.
Спрощено схему гідрогенного зв’язку наводять так:

 Xδ-―Hδ+·····Yδ- ―
Xδ-―Hδ+·····Yδ- ―
Атом Гідрогену, що бере участь у створенні гідрогенного зв’язку, завжди розташовується на лінії, що проходить через ядра атомів Х та Y, тобто кут Х―Н·····Y дорівнює 180°. Отже, за властивістю напрямленості гідрогенний зв’язок схожий на ковалентний.
За енергією гідрогенний зв’язок є проміжним між Ван-дер-ваальсовими та хімічними силами валентної взаємодії (порівняйте енергію гідрогенного зв’язку у структурі рідкої води 25,5 кДж/моль з енергією хімічного зв’язку Н–О у молекулі води 464 кДж/моль та енергією звичайної міжмолекулярної взаємодії 0,5-15 кДж/моль). Значна енергія гідрогенного зв’язку надає речовинам аномальних фізичних властивостей. Найчіткіше це виявляється для води, кожна молекула якої має атом Оксигену, що є донором двох НЕП, у той самий час молекула вона містить два протони-акцептори електронів.
Молекула води може утворювати по чотири гідрогенні зв’язки у формі тетраедра з іншими сусідніми молекулами (рис. 14).

Рис. 14. Схема утворення гідрогенного зв’язку.
Така структура реалізується у кристалах льоду і характеризується наявністю чисельних порожнин. Тому густина льоду є меншою зі густину рідкої води, для якої до 15% молекул залишають вузлові положення кристалів та заповнюють порожнини.
Асоційована структура рідкої води з розвиненою мережею гідрогенних зв’язків зумовлює унікальні фізичні властивості цієї рідини: високу теплоємність, питому теплоту випаровування і температуру кипіння.
2.8. Особливості кристалічного стану речовини.
Залежність властивостей кристалічних структур від природи частинок, що їх утворюють
За звичайних умов речовини можуть знаходитись у газоподі6ному, рідкому чи твердому фазовому стані. Проте, переважна більшість природних та штучних речовин, що застосовуються в техніці (близько 90%) мають кристалічний стан.
Кристали – тверді тіла, що мають закономірне періодичне розташування частинок у тривимірному просторі. Саме внаслідок впорядкованої внутрішньої будови кристали мають правильну форму. У кристалах речовин кути між відповідними гранями (поверхневими шарами атомів) завжди сталі.
Регулярне розташування частинок у кристалі дозволяє встановити між ними максимальну кількість зв’язків, що сприяє зниженню запасу внутрішньої енергії у речовині.
Для кристалів характерною є анізотропія, тобто неоднаковість їх властивостей за різними напрямами. Інакше кажучи, властивості кристала (міцність, світлопоглинання, теплопровідність, електрична провідність, швидкість розчинення та ін.) залежать від його орієнтації відносно заподіяного впливу.
Властивості кристалічних речовин можна пояснити особливістю їх внутрішньої будови. Внутрішню будову кристалів характеризує кристалічна ґратка – просторовий каркас, утворений пересічними лініями, в точках перетину яких знаходяться частинки (вузли ґратки). Кристалічну ґратку можна утворити різними за природою частинками. Залежно від типу частинок, що утворюють кристал, та характеру їх зв’язків кристалічні ґратки розділяють на молекулярні, атомні, іонні та металічні.
1)

| 2)

|
3)

| 4)

|
Рис. 15. Типи кристалічних ґраток за природою частинок, що утворюють кристал, тобто розміщені у вузлах ґраток: 1) мол екулярна; 2) атомна; 3) йонна; 4) металічна.
Основні відомості про характер взаємодії структурних одиниць кристалічних ґраток і типові фізичні та фізико-хімічні властивості речовин наведені у табл. 12.
Таблиця 12. Типи кристалічних ґраток
| Характеристика | Типи ґраток | |||
| Молекулярна | Атомна | Іонна | Металічна | |
| 1. Частинки, які розміщуються у вузлах ґратки | Молекули | Атоми | Протилежно заряджені іони | Позитивно заряджені іони металів |
| 2. Тип взаємодії між структурними елементами | Ван-дер-ваальсові сили міжмолекулярної взаємодії, гідрогенний зв’язок | Ковалентний неполярний чи малополярний зв’язки | Іонний зв’язок | Металічний зв’язок |
| 3. Енергія зв’язку, кДж/моль | 5…20 20…100 (для гідрогенних зв’язків) | 200…1000 | 200…400 | 100…800 |
| 4. Твердість | Низька | Висока | Висока | Різна |
| 5. Розчинність | Неполярні: розчинні у неполярних розчинниках; Полярні: розчинні у полярних розчинниках | Не розчинні ні у яких розчинниках | Розчинні у воді, полярних органічних розчинниках з високою діелектричною проникністю | У органічних розчинниках не розчиняються, лужні метали взаємодіють з водою |
| 6. Електрична провідність | Не проводять електричний струм | Не проводять електричний струм | У твердому стані не проводять струм, в розплаві чи у розчині проводять електричний струм | Добра |
| 7. Специфічні властивості | Леткість, крихкість | Прозорість, стійкість до хімічної обробки | Крихкість, малолеткість | Ковкість, тягучість, непрозорість, добре відбивають світло |
| 8. Приклади | І2, лід, нафталін, фенол, СО2 (сухий лід), глюкоза | (С) - алмаз, Si, SiO2, карбіди: SiC, B4C, нітриди: BN, AlN, Si3N4 | Солі металів, оксиди лужних чи лужноземельних металів | Метали та сплави на їх основі |
ЛІТЕРАТУРА
1. Степаненко О.М., Рейтер Л.Г., Ледовских В.М., Іванов С.В. Загальна та неорганічна хімія. Частина І. – К.: Педагогічна преса, 2002. – 520 с., ISBN 966-7320-13-8.
2. Рейтер Л.Г., Степаненко О.М., Басов В.П. Теоретичні розділи загальної хімії. – К: Каравела, 2003. – 356 с., ISBN 966-8019-08-3.
3. Коровин Н.В. Общая химия: Учеб. для технич. направл. и спец. вузов – М.: Высшая школа, 2000. – 558 с., ISBN 5-06-003939-0.
4. Романова Н.В. Загальна та неорганічна хімія. – К.: Перун, 1998. – 480 с., ISBN 966-569-106-6.
5. Кириченко В.І. Загальна хімія. – К.: Вища школа, 2005. – 639 с., ISBN 966-642-182-8.
МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ
Національний технічний університет України
«Київський політехнічний інститут»
ЗАГАЛЬНА ХІМІЯ
«БУДОВА РЕЧОВИНИ»
НАВЧАЛЬНИЙ ПОСІБНИК
ДЛЯ СТУДЕНТІВ ТЕХНІЧНИХ НАПРЯМІВ ПІДГОТОВКИ
Київ
НТУУ «КПІ»
2010
Последнее изменение этой страницы: 2019-04-10; Просмотров: 220; Нарушение авторского права страницы