Положення хімічного елемента у періодичній системі та його хімічні властивості визначаються будовою атомів елемента.
Таблиця 8. План характеристики елемента за електронною формулою
| План характеристики елементів
|
| Елемент № 34
| Елемент № 40
|
| 1. Наводимо електронну формулу атомів елементів
|
| 34Е 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p4
| 40Е 1s22s2 2p6 3s2 3p6 4s2 3d104p6 5s2 4d2
|
| 2. Визначаємо номер періоду: число енергетичних рівнів, що заповнені електронами
|
| Період 4
| Період 5
|
| 3. Електронна родина елементів
|
| Останній електрон заповнює р-АО, тому елемент № 34 належить до р-електронної родини
| Останній електрон заповнює d-АО, тому елемент № 40 належить до d-електронної родини
|
| 4. Визначаємо підгрупи, в яких знаходяться елементи
|
| Головна підгрупа, тому що елемент належить до р-родини
| Побічна підгрупа, тому що елемент належить до d-родини
|
| 5. Номер групи
|
| 34Е… 4s2 4p4
Елемент розташований в VI групі: номер групи визначається числом валентних електронів
| 40Е … 5s2 4d2
Елемент розташований в ІV групі
|
| 6. Хімічний характер елементів
|
| Елемент №34 виявляє неметалічні властивості: на зовнішньому енергетичному рівні він містить 6 електронів
| Елемент №40 виявляє металічні властивості, оскільки на зовнішньому енергетичному рівні (5s) знаходяться лише 2 електрони
|
| 7. Хвильові функції  , які описують орбіталі з валентними електронами , які описують орбіталі з валентними електронами
|

| 
|
| 8. Валентність в основному стані
|
| Z=ІІ, тому що на зовнішньому енергетичному рівні містяться два неспарені електрони
| Z=0, оскільки на п’ятому зовнішньому енергетичному рівні немає неспарених електронів
|
| 9. Валентність у збудженому стані
|
| 34 Е* 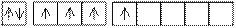
4s 4p 4d
Z*=4
34 Е** 
Z** = 6
| 40 Е*  5s 4d 5p
Z* = 4
5s 4d 5p
Z* = 4
|
| 10. Найвищий ступінь окиснення
Найвищий ступінь окиснення (С.О.) - це заряд, якого набуває атом при видаленні у нього максимально можливого числа валентних електронів.
|
| 34 Е0 - 6е = 34 Е+6
...4s24p4 …4s04p0
| 40 Е0 - 4е = 40 Е+4
...5s24d2 …5s04d0
|
| Найвищий ступінь окиснення елемент виявляє у сполуках з Флуором і з Оксигеном. Наводимо формули сполук елементів з Флуором:
|
|   
|   
|
| 11. Нижчий ступінь окиснення
|
| Нижчий с.о. неметалів - це той заряд, якого набуває атом при приєднанні необхідної кількості електронів для повної забудови зовнішнього енергетичного рівня.
34 Е0 + 2е = 34 Е - 2
4s24p4 …4s24p6
Нижчий с.о. неметали виявляють у сполуках з гідрогеном і металами:
  ; ; 
| Метали мають нижчий с.о., що дорівнює нулю: 40 Е0
|
| 12. Формули вищих оксидів елементів та гідроксидів, що їм відповідають, їх хімічний характер
У цих сполуках елемент виявляє вищий ступінь окиснення:
|
|  
Оксиди неметалів виявляють кислотний характер. Гідрат кислотного оксиду - кислота:
ЕО3 × Н2О = Н2ЕО4
|  Оксиди металів з валентністю ІІІ, IV виявляють амфотерний характер. Гідрат амфотерного оксиду - амфотерний гідроксид:
ЕО2 × Н2О = Е(ОН)4 º Н4ЕО4
у вигляді у вигляді
основи кислоти
або ще один можливий варіант:
ЕО2 × Н2О = Н2ЕО3
у вигляді кислоти
Оксиди металів з валентністю ІІІ, IV виявляють амфотерний характер. Гідрат амфотерного оксиду - амфотерний гідроксид:
ЕО2 × Н2О = Е(ОН)4 º Н4ЕО4
у вигляді у вигляді
основи кислоти
або ще один можливий варіант:
ЕО2 × Н2О = Н2ЕО3
у вигляді кислоти
|
| 13. Наводимо закінчення електронних формул
|

