
|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |

|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |
ПРАКТИКУМ ПО ПОЧВОВЕДЕНИЮСтр 1 из 23Следующая ⇒
ПРАКТИКУМ ПО ПОЧВОВЕДЕНИЮ С ОСНОВАМИ РАСТЕНИЕВОДСТВА
Учебное пособие
Рекомендовано Сибирским региональным учебно-методическим центром высшего профессионального образования для межвузовского использования в качестве учебного пособия для студентов биологических специальностей
УДК 633.47:633 (075.8) ББК ПОЗя73+П25я73 З – 37
Печатается по решению редакционно-издательского совета ФГБОУ ВПО «Кемеровский государственный университет»
Рецензенты: доктор с/хоз. наук, проф., зав. кафедрой В. М. Самаров, канд. с/хоз. наук, доцент Н. Н. Чуманова, доктор биол. наук И. В. Грехова
Заушинцена, А. В. З – 37 Практикум по почвоведению с основами растениеводства: учебное пособие для вузов / А. В. Заушинцена, С. В. Свиркова. – Кемерово: Кузбасс-вузиздат, 2012. – 114 с.
ISBN 978-5-8353-0620-6
Учебное пособие разработано по курсу «Почвоведение с основами растениеводства» для специальности «Биология» в соответствии с требованиями ФГОС ВПО и содержит подробное описание физико-химических и химических методов изучения почв и методов определения полевых культур по морфологическим особенностям плодов, семян и по всходам.
ISBN 978-5-8353-0620-6 ББК ПОЗя73+П25я73
© А. В. Заушинцена, С. В. Свиркова, 2012
СОДЕРЖАНИЕ
ПРЕДИСЛОВИЕ………………………………………….......…..……5 РАЗДЕЛ 1. ЛАБОРАТОРНЫЕ МЕТОДЫ ИССЛЕДОВАНИЯ ХИМИЧЕСКИХ СВОЙСТВ ПОЧВ…….............7 Тема 1. Отбор почвенной пробы и подготовка ее к анализу……….……......…………………..7 ТЕМА 2. ОРГАНИЧЕСКОЕ ВЕЩЕСТВО ПОЧВЫ И ПОЧВЕННЫЙ ГУМУС…………………………….………......……….12 Работа 1. Количественное определение почвенного гумуса по методу И. В. Тюрина….....…………….………………………......…...15 Работа 2. Качественное определение и изучение свойств гумусовых веществ…………………………………………….......………18 СПИСОК ИСПОЛЬЗУЕМОЙ И РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРЫ…………………………………………………….........101 ПРИЛОЖЕНИЕ………………………………………………………....102 ПРЕДИСЛОВИЕ
Настоящий практикум составлен в соответствии с утвержденной программой курса «Почвоведение с основами растениеводства», который предусмотрен учебным планом подготовки студентов биологического факультета классических университетов. В практикум включено два раздела: 1. Лабораторные методы исследования физико-химических и химических свойств почв. 2. Растениеводство. Они представлены описанием несложных лабораторных методов исследования почвенных образцов по содержанию органического вещества в разных типах почв, определению 4-х видов поглотительной способности, суммы обменных оснований, емкости поглощения, кислотности и засоленности, что позволит научить студентов рассчитывать потребность почв в известковании и гипсовании. По первому разделу представлено описание методик по 6 темам, включающим 19 лабораторных занятий продолжительностью по 2 часа каждое. В разделе «Растениеводство» представлены методики определения семян полевых культур по морфологическим признакам с использованием вспомогательных таблиц, а также методы их определения по всходам, групп подсолнечника, масличности в семенах. Изучение материала рассчитано на 8 лабораторных занятий по четырем темам. Это позволит усвоить основные отличия между культурными видами растений полевых культур и даст возможность распознавать их в агроценозах. Для проведения лабораторных занятий рекомендуется иметь набор коллекций семян в пробирках или в контейнерах разной формы, а также смесь семян разных видов растений для контроля знаний. На двух студентов достаточно иметь один набор коллекций и одну смесь семян. После каждой темы включены контрольные вопросы, которые помогут студентам освоить и закрепить практические знания. Обязательность или факультативность лабораторных работ определяет преподаватель, исходя из имеющегося технического оборудования, наличия химических реактивов, коллекции почвенных образцов, соответствующих разным по уровню плодородия и генезису типам почв, и семян культурных видов растений. В приложении 1 приведены требования к помещению лаборатории, в которой будут проводиться занятия, и техника безопасности работы с химическими реактивами. В приложении 2 даны требования к подбору химической посуды для исследований и правила пользования. В приложении 3 описаны правила приготовления растворов щелочей и кислот. В приложениях 4 и 5 прописаны общие правила работы с весами. В приложении 6 описаны правила фильтрования растворов, а в приложении 7 – приготовление растворов, реактивов, красителей и индикаторов. Ход работы Отбор почвенного образца в поле. Для детального почвенного обследования образцы почвы следует брать из каждого почвенного горизонта. Для этого необходимо подготовить почвенный разрез. Для химических анализов и определения гранулометрического состава почвы можно отобрать образец из пахотного слоя с нарушенной структурой. Достаточно в пяти точках поля или реперного участка по схеме «конверта» взять разовые пробы, которые затем объединить и смешать. Для определения некоторых физических свойств (удельная и объемная масса почвы в ненарушенном сложении, твердость и т. д.) используют образец с ненарушенной структурой. Для этого разовые пробы рекомендуется отбирать с помощью бура Некрасова из слоев почвы разной глубины: 0-10, 10-20, 20-30, 90-100 см. Бур Некрасова представляет собой металлический цилиндр, открытый с двух сторон, в который вставляют специальные стаканы. На верхнюю часть цилиндра навинчивают штангу с рукояткой. На штанге имеются метки, по которым определяют глубину отбора образца. После объединения разовых проб (если требуется) получают общую пробу всего почвенного материала. Масса почвенного образца должна быть от 1,0 до 2,5 кг. Почвенный образец помещают в плотный матерчатый мешочек, в плотный бумажный или пластиковый пакет. К каждому образцу прикладывают этикетку, на которой указывают номер поля или реперного участка, видовой состав биоценоза, место отбора образца, глубину почвенного горизонта, дату отбора, фамилию автора отбора проб. Подсушивание почвы. Проведение большинства анализов почвы (за исключением определения содержания нитратов в почве) требует предварительного подсушивания. Для этого образцы почвы раскладывают тонким слоем на листе бумаги, слегка разминают комки. Исключают из образца корни, гальку, раковины и видимые глазу органические остатки. В таком состоянии почву оставляют на несколько дней для подсушивания до воздушно-сухого состояния. Отбор средней пробы. Для отбора средней пробы исходный образец, взятый в поле, надо высыпать на лист чистой бумаги и высушить до воздушно-сухого состояния. Крупные комки почвы раздавить руками или раздробить пестиком в фарфоровой ступке до комков диаметром не более 5 мм. Тщательно отобрать имеющиеся в образце включения. Почву очень тщательно перемешать и придать ей форму квадрата или круга с толщиной слоя не более 1 см (рис. 1). Разделить образец на четыре равные части. Две противоположные части (квадранты) оставить в запасе и ссыпать обратно в тару, а две другие соединить вместе. Это и будет средняя проба. Если она велика, то ее таким же способом уменьшить в 2 раза. Оптимальная масса средней пробы составляет 300-500 г.
Рис. 1. Квартование пробы
Отбор лабораторной пробы. Ее следует отбирать из первоначальной пробы, которая представлена разовой или средней пробой. Если материал первоначальной пробы сравнительно однороден, то перед отбором лабораторной пробы можно ограничиться его пере- мешиванием. При меньшей однородности материала почву сначала надо измельчить, а затем уже перемешать.
Снимать крышку нужно спустя 1–2 минуты после просеивания, когда пыль полностью осядет. Почву, просеянную через сито с
Отбор аналитической пробы. Из лабораторной пробы берут аналитические пробы. Для этого всю измельченную лабораторную пробу тщательно перемешать. Высыпать на лист бумаги и разровнять слоем толщиной не более 1 см в виде квадрата или круга. Затем методом квартования отобрать почву для исследования. Если отобрано недостаточное количество почвы, оставшуюся лабораторную пробу снова перемешать и операцию отбора аналитической пробы повторить. Можно упростить процедуру. Если анализируют почву, просеянную через сито с отверстиями 1 мм, то навеску можно брать непосредственно из банки или пакета, предварительно хорошо перемешав почву. Мероприятия по отбору и подготовке почвы для анализа необходимо выбирать, руководствуясь целью и задачами исследования. Большинство анализов проводят с образцами почвы в воздушно-сухом состоянии, измельченными в фарфоровой ступке и просеянными через почвенное сито с диаметром отверстий 1 мм. Для некоторых видов анализов нужны образцы почвы, только что взятые в поле без предварительного подсушивания, например для определения нитратов. Также могут использоваться образцы сухой почвы без предварительного измельчения, например для определения структуры. Отбор торфяной пробы. Отобрать среднюю пробу торфа массой 2–3 кг. Разложить на клеенке, линолеуме или бумаге и довести до воздушно-сухого состояния. Во время подсушивания измельчить руками, молотком или фарфоровым пестиком так, чтобы кусочки были диаметром не более 1 см. Затем отобрать лабораторную пробу массой 200–500 г и измельчить её в фарфоровой ступке или на лабораторной мельнице, после чего просеять через сито с диаметром отверстий 2–3 мм. Не прошедшие через сито частицы снова размолоть. Подготовленную лабораторную пробу хранить так же, как почву. Приготовление почвенных вытяжек. В зависимости от цели работы приготавливают водную, солевую щелочную, кислотную вытяжки почв. Если в методике не указаны масса почвы и объем используемой вытяжки, то ее готовят в следующем соотношении: к одной части почвы рекомендуется добавить пятикратный объем растворителя. Для этого навеску почвы пересыпать в соответствующую колбу и прилить воду, кислоту или раствор соли. Затем надо закрыть колбу пробкой и взбалтывать в течение 5–10 минут, если не указано конкретное время взбалтывания. Полученную почвенную вытяжку отфильтровать через одно- двухслойный бумажный фильтр с целью получения прозрачного фильтрата для его дальнейшего изучения. Задание: проведите отбор средней, лабораторной и аналитической пробы из почвенного образца. В исследуемом образце почвы определите, сколько граммов почвенного скелета приходится на 100 г мелкозема. Приготовьте водную вытяжку почвы. Контрольные вопросы 1. Что называется исходным образцом почвы? 2. Что такое разовая, общая и средняя пробы? 3. Что такое мелкозем? 4. Что такое почвенная вытяжка? 5. Перечислите этапы подготовки почвы к анализу. И ПОЧВЕННЫЙ ГУМУС
Органическое вещество почвы – это совокупность живой биомассы и органических остатков растений, животных, микроорганизмов, продуктов их метаболизма и специфических новообразованных органических веществ (гумуса). Потенциальными источниками органического вещества почвы являются все компоненты биоценоза и почвенной биоты, которые попадают после завершения жизненного цикла или гибели на поверхность почв и в толщу почвенного профиля и участвуют в процессе почвообразования. Основная масса органических остатков поступает в почву с наземным и корневым опадом высших растений. В географическом плане она может существенно отличаться по количеству на единицу площади. В холодных и жарких пустынях на 1 гектар ежегодно поступает приблизительно 1,0–1,2 т органических остатков. В зоне луговых степей этот показатель достигает 10,0–14,0 т/га, а во влажных субтропических и тропических лесах – 20,0–25,0 т/га и более. В состав органического вещества почвы входят: воски, смолы, жиры, целлюлоза, гемицеллюлоза, растворимые углеводороды, лигнин, зольные макро- и микроэлементы (Ca, Mg, K, P, S, Mo, B и др.). Органические вещества, поступившие в почву, подвергаются процессам разложения. Агентами их преобразования являются: кислород, углекислый газ, вода, тепло, почвенные животные и микроорганизмы. Под их воздействием часть органики быстро минерализуется, а другая часть, претерпевая ряд превращений, накапливается в почве в виде сложных специфических высокомолекулярных органических соединений – гумусовых веществ. Совокупность биохимических и физико-химических процессов, в результате которых органические вещества индивидуальной природы превращаются в специфические гумусовые вещества называется гумификацией. Гумус – это сложный комплекс органических соединений. В его состав входят две группы веществ: 1) неспецифические органические соединения индивидуальной природы (сахара, полифенолы, простые органические кислоты), встречающиеся кроме почвы и в других объектах (тканях растений, животных) и составляющие 10–15 % от общего содержания органического вещества; 2) специфические для почв комплексы органических соединений сложного строения – собственно гумусовые вещества. Они составляют 85– 90 % общего количества органического вещества в почве. Гумусовые вещества представляют собой системы высокомолекулярных азотсодержащих органических соединений циклического строения и кислотной природы. В состав собственно гумусовых веществ входят две основные группы: 1) группа темноокрашенных гуминовых кислот, в пределах которой выделены собственно гуминовые кислоты (серые), ульминовые кислоты (бурые) и растворимые в спирте гиматомилановые кислоты; 2) группа желтоокращенных фульвокислот. Иногда почвоведы выделяют третью группу – гумины. Это комплекс гуминовых и фульвокислот, прочно связанных с минеральной алюмосиликатной частью почвы. Гуминовые кислоты имеют темный цвет (от темно-бурого до темно-коричневого), растворяются в едких щелочах и водных растворах аммиака, осаждаются из щелочных растворов кислотами в виде аморфного хлопьевидного осадка. Фульвокислоты отличаются от гуминовых кислот более светлой окраской, более низким содержанием углерода, растворимостью в воде и в кислотах, обладают большой агрессивностью и являются активными агентами разрушения первичных и вторичных минералов. Органические вещества, вследствие кислотной природы и хелатирующих свойств, способствуют процессам внутрипочвенного выветривания и переходу элементов, входящих в состав кристаллических минералов, в более подвижные формы. Определенные группы и фракции гумусовых веществ являются хорошими структурообразователями почвы, что улучшает ее физико-механические, физические, водно-воздушные свойства. Органические вещества служат источником элементов питания, особенно азота, фосфора и серы, для почвенной микрофлоры, низших и высших видов растений, источником углекислоты в почвенном воздухе и приземных слоях атмосферы. Они стимулируют рост растений. По мощности гумусовых горизонтов почвы разделены на следующие виды: 1. Крайне мелкие (менее 10 см). 2. Мелкие (10–20 см). 3. Среднемелкие (20–30 см). 4. Маломощные (30–40 см). 5. Среднемощные (40–50 см). 6. Мощные (80–120 см). 7. Сверхмощные (более 120 см).
По содержанию гумуса в гумусовом горизонте почвы ранжированы на следующие виды: 1. Очень слабо гумуссированые (менее 0,5%). 2. Слабо гумуссированые (0,5–1,5%). 3. Мало гумуссированые (1,5–3,0%). 4. Средне гумуссированые (3,0–5,0%). 5. Сильно гумуссированые (5,0–8,0%). 6. Тучные (более 8,0%).
По содержанию гумуса в альфагумусовом горизонте почвы ранжированы на 3 вида: 1. Иллювиально-малогумусовые (менее 1 %). 2. Иллювиально-среднегумусовые (1–3 %). 3. Иллювиально-многогумусовые (более 3 %).
По методу И. В. Тюрина Для количественного определения почвенного гумуса применяется несколько методов. Простотой, точностью и быстротой отличается метод, предложенный академиком И. В. Тюриным. Его широко применяют при массовых анализах почвы. Метод позволяет определить суммарное содержание в почве новообразованных органических соединений и сильно измененных мельчайших растительных остатков. Определение гумуса по этому методу основано на окислении органического углерода хромовой кислотой до углекислоты (реакция 1). Цель работы: изучить и апробировать метод количественного определения почвенного гумуса и изучить содержание гумуса в разных типах почв. Материалы и оборудование: фарфоровая ступка с пестиком, весы, лопаточка или ложка для отбора почвенной пробы, две конические колбы объемом 100 мл, две небольшие воронки диаметром 2–4 см, электрическая плитка, железный штатив с зажимом для титрования, бюретка объемом 50 мл. Для приготовления рабочих растворов потребуется мерный цилиндр, три колбы объемом по 2 л, колба объемом 100 мл, фарфоровая чашка диаметром 10 см. Реактивы: кристаллический бихромат калия (K2Cr2O7) и 0,4н. раствор бихромата калия, концентрированная серная кислота (H2SO4), соль Мора и 0,2н. раствор соли Мора, фенилантропиловая кислота в порошке и 0,2 % раствор фенилантропиловой кислоты, сода. Приготовление растворов включает ряд последовательных действий (приложение 7). Объект исследования: образцы почвы минеральных и органических типов. Ход работы. Образец воздушно-сухой почвы растереть в ступке пестиком. Отобрать среднюю пробу, из которой взять навеску в 1 г. Навеску высыпать на белый лист бумаги и отобрать растительные остатки. Перенести в отдельный пакетик и взвесить. Из образца, очищенного от растительных остатков, взвесить 0,2 г почвы и перенести в коническую колбу объемом 100 мл. В эту колбу (опытная) прибавить из бюретки 15 мл хромовой смеси. Во вторую колбу объемом 100 мл, которая является контрольной, налить 15 мл хромовой смеси. Обе колбы поставить на электрическую плитку и кипятить 5 минут. Во избежание испарения небольшого количества жидкости каждую колбу накрыть маленькой воронкой носиком внутрь в качестве обратного холодильника. Охладить жидкости в эксикаторе. После того, как жидкости в колбах остынут, в них добавить дистиллированной воды до ¼ объема колбы, а затем прибавить 5 капель индикатора (0,2-процентный раствор фенилантропиловой кислоты). При помощи бюретки произвести титрование 0,2-нормальным раствором соли Мора. В процессе титрования окраска раствора в колбе постепенно начнет меняться до фиолетовой, синей, зеленой. Титрование заканчивают при появлении ясной зеленой окраски. Это свидетельствует о восстановлении индикатора (полная нейтрализация хромовой смеси). В первую очередь надо титровать чистую хромовую смесь (контрольная колба) для определения исходного количества хромовой смеси, взятой для опыта. Затем титруют раствор в колбе с анализируемой почвой (опытная колба), что позволит определить количество хромовой смеси, сохранившейся в песке после окисления органического углерода. Израсходованный объем раствора соли Мора, пошедший на титрования хромовокислого калия, записать в рабочую таблицу. При нагревании бихромат калия в серной кислоте в присутствии гумуса почвы происходит его окисление до СО2. Это доказывается уравнением реакции 1:
2K2Cr2O7 +8H2SO4 +3C(гумус)=2Cr2(SO4)3 + 2K2SO4 + 8H2O+3CO2.
При титровании солью Мора избытка бихромата калия проис- ходит реакция, которую можно представить уравнением 2:
K2Cr2O7 +7H2SO4+6FeSO4 = Cr2(SO4)3+K2SO4+2Fe2(SO4)3+7H2O.
Содержание гумуса определяется по формуле:
А – количество гумуса, %; V1 – количество раствора соли Мора, израсходованное на титрование хромовой смеси без почвы (контроль), мл; V2 – количество раствора соли Мора, израсходованное на титрование хромовой смеси с почвой (опытная колба), мл; N– нормальность раствора соли Мора (0,2); K – коэффициент перевода на гумус, равен 0,00517; m – навеска воздушно-сухой почвы, г.
Задание: определите количество гумуса (%) в почвенных образцах. Результаты исследований запишите в таблицу 1 и сделайте выводы.
Таблица 1 Содержание гумуса в почве
Растворе аммиака Ход работы. Приготовленный, как указано в первом опыте, мелкозём предложенных образцов почвы отмерить по одной мерке в отдельные колбы. Прилить в каждую колбу пятикратное количество водного раствора аммиака, взболтать 5 мин, профильтровать через бумажный фильтр. Определение способности к коагуляции провести, как описано в опыте 2. Задание: проведите осмотр фильтратов аммиачных вытяжек почв. Определите их окраску, прозрачность и способность к коагуляции. Результаты запишите в таблицу 6.
Таблица 6 Растворе аммиака
По результатам проведенных опытов сделайте вывод, как по окраске вытяжек, способности к коагуляции и растворимости можно определить присутствие в образце почвы гумусовых веществ. Контрольные вопросы 1. Что называется органическим веществом почвы? 2. Каким процессам подвергается органическое вещество почвы? 3. Что такое гумус? 4. Ранжируйте почвы по мощности гумусового горизонта и содержанию гумуса. 5. Какие вещества входят в состав гумуса? Охарактеризуйте их по строению и химическим свойствам. 6. Какие мероприятия способствуют сохранению и увеличению содержания гумуса в почве? 7. Определите роль гумуса в формировании плодородия и других свойств почвы. 8. Какие методы служат для количественного и качественного определения почвенного гумуса?
Определение основных типов Поглотительной способности Цель работы – сравнительно продемонстрировать механическую поглотительную способность почв, различающихся по гранулометрическому составу и структурности. Материалы и оборудование: штативы, воронки диаметром 5–8 мм, колбы объемом 100 мл, кусочки марли, почвенное сито с диаметром отверстий 2 мм. Реактивы: дистиллированная вода. Объект исследования: чернозем и образцы почв, различающихся по гранулометрическому составу (суглинок и крупнозернистый песок).
В проведенном опыте почва и песок выполняют роль фильтра. Фильтрат, полученный после прохождения через воронку, будет обладать различной прозрачностью в зависимости от того, какая почва лучше механически задерживает взмученные в почвенном растворе частицы. В почве поры меньше, чем в песке, поэтому фильтрат из-под воронки с почвой будет прозрачнее, чем из-под воронки с песком. В фильтрат попадают частицы почвы, которые мельче почвенных пор. Механическое поглощение почвы всецело зависит от гранулометрического состава почвы. Чем больше глинистых частиц, тем больше механическое поглощение. Задание: результаты опыта запишите в таблицу 7. Проанализируйте результат. Ранг 1 присвоить почве с максимальной механической поглотительной способностью, далее по убыванию к минимуму. Степень прозрачности фильтрата указать условными обозначениями: «–» – прозрачный, «+» – слабоокрашенный, «++» – сильноокрашенный. Сделайте вывод о влиянии гранулометрического состава и структурности почвы на механическое поглощение.
Таблица 7 Поглотительной способности Цель работы: провести расчет химической поглотительной способности. Материалы и оборудование: воронки, фарфоровые чашки, колбы объемом 500 мл, весы, водяная баня, эксикатор, фильтровальная бумага, встряхиватель. Реактивы: 5 % раствор К2НРО4 или Na2HPO4. Ход работы. В колбу объемом 500 мл насыпать 10 г почвы, прилить 100 мл 5 % раствора К2НРО4, взболтать в течение 30 минут на встряхивателе. По окончании взбалтывания смеси дать отстоятся. Отстоявшийся раствор профильтровать через бумажный фильтр, чтобы получился прозрачный фильтрат. Во взвешенную колбу объемом 100 мл или фарфоровую чашку налить 50 мл фильтрата и поставить на водяную баню для выпаривания. Когда вода из колбы (чашки) испарится, ее перенести в эксикатор для охлаждения. После охлаждения колбу (чашку) с осадком взвесить. По разнице массы колбы (чашки) до и после выпаривания определить массу минерального осадка. Для расчета химической поглотительной способности надо воспользоваться следующей схемой:
3CaCl2+2Na2HPO4=Ca3(PO4)2+2HCl+4NaCl.
Надо помнить: 1. Масса сухого остатка 100 мл 5 % раствора K2HPO4 равна 5 г. Значит, масса 50 мл 5 % раствора K2HPO4 будет равна 2,5 г. 2. Если почва после фильтрования 100 мл 5 % раствора не поглотит никаких химических элементов, то сухой остаток фильтрата должен быть равен 5 г. Если мы для эксперимента будем брать 50 мл фильтрата, то теоретически при этих условиях в нем должно быть 2,5 г сухого остатка. В связи с этим процент химической поглотительной способности почв можно рассчитать по следующей схеме: 1. Определить массу сухого остатка после выпаривания фильтрата на водяной бане по формуле:
a = a2 – a1 (г), где
a – масса сухого остатка, г; a1 – масса сухой чистой чашки, г; a2 – масса сухой чашки с сухим остатком, г.
2. Вычислить процент химической поглотительной способности по формуле:
Задание: определите массу минерального осадка и рассчитайте химическую поглотительную способность почвы. Результаты исследований запишите в таблицу 9. Ранжируйте типы почв по показателю химической поглотительной способности и сделайте выводы.
Таблица 9 Основаниями 1. Черноземный тип почвообразования. ППК насыщен двухзарядными катионами кальция (Ca2+) и магния (Mg2+). Этот тип почвообразования обладает устойчивостью поглощающего комплекса, высокой долей органических коллоидов и характерен для степных областей. 2. Солонцовый тип почвообразования. Кроме двухзарядных катионов кальция (Ca2+) и магния (Mg2+) в ППК содержится однозарядный натрий (Na+). Этот тип почвообразования представлен фазами солончаков, солонцов, солодей. В фазе солонцов и солодей коллоиды легко диспергируются, что приводит к неустойчивости поглощающего комплекса. Солонцовый тип почвообразования распространен локально в степных, пустынно-степных и пустынных областях и характерен для почв, которые формируются на засоленных породах или при воздействии минерализованных, содержащих Na2CO3, грунтовых вод.
Основаниями
3. Подзолистый тип почвообразования. В ППК содержатся водородный ион (H+), ион поглощающего алюминия (Al3+), а также остаточные катионы кальция (Ca2+) и магния (Mg+). Поглощающий комплекс неустойчив. В кислой среде идет разрушение и растворение минеральных и органических коллоидов, вымывание их из верхних генетических горизонтов почвенного профиля. Почвы подзолистого типа с ненасыщенным и неустойчивым поглощающим комплексом приурочены к влажным лесным и таежным ландшафтам. 4. Латеритный (ферсиаллитный и ферралитный) тип почвообразования. В составе ППК преобладают ионы водорода (H+) и ионы алюминия (Al3+). Поглощающий комплекс не устойчив, легко распадается с энергичным выносом продуктов распада (оснований и SiO2). Этот тип почвообразования характерен для влажных субтропических и тропических лесных ландшафтов. К. К. Гедройца Метод основан на вытеснении обменного натрия из почвы углекислым кальцием при добавлении к ней мела (СаСО3) и воды, насыщенной углекислотой. Цель работы: определить количество поглощенного натрия в почвенных образцах. Материалы и оборудование: фарфоровые чашки, толстостенная коническая колба объемом 2 л, колбы объемом 200–300 мл, почвенные сита с диаметром отверстий 1 мм, фильтры, стеклянные палочки с каучуковым наконечником, весы, водяная баня. Реактивы: углекислый газ в баллоне, мел (СаСО3), дистиллированная вода, лишенная СО2 кипячением, 0,02 н раствор H2SO4, 1 н раствор CH3COONH4. Объект исследования: образцы почв. Ход работы. Взвесить на весах 10 г воздушно-сухой почвы, просеянной через сито с отверстиями диаметром 1 мм. Почву поместить в толстостенную двухлитровую коническую колбу, прибавить 1 г мела и 1 л дистиллированной воды. Пропустить через колбу в течение 3 часов ток углекислого газа из баллона, тщательно взбалтывая смесь через каждые 15 минут. После этого раствор отфильтровать через складчатый фильтр. В прозрачном фильтрате определить содержание натрия объемным методом. Для этого: 1. Выпарить 100 мл фильтрата в небольшой фарфоровой чашке (или колбе объемом 200–300 мл) на водяной бане. 2. Для отделения углекислого натрия от солей кальция и магния к осадку в чашке прилить 3–5 мл горячей, хорошо прокипяченной дистиллированной воды (без СО2). Содержимое чашки быстро перемешать стеклянной палочкой с каучуковым наконечником и отфильтровать через беззольный фильтр. Операцию промывания и декантации повторить 8–10 раз. Фильтрат декантировать 1 н раствором CH3COONH4 (при рН около 6,5) до прекращения реакции на кальций. 3. Фильтрат с осадком промыть 10–12 раз малыми порциями такой же дистиллированной воды, которую применяли выше. 4. Фильтрат вновь выпарить досуха на водной бане, слегка прокалить и снова обработать горячей водой (пункт 2 и 3). Выпаривание и фильтрование повторять до тех пор (4–5 раз), пока осадок полностью не растворится в воде и не будет мути от углекислого кальция и магния. 5. Прозрачный фильтрат (последней обработки) охладить до комнатной температуры и сразу оттитровать 0,02 н раствором H2SO4. 6. Содержание натрия вычислить по формуле:
CNa + – поглощенный натрий (мг-экв на 100 г сухой почвы); Vф – количество миллилитров фильтрата, взятого для титрования;
0,02 – нормальность раствора серной кислоты; 100 – коэффициент пересчета на 100 г почвы;
m – навеска воздушно сухой почвы (в г), соответствующая взятому объему фильтрата для выпаривания.
Для пересчета результатов в процентах количество миллиграмм-эквивалентов умножают на эквивалентную массу натрия (23) и делят на 1000. Задание: определите содержание обменного натрия в разных типах почв. Данные исследований запишите в таблицу 11. Ранжируйте почвы и сделайте выводы.
Таблица 11 Содержание поглощенного натрия в разных типах почв
Контрольные вопросы 1. Что такое обменные основания? 2. Когда почвы можно считать насыщенными основаниями? 3. Когда почвы можно считать ненасыщенными основаниями? 4. Какие почвы обладают устойчивым поглощающим комплексом? 5. Какие почвы обладают неустойчивым поглощающим комплексом? 6. Как связано содержание обменных оснований со структурой и почвенным плодородием? 7. Для каких типов почвообразовательного процесса характерны почвенно-поглощающие комплексы, насыщенные основаниями? 8. Для каких типов почвообразовательного процесса характерны почвенно-поглощающие комплексы, ненасыщенные основаниями? ТЕМА 5. КИСЛОТНОСТЬ ПОЧВЫ Атмосферная влага, попадая в почву, растворяет минеральные и органические вещества, взаимодействует с почвенными коллоидами, с живыми почвенными организмами, с почвенным воздухом и превращается в почвенный раствор (рис. 5).
Рис. 5. Схема взаимодействия почвенного раствора с другими компонентами почвы (по Белоброву В. П., 2004)
Почвенный раствор представляет собой подвижную систему. По мере перемещения из одного генетического горизонта в другой его химический состав заметно изменяется. Концентрация и состав растворенных соединений обусловливают ту или иную реакцию почвенного раствора. Она определяется соотношением свободных ионов H+ и гидроксила (OH-) в почвенном растворе. Концентрацию свободных ионов H+ выражают единицами pH – отрицательным логарифмом концентрации водородных ионов. Показатель pH определяют на приборах, которые называют потенциометрами, либо pH-метрами. Показатель pH чистой воды равен 7,0, что характерно для нейтральной реакции почвенного раствора. При увеличении концентрации водородных ионов значения pH понижаются и свидетельствуют о кислой реакции почвенного раствора (pH < 7). В связи с этим необходимо знать такие понятия, как кислотность и щелочность почв. Кислотность – это способность почвы подкислять почвенный раствор или растворы нейтральных солей вследствие наличия в составе почвы водорастворимых кислот (угольной, масляной, щавелевой, лимонной, фульво-кислот) и гидролитически щелочных солей. В зависимости от состояния ионов водорода в почве различают два вида кислотности – актуальную и потенциальную. Актуальная кислотность обусловлена повышенной концентрацией ионов водорода в почвенном растворе по сравнению с ионами гидроксида. Ее определяют по значению pH водной вытяжки из почвы. Потенциальная кислотность – это способность твердой фазы почвы подкислять раствор при взаимодействии с солями. Она обусловлена присутствием в ППК ионов водорода (H+) и алюминия (Al3+). В зависимости от того, какие соли используют для выявления потенциальной кислотности, ее подразделяют на обменную и гидролитическую. Обменная кислотность – это часть потенциальной кислотности, которая выявляется при вытеснении из почвы ионов H+ и Al3+ раствором нейтральной соли (KCl). Схематически это выглядит следующим образом:
H+ K+ ППК] + 3 KCl = ППК] K + + 3 HCl; K+
Al3+ K ППК] + 3 KCl = ППК] K + AlCl3; K
AlCl3+3H2O = Al(OH)3+3 HCl. Гидролитическая кислотность – это потенциальная кислотность, которая выявляется при вытеснении из почвы ионов водорода (H+) и алюминия (Al3+) растворами гидролитических щелочных солей. Так, при взаимодействии раствора гидролитической щелочной соли (CH3COONa) с почвенно-поглощающим комплексом, в раствор вытесняется гораздо большее количество ионов водорода и алюминия, чем при взаимодействии с нейтральными солями:
. H+ Na+ ППК] + CH3COONa = ППК] + CH3COOH;
Al3+ Na+ ППК] + CH3COONa = ППК] Na+ + (CH3COO)3Al; Na+
(CH3COO)3Al+H2O = Al(OH)3+3CH3COOH.
В результате таких взаимодействий в почвенной вытяжке образуется дополнительное количество уксусной кислоты. Ее количество можно определить титрованием щелочью либо pH-метрически. В случае использования pH-метра, гидролитическую кислотность определяют с помощью переводной таблицы 12.
Таблица 12 Кислотность почв
Гидролитическая кислотность
Торфяные почвы Сильно нуждаются <3,5 <35 Средне нуждаются 3,5-4,2 35-55 Слабо нуждаются 4,2-4,8 55-65 Не нуждаются >4,8 >65 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
После установления потребности почвы в известковании по величине гидролитической кислотности требуется рассчитать норму извести для нейтрализации кислотности. При этом следует учитывать, что внесенная в почву известь перемешивается с пахотным горизонтом и нейтрализует лишь его кислотность. Поэтому для вычисления дозы извести надо знать, сколько ионов водорода содержится в пахотном слое 1 гектара, для чего необходимо знать массу пахотного слоя. Если принять объемную массу почвы равной 1,5 г/см3, а мощность пахотного горизонта 20 см, то масса пахотного слоя на 1 га будет 1,5·20·100 000 000 = 30 000 000 000, или 3 000 000 кг, или 3000 т.
Например, гидролитическая кислотность равна 4,5 мг-экв/100 г (это значит, что в 100 г почвы содержится 4,5 мг-экв обменного водорода). Тогда в 1 кг почвы будет содержатся 45 мг-экв, или 45 мг, или 0,045 г, а во всем пахотном слое на гектаре – 0,045·3 000 000 = 135 000 г, или 135 кг. Это количество обменных ионов водорода и надлежит нейтрализовать. На нейтрализацию 1 кг обменного водорода требуется 50 кг извести согласно протекающей реакции:
2 Н++2 СаСО3 = Са2++Н2О+СО2.
Согласно этому, извести потребуется: 135·50 = 6750 кг, или 67,5 ц, или 6,75 т на 1 га.
Дозу извести можно рассчитать по формуле:
 =Нгид.·1,5, где
=Нгид.·1,5, где
 – доза извести, т/га;
– доза извести, т/га;
Нг. - гидролитическая кислотность, мг-экв/100 г почвы;
1,5 - объемная масса (плотность) почвы при мощности пахотного слоя 20 см, г/см3.
В нашем примере доза извести составит 4,5·1,5 = 6,75 т/га.
Потребность в известковании в зависимости от кислотности и гранулометрического состава дерново-подзолистых почв представлены в таблице 17.
Таблица 17
Дерново-подзолистых почв
| Гранулометрический состав почв | рН солевой вытяжки | ||||||||||
| 4,5 и менее | 4,6 | 4,8 | 5,0 | 5,2 | 5,4-5,5 | ||||||
| дозы СаСО3 (т/га) | |||||||||||
| Супесь и легкий суглинок Средний и тяжелый су-глинок | 4,0
6,0 | 3,5
5,5 | 3,0
5,0 | 2,5 4,5 | 2,0
4,0 | 2,0
3,5 | |||||
Для торфяных горизонтов, оторфованных и хорошо унавоженных почв объемная масса составляет менее 1 г/см3 (для верховых торфов менее 0,1 г/см3). Вычисление дозы извести для таких почв умножением гидролитической кислотности на коэффициент 1,5 даст очень завышенные результаты. Она в торфах изменяется от 50 до 200 мг-экв. на 100 г почвы; в оторфованных горизонтах – 10–30 мг-экв. Для верховых болот со слаборазложившимся торфом доза извести равна около 8–10 т/га; для низинных болот с рН солевой вытяжки 4,8 – около 2–3 т/га.
Задание: по величине рН солевой вытяжки и степени насыщенности анализируемых почв основаниями определите потребность их в известковании и рассчитайте норму извести для нейтрализации кислотности. Запишите результаты расчетов в таблицу 18. Ранжируйте типы почв, сделайте выводы.
Таблица 18
ТЕМА 6. ЗАСОЛЕННОСТЬ ПОЧВЫ
Засоленными называются почвы, содержащие в своем профиле легкорастворимые соли в токсичных для растений и почвенной биоты концентрациях. В почвенных растворах засоленных почв содержится много анионов и катионов  . К таким типам почв отнесены: солончаки, солонцы, солоди.
. К таким типам почв отнесены: солончаки, солонцы, солоди.
К солончакам отнесены почвы, содержащие большое количество водорастворимых солей с самой поверхности в профиле. Они образуются при близком залегании грунтовых вод в условиях выпотного типа водного режима или на засоленных почвообразующих породах (морских, лагунных и озерных отложениях).
К солонцам отнесены почвы, содержащие в почвенно-поглощающем комплексе наряду с поглощенными Ca2+ и Mg2+ в ряду обменных оснований натрий (Na+), который составляет 20–40 % от емкости обмена. Солонцы с поверхности не засолены, но имеют высокую щелочность, а на небольшой глубине в них присутствуют легкорастворимые соли.
При насыщении поглощающего комплекса натрием (>10 % от емкости поглощения), коллоиды при увлажнении почвы переходят в золь и передвигаются в сторону залегания растворимых солей. Они оказывают на коллоиды коагулирующее действие. Здесь формируется иллювиальный солонцовый горизонт. Он уплотнен и имеет призматическую или столбчатую структуру, щелочную реакцию и неблагоприятные физические свойства: низкую порозность (скважность) и плохую водопроницаемость.
Солоди, по мнению К. К. Гедройца, образуются из солонцов путем их деградации в результате замещения обменного натрия (Na+) на водород (H+). Один из характерных признаков солодей и осолоделых почв – наличие в них аморфной кремнекислоты. При длительном течении процесса весь солонцовый горизонт полностью разрушается. На его месте формируется элювиальный осолоделый горизонт, наиболее обедненный органическими и минеральными коллоидами, обогащенный остаточным кварцем и оставшимся после разложения алюмосиликатов аморфным кремнеземом.
Формирование засоленных почв связано с накоплением солей в грунтовых водах и породах и с условиями, способствующими их аккумуляции в почвах: выветривание пород, выход на дневную поверхность морских соленосных осадков, извержение вулканов с выделением газов и паров, содержащих серу и хлор, которые переходят в хлориды и сульфаты, разложение растительности.
Интенсивность перераспределения солей и накопления их в почвах определяется климатом (количеством осадков и величиной испарения), а также фильтрационными свойствами почв, почвообразующих пород и растворимостью солей. По степени и типу засоления выделено 4 группы почв: слабозасоленные, среднезасоленные, сильнозасоленные, очень сильно засоленные (табл. 19).
Таблица 19
Засоленности почв
Применяя анализ водной вытяжки из почв, можно очень быстро и точно определить степень их засоленности, необходимость промывок, возможность использования вод для орошения. Этот вид анализа обязателен для всех щелочных почв.
При определении засоленности почв в водной вытяжке определяют сухой остаток, то есть общую сумму водорастворимых веществ, состав анионов (СО32-, НСО3-, Сl-, SO42-) и катионов (Са2+, Mg2+, Na+, К+). При сокращенном анализе ограничиваются определением сухого остатка, катионов Са2+ и Mg2+, анионов НСО3-, Cl-, SO42-.
Полученные данные выражают в процентах с точностью до 0,001 и в миллиграмм-эквивалентах с точностью до 0,01.
Определение хлорид-иона
О присутствии хлорид-иона в растворе судят по образовавшемуся в ходе химической реакции осадку или мути AgCl. Реакцию осаждения хлорид-иона можно представить уравнением:
NaCl+AgNO3 = AgCl↓+NaNO3.
Для этого в пробирку прилить 5 мл фильтрата водной вытяжки почвы и подкислить ее двумя каплями 10 % раствора H2SO4. Прибавить несколько капель 5 % раствора AgNO3 и все содержимое перемешать.
По количеству выпавшего осадка определить его содержание: мало – (+), много – (++), очень много – (+++).
Определение сульфат-иона
Если в водной вытяжке почвы находятся сернокислые соли, то выпадет белая муть или осадок сернокислого бария. Его образование имеет уравнение:
Na2SO4+BaCl2 = BaSO4↓+2NaCl .
Отобрать пипеткой 10 мл фильтрата водной вытяжки почвы и перенести в пробирку. Прилить в эту пробирку 1 мл 10 %-го раствора BaCl2 и кипятить жидкость на спиртовке в течение 1 минуты.
По количеству выпавшего осадка определить его содержание: мало – (+), много – (++), очень много – (+++).
Определение иона кальция
По образовавшейся белой мути или осадку в виде щавелевокислого кальция судят о присутствии кальция в растворе.
В пробирку налить 5 мл фильтрата водной вытяжки почвы и прилить 5 мл 4 % раствора щавелевокислого аммония. Содержимое довести до кипения на спиртовке. Реакцию его осаждения можно представить в виде уравнения:
CaCl2+(NH4)2C2O4 = CaC2O4↓+2NH4Cl .
По количеству выпавшего осадка определить его содержание: мало – (+), много – (++), очень много – (+++).
Задание: при оформлении работы запишите уравнения проведенных реакций. В таблице 20 отметьте условными знаками интенсивность выпадения осадков ( (+++) – очень много; (++) – много; (+) – мало; (-) – отсутствует). Ранжируйте почвы по показателям. В выводе укажите, какие ионы обнаружены в каждом образце почвы.
Таблица 20
Сухого остатка
| Тип почвы | Генетический горизонт | Глубина взятия образца, см | Навеска почвы, г | Объем воды, мл | Объем вытяжки, мл | Масса фарфоровой чашки, г | Масса чашки с сухим остатком, г | Сухой остаток | |
| г | % | ||||||||
Работа 3. Определение в почве карбонатов (НСО3-)
По концентрации ионов НСО3- судят об общей щелочности почвы. Их определение проводят методом титрования водной вытяжки 0,01 н раствором H2SO4 в присутствии метилоранжа.
Цель работы: определить общую щелочность исследуемых почв.
Материалы и оборудование: колбы объемом 100 мл, мерные стаканчики или пипетки.
Реактивы: водные вытяжки почв, 0,01 н раствор H2SO4, индикатор метилоранж.
Объект исследования: почва разных типов (чернозем, дерново-подзолистая, темно-серая лесная, торф, солончаки и другие).
Ход работы. Пипеткой или мерным стаканчиком отобрать в две колбы объемом 100 мл по 25 мл фильтрата водной вытяжки почвы. Прилить в каждую по 1–2 капли метилоранжа. В одной из колб провести титрование вытяжки 0,01 н раствором H2SO4 до слабо-розового окрашивания. Изменение окраски из желтой (в нейтральной и слабощелочной средах) в слабо-розовую (в кислой среде) трудно уловимо. Поэтому для более точного определения конца титрования и берут вторую колбу. Она служит для сравнения изменения окраски титруемой жидкости (свидетель). Обе колбы поставить на лист белой бумаги и тщательно следить за изменением окраски в колбе в момент титрования фильтрата кислотой. Как только жидкость слегка порозовеет, титрование завершить.
Содержание НСО3- в процентах вычислить по формуле:
 , где
, где
 – содержание НСО3- в процентах;
– содержание НСО3- в процентах;
0,00061 – коэффициент пересчета на щелочность, так как 1 мл 0,01 н H2SO4 соответствует 0,00061 г НСО3-;
V – количество миллилитров 0,01 н H2SO4, пошедшей на титрование 25 мл водной вытяжки;
 – поправка к титру серной кислоты;
– поправка к титру серной кислоты;
20 – коэффициент пересчета на 100 г почвы.
Содержание НСО3- в миллиграмм-эквивалентах на 100 г вычисляют по формуле:
 , где
, где
1000 – коэффициент пересчета (в мг-экв.);
61 – эквивалентная масса НСО3-.
Задание: проведите титрование почвенных вытяжек и вычислите общую щелочность в процентах НСО3- и в миллиграмм-эквивалентах на 100 г почвы. Результаты запишите в таблицу 22 и сделайте выводы.
Таблица 22
Содержание карбонатов в почве
| Тип почвы | Генетический горизонт | Глубина взятия образца, см | Объем фильтрата, мл | Объем H2SO4, требуемой для титрования, мл | Содержание НСО3- | |
| % | мг-экв/100 г почвы | |||||
Работа 4. Количественное определение хлорид-иона ( Cl - )
Цель работы: определить содержание хлорид-иона в почвенных образцах.
Материалы и оборудование: колбы объемом 50 или 100 мл, мерные пробирки или пипетки, бюретка для титрования.
Реактивы: водная вытяжка почвы, раствор K2CrO4, 0,01 н раствор AgNO3.
Объект исследования: почвенные образцы.
Ход работы. Пипеткой или мерной пробиркой отобрать по 10 мл фильтрата почвенных вытяжек в две колбы объемом 50 или 100 мл. В каждую колбу прибавить по 1 мл 10 % раствора хромовокислого калия (K2CrO4). Одну из порций титровать 0,01 н раствором AgNO3 до красновато-бурого окрашивания. Вторая порция раствора должна находиться рядом для сравнения оттенка титруемой жидкости.
При прибавлении к титруемому раствору азотнокислого серебра образуется нерастворимый белый осадок хлористого серебра по уравнению:
NaCl + AgNO3 = AgCl + NaNO3 .
Как только весь хлорид-ион превратится в хлористое серебро, каждая последующая капля AgNO3 будет вступать в реакцию с K2CrO4 и придаст жидкости не исчезающий при взбалтывании красновато-бурый оттенок. Это связанно с красным цветом образующегося хромовокислого серебра:
2 AgNO3 + K2CrO 4= Ag2CrO4 + 2KNO3 .
Начало появления неисчезающей красновато-бурой окраски и показывает окончание титрования.
Содержание Cl- в процентах вычисляют по формуле:
 , где
, где
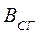 – количество миллилитров 0,01 н раствора AgNO3, пошедшего на титрование 10 мл водной вытяжки;
– количество миллилитров 0,01 н раствора AgNO3, пошедшего на титрование 10 мл водной вытяжки;
 – поправка к титру азотного серебра;
– поправка к титру азотного серебра;
0,000355 – коэффициент пересчета на содержание Cl, так как 1 мл 0,01 н AgNO3 соответствует 0,000355 г хлора;
50 – коэффициент пересчета на 100 г почвы.
Содержание хлорид-иона в миллиграмм-эквивалентах на 100 г почвы вычисляют по формуле:
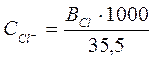 , где
, где
 – содержание хлорид-иона в мг-экв. на 100 г почвы (мг-экв./100 г);
– содержание хлорид-иона в мг-экв. на 100 г почвы (мг-экв./100 г);
 – содержание хлорид-иона в процентах;
– содержание хлорид-иона в процентах;
1000 – коэффициент пересчета в мг-экв.;
35,5 – эквивалентная масса хлорид-иона.
Задание: проведите титрование фильтратов почвенных вытяжек. Сравните типы почвы по содержанию хлорид-иона и сделайте выводы. Результаты запишите в таблицу 23.
Таблица 23
Содержание ионов Cl - в разных типах почв
| Тип почвы | Генетический горизонт | Глубина взятия образца, см | Объем фильтрата из почвенной вытяжки, мл | Объём AgNO3, требуемого для титрования, мл | Содержание Сl- | Ранг почвы | |
| % | мг-экв/100 г почвы | ||||||
Содержание сульфат-ионов в разных типах почв
| Образец почвы | Генетический горизонт | Глубина взятия образца, см | Сухой остаток, г | Содержание SO42- | Ранг почвы | |
| % | мг-экв на 100 г почвы | |||||
Работа 6. Вычисление степени солонцеватости и доз гипса для определения необходимости гипсования почв
Цель работы: изучить почвы по степени солонцеватости и провести вычисление доз гипса.
Ход работы. Взвесить на весах 10 г воздушносухой почвы, просеянной через сито с отверстиями диаметром 1 мм. Почву поместить в толстостенную двухлитровую коническую колбу, прибавить 1 г мела и 1 л дистиллированной воды. Пропустить через колбу в течение 3 часов ток углекислого газа из баллона, тщательно взбалтывая смесь через каждые 15 минут.
После этого раствор отфильтровать через складчатый фильтр. В прозрачном фильтрате определить натрий объемным методом.
Степень солонцеватости почв устанавливают по формуле:
 , где
, где
D – степень солонцеватости (% емкости поглощения);
 – количество обменного натрия (мг-экв. на 100 г почвы);
– количество обменного натрия (мг-экв. на 100 г почвы);
100 – коэффициент пересчета (%);
Е – емкость поглощения (мг-экв. на 100 г почвы).
Для нейтрализации щелочности почвы гипсуют. При этом обменный Na+ заменяется в почвенно-поглощающем комплексе (ППК -) кальцием:
Na+ Ca+
[ППК-] +CaSO4 ↔ [ППК-]+Na2SO4 .
Na+
Образовавшаяся соль сульфата натрия является физиологически нейтральной. Она достаточно безвредна для растений, растворима в воде и может быть вымыта за пределы пахотного горизонта.
Дозу гипса для замены натрия на кальций в поглощающем комплексе почвы вычисляют по формуле:
 , где
, где
 – доза гипса (т/га);
– доза гипса (т/га);
0,086 – миллиграмм-эквиваленты гипса;
 – содержание обменного натрия (мг-экв на 100 г почвы);
– содержание обменного натрия (мг-экв на 100 г почвы);
h – мощность пахотного слоя (см);
d – объемная масса мелиорируемого горизонта (г/см3).
Для устранения вредного влияния обменного натрия дозы гипса на разных солонцовых почвах колеблются от 3 до 15 т/га. Практика гипсования солонцов показывает, что применение гипса из расчета полнормы по обменному натрию дает примерно такой же эффект, как и от полной и даже полуторной нормы. На солонцеватых почвах установлен положительный эффект применения малых доз гипса (2-4 ц/га) в рядки (А. М. Гринченко и др.).
Задание: рассчитайте степень солонцеватости почв, норму гипса для нейтрализации щелочности.
Контрольные вопросы
1. Какие почвы называют засоленными?
2. Какие типы почв отнесены к засоленным?
3. С какими процессами связано формирование засоленных почв?
4. Назовите 4 группы почв по степени и типу засоления.
5. Назовите группы солончаковатости по величине плотного осадка и распределению его в профиле.
6. Чем отличаются солончаки от солонцов?
7. Что такое сухой остаток водной вытяжки?
8. Зачем необходимо знать степень солонцеватости почв?
9. Как нейтрализовать кислотность и щелочность почв?
Раздел 2. Растениеводство
К началу третьего тысячелетия население Земли перешагнуло шестимиллиардный рубеж. Считается, что в период верхнего палеолита население нашей планеты насчитывало около 3 млн человек, в период мезолита – 5 млн; в начале нашей эры – 200-300 млн; в 1000 г. – 265 млн; 1500 г. – 425 млн; 1600 – 545 млн; 1700 – 610 млн; 1800 – 905 млн; 1900 г. – 1630 млн; 2000 г. – 6200 млн человек. Следовательно, если за период с начала новой эры до 1900 г., население Земли увеличилось в 9,6 раза, то в 2000 г. – в 35,3 раза. При этом 90 % прироста населения приходится на развивающиеся страны.
Чтобы накормить растущее население Земли, которое к 2015 г., возможно, достигнет 7,1 млрд человек, производство продуктов питания предстоит увеличить по меньшей мере на 50 %.
В соответствии с научно-обоснованными нормами питания человек должен получать в сутки не менее 2500 ккал, 80–100 г. белка, в том числе 40–50 г. белка животного происхождения.
В связи с этим одной из основных и важнейших отраслей в экономике всех стран является сельское хозяйство. За счет его развития население может быть обеспечено высококачественными продуктами питания, животноводство – полноценными кормами, а перерабатывающая промышленность – многими видами сырья.
Главными объектами сельского хозяйства являются почва, зеленые растения и животные. Оно целиком построено на использовании почвы.
В растениеводстве почва – это среда для выращивания растений. Животноводство развивается за счет продукции растениеводства, а земледелие – с помощью орудий обработки почвы, посева и уборки растений, приемов защиты их от болезней, вредителей и климатических стрессов. Оно обеспечивает стабильность урожаев разных видов растений.
Растениеводство включает возделывание полевых, овощных, плодово-ягодных, луговых, бахчевых, масличных и других культурных видов растений. В связи с этим большое значение в развитии растениеводства имеют научные исследования физиологов (К. А. Тимирязев, Ф. М. Куперман и др.), почвоведов (В. В. Докучаев, Д. Н. Прянишников, К. К. Гедройц и др.), генетиков и селекционеров (Н. И. Вавилов, П. П. Лукьяненко, В. С. Пустовойт, Ф. Г. Кириченко и др.), иммунологов (А. А. Ячевский, М. К. Хохряков и др.), земледельцев (Т. С. Мальцев, А. И. Бараев и др.).
Научные основы растениеводства строятся на принципах современной биологической науки, изучающей особенности роста и развития растений, их требований к условиям среды. Растениеводство – это наука, изучающая культурные растения, разнообразие их форм и сортов, особенности их биологии и наиболее совершенные приемы выращивания высоких и стабильных урожаев хорошего качества при наименьших затратах труда и низкой себестоимости продукции.
Выращиваемые культуры отличаются по морфологическим признакам, биологическим особенностям и по целям выращивания. Для удобства изучения в растениеводстве уже много десятилетий используют деление культурных видов растений по производственной цели выращивания. Известно несколько классификаций, но особенно удобна следующая (по Г. В. Кореневу и др.):
I. Группа зерновых культур, которые выращиваются для получения зерна.
Она делится на подгруппы:
1. Типичные хлеба: пшеница, рожь, тритикале, овес, ячмень.
2. Просовидные хлеба: кукуруза, просо, сорго, рис.
3. Зерновые бобовые: горох, чечевица, чина, нут и др.
4. Прочие незлаковые зерновые – гречиха, амарант.
II. Группа технических культур, которые выращиваются для получения масел, волокна, сахара, крахмала, лекарств и на пищевые цели.
Она делится на следующие подгруппы:
1. Масличные: жирномасличные – подсолнечник, сафлор, горчица, рапс, клещевина, лен и др.; Эфирномасличные – кориандр, анис, тмин, мята и др.
2. Прядильные: хлопчатник (с волокном на семени); лен, конопля, кенаф и др. (с лубяным волокном в стеблях); лен новозеландский, сизаль и др. (с волокном в листьях).
3. Сахароносные, которые выращиваются для переработки на сахар: корнеплоды (сахарная свекла, цикорий); другие сахароносы (сахарный тростник).
4. Крахмалоносные, которые выращивают для пищевых целей и промышленной переработки: клубнеплоды картофеля и топинамбура.
5. Лекарственные, инсектицидные, которые выращивают на медицинские цели: мак, табак, махорка, хмель и др.
6. Бахчевые, которые выращиваются для пищевых целей и переработки:
пищевые: арбуз, дыня, тыква столовая;
технические: люффа.
Различные требования многих видов культурных растений к сумме активных температур имеют высокое значение для их размещения по зонам России (табл. 25).
В зависимости от биологических особенностей каждый вид культурных растений требует определенной площади питания, а потому индивидуально для каждого из них рассчитана норма высева семян на единицу площади (табл. 26). В сельскохозяйственном производстве все пересчеты делают на 1 га.
Таблица 25
Тема 7. Хлебные злаки
В мировом земледелии зерновые культуры занимают ведущее место и имеют важнейшее значение для населения всего земного шара. Хлеб – основной продукт питания человека, фуражное зерно – концентрированный корм для сельскохозяйственных животных. Зерновые культуры по морфологическим и биологическим особенностям делят на две группы. Различают хлеба I и II групп и зерновые бобовые.
Хлеба I группы относятся к семейству мятликовых (Роасеае) – пшеница, рожь, ячмень, овес, тритикале. Растения этой группы характеризуются следующими признаками: соцветия – колос (у овса – метелка), плод – зерновка с продольной бороздкой, стебель – соломина, корневая система мочковатая, зерно прорастает несколькими корешками. Культуры озимые и яровые, мало требовательные к теплу, но нуждаются во влаге, относятся к растениям длинного дня.
Хлеба II группы также относятся к семейству мятликовых – кукуруза, просо, сорго, рис, чумиза. Отличительные особенности растений этой группы: соцветие – метелка (у кукурузы женское соцветие – початок, мужское – метелка), стебель – соломина с выполненной сердцевиной, корневая система мочковатая. Зерно прорастает одним корешком, плод – зерновка без бороздки. Представлена только яровыми формами, растения более требовательны к теплу и свету, засухоустойчивы (кроме риса), относятся к растениям короткого дня.
Зерно у хлебных злаков различается по химическому составу (табл. 27).
Таблица 27
Химический состав зерна хлебных культур, %
| Культура | Вода | Белки | Углеводы | Жиры | Зола | Клетчатка |
| Пшеница мягкая | 14,0 | 13,9 | 79,9 | 2,0 | 1,9 | 2,3 |
| Пшеница твердая | 14,0 | 16,0 | 77,4 | 2,1 | 2,0 | 2,4 |
| Рожь | 14,0 | 12,6 | 80,9 | 2,0 | 2,1 | 2,4 |
| Ячмень | 14,0 | 12,2 | 77,2 | 2,4 | 2,9 | 5,2 |
| Овес | 12,8 | 11,7 | 68,5 | 6,0 | 3,4 | 11,5 |
| Кукуруза | 14,0 | 11,6 | 78,9 | 5,3 | 1,5 | 2,6 |
| Рис | 12,0 | 7,6 | 72,5 | 2,2 | 5,9 | 11,8 |
| Просо | 12,5 | 12,1 | 69,8 | 4,5 | 4,3 | 9,2 |
| Гречиха | 14,5 | 13,1 | 67,8 | 3,1 | 2,8 | 13,1 |
В состав некоторых из указанных родов входит несколько видов, подразделяющихся в свою очередь на разновидности.
При всем разнообразии ботанических форм у всех хлебных злаков наблюдается большое сходство, однако они имеют и свойственные каждой культуре различия в морфологических признаках и биологических свойствах.
Хлеба первой группы
| Признаки зерен | Пшеница Triticum L. | Рожь Secale L. | Ячмень Hо deum L. | Овес Avena L. |
| Пленчатость | Обычно голые, реже пленчатые, не склеенные с чешуями | Голые | Пленчатые, склеенные с чешуями, редко голые | Пленчатые, не склеенные с чешуями, редко голые |
| Форма | Продолговато-овальная, яйцевидная; пленчатые зерна обычно в целых колосках | Удлиненная, к снованию заостренная | Эллиптическая, удлиненная, заостренная к обоим концам | Удлиненная, сильно суженная; пленчатые зерна веретеновидные, к верхушке заостряющиеся |
| Поверхность чешуй (пленок) | Ребристая | - | С одной продольной нервацией | Гладкая |
| Хохолок | Имеется, иногда очень слабый | Имеется | Отсутствует | Имеется |
| Бороздка | Широкая | Глубокая | Широкая | Широкая |
| Поверхность зерновки | Гладкая | Мелкоморщини-стая | Гладкая или слабоморщинистая | Опушенная, покрыта легко стирающимися волосками |
| Окраска | Белая, янтарно-желтая, красная | Зеленая, серая, реже желтая или коричневая | У пленчатых зерен – желтая или черная, у голых – желтая, часто с антоциановой окраской | У пленчатых зерен – белая, желтая, ко-ричневая, у голых – светло-желтая |
Таблица 29
Хлеба второй группы
| Признаки зерен | Кукуруза Zea L. | Сорго Sorghum L. | Просо Panicum L. | Рис Oryza L. |
| Пленчатость | Голые | Голые и пленчатые | Пленчатые | Пленчатые |
| Форма | Округлая или гранистая, реже вверху заостренная | Округлая | Округлая, на концах слабо заостренная | Удлиненно-овальная |
| Поверхность чешуй (пленок) | - | Гладкая, блестящая | Гладкая, глянцевая или с тусклым блеском | Продольно-ребристая, матовая |
| Величина (в мм) | 6 – 20 | 4 – 6 | 2 – 3 | 6 – 10 |
| Окраска чешуй | - | Белая, желтая, оранжевая, коричневая, черная | Кремовая, желтая, красная, зеленоватая, коричневая | Соломенно-желтая, коричневая |
| Окраска зерновки | Белая, желтая, красная, реже синяя | Белая, кремовая, оранжевая, коричневая | Желтая | Белая, реже коричневая |
Хлебных злаков
| Культура | Проростки | Листья | |||||
| число зародышевых корешков | положение стеблевого побега | опушенность | окраска | ширина пластинки | закручивание | положение по отношению к поверхности почвы | |
Контрольные вопросы
1. Назовите растения хлебных злаков.
2. К какому семейству относятся зерновые культуры?
3. Что представляет собой плод зерновых культур?
4. Назовите основные морфологические признаки семян хлебных злаков, по которым проводят описание и определяют принадлежность к ботаническому виду. Поясните каждый.
5. Назовите фазы вегетации жизненного цикла зерновых злаков.
6. Что предшествует фазе всходов?
7. Что происходит в семени при его набухании?
8. Как прорастают зерна злаков?
9. Какова роль колеоптиле для растения?
10. Когда начинается и заканчивается фаза всходов?
Зернобобовых культур
| Вид (русское и латинское название) | Семена | Рубчик | Плод | |||||||
| форма | окраска | величина (крупность) | форма | окраска | месторасположение | форма | окраска | величина | опушение | |
Контрольные вопросы
1. К какому семейству относятся зерновые бобовые культуры?
2. Назовите важнейших представителей зернобобовых культур.
3. Назовите основные морфологические признаки плодов и семян зернобобовых культур. Поясните каждый.
4. Назовите фазы вегетации жизненного цикла рассматриваемого семейства.
ТЕМА 9. КОРНЕПЛОДЫ
К корнеплодам относятся сахарная и кормовая свекла, морковь, брюква, турнепс. По хозяйственному использованию их делят на технические (сахарная свекла) и кормовые (кормовая свекла, морковь, брюква, турнепс). При высоких урожаях корнеплодов сбор сухого вещества с единицы площади в 2–3 раза больше, чем у зерновых культур. Ботва корнеплодов богата питательными веществами, поэтому ее также используют для кормления скота и приготовления силоса.
Корнеплоды – молокогонный корм, их вводят в рацион дойного стада. При кормлении животных корнеплодами возрастает их продуктивность, улучшается физиологическое состояние, повышается усвояемость грубых и концентрированных кормов.
Все корнеплоды, несмотря на их ботаническое разнообразие, имеют много общего. Они относятся к группе геофитов, т. е. растений, у которых головка (эпикотиль), шейка (гипокотиль) и собственно корень превратились в органы накопления запасных питательных веществ. Головка – это верхняя часть корнеплода, несущая на себе листья. Она появляется в результате развития конуса нарастания и представляет собой стеблевое образование, где располагаются почки возобновления, дающие начало листьям и цветоносным побегам. Головка частично образуется и из надсемядольного колена. Шейка расположена ниже головки. Она разрастается из подсемядольного колена, не имеет листьев и корешков. Собственно корень расположен в нижней части корнеплода и представляет собой разросшийся главный корень, на котором образуются боковые корешки.
Корнеплоды – двулетние растения. В первый год они образуют розетку листьев и утолщенный корнеплод с большим запасом питательных веществ. На второй год из высаженного корнеплода вырастают цветоносные побеги, дающие семена. Некоторые растения образуют цветоносные побеги в первый год жизни, их называют цветушными (или цветухой). Растения, которые на второй год жизни не дают цветоносных побегов, называют упрямцами.
Корнеплоды имеют также большое агротехническое значение, являясь прекрасным предшественником для зерновых и зерновых бобовых культур.
К распространенным растениям, используемым в качестве сочных кормовых корнеплодов, относятся свекла (кормовая, сахарная), брюква, морковь, турнепс и цикорий. Растения эти двулетние. В первый год жизни они развивают корни и прикорневую розетку листьев, а на второй год – цветоносные стебли.
Кормовых корнеплодов
| Признаки плодов и семян | Свекла | Морковь | Брюква | Турнепс | Цикорий |
| Форма Величина Окраска Характер поверхности оболочки семян |
ТЕМА 10. МАСЛИЧНЫЕ РАСТЕНИЯ
К масличным культурам относят подсолнечник, лен-кудряш, горчицу, рыжик, рапс, сою, арахис, клещевину и ляллеманцию. Растительное масло получают также из семян льна-долгунца, хлопчатника, конопли и др.
Растительные масла широко используют для пищевых и технических целей.
При переработке семян на масло получают побочные продукты (жмых и шроты), которые богаты белком и жиром и используются как высокоценный концентрированный корм для животных. Жмых клещевины применяют в производстве пластмасс, клея, казеина.
Стебли многих масличных культур идут на топливо, для изготовления бумаги, мешковины и получения поташа.
Многие масличные культуры возделывают как пропашные потому, что они являются хорошими предшественниками для зерновых культур.
Содержание масла в семенах масличных культур колеблется от 20 до 60 % массы семян, причем количество и качество масла зависят от почвенно-климатических условий, зоны возделывания, культуры, уровня агротехники.
В группу масличных растений входят представители различных ботанических семейств. В таблице 35 представлены ботанические виды, входящие в группу масличных растений, и указанно семейство, к которому они относятся.
Посев масличных растений производится как семенами в ботаническом понимании этого термина (мак, горчица и др.), так и плодами (подсолнечник). В связи с этим семена и плоды, используемые для посева, в производстве называют посевным материалом.
Таблица 35
Ботаническим семействам
| Семейство | Вид |
| Сложноцветных – Compositae | Подсолнечник – Helianthus annuus L. Сафлор – Carthamus tinctorius L. |
| Молочайных – Euphorbiaceae | Клещевина – Ricinum |
| Кунжутовых – Pedaliaceae | Кунжут - Sesamum indicum L. |
| Маковых – Papaveraceae | Мак масличный - Papaver somniferum L. |
| Губоцветных – Labiatae | Ляллеманция – Lallemantia iberica F. et M. Перилла – Perilla ocymoides L. |
| Бобовых – Fabaceae | Арахис – Arachis hypogaea L. |
| Крестоцветных– Brassicaceae | Рапс - Brassica napus oleifera DC. Сурепица – Brassica rapa oleifera DC. Рыжик – Camelina sativa Grantz. Горчица белая – Sinapis alba Grenz. Горчица сизая – Brassica juncea Grenz. |
Подсолнечника
Подсолнечник – важнейшая масличная культура. В нашей стране около 80 % растительного масла получают из семян подсолнечника. Советские ученые – академик В. С. Пустовойт, академик Л. А. Жданов и др. создали ценные сорта подсолнечника, устойчивые к болезням, вредителям, заразихе, с содержанием в ядре семянок свыше 50 % жира.
Существует много форм и сортов подсолнечника, так как подсолнечник является перекрестно-опыляемым растением, классификация его сильно затруднена. Принято объединять все формы подсолнечника по строению семянок в следующие три основные группы: грызовой, масличный и межеумок.
Грызовой подсолнечник отличается от других групп высотой стебля (достигает 4 м), крупной корзинкой с диаметром до 45 см, как правило, не имеет боковых побегов. Семянки грызового подсолнечника крупные длина 11–23 мм, ширина – 7,5–12 мм, плохо выполнены (ядро заполняет примерно на 2/3 полость кожуры). В связи с чем в этой группе подсолнечника самая высокая лузжистость (от 42 до 56 %). Содержание масла от 20 до 35 %. Кожура толстая и ребристая. Грызовой подсолнечник имеет ограниченное распространение. Возделывается на силос.
Масличный подсолнечник имеет более низкий стебель (от 1,5 до 2,5 м), нередко стебель ветвящийся, корзинки мелкие – от 14 до 20 см в диаметре. Семянки масличного подсолнечника мелкие, длинна – 7–13 мм и ширина – 4–7 мм, ядро полностью заполняет полость кожуры. Такие семянки являются выполненными. Содержание масла в ядре 53–65 %. Кожура тонкая и не ребристая и поэтому масличный подсолнечник имеет самую низкую лузжистость – 25–35 %. Масличный подсолнечник используется для получения масла.
Межеумок по всем характерным признакам занимает промежуточное положение между грызовым и масличным подсолнечником, а именно: высота стебля – 2 – 3 м, размер корзинки – 15 – 30 см в диаметре, длина семянки – 11 – 55 мм и ширина – 7,5 – 10 мм, лузжистость – 48 – 52 %. Семянки средневыполненные. Культурные формы подсолнечника делят на два подвида: полевой и декоративный.
Цель работы: изучить морфологические признаки плодов различных сортов и групп подсолнечника.
Материал и оборудование: пробирки для семян, чашки Петри, пинцеты, линейки, лупы.
Объект исследования: коллекция сортов подсолнечника.
Ход работы. Рассмотрите плоды (семянки) подсолнечника разных сортов по внешним признакам и проведите их описание. Обратите внимание на сортовые различия. Используя представленную на стр. 99 характеристику и проведя соответствующие измерения семянок (длина, ширина, толщина и ребристость кожуры), попробуйте указать принадлежность сорта к одной из трех групп подсолнечника. Возникшие вопросы выясните у руководителя занятия.
Задание: ознакомьтесь с морфологическими признаками семянок коллекционных сортов подсолнечника, проведите их краткое описание. Описания оформляйте в виде таблицы 37.
Таблица 37
Подсолнечника
Определение масличности, или определение жиров в семенах подсолнечника, позволяет дать оценку технических качеств.
Академик А. А. Шмук предложил оригинальный способ быстро определить содержание жира в семенах. Сущность этого метода заключается во взвешивании семян, погруженных в масло. При этом масса находящегося в семенах масла «теряется», а взвешивается лишь обезжиренное вещество семян. Установлено, что 1 г обезжиренного вещества семян подсолнечника весит в подсолнечном масле 0,28 г. Следовательно, отношение массы обезжиренного вещества семян подсолнечника к его массе в подсолнечном масле выражается коэффициентом: 1:0,28 = 3,57.
Цель работы: апробировать метод определения масличности в семенах подсолнечника.
Материал и оборудование: электронные весы, стаканчики, чашки для взвешивания, подсолнечное масло.
Объект исследования: семена подсолнечника.
Ход работы. Перед началом работы необходимо установить весы. Из среднего образца отсчитать 100 семян подсолнечника, очистить их от кожуры, положить их в чашку весов и взвесить в воздухе. Затем переложить семена в масло и взвесить их в масле. Полученную массу семян в масле умножить на коэффициент 3,57. Это позволит рассчитать массу обезжиренного вещества. Определить количество жира (г) в исследуемом образце следует вычитанием массы обезжиренного вещества из массы семян в воздухе. Затем определяют процентное содержание жира в семенах. Масса семени берется за 100 %, а масса жира определена в ходе исследований.
Задание: определите массу жира и его процентное содержание в семенах подсолнечника. Для облегчения расчетов составьте соответствующие формулы. Результаты работы запишите в таблицу 38.
Таблица 38
ЛИТЕРАТУРЫ
1. Агрохимия / под ред. проф. Б. А. Ягодина. – М., 2001. –200 с.
2. Александрова, Л. Н. Органическое вещество почв и процессы его трансформации / Л. Н. Александрова. – Л.: Наука, 1980. – С. 83 - 95.
3. Аринушкина, Е. В. Руководство по химическому анализу почв / Е. В. Аринушкина. – М.: Изд. МГУ, 1970. – 400 с.
4. Биологические основы сельского хозяйства / под ред. И. М. Ващенко. – М.: Академия, 2004. – 544 с.
5. Вавилов, П. П. Полевые сельскохозяйственные культуры СССР / П. П. Вавилов, Л. Н. Балыньев. – М.: Колос, 1984. –160 с.
6. Майсурян, Н. А. Полеводство. Лабораторно-практические занятия / Н. А. Майсурян. – М.: Просвещение, 1964. – 247 с.
7. Радов, А. С. Практикум по агрохимии / А. С. Радов, И. В. Пустовой, А. В. Корольков; под ред. И. В. Пустового. – 4-е изд., перераб. и доп. – М.: Агропромиздат, 1985. – 312 с.
8. Цупак, В. Ф. Практикум по основам агрохимии с ботаникой / В. Ф. Цупак. – Л.: Колос, 1967. – 367 с.
ПРИЛОЖЕНИЕ 1. Требования к помещению
ПРИЛОЖЕНИЕ 2. Химическая посуда
По назначению посуду можно разделить на посуду общего назначения, специального и мерную.
Посуда общего назначения необходима для большинства работ и всегда есть в лаборатории. К ней относятся: пробирки, воронки простые и делительные, колбы плоскодонные, стаканы, кристаллизаторы, конические колбы (Эрленмейера), фарфоровые чашки, металлические бюксы с крышечками. Специальная посуда применяется только для какой-то определенной цели. Например, приборы для определения карбонатов, плотности, молекулярного веса и др. К мерной посуде относят мерные цилиндры, пробирки, пипетки, бюретки, мерные колбы и стаканчики.
Объем реагентов в пробирке не должен превышать 1/4 объема. Сыпучие вещества вносят в пробирку с помощью шпателя или совочка из кальки или бумаги шириной, немного меньшей диаметра пробирки, а длиной, соответствующей длине пробирки. Реактивы, налитые в пробирку, перемешивают в левой руке, ударяя по низу пробирки указательным пальцем правой руки. Если пробирка заполнена жидкостью больше чем наполовину, ее содержимое перемешивают стеклянной палочкой. Нельзя закрывать пробирку пальцем и встряхивать ее содержимое. Для этого существуют резиновые пробки.
Нагревать вещества до 100°С (температура кипения воды) можно и в конических колбах, и в химических стаканах на электроплитке или газовой горелке с асбестированной сеткой. Реакции при более высокой температуре проводят в круглодонных колбах.
Различные сорта стекол обладают разными термическими свойствами. Обычное химическое стекло из-за высокого температурного коэффициента расширения термически малоустойчиво. Тонкостенную посуду и изделия из обычного химического стекла можно нагревать только до температуры кипения воды на асбестовой сетке, избегая резких изменений температуры. Нельзя нагревать кристаллизаторы – плоскодонные стеклянные толстостенные чашки. Стекло «пирекс» жароустойчиво и химически устойчиво. Высокой механической прочностью и термоустойчивостью характеризуется и «молибденовое» стекло, однако оно химически менее устойчиво. Наиболее термостойко кварцевое стекло.
Для хранения и переливания небольших количеств жидкостей используют капельницы, пипетки и бюретки. Капельницы бывают чаще всего двух типов. Сдавливая и отпуская резиновый колпачок (от глазной пипетки) капельницы, можно набирать в пипетку жидкость, отливать нужное число капель. Из капельницы с клювиком жидкость выливается в сосуд при нагревании воздуха над раствором теплом руки.
В лабораториях пользуются пипетками Мора (простые) и пипетками градуированными. Последние применяют для отмеривания различных объемов жидкости. Пипетки Мора предназначены для переноса определенного объема жидкости из одного сосуда в другой. Пипетки наполняют жидкостью следующим образом. Химические растворы, особенно ядовитые и сильно пахнущие жидкости, рекомендуется отбирать резиновой грушей, присоединяя ее к верхнему концу пипетки. Жидкость набирают выше необходимой метки. После насасывания грушу снимают. Быстро закрывают указательным пальцем верхнее отверстие пипетки. Держа пипетку строго вертикально, поднимают ее так, чтобы метка оказалась на уровне глаз, затем понемногу ослабляют палец на верхнем отверстии пипетки, чтобы жидкость медленно вытекала. В тот момент, когда нижняя часть мениска опускающейся жидкости коснется метки, верхнее отверстие опять плотно закрывают пальцем и жидкость доводят до метки.
Бюретки применяют для титрования раствора. Для отсчета малых объемов жидкости используют микробюретки.
Бюретку споласкивают 3–4 раза дистиллированной водой и 3 раза небольшими порциями заполняемого раствора. Каждый раз после промывания дают возможность жидкости полнее стечь из бюретки. Затем бюретку наполняют раствором несколько выше верхней черты и открывают кран или зажим так, чтобы кончик бюретки наполнился раствором и вышли все пузырьки воздуха. Если из кончика бюретки пузырек не выходит, надо, согнув каучуковую трубку, поднять кверху кончик бюретки и открыть зажим. Пузырек быстро поднимается вверх и выходит. Если бюретка с краном, можно удалить пузырек, резко открыв кран и пустив сильную струю раствора, или при помощи резиновой груши. Перед самым началом титрования надо довести уровень жидкости в бюретке до нулевой черты. Точность отсчетов по бюретке составляет 0,02 мл. Поэтому отсчеты следует записывать с двумя десятичными знаками (например, 15,00 или 16,34). Микробюретки, в отличие от обычных, имеют градуировку 0,01 мл, что дает возможность делать отсчеты с большей точностью.
Мерная (измерительная) химическая посуда применяется для отмеривания (и измерения) объемов жидкостей или для приготовления растворов заданного объема и определенной концентрации. На наружной стенке цилиндров и мензурок нанесены деления, указывающие объем в миллиметрах или в долях миллиметра (1 мл соответствует 1 см3, 1000 мл = 1 л, 1л соответствует 1 дм3, 1 дм3 = 1 х 103 м3). Кольцевая метка на горле колбы соответствует указанному на ней объему при 25°С. Чтобы отмерить нужный объем жидкости или определить имеющийся, жидкость наливают в измерительный сосуд до тех пор, пока край мениска не достигнет желаемого деления. Глаз и поверхность жидкости должны находиться в одной горизонтальной плоскости. Обычно измерение объема проводят по нижнему краю мениска, если жидкости, смачивающие стекло, прозрачные, и по верхнему – для непрозрачных. Вся мерная посуда должна быть тщательно вымыта хромовой смесью и промыта водой.
При пользовании градуированной мерной посудой важно знать так называемую цену деления, т. е. скольким миллилитрам или долям миллилитра жидкости соответствует каждое деление. Цена деления определяется следующим образом: на шкале находят нулевое деление, а затем, внимательно рассматривая шкалу, находят следующее деление, обозначенное цифрой. Например, объем от 0 до 1 составляет 1 мл; считают число мелких делений между нулем и первой значащей цифрой; непосредственно определяют цену одного деления. Для этого объем от нуля до значащей цифры делят на число делений.
Фарфоровая посуда более прочная, чем стеклянная. Обычно в почвенных исследованиях используются фарфоровые ступки с пестиками различных вместимостей, чашки для выпаривания разного диаметра, фарфоровые тигли, металлические бюксы с крышечками, металлические цилиндры, ложки и шпатели.
Эксикаторы применяют для высушивания материала и сохранения веществ, поглощающих влагу из воздуха. Стеклянная крышка эксикатора должна быть притерта к верхнему цилиндру. Притертые части эксикатора необходимо смазать вазелином или вакуумной смазкой. Внутрь на дно цилиндра помещают фарфоровую вкладку. В качестве поглотителей в эксикаторе используют безводный хлористый кальций, силикагель и фосфорный ангидрид – самый сильный поглотитель воды. Количественную часть эксикатора заполняют поглотителем примерно на треть высоты. Для поглощения воды можно использовать и серную кислоту, но лишь когда ее пары не взаимодействуют с материалом в эксикаторе.
Маркировка посуды. Каждая колба, пробирка или сосуд должны быть маркированы, т. е. на них должны быть обозначены название вещества, номер опыта, дата, время и другие нужные сведения. Чаще всего применяют временную маркировку восковыми карандашами (некоторые выдерживают высокую температуру, даже автоклавирование). Применяют также чернила разного цвета, фломастеры и стеклографы.
ПРИЛОЖЕНИЕ 3. Правила приготовления растворов
щелочей и кислот
Техника приготовления растворов щелочей и кислот отличается от техники приготовления растворов солей.
Правила приготовления растворов щелочей:
1. Кусочки щелочи нельзя брать голыми руками, их можно брать пинцетом, щипцами, а если нужно взять руками, то обязательно в резиновых перчатках. Гранулированную щелочь (в виде маленьких лепешек) насыпают фарфоровой ложечкой.
2. Отвешиваемую щелочь нельзя класть на бумагу; ее можно взвешивать только в стеклянной или фарфоровой посуде.
3. Щелочь нельзя растворять в толстостенных бутылях, так как при растворении происходит сильное разогревание, и бутыль может лопнуть.
Правила приготовления растворов кислот:
Расчеты при приготовлении кислот иные, чем для приготовлений солей и щелочей, так как концентрированные растворы кислот содержат воду. Нужное количество кислоты не отвешивают, а отмеряют мерным цилиндром.
1. Раствор нельзя приготовлять в толстостенной бутыли, так как при разбавлении кислот, особенно серной, происходит сильное разогревание. Растворы кислот готовят в колбах.
2. При разбавлении раствора нельзя лить воду в кислоту. В колбу наливается рассчитанное количество воды, а затем тонкой струей, постепенно, при перемешивании добавляют нужное количество кислоты. Кислоту и воду отмеряют мерными цилиндрами. Операцию проводят в очках.
3. После того как раствор остынет, его переливают в бутыль и наклеивают этикетку.
ПРИЛОЖЕНИЕ 4. Весы и взвешивание
В зависимости от точности, с которой проводится взвешивание, различают и группы весов. Одни предназначены для грубого взвешивания (точность до 1 г), другие – для более точного (до 1 мг). К первым относятся чашечные и циферблатные весы, ко вторым – технические весы. Самые точные – аналитические весы и электронные. Они позволяют определить массу с точностью до долей миллиграмма. Для каждых весов имеется свой разновес – набор гирь разной массы. На весах обычно указана предельная нагрузка, превышать которую не рекомендуется.
ПРИЛОЖЕНИЕ 5. Общие правила работы с весами
1. Одно из главных правил – установка весов в правильном положении по уровню или отвесу. Для регулировки положения используют винтовые подпорки весов. Необходимо исключить их вибрацию.
2. Весы запрещается передвигать и тем более переносить с места на место.
3. Нуль на весах обязательно проверяется перед работой.
4. Ни в коем случае нельзя насыпать вещества на чашку весов! Взвешивать вещества разрешается на листе бумаги (лучше кальки), на часовом стекле, в стакане, бюксе и т. п. Разумеется, масса вещества определяется как результат разницы двух взвешиваний – пустой тары и с веществом.
5. Запрещается на чашки ставить грязные и горячие предметы.
6. Вещества и тару всегда взвешивают при той температуре, при которой находятся сами весы. Поэтому, если взвешиваемый объект был взят из сушильного шкафа, печи или холодильника, его следует выдержать рядом с весами 5–10 мин, чтобы он приобрел температуру весов.
7. Если в одной работе требуется провести несколько взвешиваний, то следует пользоваться только одними и теми же весами (и одним разновесом). Перед началом работы следует проверить вертикальное положение стойки весов.
8. По окончании работы весы следует отключить и прибрать рабочее место.
ПРИЛОЖЕНИЕ 6. Фильтрование
Фильтрованием называют отделение от жидкости находящихся в ней частиц твердого вещества при помощи фильтрующей перегородки (фильтра). Жидкость, отделяемая при фильтровании, называется фильтратом.
Для фильтрования используют бумажные фильтры, которые готовят непосредственно перед началом работы. Бумажные фильтры бывают двух типов: обычные и складчатые. Обычный фильтр делается из квадратного листа фильтровальной бумаги размером, соответствующему иаметру воронки. Листок складывают вчетверо, и открытые концы полученного квадратика обрезают полукругом. Выпускаются уже готовые кружки обеззоленной фильтровальной бумаги. Вставленный в воронку фильтр должен плотно прилегать к ее внутренней поверхности. Это достигается смачиванием его дистиллированной водой или фильтруемым раствором. Уровень фильтрующейся жидкости должен быть на 1/5 ниже краев фильтра.
Для ускорения фильтрования применяют складчатые фильтры. Складчатый бумажный фильтр изготовляют следующим образом: сначала делают из фильтровальной бумаги простой гладкий фильтр, затем складывают его пополам и сгибают несколько раз в одну и другую сторону, далее каждую четверть фильтра снова сгибают пополам и так далее, пока не получится конусообразная гармошка. При фильтровании фильтр не должен выступать за края воронки или быть ниже её. Складчатые фильтры используют, когда для последующей работы нужен раствор. Если нужно получить осадок, то используют гладкие фильтры, с которых его легче собрать.
Зачастую фильтрование в колбу приостанавливается из-за того, что воздух не проходит в месте соприкосновения воронки с краем горла колбы. В этом случае надо несколько раз слегка приподнимать воронку или под воронку на колбу положить кусочек бумаги, свернутый в трубочку и загнутый посередине.
При проведении агрохимических анализов почвы нередко приходится встречаться с мутными вытяжками, плохо фильтрующимися. Чтобы получить всё же прозрачный фильтрат и в то же время добиться этого быстро, рекомендуется пользоваться складчатым фильтром из самой плотной бумаги и снизу его вставлять в воронку обычный (не складчатый) фильтр.
ПРИЛОЖЕНИЕ 7. Приготовление некоторых растворов,
Растворы
1. 0,1- нормальный раствор азотнокислого серебра: 17 г азотно-кислого серебра помещают в мерный цилиндр объёмом 1 л и растворяют дистиллированной водой. Хранить необходимо в посуде, обернутой светонепроницаемой фотооберточной бумагой, хранить в темном месте. Для приготовления 0,01 н раствора необходимо взять 1,7 г азотнокислого серебра и растворить в 1 л воды.
2. 1-нормальный раствор едкого натра: 40 г кристаллического едкого натра растворяют в 1 л дистиллированной воды. Для приготовления 0.1-нормального раствора берется навеска 4 г на 1 л дистиллированной воды.
3. Раствор хромовой смеси: на весах взвешивают 40 г предварительно растертого в порошок в фарфоровой ступке бихромата калия (К2Сr2О7), переносят в двухлитровую колбу и добавляют 1 л дистиллированной воды. После растворения бихромата калия в колбу осторожно небольшими порциями наливают 1 л концентрированной серной кислоты. Эта операция требует большой осторожности, так как при смешивании воды с серной кислотой происходит сильное разогревание. Серная кислота поглощает пары из воздуха, поэтому необходимо держать хромовую смесь тщательно закрытой.
4. 0,2-процентный раствор фенилантропиловой кислоты: 0,2 г фенилантропиловой кислоты растворяют в 100 мл 0,2 % раствора соды. Раствор готовят в два приёма. Навеску порошка фенилантропиловой кислоты помещают в фарфоровую чашку и после добавления нескольких миллилитров 0,2 % содового раствора размешивают стеклянной палочкой до сметанообразной консистенции. Затем постепенно наливают остальное количество содового раствора при постоянном помешивании.
5. 0,2-нормальный раствор соли Мора: 160 г кристаллической соли мора растворяют в 1960 мл дистиллированной воды. После растворения прибавляют 40 мл концентрированной серной кислоты. Полученный раствор фильтруют для очищения от механических примесей.
6. 0,1-нормальный раствор соляной кислоты: 8,2 мл соляной кислоты с удельным весом 1,19 разбавляют дистиллированной водой до 1л.
7. Раствор фенолфталеина: 0.1 г фенолфталеина растворяют в 100 мл 20 % этилового спирта.
8. Метиленовый синий. Для приготовления раствора красителя 6 г растворяют в 100 мл 96 % этанола. Навеску краски высыпают в склянку из темного стекла, заливают спиртом и ставят в термостат при температуре 37оС на 18-24 ч, периодически встряхивая раствор. За это время большая часть краски растворяется, на дне склянки остается небольшой осадок, свидетельствующий о насыщении раствора. На основе насыщенных растворов готовят водные растворы красок на дистиллированной воде, используя красители в соотношении: 1:100; 1:1000.
9. Метиловый красный для титрования слабых оснований и аммиака. Водный раствор метилового красного окрашен в оранжевый цвет. Несколько капель такого раствора окрашивают 50 – 100 мл воды в бледно-желтый цвет. Главное преимущество этого индикатора состоит в чрезвычайно резком переходе бледно-желтой окраски в фиолетово-красную от одной капли соляной кислоты (без промежуточных оттенков), которая почти обесцвечивается от одной капли 0,1 гидроксида натрия. Для приготовления раствора метилового красного берут навеску 0,02 г и растворяют ее в 100 мл горячей воды. По охлаждении раствора его фильтруют. На каждые 100 мл титруемого раствора берут 2–3 капли индикатора.
Таблица 1
ПРАКТИКУМ ПО ПОЧВОВЕДЕНИЮ
С ОСНОВАМИ РАСТЕНИЕВОДСТВА
Учебное пособие
Редактор З. А. Кунашева
Подписано в печать 03.04.2008 г. Формат 60х841/16.
Печать офсетная. Бумага офсетная №1.
Печ. л. 7. Тираж 200 экз. Заказ №__________
 ФГБОУ ВПО «Кемеровский государственный университет».
ФГБОУ ВПО «Кемеровский государственный университет».
650043, г.Кемерово, ул. Красная, 6.
Отпечатано в типографии издательства «Кузбассвузиздат».
650043, г. Кемерово, ул. Ермака, 7.
ПРАКТИКУМ ПО ПОЧВОВЕДЕНИЮ
Последнее изменение этой страницы: 2019-04-19; Просмотров: 653; Нарушение авторского права страницы