Изменение удельной энтропии и температуры при дросселировании
Дросселирование является необратимым процессом, так как часть энергии потока теряется на его завихрение перед диафрагмой и за ней и преобразуется в теплоту, которая при адиабатном течении передается рабочему телу. Если представить процесс, идущий в обратном направлении (например, в трубе, изображенной на рис. 34, изменить направление течения газа на обратное), то он по-прежнему будет сопровождаться падением давления при протекании газа через дроссель. Изменение удельной энтропии газа:
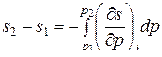 ,
,
его можно записать в виде:  ,
, 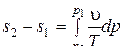 .
.
Такая запись является наиболее удобной, так как  . Из последнего уравнения следует, что всегда
. Из последнего уравнения следует, что всегда  .
.
Для определения изменения температуры в процессе адиабатного дросселирования необходимо знать значение производной 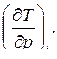
Из соотношения 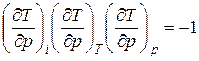 с учетом соотношений
с учетом соотношений 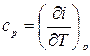 ,
, 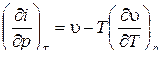 получим
получим  .
.
Величина 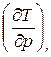 называется коэффициентом адиабатного дросселирования или дифференциальным дроссель-эффектом, его обозначают
называется коэффициентом адиабатного дросселирования или дифференциальным дроссель-эффектом, его обозначают  В общем случае величина
В общем случае величина  отлична от нуля.
отлична от нуля.
Явление изменения температуры газов и жидкостей при адиабатном дросселировании называется эффектом Джоуля – Томсона. Измеряя дифференциальный дроссель-эффект (весьма малую конечную разность температур 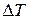 при такого же порядка разности давлений по обе стороны дросселя
при такого же порядка разности давлений по обе стороны дросселя 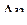 ), можно по результатам этих измерений найти величину
), можно по результатам этих измерений найти величину  , затем построить i, Т-диаграмму исследуемого вещества, определить удельную теплоемкость
, затем построить i, Т-диаграмму исследуемого вещества, определить удельную теплоемкость 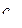 , удельный объем и т. д.
, удельный объем и т. д.
Изменение температуры газа (жидкости) при значительном перепаде давлений на дросселе называется интегральным дроссель-эффектом, он вычисляется из соотношения

где 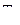 ,
,  – температуры дросселируемого вещества соответственно перед дросселем и за ним.
– температуры дросселируемого вещества соответственно перед дросселем и за ним.
Интегральный дроссель-эффект может достигать весьма большой величины. Например, при дросселировании водяного пара от давления  и температуры 450 °С до давления, равного
и температуры 450 °С до давления, равного 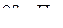 , температура пара уменьшается до 180 °С, т. е. на 270 °С.
, температура пара уменьшается до 180 °С, т. е. на 270 °С.
 Рис. 35. i, Т-диаграмма
Рис. 35. i, Т-диаграмма
| Определение величины интегрального адиабатного дроссель-эффекта удобно выполнять с помощью i, Т-диаграммы дросселируемого вещества (рис. 35). Если известно состояние газа перед дросселем, т. е. его давление  и температура и температура  , и известно давление за дросселем , и известно давление за дросселем 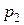 , то, нанеся точку 1 и найдя точку пересечения изоэнтальпы i = const с изобарой , то, нанеся точку 1 и найдя точку пересечения изоэнтальпы i = const с изобарой  , получим температуру за дросселем , получим температуру за дросселем 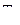 . .
|
Знак дроссель-эффекта
Проанализируем соотношение  . Поскольку всегда
. Поскольку всегда 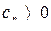 , то знак коэффициента
, то знак коэффициента  определяется знаком стоящей в числителе правой части уравнения.
определяется знаком стоящей в числителе правой части уравнения.
Очевидно, что если  , то
, то  , и тогда температура дросселируемого вещества возрастает.
, и тогда температура дросселируемого вещества возрастает.
Если 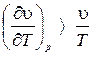 , то
, то 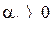 , и тогда температура дросселируемого вещества уменьшается.
, и тогда температура дросселируемого вещества уменьшается.
Если  , то
, то  , и тогда температура дросселируемого вещества не меняется. Для идеального газа характерно
, и тогда температура дросселируемого вещества не меняется. Для идеального газа характерно 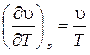 , тогда идеальный газ дросселируется без изменения температуры.
, тогда идеальный газ дросселируется без изменения температуры.
Таким образом, для газа, подчиняющегося уравнению Ван-дер-Ваальса, эффект Джоуля – Томсона не равен нулю.
Как показывает опыт, для одного и того же вещества 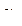 оказывается различным в зависимости от области состояния. Состояние газа (жидкости), в котором
оказывается различным в зависимости от области состояния. Состояние газа (жидкости), в котором  равен нулю, называется точкой инверсии эффекта Джоуля – Томсона. Геометрическое место точек инверсии на диаграмме состояния данного вещества называется кривой инверсии. Точки на кривой инверсии удовлетворяют уравнению
равен нулю, называется точкой инверсии эффекта Джоуля – Томсона. Геометрическое место точек инверсии на диаграмме состояния данного вещества называется кривой инверсии. Точки на кривой инверсии удовлетворяют уравнению  . Пользуясь этим условием, можно найти кривую инверсии с помощью уравнения состояния вещества.
. Пользуясь этим условием, можно найти кривую инверсии с помощью уравнения состояния вещества.
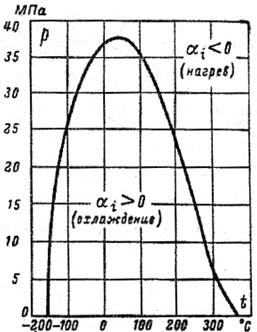 Рис. 36. Кривая инверсии азота
Рис. 36. Кривая инверсии азота
| В качестве примера на рис. 36 приведена кривая инверсии азота в p, t-диаграмме. Внутри области, ограниченной кривой инверсии  , т. е. газ при дросселировании охлаждается. Вне этой области , т. е. газ при дросселировании охлаждается. Вне этой области  , т. е. температура газа при дросселировании повышается. Аналогичный характер имеют кривые инверсии других веществ.
Процесс дросселирования используют для регулирования работы паросиловых установок, так как с увеличением дросселирования уменьшаются расход рабочего тела и располагаемая работа (теплоперепад). Действительно, если без дросселирования располагаемая работа равна , т. е. температура газа при дросселировании повышается. Аналогичный характер имеют кривые инверсии других веществ.
Процесс дросселирования используют для регулирования работы паросиловых установок, так как с увеличением дросселирования уменьшаются расход рабочего тела и располагаемая работа (теплоперепад). Действительно, если без дросселирования располагаемая работа равна  (рис. 37), то (рис. 37), то
|

