
|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |

|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |
Приклади характерних задач з розв’язанням. Задача 6. При температурі
|
|
|
Задача 1. Ідеальний газ знаходиться в адіабатно ізольованому об’ємі під постійним зовнішнім тиском Р0 . Безпосереднім розрахунком варіацій ентропії  ,
,  показати, що при рівновазі ентропія такої системи виявляється максимальною.
показати, що при рівновазі ентропія такої системи виявляється максимальною.
Розв ’ язання. З основного рівняння термодинаміки для PV - систем (3.13) у разі ідеального газу можна записати
 , (1)
, (1)
де  - кількість молів газу.
- кількість молів газу.
У нашому випадку  з першого начала маємо
з першого начала маємо
 ,
,
що дозволяє зобразити (1) у вигляді
 , (2)
, (2)
де  тиск га зу. Отже, бачимо, що рівновага
тиск га зу. Отже, бачимо, що рівновага  можлива лише при
можлива лише при 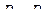 . Покажемо також, що в цьому разі ентропія максимальна.
. Покажемо також, що в цьому разі ентропія максимальна.
Інтегруючи (1) при зміні температури від  до
до  , а об’єму від
, а об’єму від 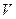 до
до  , одержимо
, одержимо
 . (3)
. (3)
Розкладуючи (3) за степенями  і
і 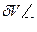 , матимемо
, матимемо

де
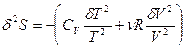 .
.
Оскільки значення  виявляється від ’ ємним при будь-яких
виявляється від ’ ємним при будь-яких  і
і  , ентропія цієї системи в стані рівноваги максимальна.
, ентропія цієї системи в стані рівноваги максимальна.
Задача 2. Як наслідок електронної емісії у порожнині всередині металу виникає електронний газ. Виходячи з мінімуму вільної енергії 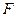 при рівновазі визначити густину електронного газу
при рівновазі визначити густину електронного газу  в цій порожнині, як функцію температури
в цій порожнині, як функцію температури  . Вважати, що ентропія електронного газу дорівнює ентропії одноатомного ідеального газу.
. Вважати, що ентропія електронного газу дорівнює ентропії одноатомного ідеального газу.
Розв’язання. При тепловій рівновазі кількість електронів, що випускається за одиницю часу, дорівнює їх кількості, що поглинається. Рівноважна густина електронів  визначається з загальної умови рівноваги
визначається з загальної умови рівноваги  , яка при сталих
, яка при сталих 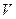 і
і  дає конкретну умову
дає конкретну умову
 ~
~  . (1)
. (1)
Розрахуємо вільну енергію  газу електронів. Внутрішня енергія
газу електронів. Внутрішня енергія 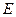 цього газу складається з середньої кінетичної енергії та суми робіт виходу
цього газу складається з середньої кінетичної енергії та суми робіт виходу  електрона з металу:
електрона з металу:
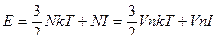 . (2)
. (2)
Ентропію  беремо за формулою (3.27):
беремо за формулою (3.27):
 , (3)
, (3)
де 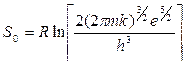 - ентропійна стала, яка розрахована методами статистичної фізики. Отже, маючи на увазі, що
- ентропійна стала, яка розрахована методами статистичної фізики. Отже, маючи на увазі, що  ,
,  , запишемо вільну енергію
, запишемо вільну енергію  у вигляді
у вигляді
 . (4)
. (4)
З умови (1) остаточно знаходимо рівноважну густину електронного газу в порожнині
 , (5)
, (5)
де  .
.
За допомогою (5) можна безпосередньо визначати силу струму насичення розжареного катода.
Задача 3. Показати, що відповідну до детермінанта стійкості  матрицю можна звести до діагональної форми.
матрицю можна звести до діагональної форми.
Розв ’ язання. Детермінант (8.16), враховуючи властивості якобіанів, можна записати як
 ,
,
що й вказує на діагональний вигляд відповідної матриці.
Задача 4. Довести вираз принципу Ле Шател ье-Брауна (8.18) безпосереднім розрахуванням на прикладі ідеального газу.
Розв ’ язання. Оскільки завжди  , нерівність (8.18) можна записати у в игляді
, нерівність (8.18) можна записати у в игляді
 (1)
(1)
або через якобіани:
 . (2)
. (2)
Ліву частину (2), користуючись властивістю якобіанів, перепишемо як
 . (3)
. (3)
Беручи до уваги результат задачі 1 розділу 3, праву частину (3) можна зобразити через відношення теплоємностей, тобто
 .
.
Оскільки для ідеального газу завжди  нерівність (8.18) можна вважати доведеною.
нерівність (8.18) можна вважати доведеною.
Задача 5. Визначити константу хімічної рівноваги  складної реакції
складної реакції

через константи  і
і 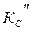 простих реакцій відповідно
простих реакцій відповідно
 ,
,
 .
.
Розв ’ язання. Згідно з законом діючих мас (8.24) константи  ,
,  ,
, 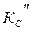 можна записати через концентрації відповідних речовин:
можна записати через концентрації відповідних речовин:
 , (1)
, (1)
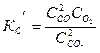 , (2)
, (2)
 . (3)
. (3)
З (1) – (3) знаходимо шуканий зв’язок:
 .
.
Задача 6. При температурі  реакція
реакція

досягла рівноваги. Відомі початкові кількості молів йоду та водню:  моль,
моль, 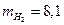 моль. Визначити кількість молів речовини
моль. Визначити кількість молів речовини  при рівновазі. Константа рівноваги
при рівновазі. Константа рівноваги  при
при  відома:
відома:  .
.
Розв’язання. Нехай  моль водню з його кількості
моль водню з його кількості  моль реагує з тією ж кількістю молів йоду (з загального числа
моль реагує з тією ж кількістю молів йоду (з загального числа  моль) і при цьому утворюється
моль) і при цьому утворюється  моль речовини
моль речовини  . Згідно з законом діючих мас (8.24) рівноважні концентрації
. Згідно з законом діючих мас (8.24) рівноважні концентрації 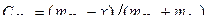 ,
,  ,
,  задовольнятимуть рівності
задовольнятимуть рівності
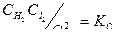 . (1)
. (1)
Підставляючи в (1) відповідні концентрації та дані умови, одержуємо квадратне рівняння відносно  :
:
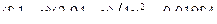 ,
,
звідки  . Отже, рівноважна кількість молів речовини
. Отже, рівноважна кількість молів речовини  дорівнює
дорівнює 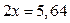 моль.
моль.
Задача 7. Знайти число термодинамічних ступенів вільності системи, яка складається з розчину:
1)  і
і  у воді в присутності кристалів обох солей і пари;
у воді в присутності кристалів обох солей і пари;
2) цих солей у присутності льоду, кристалів обох солей і пари;
Последнее изменение этой страницы: 2019-05-08; Просмотров: 209; Нарушение авторского права страницы