
|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |

|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |
Лекарственные средства, производные аминоспиртов
Эфедрина гидрохлорид Ephedrini hydrohcloridum Ephedrine Hydrochloride *
CH – CH – NH • HCl | | | OH CH3 CH3 l-эритро-2-метиламино-1-фенилпропанола-1 гидрохлорид Свойства
Подлинность 1. 2. 3. 4. R3N • HCl + AgNO3 → AgCl ↓ + R3N • HNO3 5.
2 CH – CH – NH • HCl + CuSO4 + NaOH → Na2SO4 + 2 H2O + | | | OH CH3 CH3
+ CH – CH – NH Cu | | | O- CH3 CH3 2 6.
K3[Fe(CN)6] CH – CH – NH → C = O↑ + CH3 – CH2 – NH | | | | | OH CH3 CH3 H CH3
Количественное определение По ГФ Метод, вариант Метод основан на Методика:
CH3 – C = O
CH – CH – NH • HCl + HClO4 + O → | | | / OH CH3 CH3 CH3 – C = O Моль экв.
+ → CH – CH – NH2 ClO4- + CH3 – C = O + CH3 – C = O | | | | | OH CH3 CH3 Cl OH
fэкв. = M1/z = Экспресс-анализ 1. Метод, вариант Метод основан на Методика:
R3N • HCl + NaOH → NaCl + R3N + H2O моль экв. fэкв. = M1/z = Метод Метод основан на Методика:
R3N • HCl + AgNO3 → AgCl↓ + R3N •HNO3 моль экв. fэкв. = M1/z = Применение Хранение Список
Лекарственные средства, производные парааминобензойной кислоты
R R | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 11. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
3.
NH2 NH2
 Br Br
+ 2 Br2 → ↓ + 2 HBr
R R Br Br
+ 2 Br2 → ↓ + 2 HBr
R R
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5. Температура плавления | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
6.
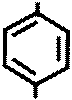 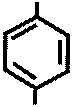 NH2 NH2
+ NaOH → + C2H5OH
COOC2H5 COONa
C2H5OH + 4 I2 + 6 NaOH → CHI3↓ + HCOONa + 5 NaI + 5 H2O NH2 NH2
+ NaOH → + C2H5OH
COOC2H5 COONa
C2H5OH + 4 I2 + 6 NaOH → CHI3↓ + HCOONa + 5 NaI + 5 H2O
| 7. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| R3N • HCl + AgNO3 → AgCl↓ + R3N •HNO3 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 8. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| R3N • HCl + NaOH → NaCl + + R3N ↓ + H2O | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 9. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Количественное определение | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1. По ГФ – метод | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Метод основан на | Метод основан на | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Методика: | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Индикаторы: | индикатор – | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 NH2 N≡ N
+ NaNO2 + 2 HCl → Cl + NaCl + 2 H2O
R R NH2 N≡ N
+ NaNO2 + 2 HCl → Cl + NaCl + 2 H2O
R R
| 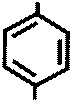 NH- C4H9
+ NaNO2 + 2 HCl →
R NH- C4H9
+ NaNO2 + 2 HCl →
R
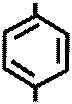 O=N – N – C4O9
→
+ NaCl + 2 H2O
R O=N – N – C4O9
→
+ NaCl + 2 H2O
R
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2 NaNO2 + 2 KI + 4 HCl → I2 + 2 NO↑ + + 2 KCl + 2 NaCl + 2 H2O | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| fэкв. = M1/z = | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4. Метод | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Вариант способ | Вариант, способ (эксаресс) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Метод основан на | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Методика: | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| R3N • HCl + NaOH → NaCl + R3N + H2O моль экв. fэкв. = M1/z = | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5. Метод | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Метод основан на | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Методика: | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| R3N • HCl + AgNO3 → AgCl↓ + R3N •HNO3 моль экв. fэкв. = M1/z = | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 6. Метод | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Применение | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Хранение | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Список | Список | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Лекарственные средства, производные сульфаниламидов
Общая характеристика сульфаниламидных препаратов
САП –
 |
H2N SO3H H2N SO2 – NH2
сульфаниловая кислота амид сульфаниловой кислоты
Общие формулы САП и их натриевых солей можно представить следующим образом:
 R΄ R R΄ R
R΄ R R΄ R
H - N SO2 – N - H H N SO2 – N - Na
САП – кислота САП – соль
САП классифицируют по характеру радикалов R и R΄.
Большинство САП являются первичными ароматическими аминами (R΄ = Н).
Водород в амидной группе может быть замещен на радикал R (алифатический или гетероциклический).
Свойства
САП-соли –
САП- кислоты –
Химические свойства обусловлены наличием следующих функциональных групп:
1. Первичной ароматической амингруппой –
2. Сульфамидной группой –
O O
 || ||
|| ||
H2 N S - N - R ↔ H2N S= N - R
|| | |
O H OH
аци-форма
3. Ароматическое ядро –
Подлинность
Реакции на первичную ароматическую аминогруппу
Если аминогруппа закрыта – то
А)
 NH2 N≡ N
NH2 N≡ N
+ NaNO2 + 2 HCl → Cl + NaCl + 2 H2O
SO2 –NH - R SO2 –NH - R
NaO
N≡ N N=N
OH
NaOH
Cl + →
SO2 –NH - R SO2 –NH - R
Б)
 NH2 N=CHR
NH2 N=CHR
+ R – C = O → + H2O
|
H
SO2 –NH - R SO2 –NH –R
В)
Реакции на сульфамидную группу
А)
Если САП- кислота – то
 NH2 NH2
NH2 NH2
+ NaOH → + CuSO4 →
- H2O
O = S–NH - R O = S = N –R
|| |
O ONa
 NH2 NH2
NH2 NH2
↓ Это реакция отличия!!!!!!!!!!!

 O = S=N - R R –N=S = O
O = S=N - R R –N=S = O
| |
O – Cu – O
Б)
САП + HNO3 → SO42-
SO42- + BaCl2 → BaSO4 ↓ + 2 Cl –
Реакции на ароматическое кольцо
А)
Если аминогруппа закрыта –
 NH2 NH2
NH2 NH2
Br Br
+ 2 Br2 → ↓ + 2 HBr
SO2 –NH - R SO2 –NH – R
4.
5.
6. САП- соли –
Количественное определение
1. По ГФ – метод
Метод основан на
Методика: Т
Если аминогруппа закрыта – то
 NH2 N≡ N
NH2 N≡ N
+ NaNO2 + 2 HCl → Cl + NaCl + 2 H2O
SO2 –NH - R SO2 –NH - R
fэкв. = M1/z =
Конец титрования определяют с помощью:
1. Внутренних индикаторов
-
-
-
2. Внешнего индикатора –
2 NaNO2 + 2 KI + 4 HCl → I2 + 2 NO↑ + + 2 KCl + 2 NaCl + 2 H2O
3. Потенциометрически
2. Методы галоидирования:
- Метод боматометрии, обратное титрование
- Метод йодометрии, обратное титрование
- Метод йодхлорметрии, обратное титрование
Методы основаны на
Если аминогруппа закрыта –
KBrO3 + 5 KBr + 3 H2SO4 → 3 Br2 + + 3 K2SO4 + 3 H2O
NH2 NH2
 Br Br
Br Br
+ 2 Br2 → ↓ + 2 HBr
SO2 –NH - R SO2 –NH - R
моль ∙ = экв.
Br2 + 2 KI → I2 + 2 KBr
I2 + 2 Na2S2O3 → 2 NaI + Na2S4O6
fэкв. = M1/z =
3. Метод нейтрализации
А) Для САП – кислот
Метод, способ
Метод основан на
Титруют

 NH2 NH2
NH2 NH2
+ NaOH →
- H2O
O = S–NH - R O = S = N –R
|| |
O ONa
fэкв. = M1/z =
Б) Для САП – солей
Метод, способ
Метод основан на
Титруют
NH2 NH2

+ HCl → + NaCl
O = S–N - R O = S - NH –R
|| | ||
O Na O
fэкв. = 1 M1/z = Mm
4. Метод
Метод основан на
.
Титруют
 NH2 NH2
NH2 NH2
+ Na2B4O7
+ 5 H2O
+ AgNO3 →
- 2NaNO3
- 4 H3BO3
O = S–NH - R O = S = N –R
|| |
O OAg
2 AgNO3 + K2CrO4 = Ag2CrO4↓ + 2 KNO3
fэкв. = M1/z =
5. Метод
6. Метод
7. Метод (для растворов САП – солей с массовой долей 5% и более)
Применение
.
Хранение
Список
| Стрептоцид Сульфаниламид | Сульфацетамид натрия Сульфацил-натрий | Норсульфазол Сульфатиазол |
| Streptocidum Sulfanilamidum Sulfanilamide * | Sulfacetamidum Natricum Sulfacylum-natrium Sulfacylum solubile Albucid-natrium Sulfacetamide Sodium * | Norsulfazolum Sulfathiazolum Sulfathiazole * |
NH2
 SO2 –NH2
SO2 –NH2
|  NH2
• H2O
SO2 – N – C – CH3
| ||
Na O NH2
• H2O
SO2 – N – C – CH3
| ||
Na O
| NH2
 N
SO2 –NH -
S
N
SO2 –NH -
S
|
| п- аминобензозсульфамид | п-аимнобензолсульфацетамид натрий | 2-(п-аминобензолсульфамидо)-тиазол |
| Свойства | ||
| Подлинность | ||
| 1. (ГФ) | ||
| 2. | ||
| 3. | ||
| 4. (ГФ, отличие) | ||
| __________ | ||
| 5. (ГФ, отличие, экспресс) | ||
| ________ | ||
| 6. (ГФ) | ||
| 7. (ГФ) | ||
| 8. - - - - | ||
| Количественное определение | ||
| 1. Метод (ГФ) | ||
| Индикатор – | Индикатор – | Индикатор – |
| 2. Метод | ||
| 3. ………………………………. (на основе реакции образования азокрасителя) | ||
| 4. Метод | ||
| 5. (для растворов с массовой долей 5% и бале) | ||
| Применение | ||
| - - | ||
| Хранение | ||
| Список | ||
Последнее изменение этой страницы: 2017-04-12; Просмотров: 298; Нарушение авторского права страницы