
|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |

|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |
Лекарственные средства, производные пиридина и пиперидина.
Классификация лекарственных препаратов. Производные никотиновой кислоты ( пиридин-3-карбоновой кислоты)
· никотиновая кислота · никотинамид · диэтиламид никотиновой кислоты · и т.д. 2. Производные изоникотиновой кислоты
· изониазид · фтивазид 3. Производные пиридинметанола
· оксиметилпиридиновые витамины · пиридоксина гидрохлорид
Никотиновая кислота Acidum nicotinicum Nicotinic Acid*
N (Витамин РР) пиридин-3-карбоновая кислота Свойства
Подлинность 1.
→ ↑ + CO2 ↑ N N 2.
COOH COO- 2 + CuSO4 → Cu2+↓ + H2SO4 N N 2 3.
COOH COO- 2 + CuSO4 + NH4SCN → Cu(SCN)2 + (NH4)2SO4 N N 2 4.
Количественное определение Метод, способ Метод основан на Методика:
+ NaOH → + H2O N N моль 1 экв
fэкв = M1/z=
Применение
Форма выпуска:
Побочное действие:
Хранение
Список Оксиметилпиридиновые витамины Пиродоксина гидрохлорид Pyridoxini hydrochloridum Vitaminum B6 Pirodoxine Hydrochloride* CH2 – OH |
• HCl / H3C N 2-метил-3-окси-4, 5- ди-(оксиметил)-пиридина гидрохлорид
Свойства
.
Подлинность
1. 2. 3.
4.
5. CH2OH CH2OH
HO – – CH2OH HO – – CH2OH + Сl – N = =O → + HCl / / \ H3C N Cl H3C N N = =O
6. (BiI3 в KI) -
7. (SiO2•12WO3•2H20 - реактив Бертрана) - 8. (H3PO4•12WO3•2H2O - реактив Шейблера) – 9. R3N • HCI + AgNO3 → AgCI ↓ + R3N • HNO3
Количественное определение Метод, (ГФ) Метод основан на Методика:
CH2OH CH2OH | CH3 – C = O |
• HCl + HClO4 + O → ClO4-+ / / / + H3C N CH3 – C = O H3C N моль экв. | H fэкв = M1/z= + CH3 – C = O + CH3 – C = O | | Cl OH Экспресс-анализ 1. Метод, вариант Метод основан на Методика:
R3N • HCl + NaOH → NaCl + R3N + H2O моль экв.
fэкв. = M1/z =
Метод Метод основан на Методика:
R3N • HCl + AgNO3 → AgCl↓ + R3N •HNO3 моль экв.
fэкв. = M1/z = Применение
Форма выпуска:
Хранение
Лекарственные средства, производные пиперидина Промедол Promedolum Trimeperidini hydrochloridum Trimeperidine hydrochloride * O || H5C6 O – C – C2H5 \/
• HCl \ N CH3 | CH3 1, 2, 5-триметил-4-пропионилокси-4-фенилпиперидина гидрохлорид
Свойства
Подлинность
1. 2. 3. 4. R3N • HCI + AgNO3 → R3N • HNO3 + AgCl↓ 5. А) Б) В)
6.
Количественное определение Метод, (ГФ) Метод основан Методика:
|| || H5С6 O – C - C2H5 H5C6 O – C - C2H5 \/ CH3 – C = O \/
• HCl +HClO4 + O → ClO4- + / + N –CH3 CH3 – C = O N –CH3 моль экв. | H + CH3 – C = O + CH3 – C = O | | Cl OH fэкв = M1/z=
2. Метод Метод основан на Методика:
R3N • HCl + AgNO3 → AgCl↓ + R3N •HNO3 моль экв. fэкв. = M1/z = NB!
Применение Хранение Список
Лекарственные средства, производные пиримидина Лекарственные средства, производные барбитуровой кислоты. Общая характеристика Из синтетических соединений пиримидина в качестве ЛС широко применяются производные барбитуровой кислоты (гидроксипроизводного пиримидина), обладающие снотворным, противоэпилептическим и наркотическим действием. Барбитуровая кислота может существовать в нескольких таутомерных формах (характерна лактим-лактамная и кето-енольная таутомерия. 1. Кетонный енольный Фрагмент фрагмент ↔ \\ O Барбитуровая кислота 2. Лактим-лактамная таутомерия
   
  
 
↨ ↨
    
 фрагмент фрагмент фрагмент фрагмент фрагмент фрагмент
Для барбитуровой кислоты характерны кислотные свойства за счет подвижного атома водорода в 5-ом положении, а также в 1-ом и в 3-ем положениях. Производные барбитуровой кислоты содержат заместители при атоме углерода в 5-ом положении. Для них кето-енольная таутомерия невозможна, т.к. отсутствуют атомы водорода при атоме углерода в 5-ом положении.
 
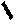
 
В медицине широко применяются барбитураты-кислоты (барбитал, фенобарбитал, бензонал и др.) и барбитураты-соли (барбитал-натрий, этаминал-натрий, гексенат, тиопентал-натрий и др.). Физические свойства
Барбитураты-кислоты –
Барбитураты-соли –
Подлинность 1.
to \ // + 5 NaOH → 2 NH3↑ + 2 Na2CO3 + CH – C / \ R′ ONa Na2CO3 + 2 HCl → CO2↑ + 2 NaCl + H2O R O R O \ // \ // CH – C + HCl → NaCl + CH – C / \ / \ R′ ONa R′ OH 2. А)
↔ + NaOH →
CaCl2 → + Co(NO3)2 →
Б
↔ + NaOH →
K2CO3 + KHCO3 → + CuSO4 →
→ В)
« + Na2CO3®
+ AgNO3 → + AgNO3 → ↓ 3.
toпл. 4. 5. 6. 7. )
Количественное определение Метод, (Для барбитуратов-кислот) Метод основан на Методика:
R R ДМФА O = ↔ + NaOH →
моль экв. → + H2O fэкв. = M1/z = 2. Метод, вариант Способ (Для барбитуратов-кислот) Метод основан на Методика:
↔ +NaOH → моль экв. → + H2O fэкв. = 1 M1/z = Mm Метод, способ (Для барбитуратов-солей) Метод основан на
+ HOH → ↓ + NaOH моль моль NaOH + HCl → NaCl + H2O моль экв. fэкв. = M1/z = 4. Метод, Метод основан на А) без индикатора –
+ Na2CO3 + АgNO3 ® - 2 NaNO3 - CO2 - H2O
моль экв.
 + Na2CO3 + Na2CO3
+ AgNO3 → ↓ - 2 NaNO3 - CO2 - H2O
fэкв. = M1/z =
+ 2 АgNO3 ® ↓ моль экв. 2 AgNO3 + K2CrO4 → Ag2CrO4↓ + 2 KNO3 fэкв. = M1/z =
4. . 5. 6. БАРБИТУРАТЫ – КИСЛОТЫ
БАРБИТУРАТЫ – СОЛИ |
Последнее изменение этой страницы: 2017-04-12; Просмотров: 617; Нарушение авторского права страницы