
|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |

|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |
МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ. УКРАЇНСЬКИЙ ДЕРЖАВНИЙ ХІМІКО-ТЕХНОЛОГІЧНИЙ УНІВЕРСИТЕТСтр 1 из 10Следующая ⇒
МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ УКРАЇНСЬКИЙ ДЕРЖАВНИЙ ХІМІКО-ТЕХНОЛОГІЧНИЙ УНІВЕРСИТЕТ
МЕТОДИЧНІ ВКАЗІВКИ до практичних занять та самостійної роботи студентів спеціальностей ТГ, ТОВ, П, ПП, ХТП, ДП з курсу "Фізична хімія" за кредитно-модульною системою. Ч астина I, тетраме c тр 7 - й
Дніпропетровськ УДХТУ 200 8 МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ УКРАЇНСЬКИЙ ДЕРЖАВНИЙ ХІМІКО-ТЕХНОЛОГІЧНИЙ УНІВЕРСИТЕТ
МЕТОДИЧНІ ВКАЗІВКИ до практичних занять та самостійної роботи студентів спеціальностей ТГ, ТОВ, П, ПП, ХТП, ДП з курсу "Фізична хімія" за кредитно-модульною системою. Ч астина I, тетрамеcтр 7 - й
Затверджено на засіданні кафедри фізичної хімії. Протокол № 4 від 3.12.2007 р.
Дніпропетровськ УДХТУ 200 8 Методичні вказівки до практичних занять та самостійної роботи студентів спеціальностей ТГ, ТОВ, П, ПП, ХТП, ДП з курсу "Фізична хімія" за кредитно-модульною системою. Частина I, тетрамеcтр 7-й / Укл. В.П. Купрін, В.В.Герасимов, Д.В. Гиренко, Д.А. Сухомлин, Д.А. Головко, І.Л. Плаксієнко, Т.В. Лук’яненко, О.А. Бєляновська – Дніпропетровськ: УДХТУ, 2008. – 50с.
Укладачі: В.П. Купрін, доктор хім. наук В.В. Герасимов, кандидат хім. наук Д.В. Гиренко, кандидат хім. наук Д.А. Сухомлин, кандидат хім. наук Д.А. Головко, кандидат хім. наук І.Л. Плаксієнко, кандидат хім. наук Т.В. Лук’яненко, кандидат хім. наук О.А. Бєляновська, кандидат техн. наук
Відповідальний за випуск Ф.Й. Данилов, доктор хім. наук
Навчальне видання
Методичні вказівки до практичних занять та самостійної роботи студентів спеціальностей ТГ, ТОВ, П, ПП, ХТП, ДП з курсу «Фізична хімія» за кредитно-модульною системою. Частина I, тетрамеcтр 7-й
Укладачі: Купрін Віталій Павлович ГЕРАСИМОВ Валерій Вікторович Гиренко Дмитро Вадимович СУХОМЛИН Дмитро Андрійович Головко Дмитро Аркадійович Плаксієнко Ірина Леонідівна Лук’яненко Тетяна Вікторівна Бєляновська Олена Анатоліївна
Зміст
ВСТУП 1.1. Предмет і мета дисципліни "Фізична хімія" Предмет навчальної дисципліни “Фізична хімія” полягає у встановленні взаємозв'язку хімічних і фізичних явищ в різних системах. Мета навчальної дисципліни – надати майбутнім інженерам-технологам теоретичні знання основних закономірностей, які визначають напрямок хімічних процесів, їх швидкість, вплив різних чинників на хімічну і фазову рівновагу, умови отримання максимального виходу необхідного продукту; сформувати навички застосування фізико-хімічних методів дослідження для вирішення основних задач хімічної технології. 1.2. Розподіл навчальних годин протягом викладання курсу "Фізична хімія"
II . Фазова рівновага | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Агрегатний стан речовини. Агрегатний стан речовини. Гази. Реальні гази. Міжмолекулярні сили. Вклад орієнтаційних, індукційних та дисперсних сил в повну енергію взаємодії. Потенціал Ленарда-Джонса. Критичні явища. Рідини. Близький та дальній порядок. Рідкі кристали. Тверде тіло. Кристалічний та аморфний стан. Електричні властивості молекул. Дипольний момент. Поляризованість орієнтаційна, електронна, деформаційна, повна. Рівняння Ланжевена-Дебая. Визначення поляризованості і дипольного моменту. Залежність поляризованості від частоти. Рівняння Клаузіуса-Мосотті. Молекулярна рефракція. Рівняння Лорентца-Лоренса. Адитивність рефракції. Використання рефрактометричного методу. (3год.) | 2 СР | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 10. Фазові переходи Фазова рівновага. Умови термодинамічної рівноваги у багатофазних багатокомпонентних системах. Правило фаз Гіббса. Фазова рівновага в однокомпонентних системах. Діаграми стану. Рівняння Клапейрона-Клаузіуса. Фазові переходи 1-го і 2-го роду. Монотропні та енантіотропні фазові переходи. | 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 11. Двокомпонентні системи Термічний аналіз. Діаграми стану двохкомпонентних систем (повна та часткова розчинність компонентів у рідкому і твердому вигляді, з евтектикою, з утворенням стійкого і нестійкого хімічного сполучення) Експериментальна побудова діаграм плавкості. Правило важеля. Фізико-хімічний аналіз. | 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 12. Трикомпонентні системи Трикомпонентні системи. Способи графічного зображення складу. Найпростіші типи діаграм стану. Діаграми розчинності у воді двох солей. | 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
1.5. Індивідуальні та домашні завдання для самостійної роботи студентів
| Вид та тема завдання | Год. | Діяльність студентів |
| Домашні завдання для самостійного опрацювання окремих розділів програми | ||
| Розділ I. Тема 1. Питання: Теоретичні і експериментальні методи фізичної хімії. Тема 2. Питання: Квантова теорія теплоємності газоподібних і кристалічних речовин. Тема 6. Питання: Розрахунки коефіцієнтів рівняння Тьомкіна – Шварцмана . Тема 8. Питання: Термодинамічні функції газів, обумовлені обертальними, коливальними та іншими видами руху молекул. Розрахунки теплоємності, ентропії, внутрішньої енергії, ентальпії та термодинамічних потенціалів на основі спектроскопічних характеристик речовини. Розділ ІІ. Тема 9. Питання: Молекулярна рефракція. Рівняння Лорентца-Лоренса. Адитивність рефракції. Використання рефрактометричного методу. | 1,5 1,5 1,5 4,5 5 | За допомогою спеціальної і учбової літератури самостійно опрацювати теми та окремі питання, які не викладаються на лекціях. |
| Індивідуальне розрахунково-графічне домашнє завдання: | ||
| 1. Розрахунки виходу продукту при заданих параметрах в ідеальних і реальних умовах технологічного процесу. | 18 | Розрахувати можливість хімічної реакції в реальних умовах технологічного процесу. Встановити і графічно виразити вплив температури, тиску, інертних домішок на вихід продукту. Обґрунтувати вибір оптимальних параметрів процесу. |
| Домашні розрахункові завдання: | ||
| 1. Визначення теплового ефекту процесу при будь-якій заданій температурі. | 6 | Обчислити тепловий ефект хімічної реакції або фазового перетворення при стандартних умовах і будь-якій температурі на основі довідкових даних про залежність теплоємності від температури. |
| 2. Фазові рівноваги в однокомпонентних системах. | 6 | Визначити середні теплоти випаровування, возгонки, плавлення речовини при заданому тиску, розрахувати термодинамічні параметри для процесу возгонки, числа термодинамічних ступенів свободи в різних точках діаграми стану. |
Завдання 1 (варіант А)
Розрахуйте стандартний тепловий ефект хімічної реакції та тепловий ефект при заданій температурі (таблиця 2.1). Встановіть, як відрізняється теплові ефекти при сталому тиску та об’єму. Термодинамічні данні для рішення задачі взяти в довіднику. Всі компоненти реакції знаходяться в газовому стані.
Таблиця 2.1
| № | Реакція | Т, К | № | Реакція | Т, К |
| 1 | 2CO + O2 = 2CO2 | 800 | 16 | СН4 + Н2О = СО + 3Н2 | 500 |
| 2 | H2 + Cl2 = 2HCl | 1000 | 17 | С2Н5Cl = C2H4 + HCl | 600 |
| 3 | N2 + O2 = 2NO | 600 | 18 | PCl5 = PCl3 + Cl2 | 700 |
| 4 | 2SO2 + Cl2 = 2SO2Cl2 | 700 | 19 | (СН2)3 = СН3СН=СН2 | 800 |
| 5 | CO + 1/2O2 + CO2 | 900 | 20 | CH3CHO = CH4 + CO | 900 |
| 6 | 2O3 = 3O2 | 1000 | 21 | 4HCl + O2 = 2H2O + 2Cl2 | 1000 |
| 7 | 2NO2 = N2O4 | 800 | 22 | С2Н5ОН = C2H4 + H2O | 1200 |
| 8 | 2H2 + S2(Г) = 2H2S(Г) | 1200 | 23 | H2 + C2H4 = C2H6 | 600 |
| 9 | 2Cl2 + 2H2O = 4HCl + O2 | 1300 | 24 | CH4 + Cl2 = CH3Cl + HCl | 500 |
| 10 | 2С2Н5ОН = (С2Н5)2О +Н2О | 1000 | 25 | 2SO2 + O2 = 2SO3 | 700 |
| 11 | NO + ½ О2 = NO2 | 1200 | 26 | HI + CH3I = CH4 + I2 | 1100 |
| 12 | Cl2 + H2 = 2HCl | 600 | 27 | 2NO + Cl2 = 2NOCl | 500 |
| 13 | СО + Сl2 = СОСl2 | 500 | 28 | 2NO = N2 + O2 | 900 |
| 14 | H2 + F2 = 2HF | 700 | 29 | 2C6H5CH3 = м-C6H4(CH3)2 + C6H6 | 800 |
| 15 | CO + 2H2 = CH3OH | 1100 | 30 | 
| 500 |
Завдання 1 (варіант Б).
1. Обчисліть зміну ентропії при нагріванні (охолодженні) 4 кг речовини А (таблиця 2.2) від t1 до t2, якщо відомі температури його плавлення та кипіння, теплоємності в рідкому, твердому та газоподібному стані, теплоти плавлення й випаровування.
2. Обчисліть зміну ентропії, енергії Гіббса, енергії Гельмгольца, внутрішньої енергії, роботи розширення, якщо 10 кмоль речовини, пари котрого підпорядковуються законам ідеальних газів, переходить при нормальній температурі кипіння з рідкого в газоподібний стан.
Таблиця 2.2
| № | Речовина | t1°С | t2°С | tпл°С | tкип°С | ΔНпл, кДж моль | ΔНвип, кДж моль | Теплоємність, кДж/кг·К | ||
| Сртв | Срж | Срг | ||||||||
| 1 | Бензол | 200 | -10 | 5,5 | 80,1 | 9,95 | 30,76 | 1,468 | 1,734 | 1,422 |
| 2 | Толуол | -100 | 120 | -95 | 110,6 | 6,62 | 37,99 | 0,921 | 1,69 | 1,281 |
| 3 | Бензиловий спирт | -15,3 | 204,7 | -15,3 | 204,7 | 8,97 | 50,48 | – | 2,014 | – |
| 4 | Плюмбум(II) хлорид | 960 | 400 | 495 | 953 | 23,85 | 128,9 | 0,277 | 0,375 | 0,199 |
| 5 | 1,4-діоксан | 101,3 | 11,8 | 11,8 | 101,3 | 12,85 | 35,77 | – | 1,735 | – |
| 6 | Етилацетат | -83,6 | 77,2 | -83,6 | 77,2 | 10,48 | 32,26 | – | 1,928 | – |
| 7 | Діетиловий етер | -120 | 45 | -116,3 | 34,6 | 7,537 | 26,6 | 1,256 | 2,321 | 1,934 |
| 8 | Бутанол | 117,5 | -79,9 | -79,9 | 117,5 | 9,28 | 52,3 | – | 2,435 | – |
| 9 | Піридин | -40 | 115,3 | -41,8 | 115,3 | – | 35,54 | – | 1,714 | – |
| 10 | Бром | -20 | 79 | -7,1 | 59,2 | 10,551 | 20,733 | 0,674 | 0,461 | 0,225 |
| 11 | Вода | -20 | 100 | 0 | 100 | 6,009 | 40,66 | 0,570 | 4,187 | 1,919 |
| 12 | Ртуть | -40 | 360 | -38,89 | 356,66 | 2,30 | 59,23 | 0,141 | 0,139 | 0,104 |
| 13 | Трихлор-метан | 65 | -63,5 | -63,5 | 61,3 | 9,211 | 31,42 | – | 0,963 | 0,545 |
| 14 | Етанол | -15,6 | 205 | -15,6 | 197,3 | 5,02 | 42,30 | – | 2,453 | 1,399 |
| 15 | Ацетон | -100 | 60 | -95,35 | 56,24 | 5,69 | 29,67 | 2,261 | 2,177 | 1,129 |
| 16 | н-Пентан | 36,074 | -129,72 | -129,72 | 36,074 | 8,42 | 26,43 | – | 1,666 | – |
| 17 | Циклогексан | 6,554 | 81,40 | 6,554 | 81,40 | 2,63 | 33,03 | – | 1,810 | – |
| 18 | Мурашина кислота | 7 | 110 | 8,2 | 100,7 | 12,687 | 23,112 | 1,620 | 2,135 | 1,058 |
| 19 | о-Ксилол | -25,175 | 144,41 | -25,175 | 144,41 | 11,282 | 367,3 | – | 1,717 | 1,891 |
| 20 | Фосген | -118 | 15 | -118 | 8,3 | 5,74 | 24,39 | – | 1,024 | 0,988 |
| 21 | Хлор | -33,8 | 100 | -100,7 | -33,8 | 6,406 | 20,41 | – | – | 0,471 |
| 22 | Калій | -10 | 63,55 | 63,55 | 791 | 2,38 | 79,2 | 0,754 | – | – |
| 23 | Аміак | 25 | -77,7 | -77,7 | -33,6 | 5,655 | 23,33 | – | 4,742 | 2,065 |
| 24 | Натрій | 886 | 910 | 97,9 | 886 | 2,64 | 90,1 | 1,225 | – | 0,904 |
| 25 | Фосфор трихлорид | -90 | 100 | -93,7 | 75,3 | – | 30,5 | – | 0,957 | 0,540 |
| 26 | Етилен-гліколь | 200 | -12,6 | -12,6 | 197,85 | 11,23 | 65,58 | – | 2,433 | 1,503 |
| 27 | Пропанол | 110 | -126,2 | -126,2 | 97,2 | 5,19 | 48,12 | – | 2,388 | 1,789 |
| 28 | Тетрахлор-метан | 80 | -22,9 | -22,9 | 76,8 | 2,512 | 30,021 | – | 0,846 | 0,543 |
| 29 | Цинк | 391 | 419,5 | 419,5 | 906,2 | 7,24 | 115,3 | 0,384 | – | – |
| 30 | Оцтова кислота | -10 | 120 | 16,8 | 118,1 | 11,53 | 23,36 | 2,039 | 2,01 | 1,197 |
Розв’язання
1) Визначаємо ізобарний тепловий ефект реакції при стандартних умовах, беручи до уваги слідство із закону Геcса (величини теплот утворення вихідних речовин та продуктів реакції виписуємо з довідника [6]):
ΔН0298 = (4ΔН0f,298 (CO2) + ΔН0f,298(S2)) - (4ΔН0f,298 (СО) + 2·ΔН0f,298 (SО2)) = =(4·(-393,51) + +128,37) - (4·(-110,53) + 2·(-296,9)) = - 409,75 кДж.
2) Визначаємо коефіцієнти в рівнянні ΔСр0 = f (Т). Виписуємо у таблицю з довідника емпіричні коефіцієнти багаточленів Ср0 = f (Т) для продуктів реакції та вихідних речовин. За їх значенням розраховуємо коефіцієнти в рівнянні ΔСр0 = f (Т).
Речовина
Ср0 = f (Т),
Дж/(моль · К)
Δа = (4·а(СО2) + а (S2))-(4·а(СО) + 2·а(SО2))= (4·44,14 + 36,11)-(4·28,41 + 2·46,19) = 6,65
За аналогією розраховуємо Δ b та Δ с´:
Δb = 5,11 · 10-3
Δс´ = - 20,43 · 105
Інтервал температур, в якому справедливі розраховані коефіцієнти, визначаємо за найменшим з усіх температурних інтервалів для реагуючих речовин.
Тоді, для даної реакції в інтервалі температур 298 – 2000 К отримаємо:
ΔС0р = 6,65 + 5,11· 10-3 · Т - 20,43· 105/Т2
3) Залежність ΔНr0 = f (Т) визначається за законом Кірхгофа:

Підставивши в попереднє рівняння значення ізобарного теплового ефекту реакції при стандартних умовах та коефіцієнтів Δа, Δb та Δс´, отримаємо ΔН0Т = f(Т):
 .
.
Підставивши Т = 700 К, визначаємо тепловий ефект реакції ΔН0700 :
 Відповідь: ΔН0700 = -410 кДж/моль.
Відповідь: ΔН0700 = -410 кДж/моль.
Задача 2.2.2. Для реакцій а) Mg(OH)2 = MgO + H2O(г); б) Al2O3(корунд) + 3SO3 = Al2(SO4)3(кр.), які перебігають при 400 К, визначте, наскільки за цих умов відрізняються теплові ефекти при сталому тиску і сталому об’ємі.
Розв’язання
Тепловий ефект при постійному тиску дорівнює: Qp = ΔH = ΔU + PΔV, а для ідеальних газів:
Qp = ΔH = ΔU + ΔnRT,
де Δn – зміна кількості молів газоподібних речовин під час проходження реакції.
Тепловий ефект при сталому об’ємі дорівнює QV = ΔU. Тоді, різниця теплових ефектів хімічної реакції в ізобарному та ізохорному процесах визначається наступним чином:
Qp - QV = ΔH - ΔU = ΔU + ΔnRT - ΔU = ΔnRT.
Визначаємо Δn для реакції а) Mg(OH)2(ТВ) = MgO(ТВ) + H2O(Г):
Δn = 1 - 0 = 1 (враховуємо тільки газоподібні речовини).
Тоді: Qp - QV = 1 · 8,314 · 400 = 3326 Дж.
Розраховуємо Δn для реакції б) Al2O3(КОРУНД) + 3SO3 = Al2(SO4)3(КР.):
Δn = 0 - 3 = -3
Тоді: Qp - QV = -3 · 8,314 · 400 = - 9977 Дж.
Відповідь: а) 3326 Дж.; б) - 9977 Дж.
Задача 2.2.3. 1. Обчисліть зміну ентропії ∆SΣ при нагріванні 25 кг метанолу від Т1 до Т2 , якщо відомі температури його плавлення та кипіння, теплоємності в рідкому та газоподібному стані, теплоти плавлення й випаровування.
2. Обчисліть зміну ентальпії ∆Н, енергії Гібса ∆G, енергії Гельмгольца ∆A, внутрішньої енергії ∆U, роботи розширення W, якщо 5 молей речовини, пари котрої підпорядковуються законам ідеальних газів, переходить при нормальній температурі кипіння з рідкого в газоподібний стан.
Речовина СН3 –ОН; g = 25 кг.; T1 = 175,3 K; T2 = 400 K;
Tпл = 175,3 К; ∆Нпл = 3,17.103 Дж/моль;
Ткип = 337,9 К; ∆Нвип = 35,296.103 Дж/моль;
Сррід = 2,512.103 Дж/кг. К; Сргаз = 1,371.103 Дж/кг.К.
Розв’язання
1. Змінення ентропіі 25 кг СН3 –ОН при нагріві від Т1 = 175,3 К до Т2 = 400 К дорівнює сумі ∆S для кількох стадій:
І - плавлення СН3 –ОН при Тпл = 175,3 К - ∆S1,
ІІ - нагрів СН3 –ОН(рід) від Тпл = 175,3 К до Ткип = 337.9 К - ∆S2,
ІІІ - кипіння СН3 –ОН при Ткип = 337,9 К - ∆S 3,
ІV - нагрів СН3 –ОН(г) від Ткип = 337,9 К до Т2 = 400 К - ∆S4.
Тобто ∆SΣ = ∆S1 + ∆S2 + ∆S3 + ∆S4 ,
де ∆S2, ∆S4 – змінення ентропіі при нагріві рідкого та газоподібного
СН3 –ОН відповідно;
∆S1, ∆S3 – змінення ентропіі при плавленні та кипінні.
Знаходимо кількість речовини 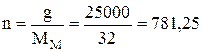 моль.
моль.
 Дж/К;
Дж/К;
 Дж/К;
Дж/К;
 Дж/К;
Дж/К;
 Дж/К;
Дж/К;
 Дж/К.
Дж/К.
2. Зміна ентальпії при випаровуванні 5 молей метанолу дорівнює:
ΔН = n ΔНвип = 5.35,296.103 = 176480 Дж.
Зміна енергії Гіббса розраховується за формулою:
 Для процесу випаровування, що відбувається за сталих тиску і температурі, зміна енергії Гельмгольца можна розрахувати таким чином:
Для процесу випаровування, що відбувається за сталих тиску і температурі, зміна енергії Гельмгольца можна розрахувати таким чином:
ΔА =ΔG – nRT = 0 – 5.8,31.337,9 = - 14039,75 Дж.
Робота розширення в ізобароізотермічних умовах
W = nRT = 14039,75 Дж.
За цих умов зміна внутрішньої енергії пов’язана зі зміною ентальпії рівнянням
ΔН = ΔU + nRT, звідки знаходимо:
ΔU = ΔН – nRT = 176480 – 5.8,31.337,9 = 162440,26 Дж.
Задача 2.2.5. Розрахувати зміну ентропії при стандартних умовах для хімічної реакції: 2С4Н10(Г) + 5О2 = 4СН3СООН(Р) + 2Н2О(Р). Необхідні дані візьміть в довіднику.
Розв’язання
Визначаємо зміну ентропії для реакції при стандартних умовах (величини ентропій вихідних речовин та продуктів реакції відповідно даних з довідника):
ΔS0298 = (2S0298(Н2О(Р)) + 4S0298(СН3СООН(Р))) - (5S0298(O2) + 2S0298(С4Н10(Г))) = (2.69,95 + 4·159,83) - (5·205,04 + 2·310,12) = -866,22 Дж/К.
Відповідь: ΔS0298 = -866,22 Дж/К.
Задача 2.2.6. 100 г водню при 298 К розширюються в вакуум, займаючи втричі більший об’єм. Обчисліть зміну ентропії, вважаючи водень ідеальним газом.
Розв’язання
Розширення водню відбувається при сталій температурі, тому скористаємось рівнянням:
ΔS = n·R·ln(V2/V1),
де кількість речовини n = 100/2 = 50 моль, а V2/V1 =3 за умовами завдання.
Отже, зміна ентропії складає:
ΔS = 50·8,314·ln3 = 457 Дж/К.
Відповідь: ΔS = 457 Дж/К.
Задача 2.2.7. Розрахуйте збільшення ентропії при змішуванні 100 см3 кисню та 200 см3 азоту при 298 К та 1,013·105 Па.
Розв’язання
Зміна ентропії при змішуванні двох газів дорівнює сумі змін ентропії кожного з газів при зворотному ізотермічному розширенні від початкового об’єму V1 або V2 до кінцевого V1 + V2:
ΔS = ΔS1 + ΔS2,
де ΔS1 = n1·R·ln((V1 + V2)/V1) та ΔS2 = n2·R·ln((V1 + V2)/V2).
Розраховуємо кількість кисню n1 та азоту n2 за рівнянням стану ідеального газу:
P·V = n·R·T , звідки n = P·V/R·T.
Тоді: n1 = P·V1/R·T = 1,013 · 105 · 100 · 10-6/8,314 · 298 = 0,0041 моль;
n2 = P·V2/R·T = 1,013 · 105 · 200 · 10-6/8,314 · 298 = 0,0082 моль.
Визначаємо зміну ентропії кисню та азоту:
ΔS1 = 0,0041·8,314·ln((100 · 10-6 + 200 · 10-6)/100 · 10-6) = 0,037 Дж/К,
ΔS2 = 0,0082·8,314·ln((100 · 10-6 + 200 · 10-6)/200 · 10-6) = 0,028 Дж/К.
Тоді, збільшення ентропії при змішуванні кисню та азоту:
ΔS = 0,037 + 0,028 = 0,065 Дж/К.
Відповідь: ΔS = 0,065 Дж/К.
Задача 2.2.8. Визначте роботу ізобарного зворотного розширення 5 моль ідеального газу при його нагріванні від 298 до 400 К.
Розв’язання
Роботу ізобарного розширення визначаємо за рівнянням:
W = P·(V2 – V1).
Для ідеальних газів воно набуває вигляд:
W = n·R·(Т2 – Т1).
Тоді: W = 5 · 8,314 · (400 - 298) = 4,240 · 103 Дж.
Відповідь: 4,240 · 103 Дж.
Задача 2.2.9. Газоподібні речовини А і В реагують з утворенням газоподібної речовини С:
3А + В = 4С
Виразіть Кр і Кс через рівноважну кількість речовини С, якщо А та В взяли в стехіометричних кількостях при загальному тиску в системі Р і температурі Т.
Розв’язання
За умовами задачі А та В взяли в стехіометричних кількостях, тобто n0A = 3 моль і n0В = 1 моль. Визначаємо рівноважні кількості А та В, прийняв до уваги, що рівноважна кількість С дорівнює х.
Кількість, моль 3А + В = 4С
Вихідна 3 1 0
Рівноважна 
 х
х
Константа рівноваги Кn має такий вираз
 . Тоді
. Тоді  .
.
Спростив вираз, отримаємо
 .
.
Кр пов’язана з Кn і Кс наступними співвідношеннями:
 ; Кр = Кс(RT) Δn.
; Кр = Кс(RT) Δn.
Кількість речовини в рівноважній системі складає
Σn =  +
+  + х = 4, а Δn = 4 – (3 + 1) = 0.
+ х = 4, а Δn = 4 – (3 + 1) = 0.
Оскільки Δn = 0, то таким чином, відповідь:  .
.
Задача 2.2.10. Константа рівноваги (К0) хімічної реакції синтезу етилацетату: С2Н5ОН(Г) + СН3СООН(Г) → СН3СООС2Н5(Г) + Н2О(Г), дорівнює при 573 К 9,00, а при 423 К – 30,0. Розрахуйте тепловий ефект цієї реакції.
Розв’язання
Якщо тепловий ефект ΔН не залежить від температури, тоді його значення можна визначити за наближеною формою рівняння ізобари:
ln(K02/K01) = ΔН·(T2 – T1)/R·T2·T1 .
Звідси: ΔН = R·T2·T1·ln(K02/K01)/(T2–T1) = 8,314·423·573·ln(30,0/9,00)/(423–573) = -16,2·103 Дж/моль
Відповідь: ΔН = -16,2·103 Дж/моль.
Задача 2.2.11. Для хімічної реакції: 4СО + 2SО2 = S2 + 4CO2, розрахуйте стандартну спорідненість при 600 К.
Розв’язання
1) Стандартну спорідненість (стандартну зміну енергії Гібса) при температурі Т розраховуємо за методом Тьомкіна – Шварцмана:
ΔG0Т = ΔН0298 - Т · ΔS0298 - Т · (Δа · М0 + Δb · М1 + Δc · М2 + Δc´ · М-2).
2) Визначаємо тепловий ефект реакціі при 298 К:
ΔН0298 = (4ΔН0f,298(CO2) + ΔН0f,298(S2)) - (4ΔН0f,298(СО) + 2ΔН0f,298(SО2)) =
(4·(-393,51) + 128,37) - (4·(-110,53) + 2·(-296,9)) = -409,75 кДж.
3) Обчислюємо зміну ентропії при 298 К:
ΔS0298 = (4S0298(CO2)+S0298(S2))-(4S0298(СО)+2S0298(SО2)) = (4·213,66+228,03) -(4·197,55+2·248,07) = -203,67 Дж/K.
4) Розраховуємо коефіцієнти в рівнянні ΔСр° = f (Т).
Речовина
Ср0 = f (Т),
Дж/(моль · К)
Δ а = (4а(СО2) + а (S2))-(4а(СО) + 2а(SО2))= (4·44,14 + 36,11) - (4·28,41 + 2·46,19) = 6,65.
За аналогією розраховуємо Δ b та Δ с´:
Δ b = 5,11 · 10-3; Δ с´ = -20,43 · 105.
Оскільки вихідні речовини та продукти реакції є неорганічними речовинами, Δс = 0.
Для T = 600 K згідно з довідником : М0 = 0,1962; М1 = 0,0759·103; М2 = 0,0303·106; М-2 = 0,1423·10-5.
Тоді, стандартна зміна енергії Гіббса при 600 К складає:
ΔG0600 = -409750 - 600 · (-203,67) - 600 · (6,65· 0,1962 + 5,11· 10-3 · 0,0759 · 103 + 0 · 0,0303 · 106 + (-20,43 · 105) · 0,1423 · 10-5) = -286,82·103 Дж
Відповідь: ΔG0600 = -286,82 кДж.
Завдання 2.
Фазові рівноваги в однокомпонентних системах.
За залежністю тиску насиченої пари від температури і густини речовини А у твердому і рідкому станах (dТВ і dРІД в кг/м3) в потрійної точці:
1) побудуйте графік залежності ln p від 1/Т;
2) визначить за графіком координати потрійної точки;
3) розрахуйте середню теплоту випаровування і сублімації;
4) визначить теплоту плавлення речовини при температурі потрійної точки;
5) обчисліть dT/dp для процесу плавлення при температурі потрійної точки;
6) обчисліть температуру плавлення речовини при тиску р;
7) обчисліть зміну ентропії, енергії Гіббса, енергії Гельмгольца, ентальпії і внутрішньої енергії для процесу сублімації 1 кмоля речовини в потрійної точці;
8) визначить число фаз і число термодинамічних ступенів свободи для фігуративних точок, вибраних вами на “полі” діаграми, “лінії” і “точці”.
Необхідні для розрахунку дані взяти із таблиці 2.3.
Таблиця 2.3
Вихідні дані до завдання 2
| № | Стан | Умови | ||||
| твердий | рідкий | |||||
| Т, К | р, Па | Т, К | р, Па | |||
| 1 | 268,2 269,2 270,2 271,2 272,2 | 401,2 437,2 475,9 517,2 533,2 | 269,2 272,2 273,2 275,2 278,2 283,2 288,2 | 505 533,2 573 656 760 982 1600 | М = 18 р = 40,5.105 Па dтв = 918 dрід = 1000 | |
| 2 | 248 254,4 258 259 260 | 7998 13300 17995 19995 23327 | 260 265 270 278 282 | 23327 27190 31860 40290 47990 | М = 27 р = 800.105 Па dтв = 718 dрід = 709 | |
| 3 | 55 58 59,2 63 64 | 1333 3999 11997 14663 17329 | 60 64 66 67,8 69 71 | 12663 17329 22394 27993 31993 39990 | М = 28 Р = 500.105 dтв = 1026 dрід = 808 | |
| 4 | 100 104 107 109 110,5 112 | 4132 8531 14663 19995 25367 29653 | 105 112 114 115 116 117 | 17329 29653 34738 38657 46435 53053 | M = 30 р = 900.105 Па dтв = 1272 dрід = 1260
| |
| 5 | 229,2 248 257 267,2 273,2 | 133,3 694,5 1333 2966 4786 | 273,2 282,5 298,2 306,7 312,5 316,5 | 4786 6665 12697 16396 18929 21328 | М = 32 р = 300.105 Па dтв = 837 dрід = 825 | |
| 6 | 173 178 183 184 190 | 7330 11600 16795 19995 31192 | 190 195 200 207 215 221 | 31192 38657 46655 55986 69476 77314 | М = 34 р = 450.105 Па dтв = 1010 dрід = 980 | |
| 7 | 196 203 213 220 | 101325 190461 402360 648480 | 212 220 223 239 241 243 | 592751 648480 674824 1005114 1065237 1131722 | М = 44 р = 750.105 Па dтв = 1542 dрід = 1510 | |
| 8 | 276,6 278,2 279,2 280,2 281,4 | 1413 1706 1879 2066 2372 | 277,2 279,2 281,4 283,2 285,2 288,7 | 1826 2052 2372 2626 2932 3279 | М = 46 р = 950.105 Па dтв = 1240 dрід = 1230 | |
| 9 | 230 233 237 240 243 245 | 26260 31458 39990 49997 58818 66650 | 236 246 248 249 252,5 253,5 | 63315 78647 83979 86645 96942 100508 | М = 52 р = 350.105 Па dтв = 3010 dрід = 2955 | |
| 10 | 1758,2 1788,2 1810,2 1835,2 1873,2 | 22,68 63,98 99,97 115,99 300,00 | 1832 1873,2 1905 1938 1956 1991 2040 | 187 300 387 486 573 800 973 | М = 52,5 Р = 500.105 Па dтв = 6800 dрід = 6750 | |
| 11 | 242,1 252,4 263,8 271,2 280,9 293,0 | 1333 2666 5332 7998 13330 26660 | 293 303 308 311 313 316 | 26600 37724 46188 51720 56186 63317 | М = 58 p = 700.105 Па dтв = 822 dрід = 812 | |
| 12 | 183,2 188,0 196,2 199,2 203,7 | 333,3 586,5 1850 3000 5305 | 201 203,7 214 216 230,2 244 | 4665,5 5305 7198 7998 13328 21728 | М = 64 р = 1000.105 dтв = 1600 dрід = 1560 | |
| 13 | 135 137 139,5 141,5 144 146 | 1999,5 2666 3999 5332 7998 9997,5 | 137 141 144 146 149 151,4 | 6665 7331,5 8664,5 9997,5 12663 15996 | М = 68 р = 200.105 Па dтв = 1450 dрід = 1434 | |
| 14 | 273,2 274,2 276,2 277,2 278,2 | 3265,8 3465,8 3923,3 4305,6 4530 | 274,2 275,2 276,2 278,2 283,2 290,2 | 3730 4000 4160 4530 6050 8930 | М = 78 р= 900.105 Па dтв = 893 dрід = 890 | |
| 15 | 177,3 180 182,0 184 185,5 | 15996 19995 23994 28659 32992 | 180 185,5 188 191 194 196,8 | 26660 32992 37057 43456 51987 59985 | М = 81 р = 300.105 Па dтв = 1625 dрід = 1610 | |
| 16 | 99 101,9 103 104,5 107,2 115,5 | 10675 13995 17330 19995 26660 68649 | 111 115,5 117 118 119 119,6 | 63984 68649 72782 77980 82646 87711 | М = 83,5 p = 800.105 Па dтв = 3330 dрід = 2150 | |
| 17 | 272,5 273,4 275,7 277,2 279,2 281,7 | 3332,5 3599,1 4065,6 4398,9 5065 5798,6 | 275,7 280,2 281,7 283,3 285,2 287,5 | 4878,8 5598,6 5798,6 6198,6 6931,6 7731,4 | М = 84 р = 120.105 Па dтв = 796 dрід = 788 | |
| 18 | 353,2 363,2 373,2 383,2 393,2 | 39,99 79,98 186,6 393,2 679,8 | 363,2 393,2 395,2 400,7 403,7 408,7 | 186,6 679,8 733,1 973,1 1133 1399,6 | М = 122 р = 850.105 Па dтв = 1105 dрід = 1095 | |
| 19 | 208 209,2 213,2 216,4 220 224,2 | 19195 22662 29859 35991 45988 59985 | 219,2 224,2 226,7 229,2 231,2 232,7 | 55319 59985 6665 75981 83979 87975 | М = 127,5 p = 500.105 Па dтв = 2970 dрід= 2850 | |
| 20 | 334,6 338,4 343,2 348,2 353,2 353,7 | 266,6 352,2 533,2 733,1 1039,7 1266,3 | 348,2 353,7 358,2 363,8 368,8 373,8 | 1046 1266,3 1399 1666 2066 2466 | М = 128 р = 180.105 Па dтв = 1145 dрід = 982 | |
| 21 | 223,2 237,2 246,2 252,2 253,2 | 133,3 466,5 799,8 1213 1319 | 244,2 253,2 270,1 282,5 285,7 303,2 | 1200 1319 2465 3865 4398 7664 | М = 154 р = 60,8.105 Па dтв =1680 dрід = 1650 | |
| 222 | 418 446,5 460,2 474,9 490,5 | 133,3 667 1333 2666 5332 | 490,5 504,8 523 552,2 583,2 612 | 5332 8020 13300 26660 53320 101308 | М = 174 р = 220.105 Па dтв = 954 dрід = 948 | |
| 23 | 252 255 257,5 260 | 10950 14198 17344 23327 | 258 260 263 267 275 281 | 22112 23327 25703 29095 36810 45791 | М = 27 р = 500.105 Па dтв = 718 dрід = 709 | |
| 24 | 106 108 110 112 | 12487 17326 23510 29653 | 107 112 113 114,5 116 117 | 20635 29653 32057 37107 46435 52354 | М = 30 р = 500.105 Па dтв = 1272 dрід = 1260 | |
| 25 | 180 185 188 190 | 13905 21613 26874 31192 | 186 190 195 202 209 | 27117 31192 37587 49485 59602 | М = 34 р = 500.105 Па dтв = 1010 dрід = 980 | |
| 26 | 279 280 280,7 281,4 | 1842 2033 2190 2372 | 280 281,4 283 284 286 | 2155 2372 2607 2754 3082 | М = 46 р = 700.105 Па dтв = 1240 dрід = 1230 | |
| 27 | 275 280 288 293 | 9256 11570 19016 26660 | 287 293 300 305 310 | 23125 26660 33950 40987 49890 | М = 58 р = 400.105 Па dтв = 822 dрід = 812 | |
| 28 | 142 143 145 146 | 5816 6786 8905 9997 | 143 145 146 148 150 | 8138 9319 9997 11758 13869 | М = 68 р =300.105 Па dтв = 1450 dрід = 1434 | |
| 29 | 61 62 63,5 64 | 9151 12074 15962 17329 | 62 64 65 67 68 70 | 14172 17329 19844 25583 28727 35436 | М = 28 р = 300.105 Па dтв = 1026 dрід = 808 | |
| 30 | 377,2 381,2 383,2 386,2 389,2 392,2 | 7064 8531 9331 10397 11997 13997 | 373,2 388,2 392,2 393,2 397,2 401,2 | 10662 12397 13997 14796 16929 19462 | М = 254 р = 200.105 Па dтв = 3960 dрід = 3900 | |
Рис. 1.
Розв’язання. Лінія со є лінією випаровування. Її хід описується рівнянням Клапейрона-Клаузіуса у лінійному вигляді:
 .
.
Аналіз рівняння показує, що теплота випаровування входить в величину кутового коефіцієнта прямої. Він дорівнює тангенсу кута нахилу лінії (α1), який можна розрахувати за графічними даними:
 .
.
Середня теплота випаровування дорівнює:
ΔHВИП = R.tgα1 = 8,314. 2816,9 = 23429,7 Дж/моль.
Лінія оb на графіку є лінією сублімації. Вона також описується рівнянням Клапейрона-Клаузіуса. Тангенс кута нахилу (α2) прямої оb дорівнює:
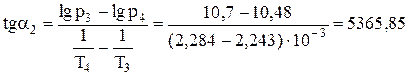 .
.
Розрахуємо середню теплоту сублімації.
ΔHСУБ = R.tgα2 = 8,314. 5365б85 = 44611,7 Дж/моль.
Задача 4. Визначить теплоту плавлення речовини при температурі потрійної точки.
Розв’язання. Теплоту плавлення речовини при температурі потрійної точки визначаємо за рівнянням:
ΔHПЛ = ΔHСУБ. – ΔHВИП = 44611,7 - 23419,7 – 21192,0 Дж/моль.
Задача 5. Обчисліть dT/dp для процесу плавлення при температурі потрійної точки.
Розв’язання. Згідно з рівнянням Клапейрона – Клаузіуса
 ,
,
де ΔV = VРІД – VТВ є різниця мольних об’ємів речовини в рідкому і твердому станах відповідно. Мольні об’єми розрахуємо за даними густини речовини (dРІД і dТВ) та її мольної маси (М = 152 г/моль)
 і
і  .
.
Тоді
 ,
,
і 
 .
.
Задача 6. Обчисліть температуру плавлення речовини при тиску р.
Розв’язання. Температуру плавлення при тиску 300.105 Па знайдемо в результаті інтегрування рівняння
 ,
,
допускаючи, що залежність T = f(p) має лінійний характер.
 .
.
Т = ТПТ + 2,67.10-8(р – рПТ) = 448,2 + 2,67.10-8(300.105 – 47454) = 449,0 К.
Задача 7. Обчисліть зміну ентропії, ентальпії, внутрішньої енергії, енергії Гіббса, енергії Гельмгольца в процесі сублімації для n = 1 кмоль речовини в потрійної точці.
Розв’язання. Для процесу сублімації в потрійній точці зміна ентропії 1 кмоль речовини дорівнює:
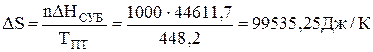 .
.
Зміна ентальпії буде дорівнювати:
ΔН = nΔНСУБ = 1000.44611,7 = 44611700 Дж.
Зміна внутрішньої енергії:
ΔU = ΔH – nRTПТ = 44611700-1000.8,314.448,2 = 40885365 Дж.
Зміна енергії Гіббса:
ΔG = ΔH – TПТ.ΔS = 44611700 – 448,2.99535,25 = 0.
Зміна енергії Гельмгольца:
ΔA = ΔG – nRTПТ = 0 – 1000.8,314.448,2 = -3726335,0 Дж.
Задача 8. Визначить число фаз і число термодинамічних ступенів свободи для фігуративних точок на “полі” діаграми, “лінії” і “точці”.
Розв’язання. Число фаз (Ф) для фігуративних точок на “полі” діаграми дорівнює 1, на “лінії” – 2, в потрійній точці – 3.
За правилом фаз Гіббса
С = К – Ф + n
для однокомпонентної системи (К = 1) і для n = 2 (змінні, що впливають на рівновагу – тиск і температура) число термодинамічних ступенів свободи в “полі” дорівнює
СП = 1 – 1 + 2 = 2,
на “лінії’
СЛ = 1 – 2 + 2 = 1,
в потрійній точці
СПТ = 1 – 3 + 2 = 0.
Питання до екзаменаційних білетів
Хімічна рівновага
79. Проаналізуйте рівняння ізобари хімічної реакції:  , (вплив температури на Кр, Кс, Ко; інтегрування рівняння, графічний спосіб визначення теплового ефекту ΔН).
, (вплив температури на Кр, Кс, Ко; інтегрування рівняння, графічний спосіб визначення теплового ефекту ΔН).
80. Знайти розчинність BaSO4, якщо розчинення відбувається за схемою:  , при Т = 298 К. (Добуток розчинності є константа рівноваги зазначеного процесу).
, при Т = 298 К. (Добуток розчинності є константа рівноваги зазначеного процесу).
81. Ступінь дисоціації N2O4 за реакцією: N2O4 = 2NO2, при t = 0oC і р = 1,013.105 Па складає 11%. До якого тиску необхідно стиснути суміш, щоб при t = 0оС ступінь дисоціації знизився до 8%?
82. Для реакції: С + 2Н2 = СН4,  . Чи можливо утворення метану при Т = 1000 К і р = 1,013.105 Па , якщо газ, що вступає в стикання з вуглецем, складається з 10% мол. СН4, 80% мол. Н2 і 10% мол. N2?
. Чи можливо утворення метану при Т = 1000 К і р = 1,013.105 Па , якщо газ, що вступає в стикання з вуглецем, складається з 10% мол. СН4, 80% мол. Н2 і 10% мол. N2?
83. Розчинність Н3ВО3 у воді при 13оС дорівнює 38,5 г на 1 л розчину і 49,1 г при 20оС. Обчислити теплоту розчинення 1 моля Н3ВО3.
84. Добуток розчинності AgCl при 25оС дорівнює 1,55.10-10 і 13,2.10-10 при 50оС. Визначте теплоту розчинення.
85. Чи може константа рівноваги бути від’ємною, додатною, рівній нулю чи безконечності?
86. Чи можлива при кімнатній температурі реакція: B2O3 + 3Mg = 2B + 3MgO?
87. Залежність константи рівноваги деякої реакції від температури описується рівнянням:  . Як зміниться вихід продуктів цієї реакції при підвищенні температури? Виділяється чи поглинається тепло в цій реакції?
. Як зміниться вихід продуктів цієї реакції при підвищенні температури? Виділяється чи поглинається тепло в цій реакції?
88. При деякій температурі загальний рівноважний тиск в системі: NH4Cl(тв) = NH3 + HCl,
дорівнює 0,5.103 Па. Обчислити константи рівноваги Кр і Ко при даній температурі.
89. Залежність lgKp = f(1/T) є лінійною з від’ємним тангенсом кута нахилу. Визначити, ендо- чи екзотермічною є реакція у даному інтервалі температур?
90. Обчислити вихід етанолу за рівнянням реакції: С2Н4(г) + Н2О(г) = С2Н5ОН(г), із суміші етилену і води стехіометричного складу при температурі 350оС і тиску 20,2.106 Па, якщо lg Kf = -4,8758 (Kf виражена в (кН/м2)-1).
91. Розрахуйте число молей PCl5 у рівноважній суміші при температурі Т і загальному тиску 2.105 Па, якщо 2 моля PCl3(газ) змішані з 1 молем Cl2(газ), а константа рівноваги реакції: PCl3(г) + Cl2 = PCl5(г), дорівнює Кр = 1.10-5 Па-1 при тій самій температурі.
92. Константа рівноваги реакції: COCl2 = CO + Cl2, при 600К Кр = 5,883.105 Па. Визначити, в якому напрямі відбувається реакція при таких заданих значеннях парціальних тисків компонентів: 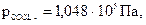


93. Для реакції: H2 + I2 = 2HI, Кс = 50 при 444оС. Визначте напрям процесу, якщо вихідна суміш має такий склад: 


94. Обчисліть константу рівноваги реакції синтезу метилового спирту: СО + 2Н2 = СН3ОН(г), при 800 К, якщо при 25оС ΔН298 = -90,44 кДж/моль, К0,298 = 1,76.1011 і мольні теплоємності газів: Ср(СО) = 28,41 + 4,1.10-3 Т Дж/моль·К;
Ср(Н2) = 27,28 + 3,26.10-3Т Дж/моль·К;
Ср(СН3ОН) = 15,28 + 105,2.10-3Т Дж/моль·К.
95. Тиск дисоціації MgCO3 при 813 К дорівнює 0,996.105 Па, а при 843 К – 1,786.105 Па. Обчисліть, за якої температури тиск дисоціації буде дорівнювати 1,013.105 Па.
96. Обчисліть тепловий ефект реакції при 1200 К: Fe3O4(т) + Н2 = 3FeO(т) + Н2О(г), якщо 
97. Визначте температуру, за якою FeO почне розкладатися на повітрі за реакцією: 2FeO(т) = 2Fe(т) + О2, якщо тиск дисоціації визначається рівнянням:  Тиск кисню в повітрі вважати рівним 0,21 атм.
Тиск кисню в повітрі вважати рівним 0,21 атм.
98. Напишіть математичне співвідношення між величинами Кр і Кс для хімічної реакції (висновок): 2Н2О(г) = 2Н2 + О2.
99. Константа рівноваги реакції: А(г) + В(г) = 2С(г), дорівнює 4. Розрахувати рівноважну кількість молей продукту С, якщо для реакції були взяті 2 моля А і 1 моль В.
100. Газоподібні речовини реагують за рівнянням: А(г) + В(г) = 2С(г). Обчисліть константи рівноваги Кр і Кс, якщо при взаємодії 1 моля речовини А і 1 моля речовини В утворюється 1,2 моля компонента С.
101. Константа рівноваги реакції: А(т) + В(г) = 2С(г), дорівнює 10 Па. Визначте рівноважну кількість молей С, якщо для її проведення було взято 2 моля речовини В, а речовина А була взята в надлишку. Рівноважний тиск р = 1.104 Па.
102. Константа рівноваги реакції: H2 + I2(г) =2HI, при Т = 693 К дорівнює 50. Обчислити вихід продукту реакції, якщо вихідні речовини були взяті в стехіометричному співвідношенні.
103. Обчислити константу рівноваги реакції: СО + Н2О(г) = СО2 + Н2, якщо в посудину сталого об’єму при 298 К було введено 28 кг СО і 18 кг Н2О, а кількість СО2 в рівноважній суміші склало 39,85 кг.
104. Стандартна спорідненість  хімічної реакції: 2HCl(г) = Cl2 + H2, дорівнює 190,6.103 Дж/моль. Розрахувати константу рівноваги цієї реакції.
хімічної реакції: 2HCl(г) = Cl2 + H2, дорівнює 190,6.103 Дж/моль. Розрахувати константу рівноваги цієї реакції.
105. Константа рівноваги гетерогенної реакції: С + О2 = СО2, дорівнює 1,03.107. Обчислити кількість утвореного СО2, якщо для реакції було взято 100 моль О2, а вугілля було взяте в надлишку.
106. Укажіть напрям процесу, якщо константа рівноваги реакції розкладення циклогексану з утворенням бутадієну і етану: С6Н12 = С4Н6 + С2Н6, дорівнює 24,9.105 Па (при 800 К), а вихідна суміш містить 6 моль циклогексану, 4 моля бутадієну і 2 моля етану. Тиск в системі 10,1.105 Па.
107. Використовуючи таблиці стандартних величин, обчислити за методом Тьомкіна-Шварцмана константу рівноваги реакції: SO2 = O2 + 1/2S2, при 800 К.
108. Константа рівноваги реакції: 3/2Н2 + 1/2N2 = NH3, дорівнює  , а
, а  - константа рівноваги реакції: 3Н2 + N2 = 2NH3. Чи будуть відрізнятися численні значення
- константа рівноваги реакції: 3Н2 + N2 = 2NH3. Чи будуть відрізнятися численні значення  і
і  при однаковій температурі? Напишіть, як зв’язані між собою
при однаковій температурі? Напишіть, як зв’язані між собою  і
і  .
.
109. Чи зміниться і як значення константи рівноваги Кр реакції: А + 2В = АВ2, якщо загальний тиск у системі збільшиться у 2 рази? Всі речовини знаходяться в ідеальному газоподібному стані.
110. Ступінь термічної дисоціації HBr не залежить від тиску, але в той же час збільшується з ростом температури. Поясніть ці факти.
111. Яка з констант рівноваги Кр або Кс більше для реакції: H2 + Cl2 = 2HCl(г), що відбувається у газовій фазі?
112. Обчислити тиск термічної дисоціації MgCO3 при Т = 800 К. Термічна дисоціація MgCO3 відбувається за рівнянням: MgCO3 = MgO + CO2.
113. Визначте, за якої температури може початися реакція відновлення MgO вуглецем на повітрі при тиску  в повітрі, рівному 3.103 Па, за реакцією: 2MgO(т) + С = 2Mg + CO2(г).
в повітрі, рівному 3.103 Па, за реакцією: 2MgO(т) + С = 2Mg + CO2(г).
Прийняти, що для цієї реакції ΔСр = 0.
114. Для реакції: 2NO2 = N2O4, залежність енергії Гіббса від температури описується рівнянням: 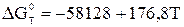 . За якому тиску NO2 на 60% перетворюється в N2O4 при 300 К?
. За якому тиску NO2 на 60% перетворюється в N2O4 при 300 К?
115. Обчисліть константу рівноваги К0 реакції конверсії метану з водяною парою, яка проводиться у газовій фазі: СН4 + Н2О(г) = СО + 3Н2, при 1000 К.
116. Константа рівноваги конверсії метану з водяною парою: СН4 + Н2О(г) = СО + 3Н2, при температурі Т = 1000 К дорівнює К0 = 24,0. Розрахувати склад рівноважної суміші при заданій температурі і тиску 1,013.105 Па, якщо вихідна суміш взята в стехіометричному співвідношенні.
117. Якісно оцініть вплив різних факторів на константи рівноваги Кр і Кс, якщо реагуючу систему можна розглядати як ідеальну. Фактори оцінки: загальний тиск, концентрація, температура, початкове число молей, присутність інертних газів і каталізатора.
118. При підвищенні температури рівноважний тиск кисню над оксидом кобальту СоО зростає. З поглинанням чи виділенням тепла відбувається дисоціація оксиду кобальту?
119. Константа рівноваги реакції: СО + Н2О(г) = СО2 + Н2, при 970 дорівнює 1. Розрахуйте величину  при цій температурі і зробіть висновок щодо сторони, у яку відбувається реакція, якщо вихідна реакційна суміш має такий склад (в мольних процентах): 50% СО, 15% Н2О, 20% СО2, 15% Н2.
при цій температурі і зробіть висновок щодо сторони, у яку відбувається реакція, якщо вихідна реакційна суміш має такий склад (в мольних процентах): 50% СО, 15% Н2О, 20% СО2, 15% Н2.
120. Зобразіть схематично графік залежності константи рівноваги Кр від температури Т, якщо у даному інтервалі температур тепловий ефект реакції ΔН = 0.
121. Виразіть константу рівноваги Кр реакції між ідеальними газами А і В, взятими в стехіометричному співвідношенні: 2А + В = С(г), означивши через х число молей утвореної сполуки С (газ), а через р – рівноважний тиск.
122. Напишіть вираз для Кf реакції: 2SO3 = 2SO2 + O2. Як пов’язані між собою Кf і стандартна константа рівноваги Ко для ідеальної газової системи?
123. Розрахуйте константу рівноваги Кр реакції: 2Ag + 1/2O2 = Ag2O, при температурі Т = 400 К.
124. Для реакції: N2 + O2 = 2NO, залежність константи рівноваги Кр від температури виражається рівнянням:  . Виведіть рівняння залежності теплового ефекту цієї реакції від температури.
. Виведіть рівняння залежності теплового ефекту цієї реакції від температури.
125. При певній температурі загальний тиск в рівноважній системі: 2Fe + O2 = 2FeO, дорівнює р. Виразіть константи рівноваги Кр і Ко цієї реакції через загальний тиск.
126. Виразіть у загальному вигляді константу рівноваги Кр реакції: 4HCl + O2 = 2 H2O(г) + 2Cl2, якщо загальний тиск в системі р, рівноважний вихід Cl2 – х моль, а початкова кількість взятих для реакції речовин – 4 моля HCl і 2 моля О2.
127. Для реакції: N2O4 = 2NO2, при 328 К константа рівноваги Кс = 50,6.10-3 моль/л. Скільки молей N2O4 необхідно помістити у посудину ємністю 10 л для того, щоб при рівновазі концентрація NO2 у ній стала дорівнювати 0,2 моль/л?
Фазові рівноваги
128. Зневоднення SrCl2.6H2O відбувається за схемою:
SrCl2.6H2O = SrCl2 + 6H2O.
Використовуючи правило фаз Гіббса, поясніть, як зміниться тиск пари води, якщо зневоднення солі проводити при сталій температурі?
129. Є в наявності відкрита посудина, яка містить розбавлений розчин NaCl. Як буде поводити себе цей розчин при ізобаричному нагріванні? Застосовуючи правило фаз Гіббса, виясніть, чи може при нагріванні температура у деякий момент часу залишатися сталою?
130. Визначіть, за якої температури буде кипіти хлорбензол при тиску 10 мм рт. ст., якщо його нормальна температура кипіння дорівнює 405,4 К, а при 372 мм рт. ст. він кипить при 383,2 К.
131. Тиск пари (мм рт. ст.) рідини в інтервалі температур 200-260 К описується рівнянням:
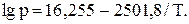
Розрахувати ентальпію випаровування і нормальну температуру кипіння рідини.
132. Залежність тиску насиченої пари ртуті від температури можна виразити рівнянням:
 .
.
Виведіть рівняння залежності теплоти випаровування ртуті від температури (в Дж/моль).
133. Густина рідкого галію більше густини твердого. Як зміниться температура плавлення цього металу при підвищення тиску і чому?
Таблиця відповідності рейтингових балів за національною та європейською шкалами
| Оцінка ECTS | Визначення
| Рейтинг в балах | Традиційна | ||
| оцінка | залік | допуск | |||
| А | ВІДМІННО –відмінне виконання лише з незначною кількістю помилок | 96-100 |
відмін-но |
зарахо-вано |
допу-щено |
| В | ДУЖЕ ДОБРЕ – вище середнього рівня з кількома помилками | 86-95 | |||
| С | ДОБРЕ – в загальному правильна робота з певною кількістю помилок | 67-85 | добре | ||
| D | ЗАДОВІЛЬНО – непогано, але зі значною кількістю недоліків | 61-66 | задо-вільно | ||
| Е | ДОСТАТНЬО – виконання задовольняє мінімальним критеріям | 51-60 | |||
| FX | НЕЗАДОВІЛЬНО – з можливістю складання іспиту | 35-50 | незадо-вільно | незара-ховано | недо-пуще-но |
| F | НЕЗАДОВІЛЬНО – з обов'язковим повторним курсом | <35 | |||
Таблиця відповідності оцінок та балів за європейською і національною шкалами
| Макси-мальний бал за роботу | Залік |
До-пуск |
Не-допуск | |||||
| Відмінно | Добре | Задовільно | ||||||
| A | B | C | D | E | FX | F | ||
| 1 | 1 | 1 | 1 | 1 | 1 | 1 | 0 | |
| 2 | 2 | 2 | 2 | 2 | 2 | 1 | 0 | |
| 3 | 3 | 3 | 3 | 2 | 2 | 2 | 0 | |
| 4 | 4 | 4 | 3 | 3 | 3 | 2 | 0 | |
| 5 | 5 | 5 | 4 | 4 | 3 | 2 | 0 | |
| 6 | 6 | 6 | 5 | 4 | 4 | 3 | 0 | |
| 7 | 7 | 7 | 6 | 5 | 4 | 3 | 0 | |
| 8 | 8 | 7 | 6 | 5 | 4 | 3 | 0 | |
| 9 | 9 | 8 | 7 | 6 | 5 | 4 | 0 | |
| 10 | 10 | 9 | 8 | 7 | 6 | 4...5 | 0 | |
| 11 | 11 | 10 | 8..9 | 7 | 6 | 4..5 | 0 | |
| 12 | 12 | 11 | 9..10 | 8 | 7 | 5..6 | 0 | |
| 13 | 13 | 12 | 9..11 | 8 | 7 | 5..6 | 0 | |
| 14 | 14 | 13 | 10..12 | 9 | 8 | 5..7 | 0 | |
| 15 | 15 | 13..14 | 11..12 | 10 | 8..9 | 6..7 | 0 | |
| 16 | 16 | 14..15 | 11..13 | 10 | 9 | 6..8 | 0 | |
| 17 | 17 | 15..16 | 12..14 | 11 | 9..10 | 6..8 | 0 | |
| 18 | 18 | 16..17 | 13..15 | 11..12 | 10 | 7..9 | 0 | |
| 19 | 19 | 17..18 | 13..16 | 12 | 10..11 | 7..9 | 0 | |
| 20 | 20 | 18..19 | 14..17 | 13 | 11..12 | 7..10 | 0 | |
| 21 | 21 | 19..20 | 15..18 | 13..14 | 11..12 | 8..10 | 0 | |
| 22 | 22 | 19..21 | 15..18 | 14 | 12..13 | 8..11 | 0 | |
| 23 | 23 | 20..22 | 16..19 | 14..15 | 12..13 | 9..11 | 0 | |
| 24 | 24 | 21..23 | 17..20 | 15..16 | 13..14 | 9..12 | 0 | |
| 25 | 24..25 | 22..23 | 17..21 | 16 | 13..15 | 9..12 | 0 | |
| 26 | 25..26 | 23..25 | 18..22 | 16..17 | 14..15 | 10..13 | 0 | |
| 27 | 26..27 | 24..25 | 19..23 | 17..18 | 14..16 | 10..13 | 0 | |
| 28 | 27..28 | 25..27 | 19..24 | 18..19 | 15..17 | 10..14 | 0 | |
| 29 | 29..30 | 25..28 | 20..24 | 18..19 | 15..17 | 11..14 | 0 | |
| 30 | 29..30 | 26..28 | 21..25 | 19..20 | 16..18 | 11..15 | 0 | |
| 35 | 34..35 | 31..3 | 24..30 | 22..23 | 18..21 | 13..17 | 0 | |
| 40 | 39..40 | 35..38 | 27..34 | 25..26 | 21..24 | 14..20 | 0 | |
| 45 | 44..45 | 39..43 | 31..38 | 28..30 | 23.27 | 16..22 | 0 | |
| 50 | 48..50 | 43..47 | 34..42 | 31..33 | 26..30 | 18..25 | 0 | |
СПИСОК РЕКОМЕНДОВАНОЇ ЛІТЕРАТУРИ
Основна література
1. 1.Стромберг А.Г., Сёмченко Д.П. Физическая химия. – М.: Высшая школа,1988.
2. Физическая химия: Учебное пособие для вузов / Под ред. Краснова К.С. М.: Высш. школа, 1982. – 687 с.
3. Кондратьев С.Н. Краткий курс физической химии. – М.: Высш. школа, 1978. – 268 с.
4. Кудряшов И.В., Каретников Г.С. Сборник примеров й задач по физической химии. – М.: Высш. школа, 1991. – 526 с.
5. Киселёва Е.В., Каретникова Г.С., Кудряшов И.В. Сборник примеров и задач по физической химии. – М., Высш. школа,1983. – 456 с.
6. Краткий справочник физико-химических величин / Под ред. Мищенко К.С., Равделя А.А. – Л.: Химия, 1983. – 231 с.
7. Еремин Е.М. Основы химической термодинамики. – М.: Высш. школа, 1978. – 391 с.
Додаткова література
1. Эткинс П. Физическая химия. – М.: Мир, 1980. – Т. 1. – 580 с.
2. Эткинс П. Физическая химия. – М.: Мир, 1980. – Т. 2. – 584 с.
3. Сборник вопросов и задач по физической химии для самоконтроля / под ред. Белевского С.Ф. – М.: Высшая школа, 1979 – 119 с.
4. Голиков Г.А. Руководство по физической химии. – М.: Высш. школа, 1988. –382 с.
5. Исаев С.И. Курс химической термодинамики: Учебное пособие для машиностроительных вузов. – М.: Высш. школа, 1986. – 271 с.
Перелік позначень
H – ентальпія
U – внутрішня енергія
S – ентропія
G – енергія Гіббса
A – енергія Гельмгольца
T – абсолютна температура
p – абсолютний тиск
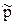 – відносний тиск
– відносний тиск
р0 – стандартний тиск
R – газова стала
k – стала Больцмана
Ср – ізобарна теплоємність
СV – ізохорна теплоємність
QV – ізохорний тепловий ефект
Qp – ізобарний тепловий ефект
n – кількість речовини у молях
ΔH – зміна ентальпії
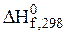 – стандартна теплота утворення речовини
– стандартна теплота утворення речовини
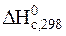 – стандартна теплота згоряння речовини
– стандартна теплота згоряння речовини
ΔS – зміна ентропії
ΔU – зміна внутрішньої енергії
ΔG – зміна енергії Гіббса
ΔA – зміна енергії Гельмгольца
K – константа рівноваги
K0 – стандартна константа рівноваги
С – концентрація, моль/л, моль/м3
х – мольна доля
μ – хімічний потенціал
а – активність
f – фугітивність
γ – коефіцієнт фугітивності
МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ
Последнее изменение этой страницы: 2019-04-10; Просмотров: 63; Нарушение авторского права страницы