
|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |

|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |
ДОМАШНІ РОЗРАХУНКОВІ ЗАВДАННЯ
Завдання 1 (варіант А) Розрахуйте стандартний тепловий ефект хімічної реакції та тепловий ефект при заданій температурі (таблиця 2.1). Встановіть, як відрізняється теплові ефекти при сталому тиску та об’єму. Термодинамічні данні для рішення задачі взяти в довіднику. Всі компоненти реакції знаходяться в газовому стані. Таблиця 2.1
Завдання 1 (варіант Б). 1. Обчисліть зміну ентропії при нагріванні (охолодженні) 4 кг речовини А (таблиця 2.2) від t1 до t2, якщо відомі температури його плавлення та кипіння, теплоємності в рідкому, твердому та газоподібному стані, теплоти плавлення й випаровування. 2. Обчисліть зміну ентропії, енергії Гіббса, енергії Гельмгольца, внутрішньої енергії, роботи розширення, якщо 10 кмоль речовини, пари котрого підпорядковуються законам ідеальних газів, переходить при нормальній температурі кипіння з рідкого в газоподібний стан. Таблиця 2.2
Приклади розв ’ язання задач. Задача 2.2.1. Для реакції: 4СО + 2SО2 = S2 + 4CO2 1) обчислить за теплотами утворення ізобарний тепловий ефект при стандартних умовах; 2) розрахуйте коефіцієнти рівняння ΔСр = f(T) (Δа, Δb, Δc, Δc´) і вкажіть інтервал температур, для якого справедлива ця залежність; 3) за результатами розрахунку визначить тепловий ефект при 700 К та Р = 101325 Па. Необхідні дані для розрахунку приведені в довіднику [6]. Розв’язання 1) Визначаємо ізобарний тепловий ефект реакції при стандартних умовах, беручи до уваги слідство із закону Геcса (величини теплот утворення вихідних речовин та продуктів реакції виписуємо з довідника [6]): ΔН0298 = (4ΔН0f,298 (CO2) + ΔН0f,298(S2)) - (4ΔН0f,298 (СО) + 2·ΔН0f,298 (SО2)) = =(4·(-393,51) + +128,37) - (4·(-110,53) + 2·(-296,9)) = - 409,75 кДж. 2) Визначаємо коефіцієнти в рівнянні ΔСр0 = f (Т). Виписуємо у таблицю з довідника емпіричні коефіцієнти багаточленів Ср0 = f (Т) для продуктів реакції та вихідних речовин. За їх значенням розраховуємо коефіцієнти в рівнянні ΔСр0 = f (Т). Речовина | Ср0 = f (Т), Дж/(моль · К) | Температурний інтервал, К | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| а | b · 103 | с´·10-5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| CO2 | 44,14 | 9,04 | -8,54 | 298 – 2500 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| S2 | 36,11 | 1,09 | -3,51 | 298 – 2000 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SО2 | 46,19 | 7,87 | -7,70 | 298 – 2000 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| СО | 28,41 | 4,10 | -0,46 | 298 – 2500 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Δа = (4·а(СО2) + а (S2))-(4·а(СО) + 2·а(SО2))= (4·44,14 + 36,11)-(4·28,41 + 2·46,19) = 6,65
За аналогією розраховуємо Δ b та Δ с´:
Δb = 5,11 · 10-3
Δс´ = - 20,43 · 105
Інтервал температур, в якому справедливі розраховані коефіцієнти, визначаємо за найменшим з усіх температурних інтервалів для реагуючих речовин.
Тоді, для даної реакції в інтервалі температур 298 – 2000 К отримаємо:
ΔС0р = 6,65 + 5,11· 10-3 · Т - 20,43· 105/Т2
3) Залежність ΔНr0 = f (Т) визначається за законом Кірхгофа:

Підставивши в попереднє рівняння значення ізобарного теплового ефекту реакції при стандартних умовах та коефіцієнтів Δа, Δb та Δс´, отримаємо ΔН0Т = f(Т):
 .
.
Підставивши Т = 700 К, визначаємо тепловий ефект реакції ΔН0700 :
 Відповідь: ΔН0700 = -410 кДж/моль.
Відповідь: ΔН0700 = -410 кДж/моль.
Задача 2.2.2. Для реакцій а) Mg(OH)2 = MgO + H2O(г); б) Al2O3(корунд) + 3SO3 = Al2(SO4)3(кр.), які перебігають при 400 К, визначте, наскільки за цих умов відрізняються теплові ефекти при сталому тиску і сталому об’ємі.
Розв’язання
Тепловий ефект при постійному тиску дорівнює: Qp = ΔH = ΔU + PΔV, а для ідеальних газів:
Qp = ΔH = ΔU + ΔnRT,
де Δn – зміна кількості молів газоподібних речовин під час проходження реакції.
Тепловий ефект при сталому об’ємі дорівнює QV = ΔU. Тоді, різниця теплових ефектів хімічної реакції в ізобарному та ізохорному процесах визначається наступним чином:
Qp - QV = ΔH - ΔU = ΔU + ΔnRT - ΔU = ΔnRT.
Визначаємо Δn для реакції а) Mg(OH)2(ТВ) = MgO(ТВ) + H2O(Г):
Δn = 1 - 0 = 1 (враховуємо тільки газоподібні речовини).
Тоді: Qp - QV = 1 · 8,314 · 400 = 3326 Дж.
Розраховуємо Δn для реакції б) Al2O3(КОРУНД) + 3SO3 = Al2(SO4)3(КР.):
Δn = 0 - 3 = -3
Тоді: Qp - QV = -3 · 8,314 · 400 = - 9977 Дж.
Відповідь: а) 3326 Дж.; б) - 9977 Дж.
Задача 2.2.3. 1. Обчисліть зміну ентропії ∆SΣ при нагріванні 25 кг метанолу від Т1 до Т2 , якщо відомі температури його плавлення та кипіння, теплоємності в рідкому та газоподібному стані, теплоти плавлення й випаровування.
2. Обчисліть зміну ентальпії ∆Н, енергії Гібса ∆G, енергії Гельмгольца ∆A, внутрішньої енергії ∆U, роботи розширення W, якщо 5 молей речовини, пари котрої підпорядковуються законам ідеальних газів, переходить при нормальній температурі кипіння з рідкого в газоподібний стан.
Речовина СН3 –ОН; g = 25 кг.; T1 = 175,3 K; T2 = 400 K;
Tпл = 175,3 К; ∆Нпл = 3,17.103 Дж/моль;
Ткип = 337,9 К; ∆Нвип = 35,296.103 Дж/моль;
Сррід = 2,512.103 Дж/кг. К; Сргаз = 1,371.103 Дж/кг.К.
Розв’язання
1. Змінення ентропіі 25 кг СН3 –ОН при нагріві від Т1 = 175,3 К до Т2 = 400 К дорівнює сумі ∆S для кількох стадій:
І - плавлення СН3 –ОН при Тпл = 175,3 К - ∆S1,
ІІ - нагрів СН3 –ОН(рід) від Тпл = 175,3 К до Ткип = 337.9 К - ∆S2,
ІІІ - кипіння СН3 –ОН при Ткип = 337,9 К - ∆S 3,
ІV - нагрів СН3 –ОН(г) від Ткип = 337,9 К до Т2 = 400 К - ∆S4.
Тобто ∆SΣ = ∆S1 + ∆S2 + ∆S3 + ∆S4 ,
де ∆S2, ∆S4 – змінення ентропіі при нагріві рідкого та газоподібного
СН3 –ОН відповідно;
∆S1, ∆S3 – змінення ентропіі при плавленні та кипінні.
Знаходимо кількість речовини 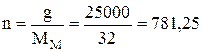 моль.
моль.
 Дж/К;
Дж/К;
 Дж/К;
Дж/К;
 Дж/К;
Дж/К;
 Дж/К;
Дж/К;
 Дж/К.
Дж/К.
2. Зміна ентальпії при випаровуванні 5 молей метанолу дорівнює:
ΔН = n ΔНвип = 5.35,296.103 = 176480 Дж.
Зміна енергії Гіббса розраховується за формулою:
 Для процесу випаровування, що відбувається за сталих тиску і температурі, зміна енергії Гельмгольца можна розрахувати таким чином:
Для процесу випаровування, що відбувається за сталих тиску і температурі, зміна енергії Гельмгольца можна розрахувати таким чином:
ΔА =ΔG – nRT = 0 – 5.8,31.337,9 = - 14039,75 Дж.
Робота розширення в ізобароізотермічних умовах
W = nRT = 14039,75 Дж.
За цих умов зміна внутрішньої енергії пов’язана зі зміною ентальпії рівнянням
ΔН = ΔU + nRT, звідки знаходимо:
ΔU = ΔН – nRT = 176480 – 5.8,31.337,9 = 162440,26 Дж.
Задача 2.2.5. Розрахувати зміну ентропії при стандартних умовах для хімічної реакції: 2С4Н10(Г) + 5О2 = 4СН3СООН(Р) + 2Н2О(Р). Необхідні дані візьміть в довіднику.
Розв’язання
Визначаємо зміну ентропії для реакції при стандартних умовах (величини ентропій вихідних речовин та продуктів реакції відповідно даних з довідника):
ΔS0298 = (2S0298(Н2О(Р)) + 4S0298(СН3СООН(Р))) - (5S0298(O2) + 2S0298(С4Н10(Г))) = (2.69,95 + 4·159,83) - (5·205,04 + 2·310,12) = -866,22 Дж/К.
Відповідь: ΔS0298 = -866,22 Дж/К.
Задача 2.2.6. 100 г водню при 298 К розширюються в вакуум, займаючи втричі більший об’єм. Обчисліть зміну ентропії, вважаючи водень ідеальним газом.
Розв’язання
Розширення водню відбувається при сталій температурі, тому скористаємось рівнянням:
ΔS = n·R·ln(V2/V1),
де кількість речовини n = 100/2 = 50 моль, а V2/V1 =3 за умовами завдання.
Отже, зміна ентропії складає:
ΔS = 50·8,314·ln3 = 457 Дж/К.
Відповідь: ΔS = 457 Дж/К.
Задача 2.2.7. Розрахуйте збільшення ентропії при змішуванні 100 см3 кисню та 200 см3 азоту при 298 К та 1,013·105 Па.
Розв’язання
Зміна ентропії при змішуванні двох газів дорівнює сумі змін ентропії кожного з газів при зворотному ізотермічному розширенні від початкового об’єму V1 або V2 до кінцевого V1 + V2:
ΔS = ΔS1 + ΔS2,
де ΔS1 = n1·R·ln((V1 + V2)/V1) та ΔS2 = n2·R·ln((V1 + V2)/V2).
Розраховуємо кількість кисню n1 та азоту n2 за рівнянням стану ідеального газу:
P·V = n·R·T , звідки n = P·V/R·T.
Тоді: n1 = P·V1/R·T = 1,013 · 105 · 100 · 10-6/8,314 · 298 = 0,0041 моль;
n2 = P·V2/R·T = 1,013 · 105 · 200 · 10-6/8,314 · 298 = 0,0082 моль.
Визначаємо зміну ентропії кисню та азоту:
ΔS1 = 0,0041·8,314·ln((100 · 10-6 + 200 · 10-6)/100 · 10-6) = 0,037 Дж/К,
ΔS2 = 0,0082·8,314·ln((100 · 10-6 + 200 · 10-6)/200 · 10-6) = 0,028 Дж/К.
Тоді, збільшення ентропії при змішуванні кисню та азоту:
ΔS = 0,037 + 0,028 = 0,065 Дж/К.
Відповідь: ΔS = 0,065 Дж/К.
Задача 2.2.8. Визначте роботу ізобарного зворотного розширення 5 моль ідеального газу при його нагріванні від 298 до 400 К.
Розв’язання
Роботу ізобарного розширення визначаємо за рівнянням:
W = P·(V2 – V1).
Для ідеальних газів воно набуває вигляд:
W = n·R·(Т2 – Т1).
Тоді: W = 5 · 8,314 · (400 - 298) = 4,240 · 103 Дж.
Відповідь: 4,240 · 103 Дж.
Задача 2.2.9. Газоподібні речовини А і В реагують з утворенням газоподібної речовини С:
3А + В = 4С
Виразіть Кр і Кс через рівноважну кількість речовини С, якщо А та В взяли в стехіометричних кількостях при загальному тиску в системі Р і температурі Т.
Розв’язання
За умовами задачі А та В взяли в стехіометричних кількостях, тобто n0A = 3 моль і n0В = 1 моль. Визначаємо рівноважні кількості А та В, прийняв до уваги, що рівноважна кількість С дорівнює х.
Кількість, моль 3А + В = 4С
Вихідна 3 1 0
Рівноважна 
 х
х
Константа рівноваги Кn має такий вираз
 . Тоді
. Тоді  .
.
Спростив вираз, отримаємо
 .
.
Кр пов’язана з Кn і Кс наступними співвідношеннями:
 ; Кр = Кс(RT) Δn.
; Кр = Кс(RT) Δn.
Кількість речовини в рівноважній системі складає
Σn =  +
+  + х = 4, а Δn = 4 – (3 + 1) = 0.
+ х = 4, а Δn = 4 – (3 + 1) = 0.
Оскільки Δn = 0, то таким чином, відповідь:  .
.
Задача 2.2.10. Константа рівноваги (К0) хімічної реакції синтезу етилацетату: С2Н5ОН(Г) + СН3СООН(Г) → СН3СООС2Н5(Г) + Н2О(Г), дорівнює при 573 К 9,00, а при 423 К – 30,0. Розрахуйте тепловий ефект цієї реакції.
Розв’язання
Якщо тепловий ефект ΔН не залежить від температури, тоді його значення можна визначити за наближеною формою рівняння ізобари:
ln(K02/K01) = ΔН·(T2 – T1)/R·T2·T1 .
Звідси: ΔН = R·T2·T1·ln(K02/K01)/(T2–T1) = 8,314·423·573·ln(30,0/9,00)/(423–573) = -16,2·103 Дж/моль
Відповідь: ΔН = -16,2·103 Дж/моль.
Задача 2.2.11. Для хімічної реакції: 4СО + 2SО2 = S2 + 4CO2, розрахуйте стандартну спорідненість при 600 К.
Розв’язання
1) Стандартну спорідненість (стандартну зміну енергії Гібса) при температурі Т розраховуємо за методом Тьомкіна – Шварцмана:
ΔG0Т = ΔН0298 - Т · ΔS0298 - Т · (Δа · М0 + Δb · М1 + Δc · М2 + Δc´ · М-2).
2) Визначаємо тепловий ефект реакціі при 298 К:
ΔН0298 = (4ΔН0f,298(CO2) + ΔН0f,298(S2)) - (4ΔН0f,298(СО) + 2ΔН0f,298(SО2)) =
(4·(-393,51) + 128,37) - (4·(-110,53) + 2·(-296,9)) = -409,75 кДж.
3) Обчислюємо зміну ентропії при 298 К:
ΔS0298 = (4S0298(CO2)+S0298(S2))-(4S0298(СО)+2S0298(SО2)) = (4·213,66+228,03) -(4·197,55+2·248,07) = -203,67 Дж/K.
4) Розраховуємо коефіцієнти в рівнянні ΔСр° = f (Т).
Речовина
Ср0 = f (Т),
Дж/(моль · К)
Δ а = (4а(СО2) + а (S2))-(4а(СО) + 2а(SО2))= (4·44,14 + 36,11) - (4·28,41 + 2·46,19) = 6,65.
За аналогією розраховуємо Δ b та Δ с´:
Δ b = 5,11 · 10-3; Δ с´ = -20,43 · 105.
Оскільки вихідні речовини та продукти реакції є неорганічними речовинами, Δс = 0.
Для T = 600 K згідно з довідником : М0 = 0,1962; М1 = 0,0759·103; М2 = 0,0303·106; М-2 = 0,1423·10-5.
Тоді, стандартна зміна енергії Гіббса при 600 К складає:
ΔG0600 = -409750 - 600 · (-203,67) - 600 · (6,65· 0,1962 + 5,11· 10-3 · 0,0759 · 103 + 0 · 0,0303 · 106 + (-20,43 · 105) · 0,1423 · 10-5) = -286,82·103 Дж
Відповідь: ΔG0600 = -286,82 кДж.
Завдання 2.
Фазові рівноваги в однокомпонентних системах.
За залежністю тиску насиченої пари від температури і густини речовини А у твердому і рідкому станах (dТВ і dРІД в кг/м3) в потрійної точці:
1) побудуйте графік залежності ln p від 1/Т;
2) визначить за графіком координати потрійної точки;
3) розрахуйте середню теплоту випаровування і сублімації;
4) визначить теплоту плавлення речовини при температурі потрійної точки;
5) обчисліть dT/dp для процесу плавлення при температурі потрійної точки;
6) обчисліть температуру плавлення речовини при тиску р;
7) обчисліть зміну ентропії, енергії Гіббса, енергії Гельмгольца, ентальпії і внутрішньої енергії для процесу сублімації 1 кмоля речовини в потрійної точці;
8) визначить число фаз і число термодинамічних ступенів свободи для фігуративних точок, вибраних вами на “полі” діаграми, “лінії” і “точці”.
Необхідні для розрахунку дані взяти із таблиці 2.3.
Таблиця 2.3
Вихідні дані до завдання 2
| № | Стан | Умови | ||||||
| твердий | рідкий | |||||||
| Т, К | р, Па | Т, К | р, Па | |||||
| 1 | 268,2 269,2 270,2 271,2 272,2 | 401,2 437,2 475,9 517,2 533,2 | 269,2 272,2 273,2 275,2 278,2 283,2 288,2 | 505 533,2 573 656 760 982 1600 | М = 18 р = 40,5.105 Па dтв = 918 dрід = 1000 | |||
| 2 | 248 254,4 258 259 260 | 7998 13300 17995 19995 23327 | 260 265 270 278 282 | 23327 27190 31860 40290 47990 | М = 27 р = 800.105 Па dтв = 718 dрід = 709 | |||
| 3 | 55 58 59,2 63 64 | 1333 3999 11997 14663 17329 | 60 64 66 67,8 69 71 | 12663 17329 22394 27993 31993 39990 | М = 28 Р = 500.105 dтв = 1026 dрід = 808 | |||
| 4 | 100 104 107 109 110,5 112 | 4132 8531 14663 19995 25367 29653 | 105 112 114 115 116 117 | 17329 29653 34738 38657 46435 53053 | M = 30 р = 900.105 Па dтв = 1272 dрід = 1260
| |||
| 5 | 229,2 248 257 267,2 273,2 | 133,3 694,5 1333 2966 4786 | 273,2 282,5 298,2 306,7 312,5 316,5 | 4786 6665 12697 16396 18929 21328 | М = 32 р = 300.105 Па dтв = 837 dрід = 825 | |||
| 6 | 173 178 183 184 190 | 7330 11600 16795 19995 31192 | 190 195 200 207 215 221 | 31192 38657 46655 55986 69476 77314 | М = 34 р = 450.105 Па dтв = 1010 dрід = 980 | |||
| 7 | 196 203 213 220 | 101325 190461 402360 648480 | 212 220 223 239 241 243 | 592751 648480 674824 1005114 1065237 1131722 | М = 44 р = 750.105 Па dтв = 1542 dрід = 1510 | |||
| 8 | 276,6 278,2 279,2 280,2 281,4 | 1413 1706 1879 2066 2372 | 277,2 279,2 281,4 283,2 285,2 288,7 | 1826 2052 2372 2626 2932 3279 | М = 46 р = 950.105 Па dтв = 1240 dрід = 1230 | |||
| 9 | 230 233 237 240 243 245 | 26260 31458 39990 49997 58818 66650 | 236 246 248 249 252,5 253,5 | 63315 78647 83979 86645 96942 100508 | М = 52 р = 350.105 Па dтв = 3010 dрід = 2955 |
|||
Последнее изменение этой страницы: 2019-04-10; Просмотров: 97; Нарушение авторского права страницы