
|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |

|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |
Сборник лабораторных работСтр 1 из 8Следующая ⇒
Х 465 ХИМИЯ Сборник лабораторных работ Методическое пособие НОВОСИБИРСК Министерство образования и науки Российской Федерации
НОВОСИБИРСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ __________________________________________________________________________ 54 № 3846 Х 465
ХИМИЯ
Сборник лабораторных работ
Методическое пособие для студентов, обучающихся
НОВОСИБИРСК УДК 54(076.5) Х 465
Составители: А.И. Апарнев, Р.Е. Синчурина, С.Н. Овчинникова
Рецензент Т.П. Александрова
Работа подготовлена на кафедре химии
© Новосибирский государственный технический университет, 2010
ОГЛАВЛЕНИЕ
Введение............................................................................................................................... 4 Общие правила работы в химических лабораториях.............................. 7 Лабораторная работа № 1.............................................................................................. 8 Лабораторная работа № 2............................................................................................ 13 Лабораторная работа № 3............................................................................................ 19 Лабораторная работа № 4............................................................................................ 24 Лабораторная работа № 5............................................................................................ 33 Лабораторная работа № 6............................................................................................ 38 Лабораторная работа № 7............................................................................................ 46 Лабораторная работа № 8............................................................................................ 57 Лабораторная работа № 9............................................................................................ 64 Лабораторная работа № 10.......................................................................................... 74 Список литературы......................................................................................................... 81 Приложение....................................................................................................................... 82
ВВЕДЕНИЕ Оказание первой помощи в лаборатории 1. При ожоге кислотами необходимо промокнуть фильтровальной бумагой или полотенцем обожженное место и промыть 2 %-м раствором соды (NaHCO3), затем перевязать бинтом. 2. При ожогах щелочью смыть обожженное место вначале теплой водой, затем 2 %-м раствором уксусной или борной кислоты, смазать борным вазелином или 5 %-м раствором перманганата калия и перевязать бинтом. 3. При термическом (тепловом) ожоге необходимо смочить обожженное место раствором перманганата калия или раствором соды и перевязать бинтом. 4. При ранении стеклом необходимо удалить кровь с пореза ватой, смоченной спиртом или раствором перманганата калия, смазать рану йодом и перевязать бинтом. Оформление отчета лабораторной работы Отчеты по лабораторной работе студент оформляет индивидуально на отдельных листах или в тетради (по указанию преподавателя). Запись должна быть аккуратной, разборчивой и содержать следующие сведения: – дату выполнения работы и ее название; – цель работы; – перечень необходимых реактивов, посуды, вспомогательных материалов, измерительных приборов (по указанию преподавателя); – номер и название опыта; – краткое, но ясное описание опыта (по указанию преподавателя); – уравнения всех происходящих в опыте реакций (с коэффициентами); – наблюдения; – таблицу с экспериментальными данными (с указанием единиц измерения), рисунки, схемы и графики с обозначениями; – формулы для расчетов в общем виде и расчеты параметров – выводы. Работа заканчивается представлением преподавателю отчета лабораторной работы.
ОПРЕДЕЛЕНИЕ МОЛЯРНОЙ МАССЫ Цель работы. Определение молярной массы эквивалентов металла по объему водорода, выделившегося при взаимодействии металла с кислотой. Химический эквивалент Э – это реальная или условная частица вещества В, которая в данной обменной (кислотно-основной) реакции эквивалентна одному атому (иону) водорода или одному электрону е– в окислительно-восстановительной реакции. Фактор эквивалентности f экв – число, показывающее, какая доля реальной частицы вещества В эквивалентна одному иону водорода в кислотно-основной реакции или одному электрону в окислительно-восстановительной реакции. Величина, обратная фактору эквивалентности – число эквивалентности zэкв – показывает, сколько химических эквивалентов содержит одна формульная единица вещества: fэкв = Численное значение числа эквивалентности (zэкв) для веществ, участвующих в кислотно-основных реакциях, определяют по числу принятых или отданных (замещенных) протонов (ионов водорода Н+), а в окислительно-восстановительных реакциях – по числу принятых или отданных электронов е–. Например, при взаимодействии магния с разбавленной серной кис-лотой протекает реакция Mg + H2SO4 = MgSO4 + H2 . В данной реакции один моль магния замещает два иона водорода в кислоте. Поэтому fэкв(Mg) = ½, роль эквивалента магния будет выполнять частица, соответствующая ½ атома магния. Масса одного моля эквивалентов называется молярной массой эквивалентов Мэкв (г/моль): Мэкв(В) = fэкв·М(В) = В рассмотренной реакции Mэкв(Мg) и Мэкв(Н2SO4) будут иметь следующие значения: Mэкв(Мg) = ½ М(Mg) = ½ · 24, 3 = 12, 15 г/моль, Мэкв(Н2SO4) = ½ М(H2SO4) = ½ · 98 г/моль = 49 г/моль. Например, при взаимодействии фосфорной кислоты Н3РО4 и гидроксида калия КОН в зависимости от их соотношения реакция может протекать с образованием различных продуктов: а) Н3РО4 + КOH = КH2PO4 + H2O При соотношении кислоты и основания 1: 1 фактор эквивалентности фосфорной кислоты fэкв равен 1, так как только один ион водорода Н+ в кислоте замещается на ион металла, т.е. кислота ведет себя как одноосновная. Роль химического эквивалента будет выполнять реальная частица – молекула фосфорной кислоты. Молярная масса эквивалентов фосфорной кислоты: Мэкв(Н3РО4)= fэкв · М(Н3РО4) = 98 г/моль; б) Н3РО4 + 2 КОН = К2НРО4 + 2 Н2О При соотношении кислоты и основания 1: 2 фактор эквивалентности фосфорной кислоты равен ½ , поскольку в данной реакции кислота ведет себя как двухосновная, а эквивалентом кислоты в данной реакции будет условная частица – ½ молекулы кислоты Н3РО4. Молярная масса эквивалентов фосфорной кислоты: Мэкв(Н3РО4)= fэкв·М(Н3РО4) = ½ · 98 = 49 г/моль; в) Н3РО4 + 3 КОН = К3РО4 + 3 Н2О. При соотношении кислоты и основания 1: 3 фактор эквивалентности фосфорной кислоты равен 1/3, поскольку в данной реакции кислота ведет себя как трехосновная, а эквивалентом кислоты в данной реакции будет условная частица – 1/3 молекулы кислоты Н3РО4. Молярная масса эквивалентов фосфорной кислоты: Мэкв(Н3РО4)= fэкв·М(Н3РО4) = 1/3 · 98 = 32, 67 г/моль. Фактор эквивалентности гидроксида калия во всех реакциях равен единице, так как только одна гидроксильная группа ОН– в этом основании может замещаться на кислотный остаток, а роль эквивалента будет выполнять реальная частица – молекула КОН. Фактор эквивалентности гидроксида калия: fэкв(КОН) =1. Молярная масса эквивалентов гидроксида калия: Мэкв(КОН)= fэкв·М(КОН) = 1 · 56 = 56 г/моль. Зная массу вещества и молярную массу эквивалентов этого вещества, можно определить количество вещества эквивалентов (число моль эквивалентов данного вещества):
Для веществ, находящихся в газообразном состоянии, можно определить эквивалентный объем Vэкв (В). Эквивалентный объем газа (В) равен произведению фактора эквивалентности на молярный объем (Vm) Vэкв(В) = fэкв(В)V m . Эквивалентный объем зависит от свойств и состава газа, участвующего в реакции, и измеряется в л/моль, например, для газообразных водорода и кислорода: Vэкв(Н2) = ½ ·22, 4 л/моль = 11, 2 л/моль, Vэкв(О2) = 1/4·22, 4 л/моль = 5, 6 л/моль. Для выполнения расчетов, связанных с взаимодействием различных веществ, используют закон эквивалентов: вещества взаимодействуют друг с другом в эквивалентных соотношениях: nэкв(А) = nэкв(В),
где m(A) и m(B) – массы реагирующих веществ. Если одно из веществ находится в газообразном состоянии, то его количество выражают в объемных единицах, тогда согласно закону эквивалентов:
Экспериментальная часть Для измерения объема водорода, выделившегося в результате взаимодействия металла с серной кислотой, используют эвдиометр (рис. 1). Прибор состоит из двух бюреток, соединенных между собой резиновым шлангом. Бюретка закрыта пробкой с газоотводной трубкой, соединяющая ее с пробиркой, в которой будет проводиться химическая реакция.
Рис. 1. Эвдиометр: 1 – бюретка 1; 2 – бюретка 2; 3 – пробирка;
Выполнение опыта 1. Налейте в пробирку с помощью мерного цилиндра 4–5 мл серной кислоты H2SO4. 2. Получите у преподавателя навеску металла (завернутую в фильтровальную бумагу). 3. Поддерживая пробирку в наклонном положении, не разворачивая навеску из фильтровальной бумаги, поместите ее на стенку у отверстия пробирки. 4. Осторожно, но плотно закройте пробирку пробкой с газоотводной трубкой и укрепите пробирку в лапке штатива. 5. Проверьте прибор на герметичность. Для этого переместите бюретку 2 вместе с лапкой штатива на 5–10 см выше, чем уровень воды в бюретке 1. 6. Если по истечении 30 секунд уровень воды в бюретках остается постоянным, прибор герметичен. 7. Верните бюретку 2 в положение так, чтобы уровень воды в бюретках 1 и 2 был одинаков. 8. Отметьте уровень в бюретке 1 по нижнему мениску воды. При этом положение мениска жидкости и глаз над поверхностью стола должны совпадать. 9. Запишите уровень воды в бюретке 1 (V, мл). 10. Осторожно выньте из лапки штатива пробирку и стряхните металл в кислоту, затем закрепите пробирку в штативе, дайте ей охладиться. 11. Приведите воду в бюретках к одинаковому уровню, опустив бюретку 2 вниз. 12. Запишите новое значение уровня воды в бюретке 1.
В отчете приведите экспериментальные и расчетные данные: 1) масса навески металла, m (г); 2) уровень воды в бюретке до опыта, V1 (мл); 3) уровень воды в бюретке после опыта, V2 (мл); 4) объем выделившегося водорода, 5) температура, К; 6) атмосферное давление, ратм (мм рт.ст.); 7) давление насыщенного водяного пара, 8) парциальное давление водорода в смеси, 9) объем выделившегося водорода при нормальных условиях (Т0=273 К, р0=760 мм рт.ст.)
10) Экспериментальное значение молярной массы эквивалентов металла по закону эквивалентов:
учитывая, что 11) Теоретическое значение молярной массы эквивалентов ме-талла:
12) Укажите, какой металл взаимодействовал с кислотой. 13) Запишите молекулярное и ионно-молекулярное уравнения реакции взаимодействия металла с кислотой. Укажите признак реакции. 14) Сделайте вывод, основываясь на законе эквивалентов.
ЛАБОРАТОРНАЯ РАБОТА № 2 ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ Цель работы. Проведение качественных опытов, раскрывающих окислительные и восстановительные свойства отдельных веществ; освоение методики составления уравнений окислительно-восстанови-тельных реакций методом электронного баланса. Окислительно-восстановительными реакциями (ОВР) называются реакции, протекающие с изменением степени окисления одного или нескольких элементов, входящих в состав реагирующих веществ. Степень окисления (с.о.) – это условный заряд, который приписывается атому в молекуле, вычисленный исходя из предположения, что молекула состоит только из ионов. Численно эта характеристика может иметь положительное, отрицательное, нулевое, а также целое или дробное значение. Основные положения теории ОВР состоят в следующем. 1. Окисление – это процесс отдачи электронов. Вещество (ион, атом, молекула), отдающее электроны, называется восстановителем. В процессе реакции восстановитель окисляется, а значение его с.о. повышается. 2. Восстановление – это процесс присоединения электронов. Вещество (ион, атом, молекула), принимающее электроны, называется окислителем. В процессе ОВР окислитель восстанавливается, а значение его с.о. понижается. 3. В замкнутой системе число электронов, отданных восстановителем, равно числу электронов, принятых окислителем. Уравнения, отражающие процессы окисления и восстановления с указанием соответствующего числа отданных и принятых электронов, называются электронными уравнениями. 4. Восстановление и окисление – два неразрывно связанных процесса: не существуют один без другого. Типичные восстановители: почти все металлы; некоторые неметаллы (Н2, С, Р, Si); сложные вещества, молекулы которых содержат элементы в низшей степени окисления ( Типичные окислители: O2; O3; галогены (F2, Cl2, Br2, I2); сложные вещества, молекулы которых содержат элементы в высшей степени окисления ( Если вещество содержит элемент в промежуточной степени окисления, то в зависимости от условий проведения реакции оно может быть и окислителем, и восстановителем ( Для составления уравнений окислительно-восстановительных реакций используют метод электронного баланса. Данный метод основан на том, что число электронов, отдаваемых восстановителем и принимаемых окислителем, должно быть одинаковым. Рассмотрим реакцию, протекающую по схеме
Рекомендуется следующая последовательность действий. 1. Вначале в заданной схеме реакции определяют элементы, которые изменили значение с.о.:
2. Далее составляют электронные уравнения процессов окисления и восстановления, и методом наименьшего общего кратного находят дополнительные множители для процессов окисления и восстановления:
При составлении электронных уравнений необходимо вести расчет на количество атомов элемента окислителя или восстановителя, содержащихся в одной молекуле (формульной единице) вещества. В данном случае для K2Cr2O7 расчет производится на 2Cr+3. 3. Затем определяют, какое вещество является окислителем, а какое – восстановителем: NaNO2 является восстановителем за счет атома азота, с.о. которого повышается с +3 до +5, а K2Cr2O7 – окислитель за счет атома хрома, понижающего с.о. с +6 до +3. 4. Найденные множители проставляют перед формулами веществ, участвующих в процессах окисления и восстановления, учитывая стехиометрические индексы при молекулах восстановителей и окисли-телей. 5. Остальные коэффициенты подбирают в следующем порядке: – перед соединениями, содержащими атомы металлов, которые не изменили с.о.; – перед формулой вещества, создающего кислую или щелочную среду в растворе. 6. В последнюю очередь уравнивают число атомов водорода и кислорода: вначале водорода по воде, а затем проверяют числа атомов кислорода в левой и правой частях уравнения.
Различают следующие типы ОВР. 1. Межмолекулярные ОВР – это реакции, в которых элементы, изменяющие с.о., находятся в составе разных веществ.
2. Внутримолекулярные ОВР – это реакции, в которых атомы-окислители и атомы-восстановители входят в состав одного и того же вещества. 3. Реакции самоокисления – самовосстановления (диспропорционирования) – один и тот же элемент, находящийся в промежуточной степени окисления, и окисляется, и восстанавливается. Частный случай таких реакций – реакции конмутации. Это процессы взаимодействия окислителя и восстановителя, в состав которых входит один и тот же элемент с разными степенями окисления, продуктом реакции является вещество с промежуточной с.о. данного элемента.
Экспериментальная часть Опыт 1. Окислительные свойства а) Среда кислая Внесите в пробирку 5-7 капель 0, 1 М раствора перманганата калия KMnO4, добавьте 1-2 капли 1М раствора серной кислоты H2SO4, а затем внесите с помощью микрошпателя небольшое количество кристаллического сульфита натрия Na2SО3. Перемешайте реакционную смесь, осторожно встряхивая содержимое пробирки. Укажите изменение окраски раствора. Определите степени окисления всех элементов. Составьте электронные уравнения процессов окисления и восстановления, расставьте коэффициенты в уравнении реакции, используя метод электронного баланса: KMnO4 + H2SO4 + Na2SO3 → K2SO4 + MnSO4 + Na2SO4 + H2O. Укажите окислитель и восстановитель, рассчитайте молярные массы их эквивалентов. б) Среда нейтральная Внесите в пробирку 5-7 капель 0, 1 М раствора перманганата калия KMnO4, и добавьте с помощью микрошпателя небольшое количество кристаллического сульфита натрия Na2SО3. Перемешайте реакционную смесь, осторожно встряхивая содержимое пробирки. Отметьте происходящие изменения в растворе, укажите окраску образовавшегося осадка. Определите степень окисления марганца в оксиде марганца(IV)? Составьте электронные уравнения процессов окисления и восстановления, расставьте коэффициенты, используя метод электронного баланса: KMnO4 + H2O + Na2SO3 → MnO2 + Na2SO4 + КОН. Рассчитайте молярную массу эквивалентов молекулы окислителя. в) Среда щелочная Внесите в пробирку 5-7 капель 0, 1 М раствора перманганата калия KMnO4, добавьте 1-2 капли 1М раствора гидроксида натрия NaOH, а затем внесите с помощью микрошпателя небольшое количество кристаллического сульфита натрия Na2SО3. Перемешайте реакционную смесь. Укажите изменение окраски растворов. Определите степень окисления марганца в манганатах калия K2MnO4 и натрия Na2MnO4. Составьте электронные уравнения процессов окисления и восстановления, расставьте коэффициенты, используя метод электронного ба-ланса: KMnO4 + NaOH + Na2SO3 → K2MnO4 + Na2MnO4 + Na2SO4 + H2O. Рассчитайте молярную массу эквивалентов молекулы окислителя. В выводе укажите, при какой реакции среды глубина восстановления (окислительная способность) перманганата калия больше и почему. К какому типу принадлежат эти окислительно-восстановительные реакции. Опыт 2. Окислительно-восстановительные свойства а) Внесите в пробирку 4-5 капель 0, 1 М раствора йодида калия KI, добавьте 1-2 капли 1М раствора серной кислотой H2SO4 (подкислите), а затем добавьте 2-3 капли концентрированного раствора пероксида водорода Н2О2. Отметьте наблюдаемые изменения окраски раствора. Докажите образование свободного йода I2, добавив в пробирку Определите степени окисления элементов в реагентах и продуктах реакции. Составьте уравнение реакции, используя метод электронного баланса: KI + H2SO4 + H2O2 → I2 + K2SO4 + H2O. Укажите окислитель и восстановитель, рассчитайте молярные массы их эквивалентов. б) Внесите в пробирку 5-7 капель 0, 1М раствора перманганата калия KMnO4, добавьте 1-2 капли 1М раствора серной кислоты H2SO4 (подкислите), а затем добавьте 2-3 капли концентрированного раствора пероксида водорода Н2О2. Отметьте наблюдаемые изменения окраски раствора, и обратите внимание на выделение пузырьков газа. Составьте уравнение реакции, используя метод электронного баланса: KMnO4 + H2SO4 + H2O2 → O2 + MnSO4 + K2SO4 + H2O. Чем является пероксид водорода в этой реакции? Сделайте вывод, почему Н2О2 проявляет окислительно-восстано-вительную двойственность? В каких случаях Н2О2 является окислителем, а в каких – восстановителем? Опыт 3. Термическое разложение бихромата аммония (NH4)2Cr2O7 (Опыт проводится демонстрационно для всей лаборатории.) Поместите небольшое количество кристаллического бихромата аммония (NH4)2Cr2O7 в виде горки на керамическую плитку или в фарфоровую чашку. Нагрейте в пламени горелки стеклянную палочку и внесите ее в середину подготовленной горки. Палочку необходимо подержать несколько секунд для начала реакции. Отметьте наблюдаемые явления. Составьте уравнение электронного баланса, укажите окислитель и восстановитель. Подберите коэффициенты в реакции, протекающей по схеме: (NH4)2Cr2O7 ® Cr2O3 + N2 + H2O. К какому типу принадлежит данная окислительно-восстановитель-ная реакция.
ЛАБОРАТОРНАЯ РАБОТА № 3 Экспериментальная часть Опыт. Определение теплоты нейтрализации Тепловые эффекты (энтальпии) различных процессов эксперимен-тально определяют с помощью прибора, называемого калориметром (рис. 2). Простейшая калориметрическая установка состоит из двух стаканов разного размера. В наружный стакан 1 большего объема вставляется внутренний стакан 2 меньшего размера. Внутренний стакан является реакционным сосудом, в котором осуществляется химическая реакция или другой процесс, сопровождающийся выделением или поглощением теплоты. Во избежание потерь теплоты через стенки калориметрического стакана между сосудами располагают пробковые прокладки 3. Калориметрический стакан закрывают крышкой 4 с отверстиями для термометра 5 (цена деления 0, 1º С) и воронки 6. Процесс проводят при перемешивании 7, способствующем выравниванию температуры во всех частях реакционной системы, на магнитной мешалке.
Рис. 2. Схема калориметрической установки: 1 – внутренний стакан; 2 – внешний стакан; 3 – термоизолирующая прокладка; 4 – крышка; 5 – термометр; 6 – воронка; 7 – магнитик для перемешивания;
Количество теплоты, выделяющейся или поглощающейся в калориметре, вычисляют по формуле Q = å С(Т2 – Т1), где Т2 и Т1 – конечная и начальная температуры жидкости в калориметрическом стакане, К; å С – теплоемкость системы, Дж/К. Суммарная теплоемкость системы складывается из теплоемкостей калориметрического стакана и находящейся в нем жидкости: å С = С1m1 + С2m2, где m1 и m2 – массы калориметрического стакана и жидкости в стакане, г; С1 и С2 – удельные теплоемкости стекла и жидкости, Сущность реакции нейтрализации сильной кислоты сильным основанием заключается в образовании воды, например: HCl(p) + NaOH(p) → NaCl(p) + H2O(ж) . Согласно теории электролитической диссоциации реакции нейтрализации отвечает термохимическое уравнение:
Выполнение опыта 1. С помощью мерного цилиндра отмерьте заданный объем V1 (по указанию преподавателя) 1 М раствора гидроксида натрия NaOH. 2. Установите на магнитной мешалке калориметрический стакан, в который поместите магнитик для перемешивания и через воронку налейте отмеренный объем раствора щелочи. 3. Включите перемешивающее устройство и установите равномерный режим перемешивания раствора. 4. Закройте крышкой калориметрический стакан и через отверстие (осторожно) в раствор щелочи погрузите термометр, закрепленный в лапке штатива. 5. Отметьте по термометру начальную температуру Т1 раствора с точностью до 0, 1 °С. 6. Налейте в мерный цилиндр такой же объем V2 1 М раствора соляной кислоты HCl и при работающей мешалке через воронку влейте раствор кислоты в калориметрический стакан. Отметьте самую максимальную температуру Т2, наблюдаемую после сливания растворов. 7. По окончании эксперимента отключите мешалку, разберите установку. В отчете: 1) запишите уравнение реакции взаимодействия соляной кислоты с гидроксидом натрия в молекулярной и ионно-молекулярной формах, термохимическое уравнение реакции нейтрализации; 2) результаты измерений занесите в табл. 1. Таблица 1
3) По полученным данным рассчитайте следующие величины: – разницу температур: DТ = Т2 – Т1; – массу жидкости (m2, г) в калориметрическом стакане: m2 = ρ (V1 + V2) при расчете считать плотность (ρ ) жидкости равной 1 г/мл; – суммарную теплоемкость калориметрической системы å С, Дж/К. При расчете использовать значения удельной теплоемкости: стекла – количество теплоты Q, выделившейся при реакции нейтрализации; – количество вещества (число молей) образовавшейся воды
– энтальпию реакции нейтрализации
и сравните с истинным значением – изменение энтропии реакции
– энергию Гиббса реакции нейтрализации
Сделайте вывод о направлении протекания, характере изменения энтальпии и энтропии реакции нейтрализации.
ЛАБОРАТОРНАЯ РАБОТА № 4 КИНЕТИКА ХИМИЧЕСКИХ РЕАКЦИЙ
Цель работы. Изучение влияния различных факторов на скорость химической реакции, а также изучение влияния температуры и концентрации реагирующих веществ на химическое равновесие. Скоростью химической реакции называют изменение концентрации реагирующего вещества в единицу времени. Скорость реакции определяется природой реагирующих веществ и зависит от условий протекания процесса (концентрации реагирующих веществ, температуры, степени измельчения веществ, наличия катализатора и др.). Зависимость скорости реакции от концентрации выражается законом действующих масс: при постоянной температуре скорость химической реакции пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам. Например, для гомогенной реакции, в которой реагенты и продукты находятся в одной фазе (жидкой или газовой), 2 NO(г) + O2(г) → 2 NO2(г) , закон действующих масс может быть записан в виде кинетического выражения скорости реакции: v = k× с2(NO)× с(О2), где v – скорость химической реакции; k – константа скорости; с(NO), с(О2) – молярная концентрация реагирующих веществ, моль/л. Реакция в гетерогенной системе осуществляется на поверхности раздела между фазами. Поэтому скорость гетерогенных реакций при постоянной температуре зависит не только от концентрации веществ, но и от площади поверхности раздела фаз. Площадь поверхности соприкосновения фаз (реагирующих веществ) определяется степенью измельчения твердых реагентов. Так, для реакции С(к) + О2(г) → СО2(г) закон действующих масс имеет вид v = k× с(О2)× s, где k – константа скорости; с(О2) – молярная концентрация кислорода, моль/л; s – площадь поверхности раздела между фазами. Концентрации веществ в твердом состоянии постоянны, поэтому в кинетическое уравнение гетерогенных реакций они не входят. В этом случае выражение скорости для прямой реакции будет иметь вид v = k× с(О2). Зависимость скорости реакции от температуры выражается правилом Вант-Гоффа
где Шведский ученый С. Аррениус на основании экспериментальных данных показал, что скорость и константа скорости возрастают с повышением температуры. Данная зависимость выражается уравнением Аррениуса:
где k – константа скорости реакции, k0 – предэкспоненциальный Энергия активации – это минимальная энергия, которой должны обладать реагирующие молекулы, чтобы их столкновение приводило к химическому взаимодействию. Уравнение Аррениуса позволяет проводить расчеты изменения скорости реакции при различных температурах:
Одним из способов ускорения реакции является катализ, который осуществляется при помощи веществ – катализаторов, увеличивающих скорость реакции, но не расходующихся в результате ее протекания. Механизм действия катализатора сводится к уменьшению величины энергии активации реакции, т. е. к уменьшению разности между средней энергией активных молекул (активированного комплекса) и средней энергией молекул исходных веществ. В отличие от необратимых (односторонних) реакций кинетически обратимые реакции характеризуются состоянием химического равновесия. Химическим равновесием называют такое состояние реагирующей системы, при котором скорость прямой реакции Количественно химическое равновесие характеризуется равновесным составом реакционной смеси, равновесной степенью превращения, равновесным выходом продуктов и константой химического равновесия. Величина, равная отношению произведения равновесных концентраций продуктов реакции к произведению равновесных концентраций исходных веществ, взятых в степенях, соответствующих их стехиометрическим коэффициентам в уравнении реакции, называется константой равновесия Kс. Для обратимой гомогенной реакции 2 Н2(г) + О2(г) « 2 Н2О (г) константа равновесия имеет вид
Для гомогенных химических равновесий, устанавливающихся в идеальных жидких системах, константу равновесия можно выразить через равновесные молярные концентрации (Kс), а для газообразных систем также через равновесные парциальные давления (Kр). Например, для гомогенной реакции СН4(г) + СО2(г) « 2 СО (г) + 2 Н2(г)
В выражение констант равновесия гетерогенных обратимых реакций не входят равновесные молярные концентрации чистых твердых и жидких веществ. Например, для обратимой гетерогенной реакции 2 N2O(г) + S(т) « 2 N2(г) + SO2(г) константа равновесия Kс будет иметь вид:
Константа равновесия зависит от природы реагентов, температуры и не зависит от исходной концентрации веществ в системе. В общем случае направление смещения равновесия обратимых реакций определяется принципом Ле Шателье–Брауна: если на систему, находящуюся в состоянии химического равновесия, оказывать внешнее воздействие путем изменения какого-либо из условий (с, р, Т), то равновесие смещается в направлении того процесса, протекание которого ослабляет эффект (влияние) внешнего воздействия. Экспериментальная часть Опыт 1. Зависимость скорости реакции Зависимость скорости реакции от концентрации реагирующих веществ в данном опыте изучают на примере реакции взаимодействия тиосульфата натрия Na2S2O3 с серной кислотой H2SO4: Na2S2O3 + H2SO4 = S¯ + SO2+ Na2SO4 + H2O. Качественным признаком реакции является помутнение раствора вследствие образования коллоидной серы. Скорость реакции измеряется временем от начала сливания растворов до появления во всех опытах одинаковой степени мутности раствора. Выполнение опыта В три пробирки налейте 1 н. раствор тиосульфата натрия Na2S2O3 и воду в количествах, указанных в табл. 2. Таблица 2
Содержимое пробирок 1 и 2 осторожно встряхните (перемешайте). К раствору тиосульфата натрия в первой пробирке добавьте каплю 2 н. раствора серной кислоты (необходимо стараться, чтобы капля кислоты сразу попала в раствор, а не на стенку пробирки), и сразу включите секундомер. Как только в растворе появится муть, остановите секундомер, замерьте время и запишите его в табл. 2. Аналогичные опыты повторите с пробирками 2 и 3. Занесите полученные данные в табл. 2. Рассчитайте условную скорость реакции. На основании полученных значений постройте график зависимости скорости реакции от концентрации Na2S2O3: по оси абсцисс отложите условную концентрацию Na2S2O3, по оси ординат – условную скорость реакции. Сделайте вывод о зависимости скорости реакции от концентрации тиосульфата натрия в растворе. Опыт 2. Зависимость скорости реакции от температуры Влияние температуры на скорость химической реакции в данном опыте изучается на примере реакции, описанной в опыте 1. Опыт проводят при следующих температурах: Т1 – комнатная температура, Т2 – на 10 °С выше комнатной температуры, Т3 – на 20 °С выше комнатной температуры. Экспериментальные данные опыта 1 для пробирки 1 перенесите в табл. 3. Укажите значение комнатной температуры (Т1), при которой проводился опыт 1. Выполнение опыта Заполните по две пробирки 1 и 2 в соответствии с данными табл. 3. Таблица 3
Приготовьте стакан с водой, температура которой на 10 °С выше комнатной температуры. В данный стакан поместите пробирки 1 и 2 и выдержите их в течение 3–5 минут. Быстро выньте пробирки, слейте их содержимое (раствор из пробирки 2 необходимо приливать к раствору тиосульфата в пробирке 1) и отметьте время до начала помут-нения. Аналогично повторите опыт при температуре на 20 ° выше комнатной. Данные (температуру Т2 и Т3, время до помутнения в опытах 2 и 3) занесите в таблицу (результаты опытов 2 и 3). Пользуясь правилом Вант–Гоффа и значениями условной скорости реакции при разных температурах, рассчитайте значения температурного коэффициента g1, g2, g сред по формулам:
Постройте график зависимости скорости реакции от температуры, отложив по оси абсцисс температуру, а по оси ординат величины Рассчитайте энергию активации данной реакции при температурах Т1 и Т2 по уравнению Аррениуса:
Сделайте выводы о выполнении правила Вант–Гоффа и о зависимости скорости химической реакции от температуры. Опыт 3. Влияние поверхности раздела Приготовьте два образца, приблизительно равные по массе: кусочек мела (мрамора) СаСО3 с площадью поверхности s1 и порошок мела (мрамора) с площадью поверхности фазы s2. В две пробирки внесите по 15-20 капель (~ 1 мл) концентрированного раствора соляной кислоты HСl. В одну пробирку внесите кусочек мела (мрамора), а в другую – порошок мела (мрамора). В какой из пробирок реакция протекает быстрее и почему? Напишите уравнение реакции взаимодействия карбоната кальция с соляной кислотой в молекулярном и ионно-молекулярном видах. Запишите кинетическое уравнение скорости гетерогенной реакции. Сделайте вывод о влиянии площади поверхности соприкосновения реагирующих веществ на скорость химической гетерогенной реакции. Опыт 4. Гетерогенный катализ При гетерогенном катализе реагирующие вещества и катализатор находятся в разных фазах, обычно катализатор является твердым веществом, а реагенты – газами или жидкостями. Химическое взаимодействие непосредственно протекает на поверхности катализатора. Поэтому активность катализатора зависит от свойств его поверхности: ее величины, химического состава, структуры. В данном опыте изучается скорость реакции разложения пероксида водорода Н2О2 в присутствии катализатора МnО2. Выполнение опыта Налейте в пробирку 1–2 мл 10%-го раствора пероксида водорода Н2О2. С помощью тлеющей лучинки убедитесь в отсутствии свободного газообразного кислорода. Затем внесите в раствор на кончике микрошпателя МnО2 и наблюдайте выделение газообразного кислорода. Убедитесь в наличии кислорода по загоранию тлеющей лучинки, внесенной в верхнюю часть пробирки. Напишите уравнение реакции разложения пероксида водорода в присутствии катализатора и запишите кинетическое уравнение для скорости каталитической реакции. Сделайте вывод о влиянии катализатора на скорость реакции разложения пероксида водорода. В выводе приведите определение гетерогенного катализа, катализатора. Как изменяется энергия активации каталитических реакций? Опыт 5. Химическое равновесие а) Влияние концентрации реагирующих веществ на химическое равновесие В данном опыте изучают обратимую реакцию взаимодействия хлорида железа(III) FeCl3 с роданидом аммония NH4SCN: FeCl3 + 3NH4SCN ↔ Fe(SCN)3 + 3NH4Cl. Образующийся в результате реакции роданид железа Fe(SCN)3 придает раствору кроваво-красную окраску, интенсивность которой зависит от концентрации Fe(SCN)3 в растворе. Это позволяет наблюдать за направлением (сдвигом) смещения равновесия при изменении концентрации веществ, участвующих в реакции. Выполнение опыта В химический стаканчик внесите по 2 капли 0, 005 М раствора FeCl3 и 0, 01 М раствора NН4SCN и добавьте с помощью мерного цилиндра 10–15 мл дистиллированной воды до образования прозрачного раствора красного цвета. Полученный раствор разделите на четыре пробирки. Поставьте все пробирки в штатив. В одну из пробирок добавьте 1–2 капли раствора FеCl3, в другую – 2–3 капли раствора NН4SCN, в третью – на кончике микрошпателя кристаллической соли хлорида аммония NН4Cl, четвертую пробирку оставьте для сравнения (эталон). Содержимое пробирок тщательно размешайте интенсивным встряхиванием или с помощью стеклянной палочки. Отметьте изменение интенсивности окраски растворов в каждой из пробирок в сравнении с эталоном. Исходные данные, наблюдения и выводы занесите в табл. 4 Таблица 4
В отчете запишите: – уравнение реакции взаимодействия между FeCl3 и NН4SCN в молекулярной и ионно-молекулярной форме; – кинетическое уравнение для скорости прямой и обратной реакции; – условие химического равновесия и выражение константы Kс равновесия данной реакции. Сделайте обобщенный вывод о влиянии концентраций исходных веществ и продуктов реакции на положение равновесия (как согласуются полученные данные с принципом Ле Шателье? ). б) Влияние температуры на химическое равновесие Наблюдать за смещением равновесия при изменении температуры можно в системе
Протекание прямого и обратного процессов в данной системе связано с изменением кислотно-основного характера среды. В результате протекания прямого процесса образуются гидроксидные ионы ОН–, и среда становится щелочной. О направлении смещения равновесия судят по изменению цвета растворов в присутствии индикатора фенолфталеина. Выполнение опыта В пробирку налейте 2-3 мл дистиллированной воды, добавьте 1–2 капли концентрированного раствора аммиака NH4ОН и 1-2 капли индикатора фенолфталеина. Отметьте окраску раствора. Полученный раствор нагрейте до кипения, а затем охладите холодной водой (под краном) или в стакане со снегом. Как изменилась окраска раствора при нагревании и после охлаждения? Дайте объяснения, записав уравнение обратимой реакции. Сделайте вывод о направлении смещения положения равновесия реакции диссоциации аммиака при нагревании и охлаждении. Объясните наблюдаемые явления с помощью принципа Ле Шателье.
ЛАБОРАТОРНАЯ РАБОТА № 5 ПРИГОТОВЛЕНИЕ РАСТВОРОВ
Цель работы. Освоение навыков приготовления растворов различной концентрации из сухой соли или более концентрированного раствора и методики их количественного анализа.
Растворы – однородные смеси переменного состава двух или большего числа веществ (компонентов), одним из которых является растворитель. Сумма масс всех компонентов раствора составляет его массу: mр-ра = mрастворенных веществ + mрастворителя . Массу раствора легко можно найти экспериментальным путем, зная его объем и плотность: mр-ра = Vr. Основной количественной характеристикой растворов является концентрация, которая отражает содержание растворенных веществ в единице массы, единице объема раствора или растворителя. Массовая доля – отношение массы растворенного вещества к массе всего раствора (в % – число граммов растворенного вещества в 100 г раствора):
Молярная концентрация (св) – число молей растворенного вещества в 1 л раствора:
Молярная концентрация эквивалентов (сэкв) – число молей эквивалентов растворенного вещества в 1 л раствора:
Титр (Тв) – число граммов растворенного вещества в 1 мл раствора Метод определения концентрации растворов
Ареометр - это стеклянный поплавок, имеющий вверху шкалу, градуированную в единицах плотности. Исследуемый раствор наливают в стеклянный цилиндр и подбирают такой ареометр, который свободно плавает в растворе, не касаясь стенок и дна сосуда. Плотность определяют по делению шкалы ареометра, до которого он погружается в раствор и, сравнивая полученное значение с табличными данными, находят концентрацию раствора (см. рисунок). Если в таблице нет значения плотности, точно соответствующего показанию ареометра, концентрацию находят интерполяцией. Например, измеренная плотность раствора карбоната натрия равна 1, 070 г/мл. В таблице имеются следующие значения:
Полученное значение 1, 070 г/мл отличается от плотности 6 %-го раствора на 1, 070 - 1, 0606 = 0, 0094 г/мл. Составляем пропорцию: 0, 0210 г/мл ¾ ¾ 2 % 0, 0094 г/мл ¾ ¾ х х = 0, 90 %. Таким образом, концентрация раствора карбоната натрия с плотностью 1, 070 г/мл равна 6 + 0, 90 = 6, 90 %. Экспериментальная часть Опыт 1. Приготовление водного раствора соли Получите у преподавателя задание: приготовить раствор соли c заданной массовой долей растворенного вещества (%) заданного объема (табл. 5). Таблица 5
Выполнение опыта 1. Рассчитайте массу соли mв-ва, массу воды и объем воды V ( 2. Взвесьте на технических весах на листе бумаги рассчитанную навеску соли и перенесите в химический стакан емкостью 150 мл. 3. Мерным цилиндром отмерьте рассчитанный объем дистиллированной воды и прилейте в стакан с солью. 4. Полностью растворите соль в отмеренном количестве воды, помешивая раствор стеклянной палочкой. 5. Перелейте приготовленный раствор в мерный цилиндр. 6. В присутствии преподавателя с помощью ареометра определите плотность полученного раствора (ρ эксп.). В отчете приведите расчеты массы соли mв-ва, массы воды и объем воды и рассчитайте: – массовую долю полученного раствора (ω эксп.); – молярную концентрацию (св); – молярную концентрацию эквивалентов (сэкв); – титр (Тв) приготовленного раствора. Опыт 2. Приготовление раствора заданной концентрации смешиванием растворов более высокой и более низкой Получите у преподавателя задание: приготовить заданный объем раствора хлорида натрия заданной концентрации, имея в своем распоряжении 5 %-й и 20 %-й растворы NaСl. Выпишите из таблицы приложения плотности приготовляемого и исходных растворов NaCl. Вычислите массу раствора mр-ра(х) с заданной массовой долей и объемом mр-ра(х) = Vr. Рассчитайте необходимые объемы исходных 5 %-го и 20 %-го раствора. Для расчета можно использовать правило смешения, известное под названием правило креста. Концентрации исходных растворов записываем в первом столбце, во втором столбце записываем заданную концентрацию. Разность между исходными концентрациями и заданной записываем в третьем столбце в направлении пересекающихся диагоналей. Полученные цифры а и в указывают, в каком соотношении по массе должны быть смешаны растворы. Массу приготовляемого раствора рассчитываем по формуле
х – заданная массовая доля. Она должна быть распределена между исходными растворами пропорционально найденным частям. Всего частей: а + в. Масса 20 %-го раствора NaCl, необходимая для приготовления заданного раствора, равна:
а объем его Аналогично рассчитывается масса и объем 5 %-го раствора NaCl:
Отмерьте вычисленные объемы исходных растворов мерным цилиндром, слейте их в колбу или стакан подходящего объема, тщательно перемешайте полученный раствор. Отлейте часть раствора в цилиндр, измерьте ареометром плотность приготовленного раствора. По таблице приложения найдите концентрацию раствора (в %). Определите относительную погрешность величины концентрации приготовленного раствора:
В отчете приведите расчеты массы заданного раствора, массы и объема 5 %-го и 20 %-го раствора и рассчитайте: – молярную концентрацию (св), – молярную концентрацию эквивалентов (сэкв), – титр (Тв) приготовленного раствора.
ЛАБОРАТОРНАЯ РАБОТА № 6 ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ.
Цель работы. Ознакомление с процессами, протекающими в водных растворах электролитов – диссоциация и гидролиз, сравнение свойств растворов сильных и слабых электролитов, гомогенных и гетерогенных равновесий в растворах электролитов. Жидкие растворы подразделяются на растворы электролитов, способные проводить электрический ток, и растворы неэлектролитов, которые не электропроводны. Процесс распада веществ на ионы под действием полярных молекул растворителя (например, воды) называется электролитической диссоциацией. Следствием электролитической диссоциации является электролитическая проводимость растворов электролитов (кислот, оснований, солей). Электролитическая диссоциация – процесс обратимый. В растворах электролитов имеет место равновесие между ионами и молекулами. Количественно диссоциация характеризуется степенью диссоциации a – отношение числа молекул, распавшихся на ионы (Ni), к общему числу растворенных молекул (Nобщ) электролита: a = Ni /Nобщ. Степень диссоциации электролита определяется экспериментально и выражается в долях единицы или в процентах. Степень диссоциации зависит от природы электролита, его концентрации, природы растворителя, присутствия в растворе одноименных ионов. По степени диссоциации электролиты делятся на сильные, средние и слабые. К сильным электролитам относятся такие, которые в 0, 1 М растворе имеют a > 30 %. Сильными электролитами являются: – почти все растворимые соли (кроме HgCl2, CdCl2, Fe(SCN)3, Pb(CH3COO)2 и некоторых других); – многие минеральные кислоты, например, HNO3, HCl, HI, HBr, H2SO4, HClO4 и др.; – основания щелочных и щелочно-земельных металлов, например, KOH, NaOH, Са(ОН)2, Ba(OH)2, La(OH)3 и др. У средних электролитов a = 3…30 % в 0, 1 M растворах; к ним относятся, например, H3PO4, H2SO3, HF, Mg(OH)2. Для слабых электролитов в 0, 1 М растворах a < 3 %; слабыми электролитами являются H2S, H2CO3, HNO2, HCN, H2SiO3, H3BO3, HClO и другие, а также большинство оснований многовалентных металлов, NH4OH и вода. Диссоциация слабых электролитов протекает обратимо. Многоосновные кислоты и многокислотные основания диссоциируют ступенчато. Например: Н2СО3 Û Н+ +
Al(OH)3 Û [Al(OH)2]+ + OH– (I ступень) [Al(OH)2]+ Û [Al(OH)]2+ + OH– (II ступень) [Al(OH)]2+Û Al3+ + OH– (III ступень) Ступенчатость диссоциации обусловливает возможность образования кислых и основных солей. Об относительной силе электролитов можно судить по электрической проводимости их растворов. Электрическая проводимость тем выше, чем больше ионов в растворе. При разбавлении растворов степень диссоциации электролита увеличивается. Присутствие в растворе одноименных ионов понижает степень диссоциации. Кроме степени диссоциации, состояние слабых электролитов в растворе характеризуется константой равновесия между молекулами и ионами, которую называют константой диссоциации. Например, для HNO2 Û H+ + NO2–
Между константой и степенью диссоциации слабого электролита существует взаимосвязь:
Это уравнение – математическое выражение закона разбавления Оствальда. Для слабого электролита при небольших разбавлениях a очень мала, а величина (1 – a) близка к единице. Поэтому при расчетах закон разбавления Оствальда можно использовать в виде
Вода – малодиссоциированное вещество. При ее электролитической диссоциации образуется равное количество ионов Н+ и ОН–: Н2О Û Н+ + ОН–. Константа диссоциации воды равна:
Молярная концентрация воды [H2O] составляет 55, 5 моль/л, откуда ионное произведение воды (постоянная воды): Kв = [H+][OH–] = 1, 8 . 10–16 × 55, 5 = 10–14 (при 25 °С). В нейтральном растворе: [H+] = [OH–] = Однако при добавлении к воде кислоты или щелочи ионное равновесие будет смещено влево (вспомните действие одноименного иона на степень диссоциации слабого электролита). Для кислых растворов [H+] > 10–7, а в щелочных – [H+] < 10–7. Количественно характер среды определяется водородным показателем рН, который вычисляется через отрицательный десятичный логарифм от концентрации ионов водорода: рН = - lg [H+]. Для нейтральных растворов рН равен 7, для кислых меньше 7, а для щелочных – больше 7. Если выражение для ионного произведения воды прологарифмировать и поменять знаки, то получим рН + рОН = 14. Характер среды раствора можно определить с помощью кислотно-основных индикаторов, меняющих свой цвет в зависимости от концентрации ионов водорода или гидроксид-ионов. Каждый индикатор характеризуется определенным интервалом рН раствора, при котором он изменяет свой цвет. Изменение цвета лакмуса от красного до синего происходит при рН от 5 до 8, метилового оранжевого – от розового до желтого – при рН от 3, 1 до 4, 4; фенолфталеина – от бесцветного до малинового – при рН от 8, 3 до 9, 8. Эти интервалы значений рН называются областями перехода окраски индикатора. Более точно рН раствора измеряется с помощью электрического прибора – рН-метра (потенциометра). Изменение характера среды раствора происходит не только в результате добавления к воде кислоты или щелочи, но и при растворении некоторых солей. Процесс обменного взаимодействия ионов соли с водой, который приводит к изменению среды раствора, называется гидролизом соли. Вследствие связывания ионов соли с ионами воды в малодиссоциированные соединения (молекулы или ионы) нарушается равновесие диссоциации воды в сторону ее усиления и накопления в растворе ионов водорода или гидроксид-ионов. При этом изменяется рН раствора. Причиной гидролиза соли является наличие в ней ионов слабого электролита: основания или (и) кислоты. Соли, образованные многозарядными катионами или анионами, гидролизуются ступенчато с образованием малодиссоциированных гидроксокатионов или гидроанионов. При комнатной температуре, как правило, гидролиз идет по первой ступени. Различают гидролиз соли: 1) по катиону (соли, образованные слабыми основаниями и сильными кислотами, NH4Cl, CuCl2, Zn(NO3)2, FeSO4 и т.п.), который приводит к связыванию гидроксид-ионов воды и накоплению ионов водорода, среда кислая, рН < 7 CuSO4 = Cu 2+ + Cu2+ + HOH Û (CuOH)+ + H+ (I ступень гидролиза, рН < 7) 2 CuSO4 + 2 Н2О Û (CuOH)2SO4 + H2SO4 ; 2) по аниону (соли, образованные сильными основаниями и слабыми кислотами, K2S, Na2CO3, KCN, NaNO2 и т. п.), который приводит к связыванию ионов водорода от воды и накоплению ионов ОН–, среда щелочная, рН > 7
K3PO4 + Н2О Û K2HPO4 + KOH; 3) по катиону и аниону (соли, образованные слабыми основаниями и слабыми кислотами, NH4CH3COO, (NH4)2S, Pb(CH3COO)2 и т. п.). NH4CH3COO =
Соли, гидролизующиеся и по катиону и аниону, в растворе, как правило, не существуют, так как они полностью разлагаются водой, образуя соответствующее слабое основание и слабую кислоту: 2 AlCl3 + 3 Na2S + 6 H2O → 2 Al(OH)3↓ +3 H2S↑ + 6 NaCl. Соли, образованные сильным основанием и сильной кислотой, гидролизу не подвергаются. Значение рН водных растворов таких солей равно 7. Для процесса гидролиза характерны следующие закономерности. 1. Гидролиз соли усиливается с повышением температуры и разбавлением раствора. 2. Реакция гидролиза соли обратима. В соответствии с принципом Ле Шателье процесс гидролиза должен подавляться при подкислении (если соль образована сильной кислотой и слабым основанием, накапливаются ионы Н+) или при подщелачивании (если соль образована слабой кислотой и сильным основанием, накапливаются ионы ОН–). 3. Гидролиз, в результате которого образуются малорастворимые или газообразные продукты, удаляющиеся из сферы реакции, необ-ратим. Полнота гидролиза характеризуется степенью гидролиза b, которая показывает отношение числа гидролизованных молекул к общему числу растворенных молекул: b = Nгидр /Nобщ. К реакции гидролиза соли применимы все положения и законы учения о химическом равновесии. Константа равновесия реакции гидролиза называется константой гидролиза соли Kг. Ее величина характеризует соотношение между равновесными концентрациями всех компонентов системы. Связь между константой гидролиза соли (Kг) и степенью гидролиза (b) в растворе заданной концентрации (св) выражается законом Оствальда:
Электролиты, обладающие ограниченной растворимостью в воде, характеризуются произведением растворимости. В насыщенном растворе труднорастворимого электролита, например Са3(РО4)2, устанавливается гетерогенное равновесие Са3(РО4)2(т) для которого произведение растворимости есть величина постоянная и равна произведению концентрации ионов, взятых в степенях, соответствующих коэффициентам в уравнении реакции ПР = [Ca2+]3[ Чем меньше величина ПР, тем труднее растворяется соединение, и наоборот, чем больше ПР, тем большей растворимостью обладает соединение. В случае, если величина ПР будет меньше величины произведения ионов в растворе, то самопроизвольно образуется осадок труднорастворимого соединения. Экспериментальная часть Опыт 1. Сравнение химической активности сильных а) На универсальную индикаторную бумагу нанесите по капле 0, 1М растворов соляной HCl и уксусной кислот СН3СООН. Определите значения рН растворов. Объясните, почему они различаются? Составьте уравнения процессов диссоциации в растворах данных электролитов. б) На универсальную индикаторную бумагу нанесите по капле 0, 1М растворов гидроксида натрия NaOH и гидроксида аммония NH4OH. Определите значения рН растворов. Объясните, почему они различаются? Составьте уравнения процессов диссоциации в растворах данных электролитов. Опыт 2. Влияние одноименного иона В две пробирки поместите по 2-3 капли разбавленной уксусной кислоты и добавьте по одной капле индикатора – раствора метилоранжа. Одну пробирку оставьте для сравнения, а в другую внесите микрошпателем 2-3 кристаллика ацетата натрия CH3COONa и хорошо перемешайте, встряхивая содержимое пробирки. Сравните окраску растворов в обеих пробирках и объясните ее изменение, пользуясь выражением константы диссоциации уксусной кислоты. Сформулируйте вывод: что необходимо добавить к раствору слабой кислоты, чтобы сместить равновесие в сторону образования недиссоциированных молекул. Опыт 3. Определение характера среды в растворах солей. Гидролиз солей Для определения реакции среды используйте универсальную индикаторную бумагу. Вначале нанесите несколько капель дистиллированной воды на полоску универсальной индикаторной бумаги и определите рН среды. Почему дистиллированная вода, находящаяся в лаборатории, показывает слабокислую реакцию? Затем в четырех пробирках растворите в 8-10 каплях дистиллированной воды по 2-3 кристаллика предложенных солей и с помощью универсальной индикаторной бумаги определите рН полученных растворов. Полученные данные занесите в табл. 6. Таблица 6
В отчете для каждой соли: – запишите уравнение диссоциации соли; – укажите состав и силу электролитов, которыми образована данная соль; – укажите, каким ионом определяется реакция среды; – запишите уравнения гидролиза растворов испытуемых солей в молекулярной и краткой ионно-молекулярной форме по первой ступени; – запишите выражение для константы гидролиза по первой ступени КгI, рассчитайте ее численное значение. Опыт 4. Влияние температуры на степень гидролиза Налейте в пробирку 2-3 мл раствора ацетата натрия и 1-2 капли раствора фенолфталеина. Отметьте интенсивность окраски раствора. Половину полученного раствора отлейте в другую пробирку и оставьте для сравнения, а оставшийся раствор нагрейте на спиртовке до кипения. Изменилась ли интенсивность окраски раствора? Охладите раствор и вновь сравните его с контрольным образцом. Объясните наблюдаемые явления. Напишите уравнение реакции гидролиза соли в молекулярной и ионно-молекулярной формах. Укажите знак величины теплового эффекта реакции гидролиза. Опыт 5. Условия выпадения и растворения осадков В одну пробирку внести 5 капель раствора хлорида кальция СаСl2, в другую 5 капель раствора хлорида бария ВаСl2. Затем в каждую пробирку добавить по 2-3 капли 0, 1 М раствора серной кислоты.
ЛАБОРАТОРНАЯ РАБОТА № 7 ДИСПЕРСНЫЕ СИСТЕМЫ Цель работы. Изучение способов получения коллоидных растворов методами диспергирования и конденсации и изучение их свойств. Дисперсные системы – это гетерогенные или гомогенные системы, состоящие из двух и более фаз: твердой, жидкой и газовой. Характеризуются сильно развитой поверхностью раздела между фазами. Фаза, являющаяся непрерывной (сплошной) и играющая роль растворителя, называется дисперсионной средой (ДС); другая фаза, раздробленная и распределенная в объеме ДС, – дисперсной фазой (ДФ). Дисперсных фаз (в виде мелких кристаллов, твердых аморфных частиц, капель или пузырьков) в системе может быть несколько. Например, в воздушной дисперсионной среде могут присутствовать частицы пыли разного химического состава и строения, капельки воды. Строение коллоидных частиц Всякий золь состоит из мицелл (дисперсная фаза) и интермицеллярной жидкости (дисперсионная среда). Мицелла состоит из ядра, окруженного двойным электрическим слоем (ДЭС). Рост кристаллов и стабилизация коллоидной системы обеспечивается специальными веществами электролитами – стабилизаторами. Ионы стабилизатора, адсорбируясь на поверхности микрокристаллика – агрегата, образуют заряженный слой, на основе которого и формируется двойной электрический слой. ДЭС состоит из адсорбционного и диффузного слоев. ДЭС образуется адсорбционным путем и путем поверхностной диссоциации. Природа стабилизатора определяется согласно правилу Панета-Фаянса: на кристалликах агрегата энергично адсорбируются из окружающего раствора те ионы, которые входят в состав кристаллической решетки малорастворимого соединения. В связи с этим стабилизатором могут служить ионы любого из реагентов, используемых для получения вещества дисперсной фазы, если этот реагент взят в избытке. В зависимости от природы стабилизатора на основе одного и того же агрегата возможно образование мицелл двух видов. Например, в результате реакции ионного обмена MnCl2 + 2 NaOH → Mn(OH)2¯ + 2 NaCl образуется золь малорастворимого соединения гидроксида марганца(II) Mn(OH)2, строение мицеллы которого можно записать следующим образом: а) в случае избытка MnCl2
б) в случае избытка NaOH
Составные части мицеллы: Агрегат – мельчайший кристаллик, состоящий из некоторого количества молекул (m), нерастворимый в дисперсной среде вещества. Ядро – включает агрегат и потенциалопределяющие ионы (ПОИ), входящие в адсорбционный слой (ионы стабилизатора). Гранула – заряженная, вследствие неполной компенсации заряда ПОИ, включает ядро и противоионы (ПИ) адсорбционного слоя. Мицелла – состоит из гранулы и ПИ диффузионного слоя. Мицелла электронейтральна. Экспериментальная часть Опыт 1. Получение гидрозоля серы методом конденсации Сера растворяется в этиловом спирте, образуя истинный раствор. В воде сера практически нерастворима, поэтому при добавлении воды к спиртовому раствору молекулы серы конденсируются в более крупные агрегаты. В пробирку, примерно наполовину заполненную дистиллированной водой, добавьте 2–3 капли насыщенного раствора серы в этиловом спирте. Содержимое пробирки тщательно перемешайте встряхиванием – получается молочно-белый опалесцирующий золь. Налейте полученный золь в кювету (l = 1 см) и через золь в кювете пропустите луч света – наблюдайте (при слабом затемнении помещения) сбоку кюветы светорассеяние (конус Тиндаля). В отчете укажите способ получения золя серы, объясните наблюдаемые явления. Опыт 2. Получение золей берлинской лазури Fe4[Fe(CN)6]3 Реакция образования берлинской лазури протекает по схеме 3 K4[Fe(CN)6] + 4 FeCl3 → Fe4[Fe(CN)6]3 + 12 KCl. а) Налейте в пробирку 0, 5 мл 0, 005 н. раствора K4[Fe(CN)6] и разбавьте дистиллированной водой до 10 мл. Затем к разбавленному раствору при взбалтывании добавьте по каплям 0, 1 н. раствора хлорида железа(III) FeCl3 до образования прозрачного синего цвета золя берлинской лазури. б) Налейте в пробирку 0, 5 мл 0, 1 н. раствора FeCl3 и разбавьте водой до 5 мл. К полученному раствору при взбалтывании добавьте по каплям 0, 005 н. раствора K4[Fe(CN)6] до образования мутного раствора золя берлинской лазури сине-зеленого цвета. Знак заряда коллоидной частицы золя можно определить методом капиллярного анализа, который основан на том, что при смачивании водным раствором целлюлозные стенки капилляров фильтровальной бумаги заряжаются отрицательно, а пропитывающая бумагу вода – положительно. Поэтому золь с «+» заряженными частицами будет адсорбироваться бумагой и окрашивать ее. Пятно золя на бумаге в этом случае будет окрашено в центре и бесцветно по краям. Золь с отрицательно заряженными частицами не будет адсорбироваться бумагой и образует равномерно окрашенное пятно. На два листка фильтровальной бумаги нанесите по капле различных золей и наблюдайте за распределением окраски пятна, которое появится на бумаге после того, как золь впитается. Напишите молекулярное и ионно-молекулярное уравнения получения берлинской лазури. Напишите формулу каждой мицеллы и укажите знак заряда соответствующих частиц.
Опыт 3. Получение золя оксида марганца(IV) MnO2 Внесите в пробирку 0, 5 мл 0, 1М раствора KMnO4 и добавьте 4, 5 мл дистиллированной воды. В разбавленный раствор прибавьте по каплям 1, 5–2 мл 1 %-го раствора тиосульфата натрия Na2S2O3 до образования вишнево-красного золя MnO2. Составьте уравнение окислительно-восстановительной реакции получения золя MnO2 KMnO4 + H2O + Na2S2O3 → MnO2¯ + Na2SO4 + K2SO4 + KOH и напишите формулу мицеллы золя MnO2. Опыт 4. Получение золя гидроксида железа(III) Реакция получения золя гидроксида железа(III) при нагревании идет по схеме FeCl3 + 3H2O → Fe(OH)3¯ + 3HCl. При этом поверхностные молекулы агрегата Fe(OH)3 вступают в химическое взаимодействие с HCl: Fe(OH)3¯ + HCl ↔ FeOCl + 2 H2O. Молекулы FeOСl диссоциируют, образуюя ионы FeO+ и Cl– FeOCl ↔ FeO+ + Cl–. Выполнение опыта а) В коническую колбу емкостью 250 мл с помощью мерного цилиндра прилейте 100 мл дистиллированной воды и нагрейте до кипения. Затем быстро, но по каплям, в кипящую воду прилейте 10-15 мл 2 %-го раствора FeCl3. Полученную смесь прокипятите несколько минут до образования золя Fe(OH)3 красно-бурого цвета («чайной заварки»). Запишите уравнения получения золя гидроксида железа(III), формулы мицеллы, учитывая, что стабилизатором является FeOCl. Укажите заряд гранулы мицеллы. Нарушение агрегативной устойчивости золей – коагуляция – может происходить при добавлении электролита. Легкое помутнение золя свидетельствует о начале коагуляции. б) В 10 чистых пробирок внесите по 5 мл полученного и охлажденного до комнатной температуры золя Fe(OH)3. Затем добавьте указанное в табл. 8 количество дистиллированной воды и раствора электролита (1 н. раствор KCl, 0, 01 н. раствор K2SO4, 0, 001 н. раствор K3[Fe(CN)6]). Содержимое пробирок перемешайте взбалтыванием и через 30 мин отметьте, в каких пробирках наблюдается явная коагуляция (помутнение) и последующая седиментация (выпадение) осадка. При помутнении раствора в таблице поставьте знак «+». Порог коагуляции вычислите по формуле
где Ск – порог коагуляции, моль/л; Сэ – концентрация электролита, моль/л; Vзоля – объем золя, мл; Vэ – наименьший объем раствора электролита, достаточный для коагуляции, мл. Таблица 8
Порог коагуляции для каждого электролита (полученный разными группами студентов) запишите в табл. 9. Таблица 9
Сделайте вывод о выполнении правила Шульце–Гарди (применимость правила значимости). Запишите основные правила коагуляции электролитами.
ЛАБОРАТОРНАЯ РАБОТА № 8 КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ Цель работы. Изучение строения и свойств комплексных соединений. Комплексные соединения – сложные вещества, молекулы которых состоят из атома или иона – комплексообразователя, связанного с несколькими способными к самостоятельному существованию молекулами или ионами, называемыми лигандами. Согласно координационной теории Вернера, различают внутреннюю и внешнюю сферы комплексного соединения. Лиганды, непосредственно связанные с комплексообразователем, образуют вместе с ним по донорно-акцепторному механизму внутреннюю сферу – комплексный ион. Обозначается внутренняя сфера квадратными скобками: [SnCl6]2–, [HgI4]2–, [Al(H2O]3+ и др. Ионы, нейтрализующие заряд внутренней сферы, но не связанные с комплексообразователем ковалентно, образуют внешнюю сферу комплексного соединения. Комплексообразователями могут выступать любые атомы или положительно заряженные ионы, имеющие вакантные орбитали. Наиболее характерными комплексообразователями являются d-элементы побочных подгрупп (Ag+, Zn2+, Cr3+, Mn2+, Fe3+, Ni2+ и др.). В качестве лигандов могут выступать молекулы или анионы, обладающие неподеленными электронными парами – это простые анионы (F–, Cl–, Br–, I–), сложные анионы (ОН–, CN–, SCN–, Число химических связей, которые комплексообразователь образует с лигандами, называют координационным числом. Значение коорди-национного числа может изменяться в пределах от 2 до 12 и зависит от природы и степени окисления комплексообразователя, природы и дентатности лиганда, а также от условий (температуры, природы растворителя и др.), при которых протекает реакция комплексообразования. Число химических связей, которые образует один лиганд с комплексообразователем, называют дентатностью. Например, однозарядные анионы ( Между значением координационного числа и степенью окисления элемента комплексообразователя существует определенная взаимосвязь – чаще всего координационное число равно удвоенному значению степени окисления комплексообразователя: например, [Ag(NH3)2]+, [Zn(NH3)4]2+, [Cr(H2O)6]3+, [Fe(SCN)6]3– и др. В зависимости от знака заряда комплексного иона выделяют соединения, содержащие комплексные катионы, например [Co(H2O)6]2+, комплексные анионы, например [AlF6]3–, и нейтральные комплексы, например [Fe(CO)5]. По природе лигандов различают следующие комплексные соединения: – аквакомплексы, например [Cr(H2O)6]Cl2 (лигандами являются молекулы воды), – аммиакаты, например [Ni(NH3)4](NO3)2 (лиганды – молекула аммиака), – гидроксикомплексы, например Na2[Zn(OH)4] (лиганды – гидроксианионы ОН–), – ацидокомплексы, например K3[Fe(CN)6] (лиганды – анионы кислот), – смешанные комплексы, например [Co(H2O)(NH3)4Cl]SO4 (лиганды – любые молекулы и ионы)
Рассмотрим строение комплексных соединений на примере [Ag(NH3)2]Cl. Внутренняя сфера – комплексный катион [Ag(NH3)2]+; внешняя сфера – хлорид-ионы Cl–. Внутренняя сфера состоит из иона Ag+ – ион-комплексообразо-ватель, лигандов – молекул аммиака NH3. Число присоединившихся к комплексообразователю лигандов равно двум, поэтому в соединении [Ag(NH3)2]Cl ион Ag+ имеет координационное число, равное 2. Рассмотрим виды связей в комплексном соединении [Ag(NH3)2]Cl. Для этого запишем электронные формулы элементов и подчеркнем валентные электроны:
 Но 1s1 Но 1s1
No 1s2 2s2 2p3 Ago 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5s1 5po Ag+ 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 5so 5po
В молекуле аммиака NH3 между атомами азота и атомами водорода существует обычная ковалентная связь, образованная 1s электронами атома водорода и 2p электронами атома азота (обменный механизм). У атома азота имеется неподеленная пара 2s2 электронов. Азот предоставляет эту пару электронов иону серебра на свободные 5s и 5p орбитали. Между ионом Ag+ и молекулами NH3 образуется ковалентная связь по донорно-акцепторному механизму. Ag+ – акцептор электронов, азот в молекуле NH3 – донор. Типы связей в комплексном соединении [Ag(NH3)2]Cl:
Химическая связь между внутренней и внешней сферой комплекса – ионная.
В водных растворах комплексные соединения диссоциируют на Вначале происходит первичная электролитическая диссоциация – по типу сильного электролита – диссоциация протекает полностью на [Ag(NH3)2]Cl ® [Ag(NH3)2]+ + Cl–. Затем происходит вторичная диссоциация уже по типу слабого электролита – ступенчато отщепляются лиганды внутренней сферы. Каждая ступень диссоциации внутренней сферы комплекса характеризуется своей константой химического равновесия, произведение которых называется полной константой нестойкости. Например, для суммарного процесса диссоциации комплексного иона [Ag(NH3)2]+ ↔ Ag+ + 2 NH3 , применяя закон действующих масс к обратимым процессам, получим выражение для константы равновесия диссоциации комплексного
Величина Кн характеризует устойчивость комплексного иона. Чем больше Кн, тем менее устойчив комплексный ион. Непрочные (неустойчивые) комплексные ионы можно разрушить добавлением воды, так как при разбавлении увеличивается степень диссоциации. Например, ион [Co(SCN)4]2– неустойчив (Кн = 1, 0× 10–3), и при добавлении воды наблюдается переход фиолетовой окраски раствора, характерной для ионов [Co(SCN)4]2–, в розовую, характерную для иона Со2+. Устойчивые комплексные ионы можно разрушить, выводя из сферы реакции ионы или молекулы, образующиеся при диссоциации комплексного иона. В качестве примера рассмотрим разрушение комплексного иона [Ag(NH3)2]+ азотной кислотой НNО3. Ион [Ag(NH3)2]+ диссоциирует: [Ag(NH3)2]+ ↔ Ag+ + 2 NH3, Кн = 6, 8.10–8. При добавлении НNО3 ион Н+ выводит из сферы реакции молекулу аммиака, связывая ее в более прочный комплексный ион аммония: NН3 + Н+ ↔ В результате равновесие диссоциации [Ag(NH3)2]+ смещается вправо, концентрация Ag+ увеличивается и становится достаточной для образования осадка AgСl [Ag(NH3)2]Cl + 2 НNО3 = AgCl¯ + 2 NH4NО3. В отличие от комплексных соединений соединения с малоустойчивой внутренней сферой называют двойными солями. Их формулы записывают без квадратных скобок, как соединения молекул: (NH4)2SO4.Fe2(SO4)3; К2SO4.Al2(SO4)3. В растворах двойные соли диссоциируют практически полностью (NH4)2SO4.Fe2(SO4)3 → 2Fe3+ + 2 Экспериментальная часть Опыт 1. Свойства двойных и комплексных солей В три пробирки внесите по 5-7 капель 0, 5 н. раствора железоаммонийных квасцов (NH4)Fe(SO4)2× 12H2O. В четвертую пробирку поместите 3 капли раствора гексацианоферрата(III) калия K3[Fe(CN)6]. Докажите наличие ионов в первую пробирку прибавьте 2 капли раствора роданида аммония NH4SCN; во вторую – 2 капли раствора хлорида бария BaCl2; в третью – 3 капли 4 М раствора гидроксида натрия (содержимое этой пробирки нагрейте на водяной бане до появления специфического запаха аммиака; обнаружить газ можно по изменению окраски лакмусовой бумаги – для этого над раствором поместите смоченную водой полоску индикаторной бумаги); в четвертую – 2 капли роданида аммония NH4SСN. Во всех ли пробирках происходит реакция? Напишите уравнение электролитической диссоциации железоаммонийных квасцов, ионно-молекулярные уравнения реакций, с помощью которых были обнаружены ионы двойной соли в растворе, отметив качественный признак присутствия в растворе ионов Напишите уравнение диссоциации комплексной соли и выражение для константы нестойкости комплексного иона [Fe(CN)6]3–, запишите ее численное значение и сделайте вывод об устойчивости этого иона в растворе. В чем состоит сходство и различие в диссоциации двойных и комплексных солей? Опыт 2. Образование и диссоциация соединений а) Внесите в пробирку 5 капель 0, 1 М раствора сульфата меди(II) и прибавьте к нему 2-3 капли 2 М раствора аммиака, встряхивая пробирку для лучшего перемешивания содержимого. Наблюдайте выпадение осадка основной соли (CuOH)2SO4. Отметьте цвет осадка. Затем по каплям прибавьте избыток концентрированного раствора NH4OH до растворения осадка. Как меняется при этом цвет раствора и почему? В отчете: 1) запишите уравнение реакции получения основной соли (CuOH)2SO4; 2) запишите уравнение реакции получения комплексных соединений, учитывая, что в избытке аммиака образуются одновременно комплексное основание и комплексная соль меди(II), содержащие медно-аммиачный комплексный ион с координационным числом 4; 3) для комплексных соединений приведите: · названия и укажите: а) комплексообразователь, его координационное число и заряд, б) лиганды и их заряд, в) заряд внутренней сферы, г) ионы внешней сферы и их заряд; · напишите электронные формулы иона комплексообразователя, укажите, какие атомные орбитали участвуют в образовании химической связи; · напишите электронные формулы атомов лигандов и укажите неподеленные пары электронов донора; · запишите уравнение диссоциации комплексной соли в растворе и выражение для константы нестойкости комплексного иона, приведите ее численное значение;
б) Поместите в пробирку 5-7 капель 0, 5 М раствора нитрата висмута(III) и прибавьте к нему 2-3 капли 0, 5 М раствора иодида калия, встряхивая пробирку для лучшего перемешивания содержимого. Наблюдайте выпадение осадка средней соли – иодида висмута(III), отметьте его цвет. Добавьте еще несколько капель раствора КI до растворения выпавшего осадка. Каков цвет получившегося раствора? В отчете: 1) запишите уравнение реакций образования и диссоциации комплексного соединения и его координационную формулу, учитывая, что координационное число Вi3+ равно четырем; 2) составьте выражение для константы нестойкости комплексного иона, приведите ее численное значение. Опыт 3. Исследование устойчивости комплексных ионов Разрушение комплексного иона [Co(SСN)4]2– На часовое стекло поместите 1–2 капли раствора хлорида кобаль-та(II) и добавьте с помощью микрошпателя кристаллической соли роданида аммония NH4SСN. Раствор окрашивается в синий цвет, свойственный ионам [Co(SСN)4]2–. Составьте молекулярное и ионное уравнения реакции. К раствору комплексной соли добавьте (по каплям) дистиллированную воду и наблюдайте изменение окраски. Объясните, почему и как меняется окраска раствора при разбавлении водой. Напишите уравнение диссоциации комплексного иона. Укажите, в какую сторону смещается равновесие диссоциации комплексного иона при добавлении воды? Напишите выражение для константы нестойкости [Co(SСN)4]2– и приведите ее численное значение. Сделайте вывод об устойчивости комплексного иона [Co(SСN)4]2– ? Опыт 4. Обменные реакции комплексных соединений а) Внесите в пробирку 3 капли раствора соли железа(II) и прибавьте 2 капли раствора гексацианоферрата(III) калия K3[Fe(CN)6]. Наблюдайте выпадение осадка – «турнбулева синь» – качественная реакция на катионы Fe2+. б) Внесите в пробирку 3 капли раствора соли железа(III) и прибавьте 2 капли раствора гексацианоферрата(II) калия K4[Fe(CN)6]. Наблюдайте выпадение осадка – берлинская лазурь – качественная реакция на катионы Fe3+. в) Внесите в пробирку 3 капли раствора соли меди(II) и прибавьте 2 капли раствора гексацианоферрата(II) калия K4[Fe(CN)6]. Наблюдайте выпадение красно-коричневого осадка Cu2[Fe(CN)6]. Запишите уравнения проведенных реакций в молекулярном и ионно-молекулярном видах. Составьте выражения для констант нестойкости комплексных
ЛАБОРАТОРНАЯ РАБОТА № 9 Катодные реакции | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|  
| 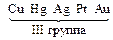
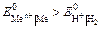
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| а) нейтральная и щелочная среда: К(–): 2 Н2О + 2е– → → Н2 + 2ОН– б) кислая среда: К(–): 2Н+ + 2е– → Н2 | Параллельные процессы: К(–): Меn+ + ne– → Me 2Н+ + 2е– → Н2 | К(–): Меn+ + ne– → → Me | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
· Анодные процессы
а) растворение металла анода: А(+): Ме – n е– ® Меn+ ;
б) окисление ОН– ионов в щелочных растворах:
А(+): 4ОН– – 4е– ® О2 + 2Н2О,
или молекул воды в кислых и нейтральных растворах:
(+)А: 2Н2О – 4е– ® О2 + 4Н+ ;
в) окисление других восстановителей: (+) А: Red – n e– ® Ox.
Все восстановители в зависимости от значений стандартных потенциалов подразделяют на две группы:
1) восстановители, у которых стандартный потенциал меньше потенциала кислородного электрода при данном значении рН. Анод, из-готовленный из металла, будет растворяться в том случае, если 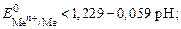
2) восстановители, у которых стандартный потенциал превышает 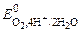 = 1, 229 В.
= 1, 229 В.
В этом случае идет электролиз с нерастворимым анодом при следующей очередности разрядки ионов. Сначала окисляются простые ионы по мере роста значений их Е0, не превышающих 1, 5В (S2–, I–, Br–, Cl–), с выделением простых веществ, например:
2Cl– – 2e– → Cl2 .
На аноде не окисляются ионы 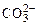 ,
, 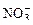 ,
, 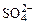 ,
, 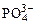 , F–. В этом случае выделяется кислород из воды или ОН–-групп.
, F–. В этом случае выделяется кислород из воды или ОН–-групп.
Экспериментальная часть
Опыт 1. Гальванический элемент Якоби–Даниэля
Соберите установку, изображенную на рис. 3.
1. В один химический стакан 4 налейте ½ его объема 1М раствора ZnSO4, в другой стакан 5 – 1М раствор CuSO4.
2. В раствор CuSO4 опустите медную пластинку 1, в раствор ZnSO4 – цинковую 2.
Если металлические пластинки (электроды) в результате окисления покрылись слоями оксидов, их поверхность очистите с помощью наждачной бумаги и протрите салфеткой, смоченной раствори-телем.
3. Соедините электроды электролитическим ключом 3.

Рис. 3. Схема гальванического элемента Якоби–Даниэля:
1 – медный электрод; 2 – цинковый электрод; 3 – электролитический ключ; 4 – стакан с 1М раствором сульфата цинка; 5 – стакан с 1М раствором сульфата меди;
6 – вольтметр
4. Измерьте равновесное напряжение элемента (Еэксп) с помощью вольтметра (милливольтметра) 6.
5. Включите в цепь на 5 мин вместо вольтметра сопротивление. Затем отключите сопротивление и снова измерьте напряжение
В отчете:
1) сделайте рисунок гальванического элемента (ГЭ);
2) запишите электрохимическую схему ГЭ;
3) запишите уравнения реакций на электродах и суммарное уравнение реакции, определяющее работу ГЭ;
4) вычислите равновесное напряжение ГЭ (Е0) и сравните его значение с экспериментальным значением Еэксп;
5) изменилось ли напряжение ГЭ после включения и отключения сопротивления? Почему?
6) рассчитайте энергию Гиббса и константу равновесия суммарной реакции, определяющей работу ГЭ
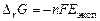 ,
, 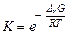
и сделайте вывод о направлении протекания реакции в ГЭ.
Опыт 2. Зависимость ЭДС гальванического элемента
от активности ионов металла в растворе
В данном опыте предлагается изучить зависимость ЭДС гальванического элемента Якоби–Даниэля от активности ионов цинка в анодном пространстве при постоянной активности ионов меди в катодном пространстве. Согласно уравнению Нернста
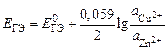 ,
,
зависимость 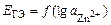 должна быть линейной.
должна быть линейной.
Выполнение опыта
1. В три химических стакана налейте по ½ объема 0, 1М, 0, 01М и 0, 001М растворов сульфата цинка ZnSO4, в другой стакан налейте
½ его объема 1М раствора сульфата меди CuSO4.
2. Опустите в 0, 001М раствор ZnSO4 цинковую пластину, в 1М раствор CuSO4 – медную.
3. Соедините полуэлементы солевым мостиком (электролитическим ключом) и измерьте напряжение (ЭДС) гальванического элемента с помощью высокоомного милливольтметра.
4. Без отключения милливольтметра перенесите цинковую пластину и колено солевого мостика, находившиеся в 0, 001М растворе ZnSO4, в раствор сульфата цинка с концентрацией 0, 01М и измерьте ЭДС гальванического элемента.
5. Повторите п. 4, перенеся колено солевого мостика и цинковую пластину в 0, 1М раствор ZnSO4.
6. Отключите милливольтметр, выньте солевой мостик из стаканов и поместите его в раствор нитрата калия.
7. Вымойте стаканы и металлические пластины, последние протрите фильтровальной бумагой.
В отчете:
1) исходные данные, результаты измерений и расчетов занесите в табл. 10;
2) рассчитайте теоретическое значение Етеор гальванического элемента, приняв, что активности а ионов Cu2+ и Zn2+ равны молярной концентрации электролитов;
Таблица 10
| Исходные данные | Результаты измерений | Результаты расчетов | |||||
| c, моль/л |
| Еэксп, В | Активность иона a, моль/л | Етеор , В | |||
| CuSO4 | ZnSO4 | Cu2+/Cu | Zn2+/Zn | Cu2+ | Zn2+ | ||
| 1 | 0, 001 | ||||||
| 0, 01 | |||||||
| 0, 1 | |||||||
3) постройте графическую зависимость ЭДС гальванического элемента от десятичного логарифма активности цинка;
4) сделайте вывод о соответствии полученной экспериментальной зависимости уравнению Нернста.
Опыт 3. Электролиз раствора сульфата натрия
с угольными электродами
Выполнение опыта
1. В электролизную ячейку (U-образная трубка) налейте 0, 5 М раствора сульфата натрия Na2SO4, заполнив на 2/3 объем трубки.
2. В катодное пространство (правое колено) внесите 3-4 капли индикатора фенолфталеина, а в анодное пространство (левое колено) –
3-4 капли метилового оранжевого.
3. Вставьте в оба колена трубки угольные электроды.
4. Соедините электроды с источником постоянного тока (12 В) – крепеж, маркированный минусом, соедините с электродом в катодном пространстве, а плюсом – в анодном пространстве.
5. Включите ток и пропустите его в течение 2–3 минут.
6. Наблюдайте выделение пузырьков газа на электродах и изменение окраски индикаторов.
В отчете:
1) сделайте схематический рисунок электролизной ячейки;
2) запишите уравнения электродных процессов, происходящих при электролизе;
3) объясните причину изменения окраски индикаторов;
4) в выводе приведите определение электролиза и, используя значения электродных потенциалов, поясните реакции, протекающие на электродах.
Опыт 4. Электролиз раствора хлорида меди
с угольными электродами
Выполнение опыта
1. Налейте в U-образную трубку 0, 5 М раствора хлорида меди(II) СuCl2.
2. Вставьте в оба колена угольные электроды.
3. Соедините электроды с источником постоянного тока
4. Включите ток и пропустите его в течение 2–3 минут.
5. Выключите ток. Рассмотрите катод и убедитесь, что на нем выделилась медь. Отметьте окраску меди и запах газа на аноде.
6. Опустите вновь электроды в трубку и пропустите ток в течение 1–2 минут.
7. Выключите ток и замкните электроды с помощью проводников на вольтметр, измерьте напряжение ГЭ, образовавшегося в результате электролиза.
В отчете:
1) запишите уравнения реакций, протекающих на электродах при электролизе;
2) запишите схему образовавшегося в результате электролиза гальванического элемента, электродные реакции при его работе и рассчитайте теоретическое значение напряжения образовавшегося ГЭ;
3) используя значения электродных потенциалов, поясните реакции, протекающие на электродах;
4) сделайте вывод о направлении течения процессов в гальваническом элементе и электролизере.
ЛАБОРАТОРНАЯ РАБОТА № 10
КОРРОЗИЯ МЕТАЛЛОВ И ЗАЩИТА МЕТАЛЛОВ
ОТ КОРРОЗИИ
Цель работы. Изучение процессов электрохимической коррозии и основных методов защиты от нее.
Коррозией называется самопроизвольное разрушение металлов вследствие их химического или электрохимического взаимодействия с окислительными компонентами окружающей среды.
По механизму протекания коррозионного разрушения различают химическую и электрохимическую коррозию.
Химическая коррозия наблюдается при взаимодействии металлов с газами (газовая коррозия) или с органическими жидкостями – неэлектролитами (жидкостная коррозия). Процессы окисления металла и восстановления окислителя протекают при непосредственном их соприкосновении. В результате химической коррозии металл покрывается слоем продуктов своего окисления, чаще всего пленкой оксида или гидроксида. Пленка считается защитной, если значение отношения объема продуктов коррозии к объему прокорродировавшего металла (коэффициент сплошности покрытия) равно 1, 2…1, 6.
Под электрохимической коррозией понимают разрушение металла в среде электролита (влажный воздух, влажная почва, раствор электролита). Окислители в электрохимической коррозии называют деполяри-заторами (молекулы кислорода О2, воды Н2О и ионы водорода Н+).
В случае электрохимической коррозии на поверхности металла появляются анодные и катодные участки, возникает короткозамкнутый гальванический элемент.
На анодных участках протекает окисление (разрушение) металла
(–) А: Ме = Меn+ + n ē ,
на катодных участках – восстановление окислителя коррозионной среды (электролита):
1) в насыщенных кислородом коррозионных средах:
а) при рН ≥ 7
(+) К: 2Н2О + О2 + 4 ē ® 4ОН– 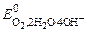 = 0, 401 В;
= 0, 401 В;
б) при рН < 7
(+) К: 4Н+ + О2 + 4 ē ® 2Н2О 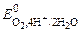 = 1, 229 В;
= 1, 229 В;
2) в несодержащих растворенный кислород коррозионных средах
а) при рН ≥ 7
(+) К: 2Н2О + 2 ē ® Н2 + 2ОН– 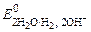 = –0, 828 В;
= –0, 828 В;
б) при рН < 7
(+) К: 2Н+ + 2ē ®Н2 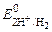 = 0 В.
= 0 В.
Коррозию, сопровождающуюся восстановлением молекул кислорода, называют коррозией с кислородной деполяризацией, или коррозией с поглощением кислорода.
Коррозию, сопровождающуюся с восстановлением молекул воды и ионов водорода, называют коррозией с водородной деполяризацией, или коррозией с выделением водорода.
С учетом характера металла, условий его эксплуатации и экономических показателей применяют самые разнообразные способы защиты от коррозии. Основные из них:
1) защитные покрытия (металлические – анодное и катодное покрытия, неметаллические и др.);
2) электронная защита (протекторная защита и электрозащита);
3) антикоррозийное легирование металла;
4) дезактивирующая обработка среды, снижающая ее агрессивность.
Экспериментальная часть
Опыт 1. Контактная коррозия
Известно, что чистые металлы слабо подвергаются коррозии. Если же к кусочку цинка, опущенному в кислоту или щелочь, прикоснуться медной проволочкой, то скорость процесса коррозии возрастает и будет наблюдаться активное выделение водорода. При контакте цинка с медью возникает коррозионный гальванический элемент (КГЭ), в котором медь является катодным участком ( 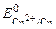 = + 0, 34 В), а цинк – анодным (в кислой среде
= + 0, 34 В), а цинк – анодным (в кислой среде 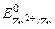 = – 0, 76 В, в щелочной среде
= – 0, 76 В, в щелочной среде 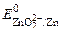 = – 1, 22 В).
= – 1, 22 В).
На аноде идет окисление (растворение) цинка
Zn – 2ē → Zn2+,
причем в щелочной среде происходит следующая реакция
Zn + 4ОН– – 2ē → 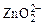 + 2Н2О.
+ 2Н2О.
На катоде в кислой среде восстанавливаются ионы водорода
2Н+ + 2ē ® Н2,
а в щелочной среде возможны две реакции:
2Н2О + 2ē = Н2 + 2ОН- (водородная деполяризация)
О2 + 2Н2О + 4ē ® 4ОН– (кислородная деполяризация)
Первая реакция протекает, если потенциал анода меньше –0, 83 В, вторая – если потенциал больше –0, 83 В.
Выполнение опыта
1. Налейте в пробирку 0, 5 мл 0, 01 М раствора соляной кислоты HCl и опустите гранулу цинка.
2. Внесите в пробирку с кислотой медную проволочку, не дотрагиваясь до цинка. Наблюдается ли выделение водорода на меди?
3. Погрузите проволочку так, чтобы она контактировала с цинком. Что наблюдаете?
4. Аналогичным образом проведите опыт в пробирке с раствором щелочи (0.01 M NaOH).
В отчете:
1) запишите уравнения реакций взаимодействия цинка с соляной кислотой и гидроксидом натрия в молекулярном и ионно-молекуляр-ном видах;
2) запишите схему КГЭ в кислой и щелочной средах;
3) запишите уравнения, протекающих при контакте цинка и меди в различных средах.
Опыт 2. Коррозия стальной пластинки
при неравномерной аэрации
2.1. Обнаружение иона Fe2+. В пробирке в небольшом количестве воды растворите кристаллы FeSO4, прибавьте 1–2 капли раствора K3[Fe(CN)6]. Напишите молекулярное и ионно-молекулярное уравнения образования осадка турнбулевой сини Fe3[Fe(CN)6]2.
2.2. Коррозия под каплей воды
1. В пробирку внесите 1–2 мл 3%-й раствора NaCl, добавьте
1–2 капли раствора K3[Fe(CN)6] и 3–4 капли фенолфталеина. Перемешайте полученный раствор встряхиванием или с помощью стеклянной палочки.
2. Очистите стальную пластинку наждачной бумагой, промойте и осушите фильтровальной бумагой.
3. На чистую поверхность стальной пластинки с помощью пипетки нанесите каплю полученного раствора. Наблюдайте появление синего окрашивания в центре капли и малинового по ее окружности.
В отчете:
1) запишите схему коррозионного элемента;
2) запишите уравнения процессов, протекающих на катодном и анодном участках;
3) запишите суммарное уравнение коррозионного процесса;
4) объясните появление разной окраски в центре и по краям капли.
Опыт 3.Анодные и катодные покрытия
При нарушении металлического покрытия в токопроводящей среде образуются гальванопары, в которых покрытие может выполнять роль анода и катода. Поэтому различают анодные и катодные покрытия. Если потенциал металла покрытия меньше потенциала основного (корродируемого) металла, то покрытие будет анодным. Если потенциал основного металла меньше потенциала металла покрытия, то покрытие будет катодным.
При нарушении анодного покрытия окисляется металл покрытия.
Примером анодного покрытия может служить оцинкованное железо, при повреждении которого корродирует Zn.
В нейтральной среде
А (–) Zn ½ Н2О, О2, NаCl ½ Fe (+) К
А(–): Zn – 2ē ® Zn2+
К(+): О2 + 2 Н2О + 4 ē = 4ОН–
Суммарное уравнение (в растворе): Zn2+ + 2 ОН– = Zn(ОН)2.
Примером катодного покрытия может служить луженое железо (железо, покрытое оловом). Если покрытие нарушено, то разрушается основной металл – железо.
А (–)Fe ½ Н2О, О2, NаCl ½ Sn (+) К
А(–): Fe – 2ē ® Fe 2+
К(+): О2 + 2 Н2О + 4 ē ® 4ОН–
Суммарное уравнение (в растворе): Fe 2+ + 2 ОН- = Fe (ОН)2.
Выполнение опыта
1. В пробирку внесите 1–2 мл 3%-й раствора NaCl, добавьте 1–2 капли раствора K3[Fe(CN)6] и 3–4 капли фенолфталеина.
2. Разделите раствор на две пробирки.
3. В одну пробирку поместите образец оцинкованного железа, а в другую – луженого с предварительно сделанными на их поверхности глубокими царапинами.
4. Через 5 мин отметьте изменение цвета раствора в пробирках.
5. Вылейте растворы из пробирок – полоски оцинкованного и луженного железа промойте под краном воды и просушите фильтровальной бумагой.
В отчете:
1) запишите схемы КГЭ в нейтральной среде;
2) запишите электродные процессы; отметьте, в каком случае корродирует железо и как вы это обнаружили;
3) сделайте вывод, какое покрытие, анодное или катодное, более эффективно для защиты от коррозии.
Опыт 4. Электронная защита
Анодное окисление металла можно приостановить, если искусственно создать поток электронов в направлении, обратном коррозионному току. Тогда электроны, получаемые защищаемым металлом извне, смещают равновесие реакции
Ме « Меn+ + n ē
справа налево, что создает препятствие к переходу катионов металла в раствор (его разрушению). Этот способ называется электронной защитой металла от коррозии. Существуют следующие разновидности электронной защиты: протекторная защита и электрозащита.
4.1. Электрозащита. Сущность электрозащиты заключается в том, что защищаемое сооружение присоединяют к отрицательному полюсу внешнего источника постоянного тока. В искусственно созданной электролизной ячейке защищаемое сооружение – катод. В качестве анода применяются железные или графитовые электроды.
Выполнение опыта
1. Налейте в химический стакан (½ объема) 3%-го раствора NaCl (Na2SO4), добавьте 3–5 капель раствора K3[Fe(CN)6] и 3–5 капель фенолфталеина.
2. Соберите устройство для электролиза. В качестве катода примените стальной образец, подключив его к отрицательному полюсу внешнего источника постоянного тока. В качестве анода используйте графитовый стержень, подключив его к положительному полюсу.
3. Включите ток на 2 мин. Что наблюдаете?
4. Выключите ток. Что наблюдаете через 5 минут?
В отчете:
1) запишите уравнения электролиза раствора хлорида натрия (или сульфата натрия) с нерастворимым анодом;
2) запишите схему коррозионного гальванического элемента;
3) запишите уравнения анодного и катодного процессов и реакции, протекающие в растворе;
4) в выводе оцените надежность данного метода защиты металлов от коррозии и сформулируйте сущность электрозащиты.
4.2. Протекторная защита. К защищаемой металлической конструкции присоединяется протектор – металл или сплав, имеющий меньший электродный потенциал по сравнению с потенциалом металла защищаемой конструкции. В образовавшейся гальванопаре протектор служит анодом, который в процессе защиты постепенно разрушается.
Выполнение опыта
1. В две пробирки налетйте (по ½ объема) разбавленной уксусной кислоты и добавьте в каждую 2–3 капли раствора иодида калия (KI).
2. В одну пробирку поместите металлические цинк и свинец, соединенные контактно друг с другом, в другую для сравнения поместите один свинец.
3. Отметьте, в какой из пробирок быстрее появляется желтое окрашивание (осадок иодида свинца(II)).
В отчете:
1) запишите уравнение реакции растворения свинца в уксусной кислоте
2Рb + 4СН3СООН + О2 = Рb(СН3СОО)2 + 2Н2О;
2) запишите качественную реакцию определения ионов Рb2+ в растворе в ионно-молекулярной и молекулярной форме
Рb2+ + 2I- = РbI2¯ (желтого цвета);
3) запишите схему КГЭ пары Zn–Pb, электродные процессы;
4) сформулируйте суть протекторной защиты.
СПИСОК ЛИТЕРАТУРЫ
1. Коровин Н.В., Мингулина Э.И., Рыжова Н.Г. Лабораторные работы по химии. – М.: Высшая школа, 2001.
2. Общая и неорганическая химия. Лабораторные работы для студентов I курса МТФ. – Новосибирск: Изд-во НГТУ, 2006. (№ 3099, составители: Афонина Л.И., Апарнев А.И.).
3. Практикум по общей и неорганической химии: Пособие для студентов вузов / под ред. Н.Н. Павлова, В.И. Фролова. – М.: Дрофа, 2002.
4. Коровин Н.В. Общая химия. – М.: Высшая школа, 2008.
5. Гуров А.А., Бадаев Ф.З., Овчаренко Л.П., Шаповал В.Н. Химия: учебник. – М.: Изд-во МГТУ им. Н.Э. Баумана, 2007.
6. Шевницына Л.В., Апарнев А.И., Казакова А.А. Практикум по общей и неорганической химии. – Новосибирск: Изд-во НГТУ, 2006. – Ч. 1, 2.
7. Демонстрационные опыты по общей и неорганической химии: учеб. пособие для студ. высш. учеб. заведений / под ред. Степина Б.Д. – М.: Гуманит. изд. центр ВЛАДОС, 2003. – 336 с.
ПРИЛОЖЕНИЕ
Плотности водных растворов некоторых солей при 20 °С(г/мл)
| NaCl | Na2SO4 | KCl | MgCl2 | MgSO4 | ||||||||
| w, % | r, г/мл | w, % | r, г/мл | w, % | r, г/мл | w, % | r, г/мл | w, % | r, г/мл | |||
| 1 | 1, 005 | 1 | 1, 008 | 1 | 1, 005 | 2 | 1, 051 | 2 | 1, 018 | |||
| 2 | 1, 012 | 2 | 1, 016 | 2 | 1, 011 | 8 | 1, 065 | 4 | 1, 039 | |||
| 4 | 1, 027 | 4 | 1, 035 | 4 | 1, 024 | 14 | 1, 119 | 6 | 1, 060 | |||
| 6 | 1, 041 | 6 | 1, 053 | 6 | 1, 037 | 20 | 1, 175 | 8 | 1, 081 | |||
| 8 | 1, 056 | 8 | 1, 072 | 8 | 1, 050 | 26 | 1, 235 | 10 | 1, 103 | |||
| 10 | 1, 071 | 10 | 1, 091 | 10 | 1, 063 | 32 | 1, 297 | 12 | 1, 125 | |||
| 12 | 1, 086 | 12 | 1, 111 | 12 | 1, 077 |
| 14 | 1, 148 | ||||
| 14 | 1, 101 | 14 | 1, 131 | 14 | 1, 090 |
| 16 | 1, 171 | ||||
| 16 | 1, 116 | 16 | 1, 151 | 16 | 1, 104 |
| 18 | 1, 195 | ||||
| 18 | 1, 132 | 18 | 1, 118 |
| 20 | 1, 219 | ||||||
| 20 | 1, 148 | 20 | 1, 132 |
| 22 | 1, 245 | ||||||
| 22 | 1, 164 | 22 | 1, 147 |
| 24 | 1, 270 | ||||||
| 24 | 1, 180 | 24 | 1, 162 |
| 26 | 1, 296 | ||||||
|
| ||||||||||||
| NH4Cl | MnSO4 | Na2CO3 | (NH4)2SO4 | CaCl2 | ||||||||
| w, % | r, г/мл | w, % | r, г/мл | w, % | r, г/мл | w, % | r, г/мл | w, % | r, г/мл | |||
| 1 | 1, 001 | 1 | 1, 009 | 0, 2 | 1, 000 | 1 | 1, 004 | 1 | 1, 007 | |||
| 2 | 1, 04 | 2 | 1, 019 | 2, 1 | 1, 020 | 2 | 1, 010 | 2 | 1, 015 | |||
| 4 | 1, 011 | 4 | 1, 038 | 4, 03 | 1, 040 | 4 | 1, 022 | 4 | 1, 031 | |||
| 6 | 1, 017 | 6 | 1, 059 | 5, 95 | 1, 060 | 6 | 1, 034 | 6 | 1, 049 | |||
| 8 | 1, 023 | 8 | 1, 081 | 7, 85 | 1, 080 | 8 | 1, 046 | 8 | 1, 066 | |||
| 10 | 1, 029 | 10 | 1, 102 | 9, 75 | 1, 100 | 10 | 1, 057 | 10 | 1, 083 | |||
| 12 | 1, 034 | 12 | 1, 125 | 11, 6 | 1, 120 | 12 | 1, 069 | 12 | 1, 102 | |||
| 14 | 1, 040 | 14 | 1, 148 | 13, 4 | 1, 140 | 14 | 1, 081 | 14 | 1, 120 | |||
| 16 | 1, 046 | 16 | 1, 171 | 15, 2 | 1, 160 | 16 | 1, 092 | 16 | 1, 139 | |||
| 18 | 1, 051 | 18 | 1, 196 | 16, 8 | 1, 180 | 18 | 1, 104 | 18 | 1, 158 | |||
| 20 | 1, 057 | 20 | 1, 220 | 17, 7 | 1, 190 | 20 | 1, 115 | 20 | 1, 177 | |||
| 22 | 1, 062 | 22 | 1, 246 | 24 | 1, 138 | 25 | 1, 228 | |||||
| 26 | 1, 072 | 24 | 1, 272 | 28 | 1, 161 | 28 | 1, 260 | |||||
ХИМИЯ
Сборник лабораторных работ
Методическое пособие
Редактор Л.Н. Ветчакова
Выпускающий редактор И.П. Брованова
Компьютерная верстка С.И. Ткачева
| Подписано в печать 15.06.2010. Формат 60 ´ 84 1/16. Бумага офсетная. Тираж 50 экз. Уч.-изд. л. 4, 88. Печ. л. 5, 25. Изд. № 162. Заказ № . Цена договорная |
Отпечатано в типографии
Новосибирского государственного технического университета
630092, г. Новосибирск, пр. К. Маркса, 20
Х 465
ХИМИЯ
Сборник лабораторных работ
Методическое пособие
НОВОСИБИРСК
2010
Министерство образования и науки Российской Федерации
НОВОСИБИРСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ
__________________________________________________________________________
54 № 3846
Х 465
ХИМИЯ
Сборник лабораторных работ
Методическое пособие для студентов, обучающихся
по техническим направлениям и специальностям
всех форм обучения
НОВОСИБИРСК
2010
УДК 54(076.5)
Х 465
Составители:
А.И. Апарнев, Р.Е. Синчурина, С.Н. Овчинникова
Рецензент Т.П. Александрова
Работа подготовлена на кафедре химии
© Новосибирский государственный
технический университет, 2010
ОГЛАВЛЕНИЕ
Введение............................................................................................................................... 4
Общие правила работы в химических лабораториях.............................. 7
Лабораторная работа № 1.............................................................................................. 8
Лабораторная работа № 2............................................................................................ 13
Лабораторная работа № 3............................................................................................ 19
Лабораторная работа № 4............................................................................................ 24
Лабораторная работа № 5............................................................................................ 33
Лабораторная работа № 6............................................................................................ 38
Лабораторная работа № 7............................................................................................ 46
Лабораторная работа № 8............................................................................................ 57
Лабораторная работа № 9............................................................................................ 64
Лабораторная работа № 10.......................................................................................... 74
Список литературы......................................................................................................... 81
Приложение....................................................................................................................... 82
ВВЕДЕНИЕ
Последнее изменение этой страницы: 2019-04-09; Просмотров: 544; Нарушение авторского права страницы