
|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |

|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |
Гальванический элемент и электролиз ⇐ ПредыдущаяСтр 8 из 8
Цель работы. Изучить устройство и процессы, протекающие в работающем гальваническом элементе; изучить сущность процесса электролиза и влияние на процесс состава электролита и материала электрода. Электродными процессами называют окислительно-восстанови-тельные реакции , происходящие на границе раздела фаз с участием заряженных частиц (электронов или ионов). Электрод – это система, состоящая из двух контактирующих фаз: материала с электронной проводимостью и ионного проводника (расплав, раствор электролита или твердый электролит). Электролитами служат расплавы солей, оксидов или гидроксидов, растворы солей, кислот или оснований в полярных растворителях, а также твердые электролиты. Электродом 1 рода является металлическая пластинка, изготовленная из простого вещества (металла или полупроводника) и погруженная в раствор, содержащий одноименные ионы. Электрод 2 рода – это система, в которой металл покрыт слоем его труднорастворимой соли (или оксида), а раствор содержит анионы этой соли (или OH–). Электроды изображают в виде схемы: слева от вертикальной черты, означающей границу раздела фаз, указывают вещества, находящиеся в растворе; справа – вещества, образующие электродный материал, например, Zn2+│ Zn – цинковый электрод. При погружении металла в водный раствор его соли между металлической фазой и раствором будут происходить взаимно обратные процессы ионизации и осаждения металла: Ме ↔ Меn+ + n e –. При равновесии скорость растворения металла (процесс окисления) равна скорости разряда его ионов (процесс восстановления). Потенциал, устанавливающийся на электроде при окислительно-восстанови-тельном равновесии, называется равновесным электродным потенциалом. Измерить его можно с помощью другого электрода – электрода сравнения, в качестве которого часто применяется водородный электрод. Потенциал водородного электрода в стандартных условиях (T = 298 K, Измеренную при стандартных условиях разность потенциалов между исследуемым электродом и электродом сравнения называют стандартным электродным потенциалом и обозначают Электродный потенциал любой окислительно-восстановительной системы, находящейся в нестандартных условиях, можно рассчитать по уравнению Нернста:
где Е0 – стандартный электродный потенциал; R – универсальная газовая постоянная 8, 314 Величина равновесного электродного потенциала металлического электрода зависит от активности ионов металла в растворе (молярной концентрации электролита), температуры и природы самого электрода. Данная зависимость выражается уравнением Нернста
При н.у. (
Электрохимическая система состоит из двух электродов и находящегося с ними в контакте электролита. В ней могут протекать как минимум одна реакция окисления и одна реакция восстановления. Электроды (обычно металлы) являются проводниками 1-го рода, т. е. обладают электронной проводимостью. Электролиты или проводники 2-го рода обладают ионной проводимостью. Устройство, в котором энергия химических реакций преобразуется в электрическую энергию, называется гальваническим элементом. Напротив, устройство, в котором при прохождении электрического тока через электролит происходят химические реакции, называется электролизером. Основные составные части гальванического элемента (ГЭ): · два электрода, помещенных в раствор электролитов. На границе раздела «проводник 1-го рода (электрод) – проводник 2-го рода (электролит)» возникает равновесный потенциал. На электродах протекают процессы окисления или восстановления – электродные реакции. Электрод, на котором происходит окисление, называется анодом, электрод, на котором происходит восстановление, называется катодом; · растворы электролитов, в которые погружены электроды, между собой соединяются электролитическим ключом – изогнутой трубкой, заполненной агар-агаром с KCl. Самопроизвольное протекание окислительно-восстановительных реакций на электродах является причиной возникновения напряжения в ГЭ и обеспечивает его работу, которая может быть только положительной величиной. Равновесное напряжение ГЭ, или его электродвижущая сила Δ Е, представляет собой разность равновесных электродных потенциалов катода и анода: Δ ЕГЭ = Екатод – Еанод. Максимальная электрическая работа А равна произведению перенесенного заряда (nF) и Δ Е: А = nF · Δ Е. Эта работа совершается за счет самопроизвольно протекающей реакции, для которой ∆ rG0 < 0. Так как А = – Δ G, следовательно Δ G = –nF · Δ Е. Таким образом, зная термодинамические характеристики процесса, можно рассчитать электродвижущую силу и наоборот. Рассмотрим пример ГЭ, состоящего из свинцового и серебряного электродов, погруженные в растворы их растворимых в воде солей – Pb(NO3)2 и AgNO3 соответственно. В ГЭ всегда электроны по внешней цепи движутся от электрода, имеющего наиболее отрицательное значение электродного потенциала (анода), к электроду с наиболее положительным значением потенциала – к катоду. Так как Устройство ГЭ изображается в виде схемы: (–) Pb÷ Pb(NO3)2 ÷ ÷ AgNO3÷ Ag (+) или (–) Pb÷ Pb2+ ÷ ÷ Ag+÷ Ag (+). Анод записывают слева, катод – справа. Вертикальная черта означает границу раздела твердой и жидкой фаз – место возникновения электродного потенциала, две черты – наличие электролитического ключа. Электродные реакции: реакция восстановления на катоде К(+): Ag+ + e – ↔ Ag реакция окисления на аноде A(–): Pb – 2 e – ↔ Pb2+
Сложив оба уравнения, получим суммарное уравнение, определяющее работу ГЭ: 2Ag+ + Pb → 2Ag + Pb2+. Равновесное напряжение данного гальванического элемента будет равно:
Электролизом называется совокупность электрохимических окислительно-восстановительных процессов, происходящих при прохождении электрического тока через электролит с погруженными в него электродами. На катоде катионы восстанавливаются в ионы более низкой степени окисления или в атомы, например: Fe3+ + e – → Fe2+, Сu2+ + 2е– → Сu. Нейтральные молекулы могут участвовать в превращениях на катоде непосредственно или реагировать с продуктами катодного процесса, которые рассматриваются в этом случае как промежуточные вещества электролиза. На аноде происходит окисление ионов или молекул, поступающих из объема электролита или принадлежащих материалу анода – в этом случае анод растворяется или окисляется – анодное растворение. Последовательность процессов на электродах при электролизе Особенностью электролиза водных растворов является то, что электродные процессы протекают при одновременном участии воды. Часто перенапряжение на электродах оказывается достаточным для одновременного разряда не только ионов электролита, но и молекул воды. Из электродных процессов наиболее вероятен тот, осуществление которого связано с минимальной затратой энергии. Поэтому на катоде первыми восстанавливаются наиболее сильные окислители (с максимальным значением Е0), на аноде первыми окисляются наиболее сильные восстановители (с минимальным значением электродного потенциала). · Катодные реакции По способности разряжаться на катоде все металлы в зависимости от значений стандартных потенциалов подразделяются на три группы (согласованные с электрохимическим рядом напряжений):
Катодные реакции | |||||
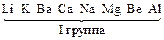 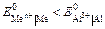
| 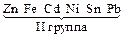 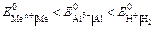
| 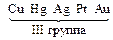
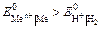
| |||
| а) нейтральная и щелочная среда: К(–): 2 Н2О + 2е– → → Н2 + 2ОН– б) кислая среда: К(–): 2Н+ + 2е– → Н2 | Параллельные процессы: К(–): Меn+ + ne– → Me 2Н+ + 2е– → Н2 | К(–): Меn+ + ne– → → Me | |||
· Анодные процессы
а) растворение металла анода: А(+): Ме – n е– ® Меn+ ;
б) окисление ОН– ионов в щелочных растворах:
А(+): 4ОН– – 4е– ® О2 + 2Н2О,
или молекул воды в кислых и нейтральных растворах:
(+)А: 2Н2О – 4е– ® О2 + 4Н+ ;
в) окисление других восстановителей: (+) А: Red – n e– ® Ox.
Все восстановители в зависимости от значений стандартных потенциалов подразделяют на две группы:
1) восстановители, у которых стандартный потенциал меньше потенциала кислородного электрода при данном значении рН. Анод, из-готовленный из металла, будет растворяться в том случае, если 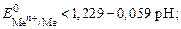
2) восстановители, у которых стандартный потенциал превышает 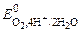 = 1, 229 В.
= 1, 229 В.
В этом случае идет электролиз с нерастворимым анодом при следующей очередности разрядки ионов. Сначала окисляются простые ионы по мере роста значений их Е0, не превышающих 1, 5В (S2–, I–, Br–, Cl–), с выделением простых веществ, например:
2Cl– – 2e– → Cl2 .
На аноде не окисляются ионы 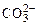 ,
, 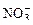 ,
, 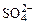 ,
, 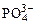 , F–. В этом случае выделяется кислород из воды или ОН–-групп.
, F–. В этом случае выделяется кислород из воды или ОН–-групп.
Экспериментальная часть
Опыт 1. Гальванический элемент Якоби–Даниэля
Соберите установку, изображенную на рис. 3.
1. В один химический стакан 4 налейте ½ его объема 1М раствора ZnSO4, в другой стакан 5 – 1М раствор CuSO4.
2. В раствор CuSO4 опустите медную пластинку 1, в раствор ZnSO4 – цинковую 2.
Если металлические пластинки (электроды) в результате окисления покрылись слоями оксидов, их поверхность очистите с помощью наждачной бумаги и протрите салфеткой, смоченной раствори-телем.
3. Соедините электроды электролитическим ключом 3.

Рис. 3. Схема гальванического элемента Якоби–Даниэля:
1 – медный электрод; 2 – цинковый электрод; 3 – электролитический ключ; 4 – стакан с 1М раствором сульфата цинка; 5 – стакан с 1М раствором сульфата меди;
6 – вольтметр
4. Измерьте равновесное напряжение элемента (Еэксп) с помощью вольтметра (милливольтметра) 6.
5. Включите в цепь на 5 мин вместо вольтметра сопротивление. Затем отключите сопротивление и снова измерьте напряжение
В отчете:
1) сделайте рисунок гальванического элемента (ГЭ);
2) запишите электрохимическую схему ГЭ;
3) запишите уравнения реакций на электродах и суммарное уравнение реакции, определяющее работу ГЭ;
4) вычислите равновесное напряжение ГЭ (Е0) и сравните его значение с экспериментальным значением Еэксп;
5) изменилось ли напряжение ГЭ после включения и отключения сопротивления? Почему?
6) рассчитайте энергию Гиббса и константу равновесия суммарной реакции, определяющей работу ГЭ
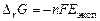 ,
, 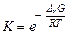
и сделайте вывод о направлении протекания реакции в ГЭ.
Опыт 2. Зависимость ЭДС гальванического элемента
от активности ионов металла в растворе
В данном опыте предлагается изучить зависимость ЭДС гальванического элемента Якоби–Даниэля от активности ионов цинка в анодном пространстве при постоянной активности ионов меди в катодном пространстве. Согласно уравнению Нернста
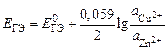 ,
,
зависимость 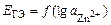 должна быть линейной.
должна быть линейной.
Выполнение опыта
1. В три химических стакана налейте по ½ объема 0, 1М, 0, 01М и 0, 001М растворов сульфата цинка ZnSO4, в другой стакан налейте
½ его объема 1М раствора сульфата меди CuSO4.
2. Опустите в 0, 001М раствор ZnSO4 цинковую пластину, в 1М раствор CuSO4 – медную.
3. Соедините полуэлементы солевым мостиком (электролитическим ключом) и измерьте напряжение (ЭДС) гальванического элемента с помощью высокоомного милливольтметра.
4. Без отключения милливольтметра перенесите цинковую пластину и колено солевого мостика, находившиеся в 0, 001М растворе ZnSO4, в раствор сульфата цинка с концентрацией 0, 01М и измерьте ЭДС гальванического элемента.
5. Повторите п. 4, перенеся колено солевого мостика и цинковую пластину в 0, 1М раствор ZnSO4.
6. Отключите милливольтметр, выньте солевой мостик из стаканов и поместите его в раствор нитрата калия.
7. Вымойте стаканы и металлические пластины, последние протрите фильтровальной бумагой.
В отчете:
1) исходные данные, результаты измерений и расчетов занесите в табл. 10;
2) рассчитайте теоретическое значение Етеор гальванического элемента, приняв, что активности а ионов Cu2+ и Zn2+ равны молярной концентрации электролитов;
Таблица 10
| Исходные данные | Результаты измерений | Результаты расчетов | |||||
| c, моль/л |
| Еэксп, В | Активность иона a, моль/л | Етеор , В | |||
| CuSO4 | ZnSO4 | Cu2+/Cu | Zn2+/Zn | Cu2+ | Zn2+ | ||
| 1 | 0, 001 | ||||||
| 0, 01 | |||||||
| 0, 1 | |||||||
3) постройте графическую зависимость ЭДС гальванического элемента от десятичного логарифма активности цинка;
4) сделайте вывод о соответствии полученной экспериментальной зависимости уравнению Нернста.
Опыт 3. Электролиз раствора сульфата натрия
с угольными электродами
Выполнение опыта
1. В электролизную ячейку (U-образная трубка) налейте 0, 5 М раствора сульфата натрия Na2SO4, заполнив на 2/3 объем трубки.
2. В катодное пространство (правое колено) внесите 3-4 капли индикатора фенолфталеина, а в анодное пространство (левое колено) –
3-4 капли метилового оранжевого.
3. Вставьте в оба колена трубки угольные электроды.
4. Соедините электроды с источником постоянного тока (12 В) – крепеж, маркированный минусом, соедините с электродом в катодном пространстве, а плюсом – в анодном пространстве.
5. Включите ток и пропустите его в течение 2–3 минут.
6. Наблюдайте выделение пузырьков газа на электродах и изменение окраски индикаторов.
В отчете:
1) сделайте схематический рисунок электролизной ячейки;
2) запишите уравнения электродных процессов, происходящих при электролизе;
3) объясните причину изменения окраски индикаторов;
4) в выводе приведите определение электролиза и, используя значения электродных потенциалов, поясните реакции, протекающие на электродах.
Опыт 4. Электролиз раствора хлорида меди
с угольными электродами
Выполнение опыта
1. Налейте в U-образную трубку 0, 5 М раствора хлорида меди(II) СuCl2.
2. Вставьте в оба колена угольные электроды.
3. Соедините электроды с источником постоянного тока
4. Включите ток и пропустите его в течение 2–3 минут.
5. Выключите ток. Рассмотрите катод и убедитесь, что на нем выделилась медь. Отметьте окраску меди и запах газа на аноде.
6. Опустите вновь электроды в трубку и пропустите ток в течение 1–2 минут.
7. Выключите ток и замкните электроды с помощью проводников на вольтметр, измерьте напряжение ГЭ, образовавшегося в результате электролиза.
В отчете:
1) запишите уравнения реакций, протекающих на электродах при электролизе;
2) запишите схему образовавшегося в результате электролиза гальванического элемента, электродные реакции при его работе и рассчитайте теоретическое значение напряжения образовавшегося ГЭ;
3) используя значения электродных потенциалов, поясните реакции, протекающие на электродах;
4) сделайте вывод о направлении течения процессов в гальваническом элементе и электролизере.
ЛАБОРАТОРНАЯ РАБОТА № 10
КОРРОЗИЯ МЕТАЛЛОВ И ЗАЩИТА МЕТАЛЛОВ
ОТ КОРРОЗИИ
Цель работы. Изучение процессов электрохимической коррозии и основных методов защиты от нее.
Коррозией называется самопроизвольное разрушение металлов вследствие их химического или электрохимического взаимодействия с окислительными компонентами окружающей среды.
По механизму протекания коррозионного разрушения различают химическую и электрохимическую коррозию.
Химическая коррозия наблюдается при взаимодействии металлов с газами (газовая коррозия) или с органическими жидкостями – неэлектролитами (жидкостная коррозия). Процессы окисления металла и восстановления окислителя протекают при непосредственном их соприкосновении. В результате химической коррозии металл покрывается слоем продуктов своего окисления, чаще всего пленкой оксида или гидроксида. Пленка считается защитной, если значение отношения объема продуктов коррозии к объему прокорродировавшего металла (коэффициент сплошности покрытия) равно 1, 2…1, 6.
Под электрохимической коррозией понимают разрушение металла в среде электролита (влажный воздух, влажная почва, раствор электролита). Окислители в электрохимической коррозии называют деполяри-заторами (молекулы кислорода О2, воды Н2О и ионы водорода Н+).
В случае электрохимической коррозии на поверхности металла появляются анодные и катодные участки, возникает короткозамкнутый гальванический элемент.
На анодных участках протекает окисление (разрушение) металла
(–) А: Ме = Меn+ + n ē ,
на катодных участках – восстановление окислителя коррозионной среды (электролита):
1) в насыщенных кислородом коррозионных средах:
а) при рН ≥ 7
(+) К: 2Н2О + О2 + 4 ē ® 4ОН– 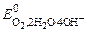 = 0, 401 В;
= 0, 401 В;
б) при рН < 7
(+) К: 4Н+ + О2 + 4 ē ® 2Н2О 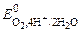 = 1, 229 В;
= 1, 229 В;
2) в несодержащих растворенный кислород коррозионных средах
а) при рН ≥ 7
(+) К: 2Н2О + 2 ē ® Н2 + 2ОН– 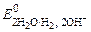 = –0, 828 В;
= –0, 828 В;
б) при рН < 7
(+) К: 2Н+ + 2ē ®Н2 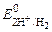 = 0 В.
= 0 В.
Коррозию, сопровождающуюся восстановлением молекул кислорода, называют коррозией с кислородной деполяризацией, или коррозией с поглощением кислорода.
Коррозию, сопровождающуюся с восстановлением молекул воды и ионов водорода, называют коррозией с водородной деполяризацией, или коррозией с выделением водорода.
С учетом характера металла, условий его эксплуатации и экономических показателей применяют самые разнообразные способы защиты от коррозии. Основные из них:
1) защитные покрытия (металлические – анодное и катодное покрытия, неметаллические и др.);
2) электронная защита (протекторная защита и электрозащита);
3) антикоррозийное легирование металла;
4) дезактивирующая обработка среды, снижающая ее агрессивность.
Экспериментальная часть
Опыт 1. Контактная коррозия
Известно, что чистые металлы слабо подвергаются коррозии. Если же к кусочку цинка, опущенному в кислоту или щелочь, прикоснуться медной проволочкой, то скорость процесса коррозии возрастает и будет наблюдаться активное выделение водорода. При контакте цинка с медью возникает коррозионный гальванический элемент (КГЭ), в котором медь является катодным участком ( 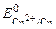 = + 0, 34 В), а цинк – анодным (в кислой среде
= + 0, 34 В), а цинк – анодным (в кислой среде 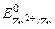 = – 0, 76 В, в щелочной среде
= – 0, 76 В, в щелочной среде 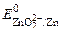 = – 1, 22 В).
= – 1, 22 В).
На аноде идет окисление (растворение) цинка
Zn – 2ē → Zn2+,
причем в щелочной среде происходит следующая реакция
Zn + 4ОН– – 2ē → 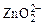 + 2Н2О.
+ 2Н2О.
На катоде в кислой среде восстанавливаются ионы водорода
2Н+ + 2ē ® Н2,
а в щелочной среде возможны две реакции:
2Н2О + 2ē = Н2 + 2ОН- (водородная деполяризация)
О2 + 2Н2О + 4ē ® 4ОН– (кислородная деполяризация)
Первая реакция протекает, если потенциал анода меньше –0, 83 В, вторая – если потенциал больше –0, 83 В.
Выполнение опыта
1. Налейте в пробирку 0, 5 мл 0, 01 М раствора соляной кислоты HCl и опустите гранулу цинка.
2. Внесите в пробирку с кислотой медную проволочку, не дотрагиваясь до цинка. Наблюдается ли выделение водорода на меди?
3. Погрузите проволочку так, чтобы она контактировала с цинком. Что наблюдаете?
4. Аналогичным образом проведите опыт в пробирке с раствором щелочи (0.01 M NaOH).
В отчете:
1) запишите уравнения реакций взаимодействия цинка с соляной кислотой и гидроксидом натрия в молекулярном и ионно-молекуляр-ном видах;
2) запишите схему КГЭ в кислой и щелочной средах;
3) запишите уравнения, протекающих при контакте цинка и меди в различных средах.
Опыт 2. Коррозия стальной пластинки
при неравномерной аэрации
2.1. Обнаружение иона Fe2+. В пробирке в небольшом количестве воды растворите кристаллы FeSO4, прибавьте 1–2 капли раствора K3[Fe(CN)6]. Напишите молекулярное и ионно-молекулярное уравнения образования осадка турнбулевой сини Fe3[Fe(CN)6]2.
2.2. Коррозия под каплей воды
1. В пробирку внесите 1–2 мл 3%-й раствора NaCl, добавьте
1–2 капли раствора K3[Fe(CN)6] и 3–4 капли фенолфталеина. Перемешайте полученный раствор встряхиванием или с помощью стеклянной палочки.
2. Очистите стальную пластинку наждачной бумагой, промойте и осушите фильтровальной бумагой.
3. На чистую поверхность стальной пластинки с помощью пипетки нанесите каплю полученного раствора. Наблюдайте появление синего окрашивания в центре капли и малинового по ее окружности.
В отчете:
1) запишите схему коррозионного элемента;
2) запишите уравнения процессов, протекающих на катодном и анодном участках;
3) запишите суммарное уравнение коррозионного процесса;
4) объясните появление разной окраски в центре и по краям капли.
Опыт 3.Анодные и катодные покрытия
При нарушении металлического покрытия в токопроводящей среде образуются гальванопары, в которых покрытие может выполнять роль анода и катода. Поэтому различают анодные и катодные покрытия. Если потенциал металла покрытия меньше потенциала основного (корродируемого) металла, то покрытие будет анодным. Если потенциал основного металла меньше потенциала металла покрытия, то покрытие будет катодным.
При нарушении анодного покрытия окисляется металл покрытия.
Примером анодного покрытия может служить оцинкованное железо, при повреждении которого корродирует Zn.
В нейтральной среде
А (–) Zn ½ Н2О, О2, NаCl ½ Fe (+) К
А(–): Zn – 2ē ® Zn2+
К(+): О2 + 2 Н2О + 4 ē = 4ОН–
Суммарное уравнение (в растворе): Zn2+ + 2 ОН– = Zn(ОН)2.
Примером катодного покрытия может служить луженое железо (железо, покрытое оловом). Если покрытие нарушено, то разрушается основной металл – железо.
А (–)Fe ½ Н2О, О2, NаCl ½ Sn (+) К
А(–): Fe – 2ē ® Fe 2+
К(+): О2 + 2 Н2О + 4 ē ® 4ОН–
Суммарное уравнение (в растворе): Fe 2+ + 2 ОН- = Fe (ОН)2.
Выполнение опыта
1. В пробирку внесите 1–2 мл 3%-й раствора NaCl, добавьте 1–2 капли раствора K3[Fe(CN)6] и 3–4 капли фенолфталеина.
2. Разделите раствор на две пробирки.
3. В одну пробирку поместите образец оцинкованного железа, а в другую – луженого с предварительно сделанными на их поверхности глубокими царапинами.
4. Через 5 мин отметьте изменение цвета раствора в пробирках.
5. Вылейте растворы из пробирок – полоски оцинкованного и луженного железа промойте под краном воды и просушите фильтровальной бумагой.
В отчете:
1) запишите схемы КГЭ в нейтральной среде;
2) запишите электродные процессы; отметьте, в каком случае корродирует железо и как вы это обнаружили;
3) сделайте вывод, какое покрытие, анодное или катодное, более эффективно для защиты от коррозии.
Опыт 4. Электронная защита
Анодное окисление металла можно приостановить, если искусственно создать поток электронов в направлении, обратном коррозионному току. Тогда электроны, получаемые защищаемым металлом извне, смещают равновесие реакции
Ме « Меn+ + n ē
справа налево, что создает препятствие к переходу катионов металла в раствор (его разрушению). Этот способ называется электронной защитой металла от коррозии. Существуют следующие разновидности электронной защиты: протекторная защита и электрозащита.
4.1. Электрозащита. Сущность электрозащиты заключается в том, что защищаемое сооружение присоединяют к отрицательному полюсу внешнего источника постоянного тока. В искусственно созданной электролизной ячейке защищаемое сооружение – катод. В качестве анода применяются железные или графитовые электроды.
Выполнение опыта
1. Налейте в химический стакан (½ объема) 3%-го раствора NaCl (Na2SO4), добавьте 3–5 капель раствора K3[Fe(CN)6] и 3–5 капель фенолфталеина.
2. Соберите устройство для электролиза. В качестве катода примените стальной образец, подключив его к отрицательному полюсу внешнего источника постоянного тока. В качестве анода используйте графитовый стержень, подключив его к положительному полюсу.
3. Включите ток на 2 мин. Что наблюдаете?
4. Выключите ток. Что наблюдаете через 5 минут?
В отчете:
1) запишите уравнения электролиза раствора хлорида натрия (или сульфата натрия) с нерастворимым анодом;
2) запишите схему коррозионного гальванического элемента;
3) запишите уравнения анодного и катодного процессов и реакции, протекающие в растворе;
4) в выводе оцените надежность данного метода защиты металлов от коррозии и сформулируйте сущность электрозащиты.
4.2. Протекторная защита. К защищаемой металлической конструкции присоединяется протектор – металл или сплав, имеющий меньший электродный потенциал по сравнению с потенциалом металла защищаемой конструкции. В образовавшейся гальванопаре протектор служит анодом, который в процессе защиты постепенно разрушается.
Выполнение опыта
1. В две пробирки налетйте (по ½ объема) разбавленной уксусной кислоты и добавьте в каждую 2–3 капли раствора иодида калия (KI).
2. В одну пробирку поместите металлические цинк и свинец, соединенные контактно друг с другом, в другую для сравнения поместите один свинец.
3. Отметьте, в какой из пробирок быстрее появляется желтое окрашивание (осадок иодида свинца(II)).
В отчете:
1) запишите уравнение реакции растворения свинца в уксусной кислоте
2Рb + 4СН3СООН + О2 = Рb(СН3СОО)2 + 2Н2О;
2) запишите качественную реакцию определения ионов Рb2+ в растворе в ионно-молекулярной и молекулярной форме
Рb2+ + 2I- = РbI2¯ (желтого цвета);
3) запишите схему КГЭ пары Zn–Pb, электродные процессы;
4) сформулируйте суть протекторной защиты.
СПИСОК ЛИТЕРАТУРЫ
1. Коровин Н.В., Мингулина Э.И., Рыжова Н.Г. Лабораторные работы по химии. – М.: Высшая школа, 2001.
2. Общая и неорганическая химия. Лабораторные работы для студентов I курса МТФ. – Новосибирск: Изд-во НГТУ, 2006. (№ 3099, составители: Афонина Л.И., Апарнев А.И.).
3. Практикум по общей и неорганической химии: Пособие для студентов вузов / под ред. Н.Н. Павлова, В.И. Фролова. – М.: Дрофа, 2002.
4. Коровин Н.В. Общая химия. – М.: Высшая школа, 2008.
5. Гуров А.А., Бадаев Ф.З., Овчаренко Л.П., Шаповал В.Н. Химия: учебник. – М.: Изд-во МГТУ им. Н.Э. Баумана, 2007.
6. Шевницына Л.В., Апарнев А.И., Казакова А.А. Практикум по общей и неорганической химии. – Новосибирск: Изд-во НГТУ, 2006. – Ч. 1, 2.
7. Демонстрационные опыты по общей и неорганической химии: учеб. пособие для студ. высш. учеб. заведений / под ред. Степина Б.Д. – М.: Гуманит. изд. центр ВЛАДОС, 2003. – 336 с.
ПРИЛОЖЕНИЕ
Плотности водных растворов некоторых солей при 20 °С(г/мл)
| NaCl | Na2SO4 | KCl | MgCl2 | MgSO4 | ||||||||
| w, % | r, г/мл | w, % | r, г/мл | w, % | r, г/мл | w, % | r, г/мл | w, % | r, г/мл | |||
| 1 | 1, 005 | 1 | 1, 008 | 1 | 1, 005 | 2 | 1, 051 | 2 | 1, 018 | |||
| 2 | 1, 012 | 2 | 1, 016 | 2 | 1, 011 | 8 | 1, 065 | 4 | 1, 039 | |||
| 4 | 1, 027 | 4 | 1, 035 | 4 | 1, 024 | 14 | 1, 119 | 6 | 1, 060 | |||
| 6 | 1, 041 | 6 | 1, 053 | 6 | 1, 037 | 20 | 1, 175 | 8 | 1, 081 | |||
| 8 | 1, 056 | 8 | 1, 072 | 8 | 1, 050 | 26 | 1, 235 | 10 | 1, 103 | |||
| 10 | 1, 071 | 10 | 1, 091 | 10 | 1, 063 | 32 | 1, 297 | 12 | 1, 125 | |||
| 12 | 1, 086 | 12 | 1, 111 | 12 | 1, 077 |
| 14 | 1, 148 | ||||
| 14 | 1, 101 | 14 | 1, 131 | 14 | 1, 090 |
| 16 | 1, 171 | ||||
| 16 | 1, 116 | 16 | 1, 151 | 16 | 1, 104 |
| 18 | 1, 195 | ||||
| 18 | 1, 132 | 18 | 1, 118 |
| 20 | 1, 219 | ||||||
| 20 | 1, 148 | 20 | 1, 132 |
| 22 | 1, 245 | ||||||
| 22 | 1, 164 | 22 | 1, 147 |
| 24 | 1, 270 | ||||||
| 24 | 1, 180 | 24 | 1, 162 |
| 26 | 1, 296 | ||||||
|
| ||||||||||||
| NH4Cl | MnSO4 | Na2CO3 | (NH4)2SO4 | CaCl2 | ||||||||
| w, % | r, г/мл | w, % | r, г/мл | w, % | r, г/мл | w, % | r, г/мл | w, % | r, г/мл | |||
| 1 | 1, 001 | 1 | 1, 009 | 0, 2 | 1, 000 | 1 | 1, 004 | 1 | 1, 007 | |||
| 2 | 1, 04 | 2 | 1, 019 | 2, 1 | 1, 020 | 2 | 1, 010 | 2 | 1, 015 | |||
| 4 | 1, 011 | 4 | 1, 038 | 4, 03 | 1, 040 | 4 | 1, 022 | 4 | 1, 031 | |||
| 6 | 1, 017 | 6 | 1, 059 | 5, 95 | 1, 060 | 6 | 1, 034 | 6 | 1, 049 | |||
| 8 | 1, 023 | 8 | 1, 081 | 7, 85 | 1, 080 | 8 | 1, 046 | 8 | 1, 066 | |||
| 10 | 1, 029 | 10 | 1, 102 | 9, 75 | 1, 100 | 10 | 1, 057 | 10 | 1, 083 | |||
| 12 | 1, 034 | 12 | 1, 125 | 11, 6 | 1, 120 | 12 | 1, 069 | 12 | 1, 102 | |||
| 14 | 1, 040 | 14 | 1, 148 | 13, 4 | 1, 140 | 14 | 1, 081 | 14 | 1, 120 | |||
| 16 | 1, 046 | 16 | 1, 171 | 15, 2 | 1, 160 | 16 | 1, 092 | 16 | 1, 139 | |||
| 18 | 1, 051 | 18 | 1, 196 | 16, 8 | 1, 180 | 18 | 1, 104 | 18 | 1, 158 | |||
| 20 | 1, 057 | 20 | 1, 220 | 17, 7 | 1, 190 | 20 | 1, 115 | 20 | 1, 177 | |||
| 22 | 1, 062 | 22 | 1, 246 | 24 | 1, 138 | 25 | 1, 228 | |||||
| 26 | 1, 072 | 24 | 1, 272 | 28 | 1, 161 | 28 | 1, 260 | |||||
ХИМИЯ
Последнее изменение этой страницы: 2019-04-09; Просмотров: 1465; Нарушение авторского права страницы