
|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |

|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |
Зависимость теплоемкости от температуры
Температурную зависимость удельной теплоемкости приближенно можно выразить в виде полинома третьей степени от t °С (рис. 9, зависимость 1–2):
где a, b, c, d – постоянные коэффициенты, численные значения которых зависят от рода газа и характера протекания процесса.
Расчетные или, как их обычно называют, интерполяционные формулы для определения истинной мольной теплоемкости некоторых газов приведены в соответствующих таблицах. Количество теплоты в процессе нагрева идеального газа от t1 до t2 графически изображается площадью под прямой и выражается уравнением:
6.7. Отношение удельных теплоемкостей ср и сυ. Показатель адиабаты В термодинамических уравнениях часто используется отношение удельных теплоемкостей в процессах при постоянном давлении и постоянном объеме, которое носит название показателя адиабаты (k): Согласно классической кинетической теории газов, величина k определяется числом степеней свободы молекулы: При с = const получим: для одноатомного газа для двухатомного газа для трех- и многоатомных газов При с ≠ const получим, что k зависит от температуры: 6.8. Определение qp и qυ для идеальных газов Уравнения для расчета количества теплоты qp и qυ выглядят следующим образом:
Следовательно, для определения теплоты необходимо знать либо удельную теплоемкость в интервале температур от 0 до t ºC, либо значения удельных энтальпий и удельных внутренних энергий. В настоящее время имеется большое количество пособий и специальных таблиц, в которых эти величины приводятся с высокой степенью точности для широкого интервала температур. Теплоемкость смеси идеальных газов При расчетах тепловых установок приходится встречаться со смесями газов, а таблицы содержат данные только для отдельных газов. Поэтому нужно уметь определять теплоемкость газовой смеси. Для массовой теплоемкости:
Для объемной теплоемкости:
Для мольной теплоемкости:
Энтропия Поскольку теплота q не является функцией состояния, Выражение
Эта формула справедлива и для идеальных, и для реальных газов. Поскольку при температуре, близкой к абсолютному нулю, вещества находятся в конденсированном состоянии, их энтропия также стремится к нулю. Этот закон называют третьим законом термодинамики. В технической термодинамике обычно используется не абсолютное значение удельной энтропии, а ее изменение в каком-либо процессе:
Поэтому удельную энтропию часто отсчитывают от произвольного уровня значения. Удельная энтропия может быть определена как функция Т и υ при сυ = const, тогда для идеального газа:
Если удельная энтропия задана как функция р и Т при ср = const, тогда для идеального газа:
Поскольку удельная энтропия есть функция состояния рабочего тела, все уравнения можно использовать для расчетов вне зависимости от пути перехода.
Обратимый круговой процесс изображен на диаграмме площадью 13241. Из уравнения δq = ds Т следует, что δq и ds имеют одинаковые знаки. Следовательно, при увеличении удельной энтропии теплота к системе подводится, а при уменьшении отводится. Разность между подведенным и отведенным количеством теплоты представляет собой полезную внешнюю работу, которую совершает рабочее тело при круговом обратимом процессе над внешним объектом работы: Контрольные вопросы 1. Что понимают под удельной теплоемкостью? 2. Дать определение массовой, объемной и мольной теплоемкостям. 3. Что называется средней теплоемкостью? 4. Что называется истинной теплоемкостью? 5. Что такое теплоемкость при постоянном объеме и теплоемкость при постоянном давлении? 6. Как записывается и какой смысл уравнения Майера? 7. Какой смысл показателя адиабаты k и как он определяется? 8. Почему удельная теплоемкость при постоянном давлении всегда больше удельной теплоемкости при постоянном объеме? 9. Каким выражением устанавливается зависимость истинной теплоемкости реальных газов от температуры? 10. Какими уравнениями вычисляется средняя теплоемкость? 11. Что представляет собой теплоемкость газовой смеси и как она вычисляется? Задача Определить изменение внутренней энергии 2 кг кислорода при расширении в цилиндре с подвижным поршнем, если температура его изменяется от 600 до 100 °С. Задачу решить при постоянной теплоемкости и по таблицам. Определить процент ошибки. Решение Изменение внутренней энергии кислорода при переменной удельной теплоемкости
где
Изменение внутренней энергии кислорода при постоянной удельной теплоемкости
Процент ошибки
7. ТЕРМОДИНАМИЧЕСКИЕ ПРОЦЕССЫ 7.1. Основные определения Первый закон термодинамики устанавливает взаимосвязь между количеством теплоты, изменением внутренней энергии и внешней работой газа, причем количество теплоты, отводимое от тела и подводимое к нему, зависит от характера процесса. Основные термодинамические процессы: 1) изохорный (υ = const); 2) изобарный (р = const); 3) изотермический (Т = const); 4) адиабатный (протекающий при отсутствии теплообмена с окружающей средой). Кроме того, существует группа процессов, являющихся при определенных условиях обобщающими для основных процессов. Эти процессы называются политропными (характеризуются постоянством теплоемкости в процессе). Для всех процессов устанавливается общий метод исследования, заключающийся в следующем: 1) выводится уравнение кривой процесса на р, υ- и Т, s-диаграммах; 2) устанавливается зависимость между основными параметрами рабочего тела в начале и конце процесса; 3) определяется изменение удельной внутренней энергии по формуле, справедливой для всех процессов идеального газа:
или при постоянной удельной теплоемкости 4) вычисляется работа изменения объема газа по основной формуле:
5) определяется удельное количество теплоты, участвующее в процессе:
6) определяется изменение удельной энтальпии в процессе по формуле, справедливой для всех процессов:
и для постоянной удельной теплоемкости 7) определяется изменение удельной энтропии идеального газа по формулам:
Рассматриваемые процессы считаются обратимыми. Изохорный процесс Изохорным называется процесс, протекающий при постоянном объеме. Кривая процесса называется изохорой (рис. 11).
Изохорного процесса | Из уравнения состояния идеального газа
|
Внешняя работа газа (работа расширения) при этом равна нулю: 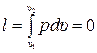 . Удельная располагаемая (полезная) внешняя работа l´, которая может быть передана внешнему объекту работы, определяется по формуле:
. Удельная располагаемая (полезная) внешняя работа l´, которая может быть передана внешнему объекту работы, определяется по формуле:
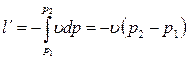 .
.
Основное уравнение первого закона термодинамики при δl = 0 принимает вид:
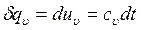 .
.
Количество теплоты, участвующее в процессе при постоянной удельной теплоемкости, равно
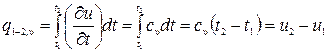 .
.
Вся внешняя теплота расходуется только на изменение удельной внутренней энергии.
При переменной удельной теплоемкости 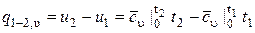 .
.
Если в процессе давление повышается, то удельное количество теплоты подводится, при этом увеличиваются внутренняя энергия и температура газа. Если давление понижается, то теплота отводится, при этом уменьшаются внутренняя энергия и температура.
Изменение удельной энтропии в изохорном процессе при постоянной удельной теплоемкости равно:
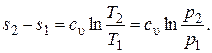
Данное уравнение показывает, что изохора на T, s-диаграмме (рис. 12) представляет собой кривую 1–2.
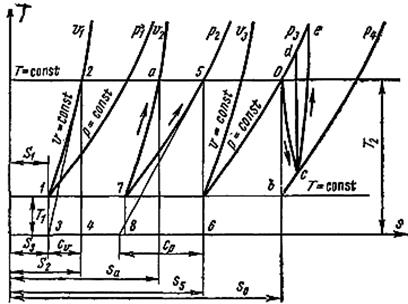
Рис. 12. Т, s-диаграмма
Площадь под кривой в некотором масштабе изображает количество теплоты q, расходуемое на изменение удельной внутренней энергии газа (u2 – u1). Изохоры, построенные для различных объемов, смещены друг относительно друга на расстояние, определяемое по уравнению при Т = const (рис. 12): 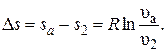 Чем больше объем газа, тем дальше находится изохора от оси ординат.
Чем больше объем газа, тем дальше находится изохора от оси ординат.
Изобарный процесс
Изобарным называется процесс, протекающий при постоянном давлении. Кривая процесса называется изобарой (рис. 13).
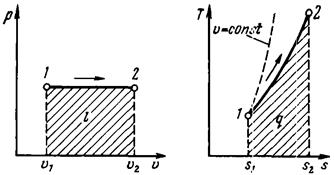 Рис. 13. р, υ- и T, s-диаграммы
изобарного процесса
Рис. 13. р, υ- и T, s-диаграммы
изобарного процесса
| Из уравнения состояния идеального газа 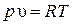 при р = const объем газа изменяется прямо пропорционально абсолютным температурам: при р = const объем газа изменяется прямо пропорционально абсолютным температурам:
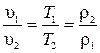 . .
|
При расширении газа его температура возрастает, при сжатии – уменьшается. Удельная работа изменения объема выражается уравнением:
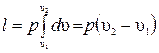 или
или 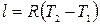 .
.
Удельная располагаемая (полезная) внешняя работа: 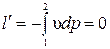 .
.
Изменение удельной внутренней энергии: 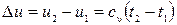 .
.
Основное уравнение первого закона термодинамики при р = const принимает вид: 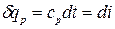 . Следовательно, удельное количество теплоты, сообщенное телу в изобарном процессе при постоянной удельной теплоемкости:
. Следовательно, удельное количество теплоты, сообщенное телу в изобарном процессе при постоянной удельной теплоемкости:
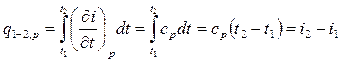 .
.
При переменной удельной теплоемкости 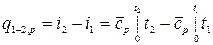 .
.
Часть сообщенного удельного количества теплоты q1–2,р, равная р (υ2 – υ1), переходит в работу расширения, а другая часть идет на увеличение удельной внутренней энергии тела.
Для обратимого изобарного процесса при постоянной удельной теплоемкости изменение удельной энтропии находится по уравнению 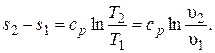
Изобара на Т, s-диаграмме изображается кривой, обращенной выпуклостью вниз. Площадь под изобарой в некотором масштабе изображает некоторое количество теплоты qp, сообщенное газу и равное изменению удельной энтальпии i2 – i1. Все изобары при одной и той же температуре имеют одинаковые угловые коэффициенты. Горизонтальные расстояния между изобарами различных давлений при Т = const (рис. 13) определяются по уравнению 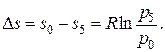 Из данного уравнения следует, что расстояние между изобарами зависит от давлений и природы газа. Чем больше давление газа, тем ближе изобара к оси ординат. В случае осуществления изобарного и изохорного процессов в одном температурном интервале возрастание удельной энтропии будет больше в изобарном процессе, так как ср всегда больше сυ. Поэтому изобара является более пологой кривой по сравнению с изохорой (рис. 13).
Из данного уравнения следует, что расстояние между изобарами зависит от давлений и природы газа. Чем больше давление газа, тем ближе изобара к оси ординат. В случае осуществления изобарного и изохорного процессов в одном температурном интервале возрастание удельной энтропии будет больше в изобарном процессе, так как ср всегда больше сυ. Поэтому изобара является более пологой кривой по сравнению с изохорой (рис. 13).
Изотермический процесс
Изотермическим называется процесс, протекающий при постоянной температуре. Кривая процесса называется изотермой (рис. 14). Для изотермического процесса идеального газа 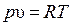 или
или 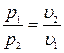 . При постоянной температуре объем газа изменяется обратно пропорционально его давлению (закон Бойля – Мариотта).
. При постоянной температуре объем газа изменяется обратно пропорционально его давлению (закон Бойля – Мариотта).
 На р, υ-диаграмме (рис. 14) изотермический процесс представляет собой равнобокую гиперболу. Основное уравнение первого закона термодинамики при T = const принимает вид:
На р, υ-диаграмме (рис. 14) изотермический процесс представляет собой равнобокую гиперболу. Основное уравнение первого закона термодинамики при T = const принимает вид: 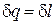 или
или 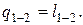 Количество подведенной к рабочему телу теплоты численно равно работе изменения объема. Удельная работа изменения объема
Количество подведенной к рабочему телу теплоты численно равно работе изменения объема. Удельная работа изменения объема 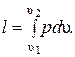 Но из уравнения изотермы
Но из уравнения изотермы 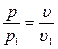 имеем
имеем 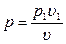 , поэтому
, поэтому 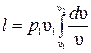 . Интегрируя последнее выражение, получим
. Интегрируя последнее выражение, получим 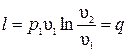 . При переходе к десятичному логарифму
. При переходе к десятичному логарифму
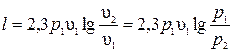 .
.
Удельная располагаемая внешняя работа l´ определяется по формуле
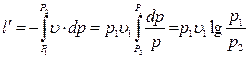 .
.
Таким образом, в изотермическом процессе идеального газа 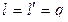 , или удельная работа изменения объема, располагаемая (полезная) работа и удельное количество теплоты, полученное телом, равны между собой.
, или удельная работа изменения объема, располагаемая (полезная) работа и удельное количество теплоты, полученное телом, равны между собой.
Удельная теплоемкость в изотермическом процессе
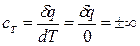 .
.
Удельная энтальпия и удельная внутренняя энергия идеального газа не меняются, т. е. di = 0 и du = 0. Для определения изменения удельной энтропии используют уравнение 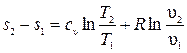 . Откуда
. Откуда 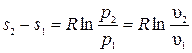 .
.
Удельное количество теплоты, участвующее в изотермическом процессе, равно произведению изменения удельной энтропии (s2 – s1) на абсолютную температуру Т:
q = T (s2 – s1).
Адиабатный процесс
Адиабатным называется процесс, протекающий без подвода и отвода теплоты, т. е. при отсутствии теплообмена рабочего тела с окружающей средой. Кривая процесса – адиабата (рис. 15).
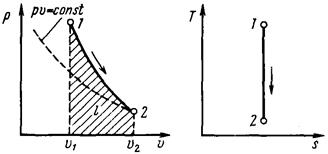 Рис. 15. р, υ- и T, s-диаграммы
адиабатного процесса
Рис. 15. р, υ- и T, s-диаграммы
адиабатного процесса
| Из уравнения первого закона термодинамики при dq = 0 имеем
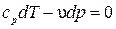 и и 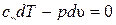 . Разделив первое уравнение на второе, получим . Разделив первое уравнение на второе, получим 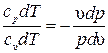 или или 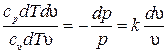 . .
|
Интегрируя последнее выражение при условии, что k = const (поскольку ср = const и сυ = const), получим 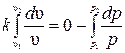 и
и 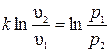 . После потенцирования имеем
. После потенцирования имеем 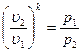 и
и 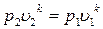 .
.
Отсюда уравнение адиабаты 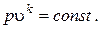
Величина k называется показателем адиабаты.
Зависимость между основными параметрами в адиабатном процессе
Из уравнения адиабаты следует, что 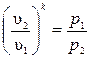 и
и 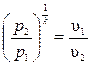 .
.
Если эти соотношения параметров тела подставить в уравнение состояния для крайних точек процесса 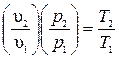 , то после соответствующих преобразований получим
, то после соответствующих преобразований получим 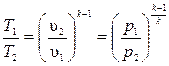 .
.
Удельная работа изменения объема 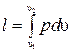 , совершаемая телом над окружающей средой при равновесном адиабатном процессе, может быть вычислена по уравнению адиабаты
, совершаемая телом над окружающей средой при равновесном адиабатном процессе, может быть вычислена по уравнению адиабаты 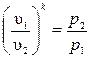 или
или
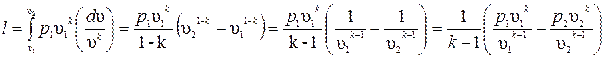 .
.
Откуда 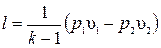 .
.
Из данного выражения могут быть получены следующие формулы:
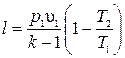 и
и 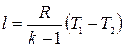 .
.
Отношение температур заменяем отношением объемов и давлений.
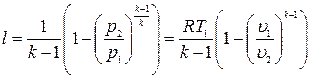 .
.
Все зависимости между р, υ и Т и уравнения работы получены при условии k = const. При переменном k при расчетах берут среднее значение, соответствующее изменению температуры в процессе по уравнению:
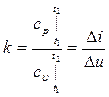 .
.
Уравнения первого закона термодинамики для адиабатного процесса:
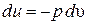 и
и 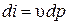 .
.
Из этих выражений можно получить дифференциальное уравнение изоэнтропного (при постоянной удельной энтропии) процесса:
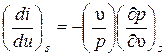 .
.
В этом уравнении 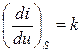 .
.
Согласно первому закону термодинамики, удельная работа изменения объема в адиабатном процессе получается за счет убыли удельной внутренней энергии тела.
При cυ = const 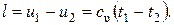
При сυ ≠ const 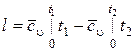 .
.
Если газ расширяется, то его внутренняя энергия и температура убывают; если газ сжимается, то его внутренняя энергия и температура возрастают.
Удельная теплоемкость в адиабатном процессе из выражения 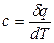 при dq = 0 также равна нулю.
при dq = 0 также равна нулю.
Располагаемая (полезная) внешняя работа в адиабатном процессе:
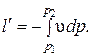
При обратимом адиабатном процессе идеального газа располагаемая внешняя работа будет в k раз больше удельной работы изменения объема и обратна ей по знаку: 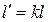 и
и 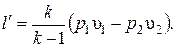
Графически располагаемая внешняя работа изображается на р, υ-диаграм-ме (пл. ABCD на рис. 16).
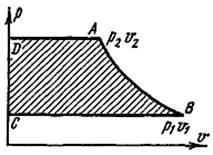 Рис. 16. Графическое изображение располагаемой внешней работы
Рис. 16. Графическое изображение располагаемой внешней работы
| На рис. 16 видно, что, поскольку k > 1, линия адиабаты (АВ) идет круче линии изотермы: при адиабатном расширении давление понижается быстрее, чем при изотермическом, так как в процессе расширения уменьшается температура газа. Для обратимого адиабатного процесса dq = 0, поэтому 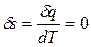 и s1 = s2 = const, т. е. обратимый адиабатный процесс является изоэнтропным. и s1 = s2 = const, т. е. обратимый адиабатный процесс является изоэнтропным.
|
Протекание необратимого адиабатного процесса не является изоэнтропным и независимо от его направления как при расширении, так и при сжатии сопровождается увеличением удельной энтропии. На рис. 12 обратимый адиабатный процесс изображается прямыми 0–b, d–c, необратимый адиабатный процесс расширения – кривая 0–с, процесс сжатия – с–e.
Политропные процессы
Политропным называется всякий процесс идеального газа, в котором удельная теплоемкость является постоянной величиной. Кривая процесса – политропа. Частные случаи политропного процесса – изохорный, изобарный, изотермический, адиабатный, протекающие при постоянной удельной теплоемкости. Удельная теплоемкость политропного процесса сП принимает значения от +∞ до –∞. Удельное количество теплоты политропного процесса:
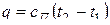 и
и 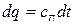 .
.
Вывод уравнения политропного процесса
на основании первого закона термодинамики
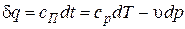 и
и 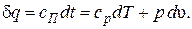
Из этих уравнений найдем 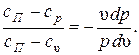 Обозначив выражение
Обозначив выражение 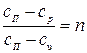 , получим
, получим 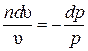 . Интегрируя полученное выражение в пределах начало–конец процесса, находим
. Интегрируя полученное выражение в пределах начало–конец процесса, находим 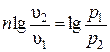 или
или
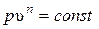 – уравнение политропного процесса.
– уравнение политропного процесса.
Показатель политропы n принимает для каждого процесса определенное числовое значение:
изохорный процесс: n = ±∞;
изобарный процесс: n = 0;
изотермический процесс: n = 1;
адиабатный процесс: n = k.
Поскольку уравнение политропы отличается от уравнения адиабаты только значениями показателя n, то и все уравнения, связывающие основные параметры, аналогичны:
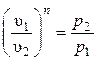 ;
; 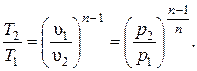
Удельная теплоемкость политропного процесса определяется из формулы 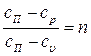 . Откуда
. Откуда 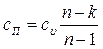 .
.
Данное уравнение позволяет определить удельную теплоемкость для каждого значения n. Подставив в него значения n для частных случаев, получим:
изохорный процесс: n = ±∞, сП = сυ;
изобарный процесс: n = 0, сП = k сυ;
изотермический процесс: n = 1, сП = ±∞;
адиабатный процесс: n = k, сП = 0.
Уравнение удельной работы изменения объема, совершаемой телом при политропном процессе, имеет аналогичный вид с уравнением при адиабатном процессе:
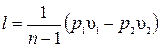 .
.
Изменение удельной внутренней энергии газа и удельное количество теплоты в политропном процессе определяется по формулам:
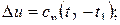
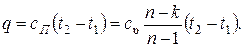
Располагаемая внешняя работа в политропном процессе по аналогии с адиабатным процессом равна:
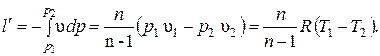
Изменение удельной энтальпии в политропном процессе:
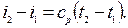
Значение n может быть определено по координатам двух любых точек графика:
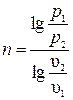 ;
; 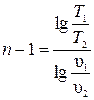 ;
; 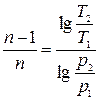 .
.
Изменение удельной энтропии газа в политропном процессе определяется по формуле: 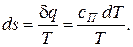
Или для конечного изменения состояния 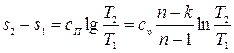 .
.
Политропный процесс на T, s-диаграмме изображается некоторой кривой, расположение которой зависит от показателя n (рис. 17). На рис. 18 показано расположение политропных процессов на p, υ-диаграмме, выходящих из одной и той же точки, в зависимости от значения показателя n.
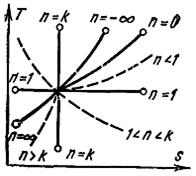 Рис. 17. T, s-диаграмма политропного процесса
Рис. 17. T, s-диаграмма политропного процесса
| 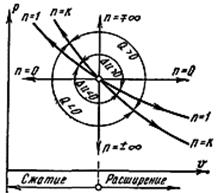 Рис. 18. р, υ-диаграмма политропного процесса
Рис. 18. р, υ-диаграмма политропного процесса
|
Изменение удельной внутренней энергии в политропных процессах следующее.
В изотермическом процессе при n = 1 удельная внутренняя энергия газа не изменяется (u2 = u1).
В изобарном процессе при n = 0 удельная внутренняя энергия увеличивается.
В изохорном процессе при n = –∞ удельная внутренняя энергия возрастает.
Отсюда можно сделать вывод, что все политропные процессы, т. е. процессы расширения, расположенные над изотермой, при n < 1, а процессы сжатия при n > 1 протекают с увеличением удельной внутренней энергии газа.
Политропные процессы, т. е. процессы расширения, расположенные под изотермой при n > 1, и процессы сжатия при n < 1 протекают с уменьшением удельной внутренней энергии газа.
Изменения знака количества теплоты политропного процесса следующие.
В адиабатном процессе теплота не подводится и не отводится.
Изохорный процесс расширения: n = –∞ – теплота подводится.
Изобарный процесс расширения: n = 0 – теплота подводится.
Изотермический процесс расширения: n = 1 – теплота подводится.
Следовательно, все политропные процессы, т. е. процессы расширения, расположенные адиабатой в пределах k > n > –∞, а процессы сжатия при ∞ > n > k протекают с подводом количества теплоты к рабочему телу.
Политропные процессы расширения при ∞ > n > k, а процессы сжатия при –∞ < n < k протекают с отводом количества теплоты.
Процессы, расположенные между адиабатой и изотермой, имеют отрицательную удельную теплоемкость, так как знак dq и du в этих процессах различный. Практически это означает, что при подводе теплоты в этих процессах температура уменьшается, а при отводе – увеличивается.
Контрольные вопросы
1. Дайте определение основным термодинамическим процессам.
2. Изобразите графически изохору, изобару, изотерму и адиабату в р, υ- и T, s-координатах.
3. Напишите уравнения основных процессов.
4. Напишите формулы соотношений между основными параметрами для каждого процесса.
5. Напишите формулы удельной работы изменения объема для каждого процесса.
6. Напишите формулы располагаемой (полезной) работы для каждого процесса.
7. При каком условии основные процессы идеального газа будут политропными?
8. Напишите уравнение политропы и укажите, в каких пределах изменяется показатель политропы.
9. Укажите значения показателя политропы для основных процессов.
10. По каким уравнениям вычисляется изменение удельной энтропии?
Задача
Воздух массой 10 кг расширяется изотермически при температуре 400 ºС и давлении 800 кПа до конечного объема V2 = 5 м3. Определить начальный объем, конечное давление, работу расширения, изменение удельных энтальпии, энтропии, внутренней энергии.
Решение
Начальный объем определяем из уравнения состояния
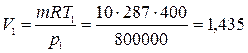 м3.
м3.
Конечное давление 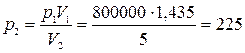 кПа.
кПа.
Работа расширения 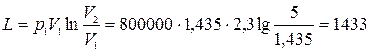 кДж.
кДж.
Изменение удельной энтропии
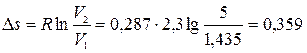
 .
.
Удельная энтальпия и удельная внутренняя энергия идеального газа в изотермическом процессе не изменяются, так как di = 0 и du = 0.
Последнее изменение этой страницы: 2019-05-08; Просмотров: 625; Нарушение авторского права страницы