
|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |

|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |
Механизм коррозионных разрушенийСтр 1 из 8Следующая ⇒
Аннотация
Работа посвящена проблеме увеличения степени защиты стали от коррозии в нейтральных и кислых средах, при использовании фосфорсодержащих ингибиторов, а также совершенствованию дискретных методов определения скорости коррозии. В первом разделе работы приведен анализ литературных данных по изучаемой проблеме. Во втором разделе содержатся результаты расчета термодинамических параметров основной реакции. В третьем разделе представлены результаты расчета материального баланса процесса получения борат метилфосфита. Четвертый и пятый разделы, соответственно, посвящены расчету теплового баланса стадии синтеза, разработке структурно-функциональной схемы процесса и расчету одного из аппаратов. Шестой раздел содержит описание объектов и методов исследования, результаты проведенных экспериментов.
Содержание Введение Литературный обзор 1.1 Проблема коррозии Механизм коррозионных разрушений 1.3 Виды коррозионных разрушений 1.4 Термодинамическая оценка процесса электрохимической коррозии 1.5 Кинетическое обоснование процесса коррозии 1.5.1 Поляризация электродных процессов 1.5.2 Концентрационная поляризация 1.5.3 Электрохимическое перенапряжение 1.6 Методы защита металлов от коррозии 1.7 Классификация ингибиторов 1.8 Методы определения скорости коррозии 1.9 Датчики скорости коррозии 2. Обсуждение результата термодинамического анализа Эмпирические методы расчета термодинамических величин 2.1.1 Метод Неймана-Коппа 2.1.2 Методы приближенного расчета энтропии и теплот образования веществ Расчет термодинамических характеристик основной реакции 3. Расчет материального баланса 4. Тепловой баланс стадии синтеза 5. Структурно-функциональная схема и расчет емкостного аппарата 5.1 Описаниеструктурно-функциональной схемы 5.2 Расчет емкостного аппарата 6. Экспериментальная часть 6.1 Объекты и методы исследования 6.2 Синтез целевого продукта 6.3 Кинетические исследования 6.4 Определение степени защиты 7. Методическая часть Выводы
Литературный обзор
Проблема коррозии Коррозия металлов и сплавов в агрессивных средах наносит огромный ущерб. В результате коррозии преждевременно выходят из строя нефте-, газо- и водопроводы, металлические конструкции, аппараты, машины и оборудование. Прямые потери от коррозии (потери стоимости выбывших из строя основных фондов, затраты на противокоррозионную защиту, на капитальные и текущие ремонты по причине коррозии) в промышленно развитых странах составляют 2–5% национального дохода, потери металлофонда – 15–30% его ежегодной выплавки. Косвенные потери, согласно ориентированным расчетам превышают прямые в 1, 5 – 2 раза [28]. Несмотря на большие возможности, которыми располагает современная техника защиты металлов, расходы, связанные с коррозией металлических изделий, конструкций и оборудования весьма велики. Ежегодные затраты на защиту от коррозии оборудования из стали достигают примерно 20% стоимости вновь изготовленных сооружений и тенденция роста этих затрат не уменьшается [34]. Поэтому разработка мероприятий, направленных на повышение коррозионной стойкости металлов и изделий из них, является весьма актуальной задачей. Научно-исследовательские работы по проблеме коррозии металлов вразличных агрессивных средах ведутся, в основном, по следующим направлениям: · создание новых коррозионно-стойких конструкционных материалов; · разработка способов защиты от коррозии конструкций, оборудования и материалов [31]. В настоящее время, вызывает интерес разработка средств технического контроля и обеспечения защиты конструкций и оборудования от коррозии металлов. Наиболее важно это для химической и нефтехимической промышленности, с целью увеличения эксплутационных ресурсов химического оборудования путем своевременного диагностирования и защиты. Кинетическое обоснование процесса коррозии В настоящее время считается достаточно строго обоснованной кинетическая теория. Она пришла на смену устаревшей теории микрогальванических (локальных) элементов. Коррозионные процессы являются гетерогенными химическими реакциями и к ним применили почти все положения формальной кинетики. Так, рассматривая этот процесс в виде последовательных стадий: 1) доставка вещества к поверхности; 2) адсорбция; 3) собственно реакция; 4) образование (или исчезновение) новой фазы; 5)отвод продуктов. Любая из этих пяти стадий электрохимического процесса может протекать затрудненно по сравнению с остальными. Поскольку в стационарных условиях скорость всего процесса определяется самой медленной стадией, то для того, чтобы эту стадию ускорить требуется определенные энергетические затраты, вызывающие перенапряжение [5, 6]. Если замедлена доставка ионов к поверхности или отвод продуктов реакция (транспортная стадия), а все остальные стадии (разряд ионов, ионизация металла, образование или разрушение кристаллической решетки) протекают без затруднений, быстро, то возникает концентрационное перенапряжение. Если замедлена только собственно электрохимическая реакция, то есть разряд ионов или окисление металла с отдачей электронов (эту стадия часто называют переносом заряда), то возникает химическое или активационное перенапряжение. Еслиэта стадия не требует ускорения, но затруднена стадия образования новой фазы, возникает фазовое перенапряжение [6]. Методы защита металлов от коррозии Основным условием противокоррозионной защиты металлов является уменьшение скорости коррозии. Уменьшить скорость коррозии можно: • путем подбора соответствующих коррозионностойких сплавов; • изменением состава агрессивной среды; • применением защитных покрытий; • изоляцией металла от агрессивной среды слоем более стойкого материала; • электрохимическими методами защиты. Первую группу методов защиты применяют на стадии изготовления металла, в процессе его термической и механической обработки. Принципы легирования и создания сплавов с определенными коррозионными и эксплуатационными характеристиками рассматривались ранее. Вторая группа методов борьбы с коррозией — это обработка среды с целью уменьшения ее агрессивности путем введения ингибиторов коррозии. Эти методы находят все более широкое применение. Нанесение изолирующего покрытия на поверхность металла позволяет в значительной степени снизить скорость его коррозии. Этот метод является универсальным и его давно применяют. Различают органические, например, лакокрасочные, и неорганические (гальванические, фосфатные и т.д.) покрытия. В ряде случаев для повышения защитного действия комбинируют неорганическое и органическое покрытие. Особенно часто применяют фосфатирование в качестве промежуточного слоя, обеспечивающего хорошую адгезию к металлу. В этом случае защитная способность органического покрытия возрастает в несколько раз. К электрохимическим методам борьбы с коррозией относятся такие, в основе которых лежит принцип непосредственного воздействия на скорость протекания сопряженных анодных и катодных реакций. Прежде всего это выражается в изменении потенциала защищаемого металла. Различают катодную и анодную электрохимическую защиту [28, 34].
Классификация ингибиторов Ингибиторы коррозии (ИК) от латинского слова inhibere - сдерживать, останавливать, предотвращать - химические вещества, влияющие на физико-химические процессы в коррозионной системе и способные предотвращать, сдерживать или останавливать коррозию (К) или коррозионно-механическое изнашивание - износ (КМИ), уменьшать наносимый металлу или металлоизделиям вред (порчу), то есть вещества, способные сохранять или улучшать функциональные свойства металлоизделий, в частности, поверхностей узлов трения, повышать долговечность, надежность (безотказность) и ресурс двигателей, машин и механизмов, а также трубопроводов, наземных и подземных сооружений и любых других металлоизделий. [27] ИК делятся на неорганические (5% от общего количества) и органические (95 %). Органические ИК - поверхностно-активные вещества (ПАВ) делятся на естественные (природные) и искусственные. Естественные ПАВ-ИК содержатся в сырой нефти и нефтепродуктах (нафтеновые, азотистые основания, асфальто-смолистые вещества), в продуктах переработки угля, торфа, горючих сланцев, растительного и животного сырья. Искусственные (синтетические) ПАВ—ИК получают на химических и нефтехимических заводах методами окисления, сульфирования, нитрования, восстановления алкилирования и т.п. Всего в качестве ИК известны многие тысячи соединений. Предложена классификация ИК, как ПАВ с делением их на водорастворимые (ВИК), водомаслорастворимые (ВМИК) и маслорастворимые (МИК) [36]. ВИК, ВМИК и МИК всех типов являются поверхностно-активными веществами (ПАВ), которые по олеофильно-гидрофильному или гидрофильно-липофильному балансу и критической концентрации мицеллообразования в полярной или малополярной среде делятся на пять групп. По механизму действия ВИК в полярных средах (электролитах) подразделяются на ИК анодного, катодного и смешанного типа. По механизму действия ВМИК и МИК в неполярных ( углеводородных средах) согласно предложенной классификации делятся на ИК хемосорбционного типа -доноры или акцепторы электронов, на ИК адсорбционного (экранирующего типа) и на быстродействующие, водовытесняющие вещества. [10] Применительно к нефти и нефтепродуктам различают их защитные (консервационные) свойства - способность защищать металл от коррозии. В тонкой пленке в системе «металл-нефтепродукт-электролит (газ)», где превалирует электрохимическая коррозия (ЭХК) и противокоррозионные свойства (коррозионную агрессивность) в системе «металл-нефтепродукт». Как правило при повышенной температуре (100-200°С) в системе «металл-нефтепродукт», превалирует химическая коррозия (ХК). [36] Защитные свойства нефтепродуктов (специальных жидкостей, смазок, составов) улучшают ВМИК и МИК, противокоррозионные свойства - специальные противокоррозионные присадки [27]. В последние годы получили значительное распространение так называемые комбинированные маслорастворимые ингибиторы коррозии (КМИК) и анти-фрикционно-защитные противоизносные композиции (АЗПК), защищающие металлоизделия от всех видов коррозии, особенно эффективные в условиях механо-химической К (МХК) - «динамической коррозии». («Обычные» ИК в условиях МХК недостаточно эффективны). Масштабы производства и потребления различных ИК, противокоррозионных присадок и АЗПК представлены в табл.1 [36].
Таблица 1.1 – Производство и потребление ингибиторов коррозии и присадок
Производство и потребление ингибиторов коррозии и присадок
Объем мирового производства ИК и защитных присадок всех типов составляет в настоящее время (2003 год) 4 – 4, 5 млн. т. с тенденцией к росту до 5 – 5, 5 млн. т. к 2005 году. Практически большинство крупных нефтяных и нефтехимических фирм США, Англии, Франции, Голландии, Японии и других развитых стран разрабатывают и производят ИК и противокоррозионные присадки, а некоторые из них специализируются на производстве этого вида продукции (Хехст, Германия; Витко, США; Любризол, Англия; и др.) Из общего количества производства и потребления ИК до 80% составляет МИК - (защитные и противокоррозионные присадки), используемые, главным образом, для ингибирования нефтепродуктов - бензинов, дизельных и реактивных топлив, масел, пластичных смазок, пленкообразующих ингибированных нефтяных составов (ПИНС), защитных водовытесняющих составов (ЗВВС), смазочно-охлаждающих технологических средств (СОТС), некоторых видов грунтовок, лаков и красок. Остальные ИК по областям применения распределяются следующим образом: до 20% — для нефтегазодобывающих отраслей промышленности (ВИК, ВМИК, МИК, КИК), остальные — ингибиторы кислотной коррозии (травление), «летучие» ингибиторы, ингибиторы для систем водяного охлаждения, теплоэнергосетей и прочее [2]. По масштабам производства и потребления на первом месте находятся нефтяные и синтетические сульфонаты, различные первичные, вторичные и третичные алифатические и ароматические амины и их производные с органическими кислотами (соли, амиды, имидазолины, алкенилсукцинимиды); основания Манниха, четвертичные аммониевые основания; фосфиты и фосфаты, диалкил- и диарилдитиофосфаты цинка и других металлов, нитрованные масла, окисленный петролатум, полные и неполные (кислые) сложные эфиры, продукты оксиэтилирования и оксипропилирования и другие неионогенные ПАВ. В последнее время особое внимание уделяется ИК-ПАВ, содержащим в своем составе металлы с высоким сродством к водороду - Mo, Ni, Co, Ti, некоторые редкоземельные элементы или их смеси. [3, 6] Подобные ПАВ эффективны в условиях кислотной коррозии, наводораживания и водородного износа, питтинга, фреттинг-коррозии, коррозии под напряжением и трении, особенно, перспективны для создания антифрикцион-но-защитных противоизносных композиций - АЗПК. [36] ИК и прежде всего ИК-органические ПАВ - наиболее эффективные средства для защиты от ХК, ЭХК и МХК металлоизделий всех видов. Подсчитано, что капиталловложения, направленные на поиск новых и расширение производства существующих эффективных ИК и ингибированных материалов дают на один-два порядка лучшие экономические показатели (окупаемость, прибыль, продление сроков службы и улучшение экономичности эксплуатации металлоизделий), чем вложения в другие средства защиты от К. (новые сплавы, изменение конструкции, гальванические, металлические и лакокрасочные покрытия, строительство специальных контейнеров и складов с регулируемыми параметрами атмосферы и пр.). Датчики скорости коррозии Надежность технологического оборудования наряду с эффективной противокоррозионной защитой определяется и наличием системы диагностики процессов коррозии и параметров средств защиты. Результаты многолетних исследований технологического оборудования с использованием устройств Лайналог (США), фирмы Хагенук (Германия), Сервейер (Англия) и других фирм, показали, что для диагностики, прогнозирования коррозии и защиты требуется оснащение трубопроводов и другого оборудования, системами способными охватить весь спектр контролируемых параметров, создать систему мониторинга и систему телеконтроля средств катодной защиты, оснащенную датчиками контроля тока, напряжения, поляризационного потенциала, скорости коррозии, образование трещин, состояния изоляционного покрытия, температуры тела трубы, удельное сопротивление грунта и т. д. Таким образом основные причины организации систем диагностического мониторинга следующие: отсутствие доступа и затрудненный доступ к объекту; высокие скорости роста эксплуатационных дефектов в конструкции; катастрофические последствия от разрушения объекта. Основные цели организации систем диагностического мониторинга: своевременное обнаружение дефектов; сбор, хранение и анализ данных технического диагностирования и прогнозирование изменения технического состояния объектов во времени; автоматизация технического диагностирования и устранение человеческого фактора в оценке результатов диагностирования [28]. Для изучения и бесконтактного контроля электрохимической коррозии элементов подземных и наземных металлических конструкций разработано многочисленное количество датчиков, в основу которых положены разнообразные принципы действия. На сегодняшний день разработаны датчики на поверхностных электромагнитных волнах, которые позволяют непрерывно наблюдать за процессом коррозии стенки трубы, за развитием трещин при прохождении процесса стресс-коррозии. Известны датчики принципом действия которых является измерение поляризационного сопротивления. Примером служит отечественный датчик – Моникор-2. С помощью индикатора скорости коррозии Моникор-2 можно узнать в течение 1 минуты скорость коррозии в водной среде в момент измерения. Работа прибора основана на измерения поляризационного сопротивления (LPR - в зарубежной терминологии) при наложении на электроды датчика минимальной поляризации (до 10 мв) вблизи стационарного потенциала коррозии. Теоретически обосновано (Штерном и Гири), что при этом ток коррозии обратно пропорционален поляризационному сопротивлению [20]. Ультразвуковые датчики коррозии применятся при неразрушающем контроле в нефтехимической промышленности, где часто требуется выявление и картографирование коррозионных поражений. И здесь хорошо зарекомендовали себя ультразвуковые системы коррозионного мониторинга. Они используется в системе диагностического контроля для обслуживания локальных участков конструкции характеризующихся интенсивным износом и высокой вероятностью появления усталостных трещин. Принцип действия этих датчиков основан на отражении ультразвуковых волн от исследуемой поверхности, изменении их амплитуды и сдвига фаз исходящей и отраженной волн в зависимости от толщины образца сдвиг фаз разный, этот способ позволяет зафиксировать даже незначительное изменение толщины, локализованные очаги питтинговой коррозии и участки межкристаллической коррозии. Волюмометрические датчики, в промышленности не нашли широкого применения, но принцип их действия – определение скорости коррозии по объему поглотившегося газа, при атмосферной коррозии, или выделившегося газа, при коррозии в кислотных средах, используется при стационарных лабораторных испытаниях. Этот метод позволяет непрерывно следить за процессом коррозии, но не имеет высокой точности. Гравиметрические датчики также не нашли большого применения в промышленности, и используются в основном для лабораторных испытаний. Принцип действия датчиков основан на изменение массы образца. Этот метод является дискретным, а полученные значения скорости коррозии усредненными. Таким образом, на основании анализа литературных источников можно сделать вывод, что использование ингибиторов коррозии (ИК) и современных средств диагностирования, становится одним из основных способов защиты и своевременного предупреждения выхода из строя технологического оборудования. В настоящее время, очевидно, что использование традиционных дискретных методов обследования становится неэффективным из-за большой трудоемкости, несвоевременности и локальности данных способов обследования. Поэтому применения и совершенствования системы непрерывного слежения (мониторинга) за техническим состоянием оборудования, а также использование ИК или их комбинаций, является необходимым условием современных технологий. В связи с этим, разработка новых средств диагностики и ингибиторов коррозии для защиты технологического оборудования от коррозии при интенсивном теплообмене по-прежнему актуальна. 2. Обсуждение результата термодинамического анализа
Метод Неймана-Коппа В этом случае используется правило сложения теплоемкостей элементов, составляющих соединение, а именно:
Cp =
где cp – теплоемкость соединения, ср, i – теплоемкость составляющего его i – го элемента (с учетом количества атомов). Установлено, что погрешность расчета по данному методу не превышает допустимую при расчете термодинамических величин (8%) [18]. 2.1.2 Методы приближенного расчета энтропии и теплот образования веществ В соответствии с индивидуальной температурной зависимостью теплот образования веществ и их энтропий:
S0T, i = Δ S0298, i +
При наличии рассчитанных интегралов задача сводится к определению При отсутствии сведений о теплотах образования или сгорания можно вычислить теплоту образования при 298 К методом Коттрелла по энергии связей. Но, поскольку в справочных таблицах приведены усредненные значения энергии связей, без учета конкретного влияния образующихся индивидуальных связей в соединении, то результат расчета может существенно отличаться от экспериментальных данных. Значения теплот образования могут быть рассчитаны также при использовании теплового эффекта реакции, вычисляемого из равновесных данных по уравнению Гиббса-Гельмгольца [4, 13]. Для вычисления Δ S0298, i жидких элементорганических соединений основным исходным параметром является температура плавления в виду того, что для рассматриваемого соединения определить эту величину не представляется возможной, определение энтропии производится полуэмпирическими зависимостями [4, 26]. Итого |
1627, 39 |
100, 00 |
16, 59 |
100, 00 | |||||||||||||||||||||||||||||||||||||||||||||
Таблица 3.3 – Расход материальных потоков
| Вещество | кг/цикл | %, масс. | кмоль/цикл | %, моль. |
| Олигомер (целевой) | 625, 00 | 38, 40 | 1, 92 | 11, 55 |
| Метанол (осн. р-ция) | 252, 99 | 15, 55 | 7, 91 | 47, 65 |
| ММФ (непр.) | 7, 12 | 0, 44 | 0, 07 | 0, 45 |
| Na2SO4 | 5, 19 | 0, 32 | 0, 04 | 0, 22 |
| Н3ВО3 (непр.) | 5, 09 | 0, 31 | 0, 08 | 0, 49 |
| ДМФ (непр.) | 701, 88 | 43, 13 | 6, 38 | 38, 46 |
| Олигомер (побоч.) | 8, 61 | 0, 53 | 0, 07 | 0, 41 |
| Метанол (поб. р-ция) | 2, 19 | 0, 13 | 0, 07 | 0, 41 |
| Потери | 19, 33 | 1, 19 | 0, 06 | 0, 36 |
|
Итого |
1627, 39 |
100, 00 |
16, 59 |
100, 00 |
Таблица 4.1 – ТД величины веществ, приходящих с реакционным потоком
Состав реакционного потока
Gi,
кмоль/ц
СР = f(T)
Δ Нf2980
кДж/моль
Таблица 4.2 – ТД величины веществ, уходящих с реакционным потоком.
|
Состав реакционного потока | Gj, кмоль/ц | СР = f(T) | Δ Нf2980 кДж/моль | |||
| а | в·103 | с´ ·10-5 | с·106 | |||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| Борат метилфосфит (основной) | 1, 92 | 432, 38 | 114, 35 | -36, 74 | – | -4049, 34 |
| СН3ОН | 7, 91 | 15, 29 | 105, 27 | – | -31, 07 | -79, 634 |
| СН5РО3непр | 0, 07 | 68, 65 | 18, 23 | -17, 32 | – | -712, 35 |
| Na2SO4 | 0, 04 | 78, 53 | 71, 96 | 0, 00 | – | -770, 9 |
| Н3ВО3 непр | 0, 08 | 81, 39 | – | – | – | -1094, 89 |
| С2Н7РО3 непр | 6, 38 | 79, 39 | 21, 62 | -19, 21 | – | -784, 14 |
| Борат метилфосфит (побочный) | 0, 07 | 132, 59 | 37, 75 | -7, 83 | – | -712, 35 |
| СН3ОН поб | 0, 07 | 15, 29 | 105, 27 | -31, 07 | -31, 07 | -79, 634 |
| Потери | 0, 06 | 432, 38 | 114, 35 | -36, 74 | – | -4049, 34 |
Теплоемкость компонентов определяем как:

Таблица 4.3. Теплоемкость веществ при температурах Т1 и Т2.
| Состав входящего реакционного потока при Т1 = 298 К | Состав выходящего реакционного потока при Т2 = 393 К | ||
| Вещество | СР, Дж/(моль·К) | Вещество | СР, Дж/(моль·К) |
| Н3ВО3 | 81, 39 | Борат метилфосфит (основной) | 453, 53 |
| Na2SO4 | 99, 97 | СН3ОН | 51, 86 |
| С2Н7РО3 | 64, 20 | СН5РО3непр | 64, 60 |
| СН5РО3 | 54, 58 | Na2SO4 | 106, 81 |
| Н3ВО3 непр | 81, 39 | ||
| С2Н7РО3 непр | 75, 45 | ||
| Борат метилфосфит (побочный) | 125, 15 | ||
| СН3ОН поб | 51, 86 | ||
| Потери | 453, 53 | ||
Количество теплоты приходящее с реакционным потоком.

где Gi –мольный поток вещества,
cpi - теплоемкость вещества,
T1 – начальная температура входящего потока.
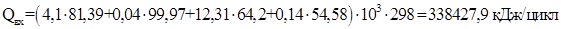
Теплота химической реакции.

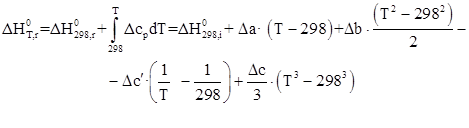
Исходные данные и результаты расчета представим в виде таблицы
Таблица 4.4 – Результаты расчета тепловых эффектов
| Состав входящего реакционного потока при Т1 = 298 К | Состав выходящего реакционного потока при Т2 = 393 К | ||||
| Вещество | Gi, кмоль/ц |  Дж/моль
Дж/моль
| Вещество | Gj, кмоль/ц |  Дж/моль
Дж/моль
|
| Н3ВО3 | 4, 10 | -1087158 | БМФ (основной) | 1, 92 | -4007491 |
| Na2SO4 | 0, 04 | -763115 | СН3ОН | 7, 91 | -77246 |
| С2Н7РО3 | 12, 31 | -778059 | СН5РО3непр | 0, 07 | -706635 |
| СН5РО3 | 0, 14 | -707151 | Na2SO4 | 0, 04 | -761078 |
| Н3ВО3 непр | 0, 08 | -1087158 | |||
| С2Н7РО3 непр | 6, 38 | -777447 | |||
| БМФ (побочный) | 0, 07 | -699150 | |||
Результаты расчета тепловых эффектов
| СН3ОН поб | 0, 07 | -77246 | |||
| Потери | 0, 06 | -4007491 | |||

| -14159990 | 
| -13714555 | ||

– реакция эндотермическая.
Рассчитаем количество тепла, необходимое для нагревания исходных веществ до температуры 393 К по следующей формуле:
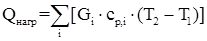 ,
,
где Gi – количество i-го компонента,
cp, i – теплоемкость i-го компонента при Т2.
Таблица 4.5 – Теплоемкость исходных веществ при температуре Т2 = 393 К.
| Состав реакционного потока | Gi, кмоль/цикл | СР = f(T) | СР393 Дж/моль | |||
| а | в·103 | с´ ·10-5 | с·106 | |||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| Н3ВО3 | 4, 10 | 81, 39 | – | – | – | 81, 39 |
| Na2SO4 | 0, 04 | 78, 53 | 71, 96 | – | – | 106, 81 |
| С2Н7РО3 | 12, 31 | 79, 39 | 21, 62 | -19, 21 | – | 75, 45 |
| СН5РО3 | 0, 14 | 68, 65 | 18, 23 | -17, 32 | – | 64, 60 |
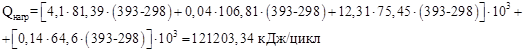
Тепло, выходящее из реактора с продуктами реакции:
 ,
,
где Т2=393 К.

Ввиду того, что в результате химического превращения ни одно из веществ не претерпевает фазового перехода, то Qф = 0 Дж/цикл.
Примем, что тепловые потери составляют 3% от приходящего тепла.

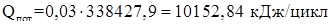
Уравнение всего энергетического баланса для нашего случая примет вид:
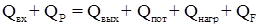
Количество тепла подводимое:


Из приведенных расчетов следует, что тепло нужно подводить.
Ориентировочная поверхность теплообмена
 ,
,
где Δ Т – средняя разность температур, Δ Т=50 оС; k – коэффициент теплообмена, k = 270 Вт/(м2·К).
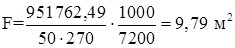 ,
,
где 1000 – количество Дж в 1 кДж; 7200 секунд – время синтеза цикла.
Таблица 4.6 Тепловой баланс.
| Приход тепла | Расход | ||||
| Тепловой поток |  10-3 10-3
| % | Тепловой поток | 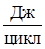 10-3 10-3
| % |
| Qвх | 338427, 90 | 26, 36 | Qвых | 713399, 06 | 55, 58 |
| QF | 951762, 49 | 73, 64 | Qпот | 10152, 84 | 0, 79 |
| QР | 445435, 13 | 34, 19 | |||
| Qнагр | 121203, 34 | 9, 44 | |||
| Итого | 1290190, 37 | 100 | Итого | 1290190, 37 | 100 |
Экспериментальная часть
Синтез целевого продукта
В данной работе проводится синтез борат метилфосфита по схеме:

Взаимодействие протекало в интервале температур от 90 до 120оС в течение двух часов с одновременной отгонкой метилового спирта. При мольном соотношении борной кислоты и диметилфосфита 1: 3. Не прореагировавший диметилфосфит отгоняли при температуре 180оС в течение трех часов. Полученную смесь охлаждали до 20оС. Продукт реакции представляет собой маловязкую неокрашенную жидкость, хорошо растворимую в воде, диметилформамиде, ацетоне, спиртах.
Кинетические исследования
С целью определения активационных параметров исследовали кинетику реакции. Кинетическое исследование проводили при соотношении диметилфосфита и борной кислоты 1: 3 по количеству выделившегося метанола. Кинетические кривые представлены на рис.6.1. Порядок реакции определяли графическим методом (рис.6.2.). Установлено, что взаимодействие диметилфосфита и борной кислоты протекает в соответствии с кинетическим уравнением второго порядка, на основании которого рассчитаны константы скорости реакции.

Рисунок 6.1 – Зависимость выхода метанола от продолжительности реакции.

Рисунок 6.2 – Зависимость обратной величины количества реакционного метанола от времени.
Условия синтеза: борная кислота: диметилфосфит =1: 3 (моль/моль), [СБК] = 0, 93 моль, [Сдмф] = 2, 79 моль. Температура: 363 К; 373 К; 383 К; 393 К.
Таким образом, скорость реакции пропорциональна концентрациям борной кислоты и диметилфосфита в первой степени и сопровождается образованием промежуточных комплексов.
Установлено, что кинетическая вязкость и молекулярная масса снижаются с увеличением количества диметилфофита в реакционной массе, что позволяет судить о прохождении реакции олигомеризации.
Поскольку анаморфоза в координатах ln(Кср) – ( 1/Т ) представлена линейной зависимостью, то активационные параметры поликонденсации подчиняются уравнению Аррениуса (рис.6.3).

Рисунок 6.3 – Температурная зависимость скорости реакции борной кислоты с диметилфосфитом
Расчет энергии активации и термодинамических параметров реакции проводили с использованием метода наименьших квадратов. Полученные значения констант средних скоростей реакции сведем в таблицу.
Таблица 6.1 – Активационные параметры реакции
| Температура, К | Кср·102, л/моль·с | Еакт, кДж/моль | ||
| 363 | 0, 1476 | 12, 449 |
Последнее изменение этой страницы: 2019-10-03; Просмотров: 168; Нарушение авторского права страницы