
|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |

|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |
РЕАКЦИИ ОБНАРУЖЕНИЯ АНИОНОВ.
АНАЛИЗ СОЛИ, РАСТВОРИМОЙ В ВОДЕ
Приведенная ниже классификация анионов основана на различной растворимости солей бария и серебра соответствующих кислот (табл.7.1). Таблица 7.1 Классификация анионов
I группа | ||||||||
| Соли бария не растворимы в воде, но растворимы в разбавленных кислотах (за исключением BaSO4). | Сульфат-ион SO42- Карбонат-ион CO32- Силикат-ион SiO32- Фосфат-ион PO43- и др. | ВаСl2 в нейтральной (или слабощелочной среде). | ||||||
|
II группа | ||||||||
| Соли серебра не растворимы в воде и HNO3. | Хлорид-ион Cl- Бромид-ион Br- Иодид-ион J- и др. | AgNО3 в присутствии HNO3. | ||||||
|
III группа | ||||||||
| Соли бария и серебра растворимы в воде. | Нитрит-ион NO2- Нитрат-ион NO3- и др. | Группового реагента нет. | ||||||
§1. Первая группа анионов
Общая характеристика анионов первой группы.
К первой группе относятся анионы серной, фосфорной, угольной, кремневой и других кислот. Для изучения реакций лучше брать соли соответствующих анионов с катионами щелочных металлов, таких как натрия и калия.
Действие группового реагента.
Групповой реагент – хлорид бария ВаСl2 с анионами SO 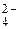 , PO
, PO 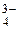 , CO
, CO 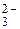 образует осадки белого цвета BaSO4, малорастворимые в воде, но легко растворяяющихся в минеральных кислотах (за исключением BaSO4). BaCO3 растворим в кислотах с выделением углекислого газа СО2. Соли Ва3(РО4)2 или ВаНРО4 растворимы в кислотах без выделения газов.
образует осадки белого цвета BaSO4, малорастворимые в воде, но легко растворяяющихся в минеральных кислотах (за исключением BaSO4). BaCO3 растворим в кислотах с выделением углекислого газа СО2. Соли Ва3(РО4)2 или ВаНРО4 растворимы в кислотах без выделения газов.
Работа 7. Реакции анионов первой группы
Реакции сульфат-иона
Опыт 1. Действие группового реагента хлорида бария ВаС l 2.
Выполнение опыта:
К небольшой порции раствора соли серной кислоты (сульфата натрия или калия) прилить немного раствора хлорида бария. Что наблюдается? Изучить отношение полученного осадка к кислотам (исключив серную кислоту). Составить молекулярное и молекулярно-ионные уравнения реакции получения осадка.
Реакции карбонат-иона
Опыт 2. Действие группового реагента ВаС l 2.
Выполнение опыта:
К небольшому количеству соли, содержащей карбонат-ион, прилить немного раствора хлорида бария. Изучить отношение осадка к кислотам (исключая серную кислоту). Написать уравнения реакций получения осадка и его растворения.
Реакции фосфат-иона
Опыт 3. Действие группового реагента ВаС l 2.
Выполнение опыта:
К отдельной порции раствора соли фосфорной кислоты прилить немного раствора хлорида бария. Наблюдать образование белого осадка – фосфата бария. Изучить отношение его к кислотам (исключая серную). Написать молекулярные и молекулярно-ионные уравнения реакций образования осадка и его растворения.
Опыт 4. Действие молибденовой жидкости
Молибдат аммония (NH4)2MoO4 в азотной кислоте (молибденовая жидкость), прибавленный в избытке, образует с ионами РО43- характерный лимонно-желтый кристаллический осадок фосформолибдата аммония:
Н3РО4+12(NH4)2MoO4+21HNO3®(NH4)3H4[P(Mo2O2)6]↓ +21NH4NO3+10H2O
Выполняя реакцию, действуют избытком реактива, так как осадок растворяется в гидрофосфате натрия.
Реакция с молибденовокислым аммонием является характерной реакцией для фосфат-иона.
Выполнение опыта:
Налить в пробирку 1-2 мл молибденовой жидкости и нагреть, затем по каплям добавить раствор соли фосфорной кислоты. Что наблюдается?
§2. Вторая группа анионов
Общая характеристика анионов второй группы.
Вторая группа анионов объединяет хлорид-ион Cl 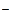 , бромид-ион Br
, бромид-ион Br 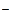 , иодид-ион J
, иодид-ион J 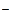 , сульфид-ион S2- и некоторые другие анионы, серебряные соли которых не растворимы в воде и в разбавленной азотной кислоте. Ко второй группе анионов относятся анионы хлора, брома, йода и другие.
, сульфид-ион S2- и некоторые другие анионы, серебряные соли которых не растворимы в воде и в разбавленной азотной кислоте. Ко второй группе анионов относятся анионы хлора, брома, йода и другие.
Действие группового реагента.
Групповым реагентом для группы является нитрат серебра AgNО3 в присутствии разбавленной азотной кислоты, который с анионом Cl- образует осадок белого цвета, с анионом Br 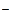 и J
и J 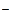 осадки светло-желтого цвета.
осадки светло-желтого цвета.
Хлорид серебра AgCl легко растворяется в растворе аммиака с образованием комплексного соединения – хлорида диаминсеребра (I).
AgCl + 2NH4 ОН ® [Ag(NH3)2]Cl + 2H2О
Бромид серебра AgBr мало растворяется в NH4OH, а йодид серебра AgI не растворим в NH4OH.
Работа 6. Качественные реакции второй группы анионов
Реакции хлорид-иона
Опыт 1. Действие группового реагента AgN О3.
Выполнение опыта:
К небольшому количеству раствора соли, содержащей хлорид-ион, прилить 1-2 мл раствора нитрата серебра. Наблюдать образование белого творожистого осадка хлорида серебра, темнеющего на свету.
Жидкость над осадком слить, добавить избыток гидроксида аммония и хорошо встряхнуть. Наблюдать растворение осадка.
Составить молекулярные и молекулярно-ионные уравнения реакций образования AgCl и его растворения.
Реакции иодид-иона
Опыт 2. Действие группового реагента AgNO 3.
Выполнение опыта:
К небольшому количеству раствора соли йодида (KJ или NaJ) прилить 1-2 мл нитрата серебра, образуется желтый осадок йодида серебра, нерастворимый в гидроксиде аммония.
Написать уравнение реакции образования осадка в молекулярном и молекулярно-ионном видах.
Опыт 3. Действие хлорной воды ( Cl 2 ).
Хлорная вода легко вытесняет свободный йод из йодида:
2KJ + Cl2 = J2 + 2KCl
Реакцию проводят в растворе подкисленном серной кислотой, так как в щелочной среде окраска йода обесцвечивается:
3J2 + 6NaOH = 5NaJ + NaJO3 + 3H2O
Хлорную воду прибавляют по каплям, так как избыток ее окисляет получившийся йод до йодноватистой кислоты:
J2 + Cl2 + H2O = 2HIO + 10 HCl
При одновременном присутствии J- и Br- хлорная вода сначала окисляет J-.
Выполнение опыта:
В пробирку налить около 1 мл соли йодида (KJ или NaJ) и около 0, 5 мл бензола, подкислить раствор 2н H2SO4, по каплям прилить хлорной воды и осторожно встряхнуть или перемешать стеклянной палочкой. Так как растворимость йода в бензоле выше, чем в воде, йод, вытесненный хлором, переходит в бензольный слой, окрашивая его в фиолетовый цвет. Наблюдать окрашивание бензольного слоя в розово-фиолетовый цвет.
Записать молекулярно-ионное уравнение реакции.
Третья группа анионов
Общая характеристика анионов третьей группы.
К третьей группе анионов относятся анионы азотной, азотистой и других кислот. Группового реагента у этой группы анионов нет.
Работа 7. Реакции анионов третьей группы
Реакции нитрат-иона
Опыт 1. Реакция с сульфатом железа ( II ) FeS О4.
Сульфат железа (II) окисляется азотной кислотой с выделением оксида азота (II). Реакция происходит в присутствии концентрированной серной кислоты:
2NaNO3 + 6FeSO4 + 4H2SO4 ® 3Fe2(SO4)3 + Na2SO4 + 2NO + 4H2O
Оксид азота образует с сульфатом железа (II) комплексное соединение бурого цвета:
FeSO4 + NO ® [Fe(NO)]SO4
Выполнение опыта:
Для выполнения реакции в пробирку налить немного раствора сульфата железа (II) и столько же соли азотной кислоты (NaNО3 или KNO3). Затем осторожно! , по стенке пробирки, чтобы жидкости не смешивались, добавить 2-3 капли концентрированной серной кислоты. На границе жидкостей образуется бурое кольцо комплексной соли [Fe(NO)]SO4.
Анионы Br- и I- мешают этой реакции. Они образуют сходные по окраске кольца, а анион NO2- также образует кольцо только с более разбавленной серной кислотой.
Реакции нитрит-иона
Опыт 2. Реакция с иодидом калия (натрия) KJ, NaJ.
Выполнение опыта:
К отдельной порции раствора, содержащего нитрит-ион, прилить растворы разбавленной серной кислоты, крахмала и йодида калия (или натрия). Наблюдать интенсивно синее окрашивание раствора и выделение газа, реакция идет быстро.
2 NaNO2 + 2H2SO4 + 2NaJ 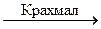 2Na2SO4 + 2NO + J2 + 2H2O
2Na2SO4 + 2NO + J2 + 2H2O
Составить молекулярно-ионное уравнение реакции.
Контрольные вопросы
1. На чем основана классификация анионов?
2. Какие ионы относят к первой группе анионов?
3. Как действует групповой реагент на анионы первой группы?
4. Какая аналитическая реакция является характерной для аниона РО 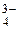 ?
?
5. Как действует групповой реагент на анионы второй группы?
6. Как действует свободный хлор на ионы брома Br- и йода J -? В какой цвет окрашивается бензольное кольцо?
7. Какие анионы относят к третьей аналитической группе?
8. Есть ли групповой реагент у этой группы анионов?
9. При помощи какого реактива можно открыть нитрат-ион?
10. Какой аналитической реакцией можно обнаружить нитрит-ион?
Последнее изменение этой страницы: 2019-10-04; Просмотров: 517; Нарушение авторского права страницы