Растворимость солей и оснований в воде
| Kt/An
| H+
| Li+
| K+
| Na+
| 
| Ba2+
| Ca2+
| Mg2+
| Sr2+
| Al 3+
| Cr3+
| Fe2+
| Fe3+
| Ni2+
| Co2+
| Mn2+
| Zn2+
| Ag+
| Hg+
| Pb2+
| Sn2+
| Cu2+
|
| OH-
|
| P
| P
| P
| P
| P
| M
| H
| M
| H
| H
| H
| H
| H
| H
| H
| H
| –
| –
| H
| H
| H
|
| F-
| P
| M
| P
| P
| P
| M
| H
| H
| H
| M
| H
| H
| H
| P
| P
| P
| P
| P
| –
| H
| P
| P
|
| Cl–
| P
| P
| P
| P
| P
| P
| P
| P
| P
| P
| P
| P
| P
| P
| P
| P
| P
| H
| P
| M
| P
| P
|
| Br–
| P
| P
| P
| P
| P
| P
| P
| P
| P
| P
| P
| P
| P
| P
| P
| P
| P
| H
| M
| M
| P
| P
|
| I–
| P
| P
| P
| P
| P
| P
| P
| P
| P
| P
| ?
| P
| ?
| P
| P
| P
| P
| H
| H
| H
| M
| P
|
| S2-
| P
| P
| P
| P
| P
| –
| –
| –
| H
| –
| –
| H
| –
| H
| H
| H
| H
| H
| H
| H
| H
| H
|
| HS-
| P
| P
| P
| P
| P
| P
| P
| P
| P
| ?
| ?
| ?
| ?
| ?
| H
| ?
| ?
| ?
| ?
| ?
| ?
| ?
|
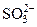
| P
| P
| P
| P
| P
| H
| H
| M
| H
| ?
| –
| H
| ?
| H
| H
| ?
| M
| H
| H
| H
| ?
| ?
|

| P
| ?
| P
| P
| P
| P
| P
| P
| P
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
|

| P
| P
| P
| P
| P
| H
| M
| P
| H
| P
| P
| P
| P
| P
| P
| P
| P
| M
| –
| H
| P
| P
|

| P
| P
| P
| P
| P
| ?
| ?
| ?
| –
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| H
| ?
| ?
|

| P
| P
| P
| P
| P
| P
| P
| P
| P
| P
| P
| P
| P
| P
| P
| P
| P
| P
| P
| P
| –
| P
|

| P
| P
| P
| P
| P
| P
| P
| P
| P
| ?
| ?
| ?
| ?
| P
| M
| ?
| ?
| M
| ?
| ?
| ?
| ?
|
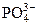
| P
| H
| P
| P
| –
| H
| H
| H
| H
| H
| H
| H
| H
| H
| H
| H
| H
| H
| H
| H
| H
| H
|
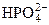
| P
| ?
| P
| P
| P
| H
| H
| M
| H
| ?
| ?
| H
| ?
| ?
| ?
| H
| ?
| ?
| ?
| M
| H
| ?
|

| P
| P
| P
| P
| P
| P
| P
| P
| P
| ?
| ?
| P
| ?
| ?
| ?
| P
| P
| P
| ?
| –
| ?
| ?
|

| P
| P
| P
| P
| P
| H
| H
| H
| H
| ?
| ?
| H
| ?
| H
| H
| H
| H
| H
| ?
| H
| ?
| H
|

| P
| P
| P
| P
| P
| P
| P
| P
| P
| ?
| ?
| P
| ?
| ?
| ?
| ?
| ?
| ?
| ?
| P
| ?
| ?
|

| P
| P
| P
| P
| P
| P
| P
| P
| P
| –
| P
| P
| –
| P
| P
| P
| P
| P
| P
| P
| –
| P
|

| H
| H
| P
| P
| ?
| H
| H
| H
| H
| ?
| ?
| H
| ?
| ?
| ?
| H
| H
| ?
| ?
| H
| ?
| ?
|
| Р
| – растворяется (> 1 г на 100 г H2O)
|
| М
| – мало растворяется (от 0, 1 до 1 г на 100 г H2O)
|
| Н
| – не растворяется
|
| –
| – в водной среде разлагается
|
| ?
| – нет достоверных сведений о существовании соединений
|
Таблица 8
Основные молекулярные массы некоторых оксидов, кислот, солей и оснований
|
| Н+
| 
| K+
| Na+
| Ag+
| Ва2+
| Са2+
| Mg2+
| Zn2+
| Сu2+
| Pb2+
| Hg2+
| Fe2+
| Fe3+
| Al3+
|
| O2–
| 18
| —
| 94
| 62
| 232
| 153
| 56
| 40
| 81
| 80
| 223
| 217
| 72
| 160
| 102
|
| OH–
| 18
| 35
| 56
| 40
| 125
| 171
| 74
| 58
| 99
| 98
| 241
| 235
| 90
| 107
| 78
|
| Cl–
| 36, 5
| 53, 5
| 74, 5
| 58, 5
| 143, 5
| 208
| 111
| 95
| 136
| 135
| 278
| 272
| 127
| 162, 5
| 133, 5
|
| Br–
| 81
| 98
| 119
| 103
| 188
| 297
| 200
| 184
| 225
| 224
| 367
| 361
| 216
| 296
| 267
|
| I–
| 128
| 145
| 166
| 150
| 235
| 391
| 294
| 278
| 319
| 318
| 461
| 455
| 310
| 437
| 408
|
| S2–
| 34
| 68
| 110
| 78
| 248
| 169
| 72
| 56
| 97
| 96
| 239
| 233
| 88
| 208
| l50
|

| 63
| 80
| 101
| 85
| 170
| 261
| 164
| 148
| 189
| 188
| 331
| 325
| 180
| 242
| 213
|
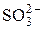
| 82
| 116
| 158
| 126
| 296
| 217
| 120
| 104
| 145
| 144
| 287
| 281
| 136
| 352
| 294
|
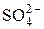
| 98
| 132
| 174
| 142
| 312
| 233
| 136
| 120
| 161
| 160
| 303
| 297
| 152
| 400
| 342
|
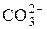
| 62
| 96
| 138
| 106
| 276
| 197
| 100
| 84
| 125
| 124
| 267
| 261
| 116
| 292
| 234
|

| 78
| 112
| 154
| 122
| 292
| 213
| 116
| 100
| 141
| 140
| 283
| 277
| 132
| 340
| 282
|
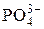
| 98
| 149
| 212
| 164
| 419
| 601
| 310
| 262
| 385
| 382
| 811
| 793
| 358
| 151
| 122
|
| СН3СОО–
| 60
| 77
| 98
| 82
| 167
| 255
| 158
| 142
| 183
| 182
| 325
| 319
| 174
| 233
| 204
|
Таблица 11
Особенности взаимодействия кислот с металлами
| Кислота
| Концентрация
| Металлы (в порядке уменьшения активности)
|
| K, Ba, Ca, Na, Mg
| Al, Fe, Cr
| Zn, Sn
| Сu
| Hg, Ag
|
| Соляная
| Разбавленная
| Соль + Н2
| Соль + Н2
| Соль + Н2
| –
| –
|
| Концентриро-ванная
| Соль + Н2
| Соль + Н2
| Соль + Н2,
| –
| –
|
| Серная
| Разбавленная
| Соль + Н2
| Соль + Н2
| Соль + Н2
| Соль+ SO2+ Н2О
| Соль + SO2 + Н2О
|
| Концентриро-ванная
| Соль + Н2S + H2O
| Металл пассивирует
| Соль + SO2+Н2О
| Соль + SO2+Н2О
| Соль + SO2+Н2О
|
| Азотная
| Разбавленная
| Соль + HN3 + Н2О
| Cоль + NO + Н2О
| Соль + NO + Н2О
| Соль + NO+Н2О
| Coль + NО + H2О
|
| Концентриро-ванная
| Соль + N2О + Н2О
| Металл пассивирует
| Соль + NО2 + Н2О
| Соль+ NO2+H2О
| Coль + NO2 + H2О
|
| Орто-фосфорная
| Разбавленная
| Соль + Н2,
| Соль + Н2О
| Соль + Н2
| –
| –
|
Тривиальные названия химических веществ
Белила
| Свинцовые белила
| Pb2(CO3)(OH)2
|
| Титановые белила
| TiO2
|
| Цинковые белила
| ZnO
|
| Циркониевые белила
| ZrO2
|
Вода
| Аммиачная вода
| водный раствор NH3
|
| Баритовая вода
| насыщенный водный раствор Ba(OH)2
|
| Бромная вода
| водный раствор брома (содержит Br2, HBrO и HBr)
|
| Жавелевая вода
| водный раствор KOH, насыщенный хлором (содержит KClO и KCl)
|
| Известковая вода
| насыщенный водный раствор Ca(OH)2
|
| Лабарракова вода
| водный раствор NaOH, насыщенный хлором (содержит NaClO и NaCl)
|
| Сероводородная вода
| насыщенный водный раствор H2S
|
| Хлорная вода
| водный раствор хлора (содержит Cl2, HClO и HCl)
|
Жидкость
| Бордосская жидкость
| водная суспензия Cu2(SO4)(OH)2 и CaSO4
|
| Бургундская жидкость
| водная суспензия Cu2(CO3)(OH)2
|
| Жидкость Вакенродера
| водный раствор H2SnO6 (n = 3-6)
|
Зелень
| Зелень Веронезе
| Cu3(AsO4)2 . 4H2O
|
| Зелень Гинье
| Cr2O3 . nH2O
|
| Зелень Ринмана
| Co2IIIZnO4
|
| Зелень Шееле
| CuHAsO3
|
Золото
Известь
| Белильная известь
| смесь Ca(ClO)2, CaCl2 и Ca(OH)2
|
| Гашеная известь
| Ca(OH)2
|
| Жженая известь
| CaO
|
| Натронная известь
| смесь CaO, Ca(OH)2 и NaOH
|
| Негашеная известь
| CaO
|
| Хлорная известь
| смесь Ca(ClO)2, CaCl2 и Ca(OH)2
|
Квасцы
| Алюмоаммонийные квасцы
| AlNH4(SO4)2 . 12H2O
|
| Алюмокалиевые квасцы
| KAl(SO4)2 . 12H2O
|
| Железоаммонийные квасцы
| FeNH4(SO4)2 . 12H2O
|
| Железокалиевые квасцы
| KFe(SO4)2 . 12H2O
|
| Хромокалиевые квасцы
| KCr(SO4)2 . 12H2O
|
Кислота
| Плавиковая кислота
| концентрированный водный раствор HF
|
| Синильная кислота
| водный раствор HCN
|
| Соляная кислота
| концентрированный водный раствор HCl
|
| Кислота Каро
| H2SO3(O2)
|
Купорос
| Ванадиевый купорос
| VSO4 . 7H2O
|
| Железный купорос
| FeSO4 . 7H2O
|
| Кобальтовый купорос
| CoSO4 . 7H2O
|
| Медный купорос
| CuSO4 . 5H2O
|
| Никелевый купорос
| NiSO4 . 7H2O
|
| Свинцовый купорос
| PbSO4
|
| Хромовый купорос
| CrSO4 . 7H2O
|
Магнезия
| Белая магнезия
| Смесь MgO и MgCO3
|
| Черная магнезия
| MnO2
|
| Жженая магнезия
| MgO
|
Масло
| Купоросное масло
| H2SO4 (техническая концентрированная)
|
| Оловянное масло
| SnCl4(ж)
|
Молоко
| Известковое молоко
| водная суспензия Ca(OH)2
|
Нашатырь
| Нашатырь
| NH4ОН
|
| Платиновый нашатырь
| (NH4)2[PtCl6]
|
Реактив
| Реактив Несслера
| щелочной водный раствор K2[HgI4]
|
| Реактив Швейцера
| водный раствор [Cu(NH3)4](OH)2
|
Ртуть
| Гремучая ртуть
| 2Hg(CNO)2 . H2O
|
Сахар
| Свинцовый сахар
| Pb(CH3COO)2 . 3H2O
|
Селитра
| Аммонийная селитра
| NH4NO3
|
| Баритовая селитра
| Ba(NO3)2
|
| Известковая селитра
| Са(NO3)2
|
| Индийская селитра
| КNO3
|
| Калийная селитра
| КNO3
|
| Кальциевая селитра
| Са(NO3)2
|
| Магнезиевая селитра
| Mg(NO3)2
|
| Натронная селитра
| NaNO3
|
| Норвежская селитра
| Са(NO3)2
|
| Чилийская селитра
| NaNO3
|
Серебро
Синь
| Вольфрамовая синь
| смесь W10O29(OH) и W3O8(OH)
|
| Тенарова синь
| (CoIIAl2)O4
|
| Турнбулева синь
| KFe[Fe(CN)6]
|
| Молибденовая синь
| смесь Mo4O10(OH)2 и Mo2O4(OH)2
|
Сода
| Сода каустическая
| NaOH
|
| Сода кристаллическая
| Na2CO3 . 10H2O
|
| Сода кальцинированная
| Na2CO3
|
| Сода питьевая
| NaHCO3
|
Соль
| Английская соль
| MgSO4 . 7H2O
|
| Бертолетова соль
| KClO3
|
| Глауберова соль
| Na2SO4 . 10H2O
|
| Желтая кровяная соль
| K4[Fe(CN)6] . 3H2O
|
| Золотая соль
| Na[AuCl4] . 2H2O
|
| Каменная соль
| NaCl
|
| Красная кровяная соль
| K3[Fe(CN)6]
|
| Оловянная соль
| [Sn(H2O)Cl2] . H2O
|
| Паяльная соль
| (NH4)2[ZnCl4]
|
| Поваренная соль
| NaCl
|
| Препаратная соль
| Na2[Sn(OH)6]
|
| Розовая соль
| (NH4)2[SnCl6]
|
| Соли Туттона
| M2IMII(SO4)2 . 6H2O (MI = Cs, K, NH4, Rb, Tl; MII = Cd, Co, Cr, Cu, Fe, Mg, Mn, Ni, V, Zn)
|
| Соль Бульриха
| NaHCO3
|
| Соль Гмелина
| K3[Fe(CN)6]
|
| Соль Вокелена
| [Pd(NH3)4][PdCl4]
|
| Соль Джонсона
| K[I(I)2] . H2O
|
| Соль Жерара
| транс-[Pt(NH3)2Cl4]
|
| Соль Клеве
| цис-[Pt(NH3)2Cl4]
|
| Соль Магнуса
| [Pt(NH3)4][PtIICl4]
|
| Соль Мора
| Fe(NH4)2(SO4)2 . 6H2O
|
| Соль Пейроне
| цис-[Pt(NH3)2Cl2]
|
| Соль Фишера
| K3[Co(NO2)6]
|
| Соль Цейзе
| K[Pt(C2H4)Cl3] . H2O
|
| Соль Шлиппе
| Na3[SbS4] . 9H2O
|
| Соль Эрдмана
| транс-NH4[Co(NH3)2(NO2)4]
|
Шпат
| Двупреломляющий шпат
| CaCO3
|
| Железный шпат
| FeCO3
|
| Известковый шпат
| CaCO3
|
| Исландский шпат
| CaCO3
|
| Малиновый шпат
| MnCO3
|
| Марганцевый шпат
| MnCO3
|
| Персидский шпат
| BaSO4
|
| Плавиковый шпат
| CaF2
|
| Известковый полевой шпат
| CaAl2Si2O8
|
| Калиевый полевой шпат
| K(AlSi3O8)
|
| Натриевый полевой шпат
| Na(AlSi3O8)
|
| Тяжелый шпат
| BaSO4
|
| Цинковый шпат
| ZnCO3
|
СПИСОК ИСПОЛЬЗУЕМОЙ ЛИТЕРАТУРЫ
1. Артеменко А.И. Справочное руководство по аналитической химии. - М.: Высшая школа, 2002.
2. Большова Т.А. Основы аналитической химии. - М.: Высшая школа, 2002.
3. Барсукова З.А. Аналитическая химия. – М.: Высшая школа, 1990.
4. Васильев В.П. и др. Практикум по аналитической химии.: Учебное пособие для вузов /В.П. Васильев, Р.П. Морозова, Л.А. Кочергина; Под ред. В.П. Васильева. – М.: Химия, 2000.
5. Золотов Ю.А. Основы аналитической химии: задачи и вопросы.- М.: Высшая школа, 2002.
6. Золотов Ю.А. Основы аналитической химии. - М.: Высшая шк. 1996.
7. Коренман И.М. Методы количественного анализа. М.: Высшая школа, 1989.
8. Коренман Я. Практикум по аналитической химии (хроматографические метода анализа). - М.: Высшая школа, 2001.
9. Лурье Ю.Ю. Справочник по аналитической химии - М.: Высшая школа, 1989.
10. Основы аналитической химии. Практическое руководство: Учебное пособие для вузов/В.И. Фадеева, Т.Н. Шелеховцева, В.М. Иванов и др.; Под ред. Ю.А. Золотова. – М.: Высшая школа, 2001.
11. Харитонов Ю.А. Аналитическая химия. В 2 кн. Учебник для вузов. - М.: Высшая школа, 2001.
12. Практикум по физико-химическим методам анализа (под ред. О.М. Петрухина). - М.: Химия, 1987.
13. Практикум по аналитической химии (под ред. В.Д.Понамарева, Л.И. Ивановой). - М.: Высшая школа. 1983.
14. Цитович И.К. Курс аналитической химии. Учебник для вузов. Спец. литература. 7-е изд., стер. – СПб.: Издательство «Лань», 2004.
Основы современной номенклатуры комплексных соединений были заложены Альфредом Вернером. До его работ в этой области химии не существовало никакой системы. Комплексные соединения называли, руководствуясь их внешним видом, например, пурпуреосоль (красная соль) [Co(NH3)5Cl]Cl2, лутеосоль (желтая соль) состава [Co(NH3)6]Cl3, либо происхождением, например, красная кровяная соль K3[Fe(CN)6] и т.п.
Немало комплексных соединений получили имена химиков, синтезировавших их: соль Фишера K3[Co(NO2)6], соль Рейнеке NH4[Cr(NH3)2(NCS)4] и др.
Современная номенклатура комплексных соединений основана на рекомендациях ИЮПАК (Международный союз общей и прикладной химии) и адаптирована к традициям русского химического языка.
Названия лигандов
Названия анионных лигандов получают концевую гласную - о, которой сопровождается название соответствующего аниона (или корня названия аниона):
| CH3COO- - ацетато
| NO- - нитрозо
|
| CN- - циано
| NO2- - нитро
|
| CO32- - карбонато
| O22- - пероксо
|
| C2O42- - оксалато
| OH- - гидроксо
|
| Cl- - хлоро
| SO32- - сульфито
|
| H- - гидридо
| SO3S2- - тиосульфато
|
Иногда анионные лиганды имеют специальные названия, например O2- - оксо, S2- - тио, HS- - меркапто. Анионы углеводородов в качестве лигандов называют так: CH3- - метил, C5H5- - циклопентадиенил.
Для нейтральных лигандов используют номенклатурные названия веществ без изменений (N2 - диазот, N2H4 - гидразин, C2H4 -этилен и т.д.), кроме веществ, которые, выступая в роли лигандов, получают следующие специальные названия:
| H2O - аква
| NH3 - аммин
|
| NO - нитрозил
| CO - карбонил
|
| SO2 - диоксосера
| PF3 - трифторофосфор
|
Громоздкие по написанию формулы органических лигандов заменяют полностью или частично буквенными обозначениями, например:
| NH2CH2CH2NH2(этилендиамин) – en
| P(C2H5)3(триэтилфосфин) – PEt3
|
| (NH2)2CO (карбамид) – ur
| C5H5N (пиридин) – py
|
Для катионных лигандов применяют следующие названия:

