ВЛИЯНИЕ ТЕМПЕРАТУРЫ НА СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ
Опытным путем Вант-Гофф установил, что скорость большинства химических реакций увеличивается в 2-4 раза при повышении температуры на 10 градусов. Это правило носит его имя и выражается уравнением
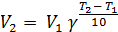
где V1 и V2 – скорости реакции при температурах Т1 и Т2 соответственно; g - температурный коэффициент, равный 2-4. Эмпирическое правило Вант-Гоффа не объясняет механизм влияния температуры на скорость реакции и не охватывает всей совокупности наблюдаемых закономерностей.
Ускорение химической реакции с ростом температуры, казалось бы, можно объяснить увеличением числа столкновений реагирующих частиц. Однако далеко не каждое столкновение приводит к акту химической реакции. Для того, чтобы столкновение стало эффективным, реагирующие частицы должны не только обладать достаточной энергией, но и иметь пространственное соответствие. Количественной характеристикой энергетического соответствия является величина, называемая энергия активации ( Еа ).
Под энергией активации понимают некоторое избыточное количество энергии по сравнению со средней ее величиной, которым должна обладать молекула в момент столкновения, чтобы произошла реакция. Энергия активации измеряется в кДж/моль и для большинства реакций изменяется в пределах от 50 до 250 кДж/моль. Считается, что реакции, у которых Еа> 150 кДж/моль, при стандартных условиях практически не протекают. Энергия активации расходуется на преодоление отталкивания между частицами и на ослабление химических связей у исходных веществ. Таким образом, энергия активации косвенно характеризует природу реагирующих веществ, так как отражает прочность химической связи в них.
Влияние температуры и природы реагирующих веществ на скорость химической реакции описывается уравнением Аррениуса, которое связывает константу химической реакции с энергией активации и температурой:

где Ао – предэкспоненциальный множитель; Еа – энергия активации; R – универсальная газовая постоянная (8, 314 Дж/моль∙ К); Т – абсолютная температура.
Множитель Ао является постоянной или очень мало зависящей от температуры величиной (для данной реакции). Ао отражает общее число столкновений частиц в единицу времени, а также вероятность распада так называемого «активированного комплекса» на исходные вещества. Множитель 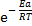
 характеризует долю частиц, обладающих энергией, достаточной для вступления в реакцию (долю активных молекул).
характеризует долю частиц, обладающих энергией, достаточной для вступления в реакцию (долю активных молекул).
Из уравнения Аррениуса следует, что при постоянной температуре константа скорости определяется величиной энергии активации. Чем выше Еа, тем меньше в реакционной смеси активных молекул, тем меньше константа скорости и сама скорость химической реакции. Согласно современным воззрениям, элементарная стадия химической реакции включает образование “ АКТИВИРОВАННОГО КОМПЛЕКСА ” (переходного состояния ПС ). Это промежуточное состояние, когда химические связи в исходных веществах частично уже разорваны, а новые связи (т.е. продукты реакции) еще не образовались. Время жизни такого состояния измеряется вели-чиной порядка 10-13-10-15секунды. Исходное и конечное состояния реакционной системы отделены друг от друга энергетическим барьером, высота которого равна энергии активации данного процесса. Состояние активированного комплекса энергетически соответствует максимуму этого барьера. Чем меньше величина этого энергетического барьера, тем быстрее протекает химическая реакция. Энергетические диаграммы экзотермической и эндотермической реакций общего вида A + B = C + D представлены на рис.2.
 < 0
> < 0
>
|
 0 0
|
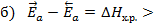 0 0
|
 < 0
> < 0
>
|
Рис.2 Энергетические диаграммы а) экзотермической и б) эндотермической реакций общего вида A + B = C + D;
 – энергия активации прямой реакции,
– энергия активации прямой реакции, 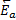 - энергия активации обратной реакции; ПС – переходное состояние
- энергия активации обратной реакции; ПС – переходное состояние
Популярное:

