Микробиологические анализаторы Sy-Lab
Автоматический анализатор для быстрого обнаружения и количественного определения микроорганизмов.
Принцип действия: измерение импеданса среды (М-параметр) и электродного импеданса (Е-параметр), которые при учете отдельно или в комбинации позволяют регистрировать рост микроорганизмов и микробные метаболиты даже в селективных питательных средах с высоким содержанием солей.
• Автоматическая регистрация роста широкого спектра микроорганизмов и обработка результатов, качественный и количественный анализ.
• Быстрое определение дрожжей и плесени методом непрямого импеданса.
• Производительность анализа - 64 образца одновременно; возможно увеличение до 768 образцов за счет 12 дополнительных модулей, управляемых с одного ПК.
• Возможность установки одновременно двух независимых температур (2 температурные зоны по 32 измерительной ячейки).
• Документация результатов исследования в соответствии с GLP.
• Возможно использование одноразовых ячеек (стерильных, заполненных питательной средой, полностью готовых к работе) или многоразовых автоклавируемых стеклянных ячеек.
• Возможности ПО: возможность одновременно проводить измерения и анализировать полученные ранее результаты; обрабатывать данные при помощи большого количества моделей и методик; задавать параметры и калибровочные зависимости для каждого образца и пр.
Определяемы микроорганизмы:
- Аэробные мезофильные микроорганизмы
- Психрофильные микроорганизмы
- Термофильные микроорганизмы
- Грамотрицательные бактерии
- Энтеробактерии
- Энтерококки
- Pseudomonas sp.
- Лактобациллы
- Колиформы
- Е.coli
- Аэробные спорообразующие бактерии
- Сальмонеллы
- Листерии
- Bacillus cereus
- Staphylococcus aureus
- Бактерии, вызывающие порчу пива
- Клостридии
- Дрожжи и плесени

Микроскопы стерео Olympus

Серия SZX2 – универсальные исследовательские микроскопы Olympus
• Оптическая система по схеме Галлилея.
• Свободные от дисторсии апохроматические объективы с большой числовой апертурой.
• Возможность установки блока флюоресценции.
• Большой выбор систем освещения, штативов и аксессуаров.
• Методы контраста: светлое поле, темное поле, поляризованный свет, «косой» свет, флюоресценция.
• Аксессуары: сиcтeмы фoтo или видeoдoкумeнтиpoвaнния, нacaдкa для pиcoвaния, пpeпapaтoвoдитeль, унивepcaльный штатив для бoльшиx oбъeктoв, cиcтeмa для иccлeдoвaния в пoляpизoвaннoм cвeтe, флуоресцентный осветитель с фильтровым слайдером, штативы для проходящего/отраженного 30Вт-галогенового/LED осветителей
SteReo Discovery V/12  Опт. сист. по схеме Аббе, зум 1: 12, 5, общ. увел. 312х Опт. сист. по схеме Аббе, зум 1: 12, 5, общ. увел. 312х
| | |
 Микроскоп исследовательский • Оптическая система по схеме Аббе; • Методы исследования: СП, ТП, поляризация; • Проходящий, падающий свет, косое освещение; • Осветители холодного света KL 1500/2500 LCD, волоконные гибкие, волоконные типа " гусиная шея" (1-2-3плечие), круговые (светлого и темного поля); • Плавная смена увеличения 1: 12, 5; • Объективы увеличение/cвободное рабочее расстояние: Achromat S 0, 33/253; Achromat S 0, 53/151; PlanApo S 0, 633/81; Plan S 13/81; PlanApo S 1, 53/30; • Максимальное увеличение 312х; • Поле на предмете (для окуляров103/23): 46–1, 5 мм; • Окуляры: 10х/23, 16х/16, 25х/10; • Фотовидеовыход; • Управление микроскопом моторизованное (увеличение, рабочее расстояние, фокус): со встроенных дисплеев, с помощью программного обеспечения компьютера, с помощью контрольного устройства SyCoP (демонстрация на экране текущих данных: дата / время, увеличение микроскопа, поле на предмете, разрешение, глубина, увеличение объектива, увеличение окуляра, z-позиция, контроль света (освещенность в плоскости предмета), функции управления, память, пользователь, установка).
Конец формы
Микроскоп исследовательский • Оптическая система по схеме Аббе; • Методы исследования: СП, ТП, поляризация; • Проходящий, падающий свет, косое освещение; • Осветители холодного света KL 1500/2500 LCD, волоконные гибкие, волоконные типа " гусиная шея" (1-2-3плечие), круговые (светлого и темного поля); • Плавная смена увеличения 1: 12, 5; • Объективы увеличение/cвободное рабочее расстояние: Achromat S 0, 33/253; Achromat S 0, 53/151; PlanApo S 0, 633/81; Plan S 13/81; PlanApo S 1, 53/30; • Максимальное увеличение 312х; • Поле на предмете (для окуляров103/23): 46–1, 5 мм; • Окуляры: 10х/23, 16х/16, 25х/10; • Фотовидеовыход; • Управление микроскопом моторизованное (увеличение, рабочее расстояние, фокус): со встроенных дисплеев, с помощью программного обеспечения компьютера, с помощью контрольного устройства SyCoP (демонстрация на экране текущих данных: дата / время, увеличение микроскопа, поле на предмете, разрешение, глубина, увеличение объектива, увеличение окуляра, z-позиция, контроль света (освещенность в плоскости предмета), функции управления, память, пользователь, установка).
Конец формы
|
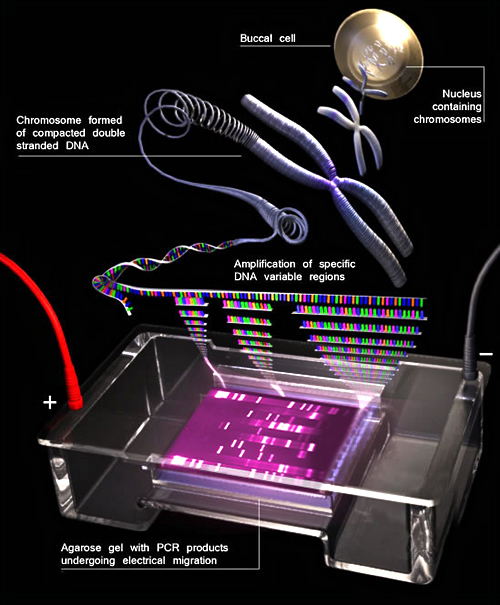
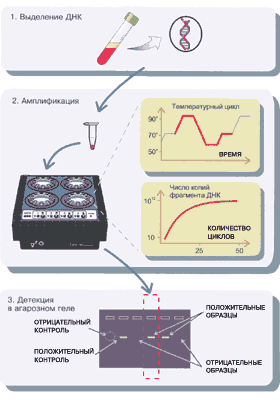
ПЦР

Участки ДНК, отмеченные связавшившимися с ними праймерами, копируются миллионы раз. В начале у нас был раствор с небольшим количеством длинных, полноценных клеточных молекул ДНК. В конце ПЦР мы имеем раствор с огромным количеством размноженных нужных участков, кусочков ДНК, «генов» (это не совсем гены, но близко к тому).
4. Раствор наносят на гель, к гелю прикладывают напряжение. За часок-другой кусочки молекул ДНК (они имеют заряд) перемещаются в геле на расстояние, пропорциональное их массе. Гель кладут под ультрафиолет и масса одинаковых кусочков ДНК, «генов», начинает светиться в том месте геля, где собралась. Если собралась — значит в ДНК был участок, соответствующий праймеру, нужный «ген». Если ничего не светится, мутная полоска без четкого участка — значит, «гена», нужного участка в ДНК нет.

Рис.2. Экспоненциальная амплификация ДНК в ПЦР
(Andy Vierstraete, 2001)

Основная проблема при проведении ПЦР-анализа — это “контаминация” (занесение постороннего нуклеинового материала в анализируемые пробы). ПЦР — необычайно чувствительный метод, поэтому даже одна посторонняя молекула, которая имеет участок, комплиментарный праймерам набора для амплификации, может привести к ложноположительному результату.
ПЦР в реальном времени
На сегодня существует метод, лишенный вышеперечисленных недостатков - это метод ПЦР в реальном времени ( Real-Time PCR ) [4]. Сущность метода заключается в исследовании накопления продуктов амплификации с помощью специального прибора без последующего электрофореза. Так как кинетика накопления продуктов амплификации связана с исходным количеством матрицы, это дает возможность точно оценить её количество [3].
Отличительными чертами данного метода, в отличие от классической ПЦР, является возможность количественного определения ДНК/РНК инфекционных агентов в исследуемом материале, отсутствие стадии электрофореза, менее строгие требования к организации ПЦР-лаборатории и автоматическая регистрация и интерпретация полученных результатов.
Отсутствие стадии электрофореза позволяет минимизировать риск контаминации продуктами ПЦР и таким образом резко уменьшить число ложноположительных результатов. Поскольку регистрация результатов проводится непосредственно в процессе ПЦР, весь анализ можно проводить в одной-двух комнатах лаборатории и нет необходимости в отдельном помещении для детекции продуктов реакции.
Данная методика в течение последних пяти лет успешно применяется в крупнейших диагностических и научно-исследовательских центрах развитых стран мира и в ближайшее время станет так же широко распространена, как и ПЦР в ее сегодняшнем формате, благодаря экономии производственных площадей, уменьшению количества персонала и востребованности количественного определения ДНК/РНК.
Использование математических методов анализа позволяет проводить автоматическую интерпретацию полученных результатов и снимает проблему субъективной оценки электрофореграмм.
Популярное:

