
|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |

|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |
Работа газа при изменении его объема
Для рассмотрения конкретных процессов найдем в общем виде внешнюю работу, совершаемую газом при изменении его объема. Рассмотрим, например, газ, находящийся под поршнем в цилиндрическом сосуде (рис. 56). Если газ, расширяясь, передвигает поршень на бесконечно малое расстояние d dА = рdV. Полную работу А, совершаемую газом при изменении его объема от V1 . (2.5) Результат интегрирования определяется характером зависимости между давлением и объемом газа. Найденное для работы выражение (2.5) справедливо при любых изменениях объема твердых, жидких и газообразных тел. Рис. 57 Произведенную при том или ином процессе работу можно изобразить графически с помощью кривой в координатах р, V. Например, изменение давления газа при его расширении изобразится кривой на рис. 57. При увеличении объема на dV совершаемая газом работа равна pdV, т.е. определяется площадью полоски с основанием dV на рисунке. Поэтому полная работа, совершаемая газом при расширении от объема V1 до объема V2 определяется площадью, ограниченной осью абсцисс, кривой p=f(V) и прямыми V1 и V2. Графически можно изображать только равновесные процессы, процессы состоящие из последовательности равновесных состояний. Они протекают так, что изменение термодинамических параметров за короткий промежуток времени бесконечно мало. Все реальные процессы неравновесны (они протекают с конечной скоростью), но в ряде случаев неравновесностью реальных процессов можно пренебречь (чем медленнее процесс протекает, тем он ближе к равновесному). В дальнейшем рассматриваемые процессы будем считать равновесными. Теплоемкость Удельная теплоемкость вещества - величина, равная количеству теплоты, необходимому для нагревания 1кг вещества на 1 К: . Единица удельной теплоемкости - джоуль на килограмм-кельвин. Молярная теплоемкость - величина, равная количеству теплоты, необходимому для нагревания одного моля вещества на 1 К:
Единица молярной теплоемкости - джоуль на моль – кельвин
Удельная теплоемкость с связана с молярной Сm соотношением Cm=cM, (2.7) Различают теплоемкости при постоянном объеме и постоянном давлении, если в процессе нагревания вещества его объем или давление поддерживается постоянным. Запишем выражение первого начала термодинамики (2.3) для 1 моля газа с учетом формул (2.4) и (2.6):
Если газ нагревается при постоянном объеме, то работа внешних сил равна нулю (2.4) и сообщаемая газу извне теплота идет только на увеличение его внутренней энергии:
т.е. молярная теплоемкость газа при постоянном объеме Сv равна изменению внутренней энергии 1 моля газа при повышении его температуры на 1 К. Согласно формуле (2.1),
тогда Если газ нагревается при постоянном давлении, то выражение (2.8) можно записать в виде . Учитывая, что продифференцировав уравнение Клапейрона–Менделеева pVm=RT по Т (p=const), получим
Использовав (2.10), выражение (2.11) можно записать в виде
. (2.12) Из формул (2.10) и (2.11) следует, что молярные теплоемкости определяются лишь числом степеней свободы и не зависят от температуры. Это утверждение молекулярно-кинетической теории справедливо в довольно широком интервале температур лишь для одноатомных газов. Уже у двухатомных газов число степеней свободы, проявляющихся в теплоемкости, зависит от температуры. Молекула двухатомного газа обладает тремя поступательными, двумя вращательными а с повышение температуры добавляются одна колебательная степень свободы. По закону равномерного распределения энергии по степеням свободы, для комнатных температур. Из качественной экспериментальной зависимости молярной теплоемкости Сv водорода (рис. 58) следует, что Сv зависит от температуры; при
Расхождение теории и эксперимента нетрудно объяснить. Дело в том, что при вычислении теплоемкости надо учитывать квантование энергии вращения и колебаний молекул (возможны не любые вращательные и колебательные энергии, а лишь определенный дискретный ряд значений энергий). Если энергия теплового движения недостаточна, например, для возбуждения колебаний, то эти колебания не вносят своего вклада в теплоемкость (соответствующая степень свободы " замораживается" – к ней неприменим закон равнораспределения энергии). Этим объясняется, что теплоемкость моля двухатомного газа - водорода - при комнатной температуре равна
Среди равновесных процессов, происходящих с термодинамическими системами, выделяются изопроцессы, при которых один из основных параметров состояния сохраняется постоянным. Изохорный процесс (V=const). Диаграмма этого процесса ( изохора ) в координатах р, V изображается прямой, параллельной оси ординат (рис. 59), где процесс 1-2 есть изохорное нагревание, а 1-3 - изохорное охлаждение. При изохорном процессе газ не совершает работы над внешними телами, т.е.
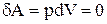 . .
Рис. 59 Для изохорного процесса следует, что вся теплота (рис.59), сообщаемая dQ=dU Согласно формуле (2.9), DUm=CvdT. |
Последнее изменение этой страницы: 2017-03-14; Просмотров: 836; Нарушение авторского права страницы