Классификация катионов по аммиачно-фосфатной схеме
| № группы
| Катионы
| Групповой реагент
| Образующиеся соединения
| Примечания
| | I
|  Na+, K+ Na+, K+
| Нет
|
| Фосфаты р-мы в воде
| | II
| I подгруппа: Li+, Mg2+, Ca2+, Ba2+, Sr2+, Mn2+, Fe2+ II подгруппа: Al3+, Cr3+, Fe3+, Bi3+
| (NH4)2HPO4 + NH4OH
| Li3PO4, MgNH4PO4, CaHPO4, MnNH4PO4, FeHPO4, SrHPO4, BаHPO4, AlPO4, CrPO4, FePO4, BiPO4
| Фосфаты нерастворимы в воде и NH4OH. Фосфаты I подгруппы р-мы в СН3СООН. Фосфаты II подгруппы нерастворимы в СН3СООН, р-мы в HCl
| | III
| Co2+, Ni2+, Cu2+, Zn2+, Cd2+, Hg2+
| NH4OH
| 
| Фосфаты р-мы в NH4OH
| | IV
| As(III, V), Sb(III, V), Sn(II, IV)
| HNO3
| HSbO3, H2SnO3, H3AsO4
| Метаоловянная и метасурьмяная кислоты нерастворимы и адсорбируют H3AsO4
| | V
| Ag+, 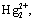 Pb2+ Pb2+
| HCl
| AgCl, Hg2Cl2, PbCl2
| Хлориды нерастворимы в воде и разбавленных кислотах
|
| № группы
| Катионы
| Групповой реагент
| Образующиеся соединения
| Примечания
| | I
|  Na+, K+ Na+, K+
| Нет
| -
| Фосфаты растворимы в воде
| | II
| I подгруппа: Li+, Mg2+, Ca2+, Ba2+, Sr2+, Mn2+, Fe2+ II подгруппа: Al3+, Cr3+, Fe3+, Bi3+
| (NH4)2HPO4 + NH4OH
| Li3PO4, MgNH4PO4, CaHPO4, MnNH4PO4, FeHPO4, SrHPO4, BаHPO4, AlPO4, CrPO4, FePO4, BiPO4
| Фосфаты нерастворимы в воде и NH4OH. Фосфаты I подгруппы р-мы в СН3СООН. Фосфаты II подгруппы нерастворимы в СН3СООН, р-мы в HCl
| | III
| Co2+, Ni2+, Cu2+, Zn2+, Cd2+, Hg2+
| NH4OH
| 
| Фосфаты р-мы в NH4OH
| | IV
| As(III, V), Sb(III, V), Sn(II, IV)
| HNO3
| HSbO3, H2SnO3, H3AsO4
| Метаоловянная и метасурьмяная кислоты нерастворимы и адсорбируют H3AsO4
| | V
| Ag+, 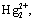 Pb2+ Pb2+
| HCl
| AgCl, Hg2Cl2, PbCl2
| Хлориды нерастворимы в воде и разбавленных кислотах
|
Ион Mg2+ является переходным между катионами первой и второй аналитических групп. Гидроксокарбонат магния (MgOH)2CO3, подобно карбонатам 2-ой группы, мало растворим в воде. Однако он растворяется в избытке солей аммония и при действии карбонатом аммония в присутствии хлорида аммония не выпадает в осадок. Поэтому ион Mg2+ остается в растворе с катионами 1-ой группы.
ХАРАКТЕРНЫЕ РЕАКЦИИ НА
КАТИОНЫ И АНИОНЫ
КАТИОНЫ
| Катионы
| Реактив, уравнение реакции, признаки присутствия данного катиона, открываемый минимум (чувствительность реакции)
| | Калий
К+
| В нейтральной или уксуснокислой среде:
1) Кобальтинитрит натрия Na3[Co(NO2)6] образует желтый кристаллический осадок:
2K+ + Na+ + [Co(NO2)6]3- ® K2Na[Co(NO2)6]
Микрокристаллоскопическая реакция с Na2Pb[Cu(NO2)6] – образуются черные кристаллы кубической формы (открываемый минимум - 0, 15 µг К+; предельное разбавление 1: 7, 5.104).
2) Окрашивает пламя в фиолетовый цвет.
| | Натрий
Na+
| 1) Микрокристаллоскопическая реакция с цинкуранилацетатом Zn(UO2)3(C2H3O2)8 – образуется зелетовато-желтый кристаллический осадок, имеющий форму тетраэдров или октаэдров; открываемый минимум - 12, 5 µг Na+; предельное разбавление 1: 5.103
Na++Zn(UO2)3(C2H3O2)8 + CH3COO- + 9H2O ® NaZn(UO2)3(C2H3O2)9 . 9H2O
2) Окрашивание пламени – желтое
| | Аммоний
NH4+
| 1) При действии щелочей при нагревании выделяется аммиак, который обнаруживают по характерному запаху, по посинению влажной лакмусовой бумаги или по почернению фильтровальной бумаги, смоченной раствором соли ртути (I). Чувствительность реакции - 0, 05 µг; предельное разбавление 1: 106.
NH4Cl + NaOH ® NaCl + NH3 + H2O
(NH4+ + OH- ® NH3 + H2O)
2) Реактив Несслера K2[HgI4] в щелочной среде образует оранжево-коричневый осадок; чувствительность реакции - 0, 25 µг иона аммония; предельное разбавление 1: 2.107
| | Магний
Mg2+
| 1) Магнезон–I (или Магнезон–II) в отсутствие NH4+ дают синее окрашивание; открываемый минимум - 0, 9 µг (или 0, 2 µг соответственно).
2) Оксихинолин (при рН = 10 – 12) дает зеленовато-желтый кристаллический осадок (чувствительность реакции - 0, 1 µг иона магния)
3) Карбонаты щелочных металлов дают белый осадок карбоната магния, легко растворимый в кислотах: Mg2+ + CO32- ® MgCO3
| | Кальций
Са2+
| 1) Окрашивает пламя в кирпично-красный цвет.
2) Щавелевокислый аммоний (оксалат аммония) в уксуснокислом растворе образует белый кристаллический осадок (в отсутствие Ва2+ и Sr2+); чувствительность – 1 µг Са2+
CaCl2 + (NH4)2C2O4 ® 2NH4Cl + CaC2O4
(Сa2+ + C2O42- ® CaC2O4)
3) Микрокристаллоскопическая реакция с H2SO4: характерная форма кристаллов в виде длинных игл или пластинок (чувствительность - 0, 1 µг Са 2+)
| | Барий
Ва2+
| 1) В уксуснокислой среде хромат калия К2СrО4 или К2Cr2O7 + CH3COONa дают ярко-желтый осадок хромата бария.
2) Серная кислота и ее соли образуют белый кристаллический осадок сульфата бария, нерастворимого в кислотах и щелочах:
Ba2+ + SO4 2- ® BaSO4
(Открываемый минимум - 0, 4 µг; предельное разбавление 1: 1, 25.105). Гипсовая вода (насыщенный раствор СаSO4) с Ва2+ на холоде вызывает медленное образование осадка (тогда как для ее взаимодействия с ионами Sr2+ требуется нагревание).
3) Окрашивает пламя в желто-зеленый цвет.
| | Алюминий
Al3+
| 1) Гидроксиды щелочных металлов образуют белый студенистый осадок Al(OH)3, растворимый в кислотах с образованием соли соответствующей кислоты; он также растворим в растворах щелочей с образованием комплексных ионов [Al(OH)4]-:
Al3+ + 3OH- ® Al(OH)3 Al(OH)3 + OH- ® [Al(OH)4]-
(Гидроксид алюминия проявляет амфотерные свойства)
В отличие от гидроксида цинка, Al(OH)3 не растворяется в NH4OH.
2) Прокаливание гидроксида алюминия с солью кобальта дает синее окрашивание (“тенарову синь” - Со(AlO2)2).
3) Оксихинолин дает желтый осадок; Ализарин красный S, Хинализарин или Алюминон - красные осадки.
| | Хром
Cr 3+
| 1) Окислители (например, перманганат калия, пероксид водорода, бромная вода) превращают зеленые или фиолетовые соединения хрома (III) в соединения хрома (VI)- хроматы СrO42- (желтого цвета) в щелочной среде или дихроматы Cr2O72- (оранжевого цвета) в кислой среде.
2) Гидроксиды щелочных металлов образуют серо-голубой осадок Сr(OH)3, проявляющий амфотерные свойства - растворяется в растворах кислот и в избытке щелочей и NH4OH.
| | Железо
Fe 3+
| 1) Гексацианоферрат (II) калия K4[Fe(CN)6] (желтая кровяная соль) образует темно-синий осадок берлинской лазури; чувствительность реакции 0, 05 µг Fe3+, предельное разбавление 1: 106:
4K4[Fe(CN)6] + 4Fe3+ ® 12К+ + 4КFeIII[FeII(CN)6] (а)
2) Гидроксиды щелочных металлов и NH4OH образуют гидроксид железа (III) красно-бурого цвета, растворимый в кислотах и нерастворимый в избытке щелочей (отличие от гидроксидов алюминия и хрома). Открываемый минимум - 10 µг железа; предельное разбавление 1: 1, 6.105.
Fe3+ + 3OH- ® Fe(OH)3
3) Роданид калия или аммония вызывает кроваво-красное окрашивание раствора
FeCl3 + 3NH4SCN « 3NH4Cl + Fe(SCN)3
Открываемый минимум - 0, 25 µг, предельное разбавление – 1: 2.105
| | Железо
Fe2+
| 1) Гексацианоферрат (III) калия K3[Fe(CN)6] (красная кровяная соль) образует темно-синий осадок турнбулевой сини; чувствительность реакции 0, 1 µг железа, предельное разбавление 1: 5.107
3K3[Fe(CN)6] + 3Fe2+ ® 3KFeII[FeIII(CN)6] + 6K+ (б)
Недавно было установлено, что берлинская лазурь и турнбулева синь – это одно и то же вещество, т.к. комплексы, образующиеся в реакциях (а) и (б) находятся между собой в равновесии:
KFeIII[FeII(CN)6] « KFeII[FeIII(CN)6]
(В разделе “Железо и его соединения” упомянутые выше реакции (а) и (б) приведены в традиционной старой записи).
| | Цинк
Zn2+
| 1) Гидроксиды щелочных металлов образуют белый амфотерный осадок Zn(OH)2, который растворим в NH4OH c образованием комплексных соединений:
Zn2+ + 2OH- ® Zn(OH)2 Zn(OH)2 + 4NH3 ® [Zn(NH3)4](OH)2
При прокаливании гидроксида цинка с соединениями кобальта образуется окрашенная в зеленый цвет масса - “ринманова зелень”, представляющая собой цинкат кобальта СоZnO2.
2) H2S при рН = 2, 2 дает белый осадок ZnS
| | Никель
Ni2+
| 1) Гидроксид натрия образует бледно-зеленый студенистый осадок Ni(OH)2; открываемый минимум - 300 µг никеля, предельное разбавление 1: 3.105. Осадок растворим в кислотах и в NH4OH и нерастворим в избытке щелочи.
2) Сероводород не осаждает NiS из сильнокислых растворов; черный осадок сульфида никеля образуется только при рН 4 – 5.
3) Диметилглиоксим (реактив Чугаева) образует красно-фиолетовый осадок; открываемый минимум - 0, 5 µг никеля, предельное разбавление 1: 1.106.
| | Серебро
Ag+
| 1) Соляная кислота дает белый творожистый осадок, растворимый в аммиаке, при подкислении HNO3 аммиачного раствора снова выпадает белый осадок; чувствительность реакции - 0, 01 µг Ag+, предельное разбавление 1: 105.
Ag+ + Cl- ® AgCl
AgCl + 2NH4OH ® [Ag(NH3)2]+ + Cl- + 2H2O
[Ag(NH3)2]+ + Cl- + 2H+ ® AgCl + 2NH4+
2) Сероводород осаждает черный сульфид серебра; открываемый минимум - 1 µг серебра, предельное разбавление 1: 5.106.
| | Медь
Cu2+
| 1) Растворы солей Сu2+ окрашены в голубой цвет; Cu2+ окрашивает пламя в зеленый цвет.
2) Сероводород образует черный осадок сульфида меди CuS; открываемый минимум - 1 µг меди, предельное разбавление 1: 5.106. Осадок нерастворим в соляной и серной кислотах, но растворяется в горячей конц. НNO3.
3) Гидроксиды щелочных металлов осаждают голубой осадок Сu(OH)2, который при нагревании дегидратируется и превращается в черный осадок оксида меди CuO:
Cu2+ + 2OH- ® Cu(OH)2 Cu(OH)2 ® CuO + H2O
Открываемый минимум - 80 µг меди, предельное разбавление 1: 5.104. Гидроксид меди растворяется в концентрированных растворах аммиака, образуя аммиакат меди интенсивно синего цвета (реактив Швейцера; растворяет целлюлозу):
Cu(OH)2 + 4NH3 ® [Cu(NH3)4]2+ + 2OH-
|
АНИОНЫ
| Анион
| Реактив, уравнение реакции, признаки присутствия данного аниона, открываемый минимум (чувствительность реакции)
| | F-
| 1) AgNO3 не образует осадка, т.к. фторид серебра растворим в воде (в отличие от других галогенидов серебра).
2) Хлорид кальция дает белый осадок фторида кальция.
| | Cl-
| 1) В азотнокислой среде AgNO3 дает белый осадок, растворимый в NH4OH. Открываемый минимум - 1 µг Cl-, предельное разбавление 1: 105.
| | Br-
| 1) В азотнокислой среде AgNO3 образует светло-желтый осадок. Чувствительность реакции - 20 µг Br -, предельное разбавление 1: 2.105.
2) Хлорная вода окисляет бромид-анион до свободного брома, который окрашивает органический растворитель в соломенно-желтый цвет. Фуксин, обесцвеченный гидросульфитом, окрашивается свободным бромом в синий цвет. Чувствительность реакции 50 µг Br-. 2Br- + Cl2 ® 2Cl- + Br2
| | I-
| 1) Нитрат серебра образует темно-желтый осадок AgI, нерастворимый в растворах HNO3, и NH4OH (в отличие от хлоридов и бромидов серебра, растворимых в аммиаке).
2) Хлорная вода окисляет йодид-анион до йода: 2I- + Cl2 ® I2 + 2Cl-
3) Открываемый минимум - 40 µг I-; предельное разбавление 1: 2, 5.104 Выделившийся йод можно открыть с помощью крахмала, который окрашивается йодом в синий цвет, или взбалтывая раствор с органическим растворителем, который приобретает красновато-фиолетовую окраску. При прибавлении избытка хлорной воды окраска исчезает, т.к. свободный йод окисляется до бесцветной йодноватой кислоты:
I2 + 5Cl2 + 6H2O ® 2HIO3 + 10H+ + 10Cl-
Другие окислители (перманганат калия, дихромат калия и др.) в кислом растворе также окисляют йодид-анион до йода:
Cr2O7 2- + 2I- + 14H+ ® 2Cr3+ + 3I2 + 7H2O
2MnO4- + 10I- + 16H+ ® 2Mn2+ + 5I2 + 8H2O
| | S2-
| 1) Хлористоводородная и др. кислоты при взаимодействии с сульфидами выделяют сероводород, который имеет запах тухлых яиц:
S2- + 2H+ ® H2S
2) Сульфид-анион с катионами многих тяжелых металлов образует разноцветные осадки: ZnS (белый), CdS (желтый), CuS, PbS, NiS (черный), HgS(красный) и др.
3) Нитропруссид натрия в щелочном растворе дает красно-фиолетовое окрашивание.
| | SO32-
| 1) Йодная вода или раствор перманганата калия обесцвечивается.
2) Разбавленные минеральные кислоты выделяют сернистый газ SO2, который обесцвечивает раствор KMnO4 или йода.
| | SO42-
| 1) Хлорид бария дает белый осадок, нерастворимый в HNO3:
Ba2+ + SO42- ® BaSO4
| | CO32-
| 1) Минеральные кислоты разлагают карбонаты (и гидрокарбонаты) с образованием углекислого газа СO2, который с известковой водой образует белый осадок:
CO32- + 2H+ ® H2O + CO2 Ca(OH)2 + CO2 ® CaCO3
| | SiO32-
| 1) Минеральные кислоты выделяют гель кремниевой кислоты
| | СН3СОО-
| 1) При растирании в ступке уксуснокислой соли с гидросульфатом калия появляется характерный запах уксусной кислоты (сильная кислота вытесняет из соли слабую):
CH3COOK + KHSO4 ® CH3COOH + K2SO4
2) Хлорид железа (III) дает на холоде интенсивно-красное окрашивание (вследствие гидролиза до основной соли), при нагревании бурый осадок (образуется конечный продукт гидролиза - гидроксид железа (III)).
3) Этиловый спирт (в присутствии конц. Н2SO4) образует сложной эфир, имеющий специфический фруктовый запах.
|
|

