Дипольные моменты некоторых молекул
| Молекула
| m, D
| Молекула
| m, D
| Молекула
| m, D
| | H2
| 0
| CO
| 0, 11
| CH4
| 0
| | Cl2
| 0
| CO2
| 0
| CH3Cl
| 1, 86
| | N2
| 0
| COCl2
| 1, 18
| CH2Cl2
| 1, 62
| | O2
| 0
| COS
| 0, 65
| CHCl3
| 1, 06
| | HF
| 1, 89
| SO2
| 1, 61
| CCl4
| 0
| | HCl
| 1, 02
| SO3
| 0
| BeCl2
| 0
| | HBr
| 0, 87
| SOCl2
| 1, 40
| ZnCl2
| 0
| | HJ
| 0, 42
| NH3
| 1, 48
| HgCl2
| 0
| | H2O
| 1, 84
| PH3
| 0, 55
| KCl
| 10, 2
| | H2S
| 0, 94
| BF3
| 0
| SnCl4
| 0
|
Таблица 6
Энергии связи атомов Есв и межьядерные расстояния ( d св )
| Связь
| Есв, кДж/моль
| dсв, нм
| Тип молекул
| | H – H
| 435, 6
| 0, 074
| H2
| | H – F
| 560, 6
| 0, 093
| HF
| | H – Cl
| 431, 3
| 0, 127
| HCl
| | H – Br
| 361, 9
| 0, 141
| HBr
| | H – J
| 298, 7
| 0, 161
| HJ
| | H – O
| 463, 2
| 0, 096
| H2O
| | H – S
| 347, 0
| 0, 133
| H2S
| | H – N
| 387, 7
| 0, 102
| NH3
| | H – C
| 366, 2
| 0, 109
| CH4
| | O = O
| 498, 0
| 0, 121
| O2
| | H – Se
| 276, 0
| 0, 146
| H2Se
| | H – Te
| 238, 0
| 0, 169
| H2Te
| | F – F
| 154, 8
| 0, 144
| F2
| | Cl – Cl
| 242, 3
| 0, 199
| Cl2
| | Br – Br
| 190, 5
| 0, 228
| Br2
| | J – J
| 148, 9
| 0, 267
| J2
| | C – C
| 262, 8
| 0, 154
| C2H6
| | C = C
| 423, 4
| 0, 134
| C2H4
| | C º C
| 536, 4
| 0, 120
| C2H2
|
Таблица 7
Стандартные энтальпии образования D 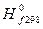 , энтропии , энтропии  и энергии образования Гиббса D и энергии образования Гиббса D  некоторых веществ при 298 К (25 ° С) некоторых веществ при 298 К (25 ° С)
| | Вещество
| D 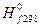 , ,
кДж/моль
|  , ,
Дж/моль× К
| D  , ,
кДж/моль
| | | 1
| 2
| 3
| 4
| | | Al(к)
| 0
| 28, 3
| 0
| | | Al2O3(к)
| − 1675, 0
| 50, 9
| − 1582, 0
| | | Al2(SO4)3(к)
| − 3434, 0
| 239, 2
| − 3091, 9
| | | B(к)
| 0
| 6, 0
| 0
| | | B2O3(к)
| − 1264, 0
| 53, 9
| − 1184, 0
| | | B2H6(к)
| 31, 4
| 232, 9
| 82, 8
| | | Ba(к)
| 0
| 64, 9
| 0
| | | BaO(к)
| − 538, 0
| 70, 0
| − 510, 0
| | | Ba(OH)2(к)
| − 943, 0
| 100, 0
| − 854, 0
| | | BaCO3(к)
| − 1202, 0
| 112, 1
| − 1138, 8
| | | Br2(ж)
| 0
| 152, 0
| 0
| | |
|
|
| Продолжение табл. 7
| | | 1
| 2
| 3
| 4
| | | C (графит)
| 0
| 5, 7
| 0
| | | CCl 4(ж)
| − 135, 4
| 214, 4
| − 64, 6
| | | CH 4(г)
| − 74, 7
| 186, 2
| − 50, 8
| | | C 2 H 2(г)
| 226, 8
| 200, 8
| 209, 2
| | | C 2 H 4(г)
| 52, 3
| 219, 4
| 68, 1
| | | C 2 H 6(г)
| -84, 6
| 229, 5
| -32, 9
| | | C 6 H 6(г)
| 82, 9
| 269, 2
| 129, 7
| | | C6H6(ж)
| 48, 9
| 173, 0
| 124, 5
| | | C2H5OH(ж)
| − 227, 6
| 160, 7
| − 174, 8
| | | C 6 H 12 O 6
(глюкоза)
| − 1273, 0
| −
| − 919, 5
| | | н– C 8 H 18(г)
| − 208, 5
| 466, 7
| 16, 5
| | | CO (г)
| − 110, 5
| 197, 5
| − 137, 1
| | | CO 2(г)
| − 393, 7
| 213, 8
| − 394, 4
| | | Ca (к)
| 0
| 42, 0
| 0
| | | CaO (к)
| − 635, 5
| 39, 7
| − 604, 2
| | | CaC 2(к)
| − 62, 7
| 70, 3
| − 67, 8
| | | CaF 2(к)
| − 1214, 6
| 68, 9
| − 1161, 9
| | | Ca 3 N 2(к)
| − 431, 8
| 105
| − 368, 6
| | | Ca ( OH )2(к)
| − 986, 3
| 76, 1
| − 896, 8
| | | CaCO 3(к)
| − 1206, 0
| 92, 9
| − 1128, 8
| | | Cl 2(г)
| 0
| 222, 9
| 0
| | | Cl 2 O (г)
| 76, 6
| 266, 2
| 94, 2
| | | ClO 2(г)
| 105, 0
| 257, 0
| 122, 3
| | | Cl 2 O 7(г)
| 287, 0
| 565, 0
| 399, 0
| | | Cs (к)
| 0
| 85, 0
| 0
| | | Cs 2 O (к)
| − 317, 6
| 123, 8
| − 274, 5
| | | CsOH (к)
| − 406, 5
| 77, 8
| − 355, 2
| | | Cu (к)
| 0
| 33, 0
| 0
| | | CuO (к)
| − 162, 0
| 42, 6
| − 129, 9
| | | F 2(г)
| 0
| 203
| 0
| | | Fe (к)
| 0
| 27, 2
| 0
| | | FeO (к)
| − 264, 8
| 60, 8
| − 244, 3
| | | Fe 2 O 3(к)
| − 822, 0
| 87, 0
| − 740, 3
| | | Fe 3 O 4(к)
| − 1117, 1
| 146, 2
| − 1014, 2
| | | H 2(г)
| 0
| 130, 5
| 0
| | | HBr (г)
| − 36, 3
| 198, 6
| − 53, 3
| | | HCN (г)
| 135, 0
| 113, 1
| 125, 5
| | | HCl (г)
| − 92, 2
| 186, 8
| − 95, 2
| | HF (г)
| − 270, 7
| 178, 7
| − 272, 8
| | | HJ (г)
| 26, 6
| 206, 5
| 1, 8
| | |
|
|
| Продолжение табл. 7
| | | 1
| 2
| 3
| 4
| | | HN 3(ж)
| 294, 0
| 328, 0
| 238, 8
| | | HNO 3(ж)
| − 173, 2
| 155, 7
| − 80, 9
| | | H 2 O (г)
| − 241, 8
| 188, 7
| − 228, 6
| | | H 2 O (ж)
| − 285, 8
| 70, 1
| − 237, 3
| | | H 2 O 2(г)
| − 136, 1
| 232, 5
| − 105, 4
| | | H2O2(ж)
| − 187, 6
| 110, 0
| − 120, 0
| | | H2S(г)
| − 21, 0
| 205, 7
| − 33, 8
| | | H2SO4(ж)
| − 811, 3
| 157, 0
| 690, 7
| | | Hg (ж)
| 0
| 76, 1
| 0
| | | HgO (к)
| − 90, 6
| 70, 0
| − 58, 0
| | | HgCl 2(к)
| − 230, 1
| 144, 4
| − 185, 8
| | | Hg 2 Cl 2(к)
| − 264, 9
| 185, 8
| − 210, 7
| | | J 2(к)
| 0
| 116, 0
| 0
| | | K (к)
| 0
| 65, 0
| 0
| | | K 2 O (к)
| − 361, 5
| 87, 0
| − 193, 3
| | | KH (к)
| − 58, 0
| 50, 0
| − 34, 0
| | | KOH (к)
| − 425, 0
| 79, 0
| − 379, 0
| | | KCl (к)
| − 435, 9
| 82, 6
| − 408, 0
| | | KClO 3(к)
| − 391, 2
| 143, 0
| − 289, 9
| | | KNO 3(к)
| − 495, 0
| 133, 0
| − 395, 0
| | | Li (к)
| 0
| 29, 0
| 0
| | | Li 2 O (к)
| − 595, 8
| 37, 9
| − 560, 2
| | | LiOH (к)
| − 487, 8
| 42, 8
| − 443, 1
| | | Mg (к)
| 0
| 33, 0
| 0
| | | MgO (к)
| − 601, 8
| 26, 9
| − 569, 6
| | | MgCl 2(к)
| − 641, 1
| 89, 9
| − 591, 6
| | | Mg 3 N 2(к)
| − 461, 1
| 87, 9
| − 400, 9
| | | Mg ( OH )2(к)
| − 925, 0
| 63, 0
| − 834, 0
| | | MgCO 3(к)
| − 1096, 2
| 65, 7
| − 1029, 3
| | | N 2(г)
| 0
| 191, 5
| 0
| | | NH 3(г)
| − 46, 2
| 192, 6
| − 16, 7
| | | NH 4 OH (ж)
| − 366, 7
| 179, 9
| − 263, 8
| | | NH4Cl(к)
| − 314, 2
| 95, 0
| − 203, 0
| | | NH4NO2(к)
| − 238, 0
| 254, 0
| − 117, 0
| | | NH4NO3(к)
| − 365, 4
| 151, 0
| − 183, 8
| | | N 2 H 4(ж)
| 50, 6
| 121, 4
| 149, 3
| | | N 2 O (г)
| 82, 0
| 219, 9
| 104, 1
| | | NO (г)
| 90, 3
| 210, 6
| 86, 6
| | | N 2 O 3(г)
| 83, 3
| 307, 0
| 140, 5
| | | NO 2(г)
| 33, 8
| 240, 4
| 51, 5
| | | N2O4(г)
| 9, 6
| 304, 3
| 98, 4
| | | | | | | | | | | | Продолжение табл. 7
| 1
| 2
| 3
| 4
| | N 2 O 5(к)
| − 42, 7
| 178, 0
| 114, 1
| | Na (к)
| 0
| 51, 4
| 0
| | Na 2 O (к)
| − 430, 6
| 71, 1
| − 376, 6
| | NaOH (к)
| − 425, 6
| 64, 2
| − 377, 0
| | NaH (к)
| − 56, 4
| 40, 0
| − 38, 0
| | Ni (к)
| 0
| 29, 9
| 0
| | NiO (к)
| − 239, 7
| 38, 0
| − 211, 6
| | O 2(г)
| 0
| 205, 0
| 0
| | OF 2(г)
| 25, 1
| 247, 0
| 42, 5
| | PH 3(г)
| 5, 0
| 210, 0
| 13, 0
| | P 2 O 3(к)
| − 820, 0
| 173, 5
| −
| | P 2 O 5(к)
| − 1492, 0
| 114, 5
| − 1348, 8
| | Pb (к)
| 0
| 65, 0
| 0
| | PbO (к)
| − 217, 9
| 66, 1
| − 189, 1
| | PbO 2(к)
| − 276, 9
| 74, 9
| − 218, 3
| | PbS (к)
| − 94, 3
| 91, 2
| − 92, 7
| | Rb (к)
| 0
| 77, 0
| 0
| | Rb 2 O (к)
| − 330, 1
| 109, 6
| − 290, 8
| | RbOH (к)
| − 413, 8
| 70, 7
| − 364, 4
| | S ( a ) (к)
| 0
| 32, 0
| 0
| | SO 2(г)
| − 296, 9
| 248, 1
| − 300, 2
| | SO 3(г)
| − 395, 2
| 256, 7
| − 371, 2
| | Si (к)
| 0
| 19, 0
| 0
| | SiCl 4(ж)
| − 687, 8
| 239, 7
| −
| | SiH 4(г)
| 34, 7
| 204, 6
| 57, 2
| | SiO 2(кварц)
| − 910, 9
| 41, 8
| − 856, 7
| | Sn (бел.) (к)
| 0
| 52, 0
| 0
| | SnO (к)
| − 286, 0
| 56, 5
| − 256, 9
| | SnO 2(к)
| − 580, 8
| 52, 3
| − 519, 3
| | Sr (к)
| 0
| 53, 0
| 0
| | SrO (к)
| − 590, 4
| 54, 4
| − 559, 8
| | SrCO 3(к)
| − 1221, 3
| 97, 1
| − 1137, 6
| | Ti (к)
| 0
| 30, 6
| 0
| | TiCl 4(ж)
| − 804, 2
| 252, 4
| − 737, 4
| | TiO 2(к)
| − 943, 9
| 50, 3
| − 888, 6
| | WO 3(к)
| − 842, 7
| 75, 9
| − 763, 9
| | Zn (к)
| 0
| 42, 0
| 0
| | ZnO (к)
| − 350, 6
| 43, 6
| − 320, 7
| | ZnS (к)
| − 201, 0
| 57, 7
| − 198, 3
| | ZnSO 4(к)
| − 978, 2
| 124, 6
| − 871, 8
|
Таблица 8
Теплоты сгорания некоторых веществ D  при 298 К (25 ° С) при 298 К (25 ° С)
[для органических соединений – конечные продукты
сгорания CO 2(г), H 2 O (ж) ]
| | Вещество (агрегатное состояние)
| − D  , кДж/моль , кДж/моль
| | Формула
| Название
|
| | | | H 2 (г)
| Водород
| 285, 8
| | | C (тв)
| Углерод
| 393, 7
| | | S (тв)
| Сера
| 296, 9
| | | CO 2 (г)
| Оксид углерода (IV)
| 0
| | | H 2 O (г)
| Вода
| 0
| | | NH 3 (г)
| Аммиак
| 382, 5
| | | N 2 H 4 (ж)
| Гидразин
| 622, 0
| | | CH 4 (г)
| Метан
| 890, 4
| | | C 2 H 6 (г)
| Этан
| 1559, 8
| | | C 2 H 4 (г)
| Этен
| 1410, 9
| | | C 2 H 2 (г)
| Этин
| 1299, 6
| | | C 3 H 8 (г)
| Пропан
| 2220, 0
| | | C 3 H 6 (г)
| Пропен
| 2058, 5
| | | C 3 H 4 (г)
| Пропин
| 1937, 6
| | | C 4 H 10 (г)
| н – Бутан
| 2877, 3
| | | C 5 H 12 (г)
| н – Пентан
| 3536, 3
| | | C 6 H 6 (ж)
| Бензол
| 3267, 6
| | | C 6 H 14 (г)
| н – Гексан
| 4194, 9
| | | C 6 H 5 CH 3 (ж)
| Толуол
| 3910, 0
| | | C 8 H 18 (ж)
| Изооктан
| 5496, 5
| | | CH 3 OH (ж)
| Метанол
| 715, 0
| | | C 2 H 5 OH (ж)
| Этанол
| 1370, 7
| | | C2H4(OH)2 (ж)
| Этиленгликоль
| 1179, 5
| | | C 3 H 7 OH (ж)
| Пропанол – 1
| 2010, 4
| | | C 3 H 5 ( OH )3 (ж)
| Глицерин
| 1661, 0
| | | C 4 H 9 OH (ж)
| Бутанол – 1
| 2671, 9
| | | C 5 H 11 OH (ж)
| Пентанол – 1
| 3320, 8
| | | C 7 H 15 OH (ж)
| Гептанол – 1
| 4622, 9
| | | CH 3 NO 2 (ж)
| Нитрометан
| 708, 8
| | | ( CH 3 )2 NH (ж)
| Диметиламин
| 1743, 5
| | | ( CH 3 )3 N (ж)
| Триметиламин
| 2420, 9
| | | ( C 2 H 5 )3 N (ж)
| Триэтиламин
| 4366, 0
| | | ( CH 3 ) NHNH 2 (ж)
| Метилгидразин
| 1303, 0
| | | C 6 H 5 NO 2 (ж)
| Нитробензол
| 3092, 8
| | | C 6 H 5 NH 2 (ж)
| Анилин
| 3396, 2
| | | | | | | | | Таблица 9
Плотность водных растворов некоторых неорганических
веществ при 20 ° С *)
| Массовая доля w, %
| r, г/см3
| Массовая доля w, %
| r, г/см3
| Массовая доля w, %
| r, г/см3
| |
HCl
| H2SO4
|
NaOH
|

