
|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |

|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |
Константы диссоциации некоторых слабых электролитов⇐ ПредыдущаяСтр 20 из 20
в водных растворах при 25 ° С *)
Продолжение табл. 11
*) Примечание: Указанные в таблице кислоты: HClO2, HJO3, HJO4, H2SO4 – следует считать сильными электролитами.
Таблица 12 Степень диссоциации некоторых электролитов в 0, 1 н. водных растворах при 18 ° С
Кислоты | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Азотная | HNO3 | 92, 0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Борная | H3BO3 | 0, 01 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Бромоводородная | HBr | 90, 0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Иодоводородная | HJ | 90, 0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Серная | H2SO4 | 58, 0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Сернистая | H2SO3 | 20, 0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Сероводородная | H2S | 0, 07 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Угольная | H2CO3 | 0, 17 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Уксусная | CH3COOH | 1, 3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Фосфорная | H3PO4 | 26, 0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Фтороводородная | HF | 15, 0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Хлороводородная | HCl | 91, 0 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Продолжение табл. 12
| 1 | 2 | 3 | ||
| Циановодородная | HCN | 0, 007 | ||
| Щавелевая | H2C2O4 | 31, 0 | ||
|
Основания | ||||
| Гидроксид аммония | NH4OH | 1, 3 | ||
| Гидроксид калия | KOH | 91, 0 | ||
| Гидроксид кальция | Ca(OH)2 | 78, 0 | ||
| Гидроксид натрия | NaOH | 92, 0 | ||
|
Соли | ||||
| Сульфат меди (II) | CuSO4 | 40, 0 | ||
| Сульфат натрия | Na2SO4 | 72, 0 | ||
| Хлорид алюминия | AlCl3 | 65, 0 | ||
| Хлорид калия | KCl | 88, 0 | ||
| Хлорид магния | MgCl2 | 72, 0 | ||
| Хлорид натрия | NaCl | 84, 0 | ||
Таблица 13
Произведения растворимости некоторых труднорастворимых
веществ в воде при 25 ° С
| Вещество | ПР | Вещество | ПР |
| AgBr | 6, 0 × 10− 13 | Fe(OH)2 | 1, 0 × 10− 15 |
| Ag2CO3 | 6, 2 × 10− 12 | Fe(OH)3 | 3, 8 × 10− 38 |
| AgCl | 1, 8 × 10− 10 | FeS | 5, 0 × 10− 18 |
| AgJ | 1, 1 × 10− 16 | Mg(OH)2 | 5, 5 × 10− 12 |
| Ag3PO4 | 1, 8 × 10− 18 | MgS | 2, 0 × 10− 15 |
| Ag2S | 6, 0 × 10− 50 | HgS | 1, 6 × 10− 52 |
| Ag2SO4 | 2, 0 × 10− 5 | MnCO3 | 5, 1 × 10− 10 |
| Al(OH)3 | 1, 9 × 10− 33 | MnS | 2, 5 × 10− 10 |
| BaCO3 | 5, 0 × 10− 9 | PbCO3 | 1, 5 × 10− 13 |
| BaSO4 | 1, 1 × 10− 10 | PbSO4 | 1, 6 × 10− 8 |
| CaCO3 | 5, 0 × 10− 9 | SrCO3 | 9, 4 × 10− 10 |
| CaC2O4 | 2, 0 × 10− 9 | SrSO4 | 3, 2 × 10− 7 |
| Ca3(PO4)2 | 1, 0 × 10− 29 | ZnCO3 | 6, 0 × 10− 11 |
| CaSO4 | 1, 3 × 10− 4 | Zn(OH)2 | 1, 0 × 10− 17 |
| CuCO3 | 2, 4 × 10− 10 | ZnS | 1, 6 × 10− 24 |
| Cu(OH)2 | 2, 2 × 10− 20 | ||
| CuS | 6, 0 × 10− 36 |
Таблица 14
Константы нестойкости некоторых комплексных ионов
в водных растворах при 25 ° С
| Уравнение диссоциации комплексного иона | Константа нестойкости, Кнест. |

| 1, 1 × 10− 21 |

| 1, 0 × 10− 8 |
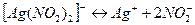
| 1, 8 × 10− 3 |

| 1, 1 × 10− 13 |

| 8, 5 × 10− 16 |

| 1, 0 × 10− 21 |

| 1, 5 × 10− 30 |

| 4, 0 × 10− 42 |

| 1, 3 × 10− 22 |

| 7, 6 × 10− 8 |
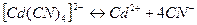
| 7, 8 × 10− 18 |

| 7, 9 × 10− 7 |

| 4, 1 × 10− 5 |

| 2, 1 × 10− 13 |

| 5, 0 × 10− 31 |

| 1, 9 × 10− 9 |

| 1, 0 × 10− 24 |

| 1, 0 × 10− 31 |

| 2, 0 × 10− 9 |

| 1, 0 × 10− 16 |
Таблица 15
Растворимость кислот, оснований и солей в воде *)
Катионы
Анионы
Примечание:
*) р – растворимые (больше 10 г/л воды);
м – малоратсворимые (от 10 г/л до 0, 01 г/л воды);
н – нерастворимые (меньше 0, 01 г/л воды);
- – разлагаются водой или не получены.
Таблица 16
Стандартные электродные потенциалы j ° некоторых окислительно-восстановительных пар в водных растворах при 25 ° С
| Элемент | Высшая степень окисления (окисленная форма) | + n е | Низшая степень окисления (восстановленная форма) | j°, В |
| AgJ ¯ | +e | Ag ¯ + J- | -0, 15 | |
| Ag | AgBr ¯ | +e | Ag ¯ + Br- | +0, 07 |
| AgCl ¯ | +e | Ag ¯ + Cl- | +0, 22 | |
| Ag+ | +e | Ag ¯ | +0, 80 | |
| Al | AlO2- +2H2O | +3e | Al ¯ + 4OH- | -2, 35 |
Продолжение табл. 16
| 1 | 2 | 3 | 4 | 5 |
| Al(OH)3 ¯ | +3e | Al ¯ +3OH- | -2, 31 | |
| Al3+ | +3e | Al ¯ | -1, 66 | |
| Ba | Ba2+ | +2e | Ba ¯ | -2, 90 |
| Br
| Br2( ж ) | +2e | 2Br- | +1, 07 |
| HBrO + H+ | +2e | Br- + H2O | +1, 34 | |
| F | F2 | +2e | 2 F - | +2, 87 |
| H | H2 | +2e | 2H- | -2, 25 |
| 2H2O | +2e | H2 +2OH- | -0, 83 | |
| 2H+ (10-7 M) | +2e | H2 | -0, 41 | |
| 2H+ (1 M) | +2e | H2 | 0, 00 | |
| C | 2CO2 +2H+ | +2e | H2C2O4 | -0, 49 |
| CO2 +2H+ | +2e | HCOOH | -0, 20 | |
| HCOOH +2H+ | +2e | HCHO | -0, 01 | |
| HCHO + 2H+ | +2e | CH3OH | +0, 19 | |
| CH3OH + 2H+ | +2e | CH4 + H2O | +0, 59 | |
| Ca | Ca2+ | +2e | Ca ¯ | -2, 87 |
| Ca(OH)2 ¯ | +2e | Ca ¯ +2OH- | -3, 03 | |
| Cl | Cl2 | +2e | 2Cl- | +1, 36 |
| HClO + H+ | +2e | Cl- + H2O | +1, 49 | |
|
J | J2 ¯ | +2e | 2J- | +0, 54 |
| JO3- + 12H+ | +10e | J2 ¯ + 6H2O | +1, 19 | |
| 2HJO + 2H+ | +2e | J2 ¯ + 2H2O | +1, 45 | |
| K | K+ | +e | K ¯ | -2, 92 |
| Li | Li+ | +e | Li ¯ | -3, 04 |
| Mg | Mg2+ | +2e | Mg ¯ | -2, 37 |
| Mg(OH)2 ¯ | +2e | Mg ¯ + 2OH- | -2, 69 | |
| Mn | Mn2+ | +2e | Mn ¯ | -1, 19 |
| MnO4- | +e | MnO42- | +0, 56 | |
| MnO4- + 2H2O | +3e | MnO2 ¯ + 4OH- | +0, 60 | |
| MnO2 ¯ +4H+ | +2e | Mn2+ + 2H2O | +1, 23 | |
| MnO4- + 8H+ | +5e | Mn2+ + 4H2O | +1, 51 |
Продолжение табл. 16
| 1 | 2 | 3 | 4 | 5 |
| N | NO2- + H2O | +e | NO + 2OH- | -0, 46 |
| NO3- + 2H+ | +e | NO2 + H2O | +0, 80 | |
| NO3- + 10H+ | +8e | NH4+ + 3H2O | +0, 87 | |
| NO3- + 3H+ | +2e | HNO2 + H2O | +0, 94 | |
| NO3- + 4H+ | +3e | NO + 2H2O | +0, 96 | |
| Na | Na+ | +e | Na ¯ | -2, 71 |
| O | O2 + 2H2O | +4e | 4OH- | +0, 40 |
| O2 + 2H+ | +2e | H2O2 | +0, 68 | |
| O2 + 4H+ | +4e | 2H2O | +1, 23 | |
| O3 + H2O | +2e | O2 +2OH- | +1, 24 | |
| H2O2 + 2H+ | +2e | 2H2O | +1, 77 | |
| O3 + 2H+ | +2e | O2 + H2O | +2, 07 | |
| P | H3PO4 + 2H+ | +2e | H3PO3 + H2O | -0, 28 |
| Pb | PbSO4 ¯ | +2e | Pb ¯ + SO42- | -0, 36 |
| Pb2+ | +2e | Pb ¯ | -0, 13 | |
| PbO2 ¯ + 4H+ | +2e | Pb2+ + 2H2O | +1, 46 | |
| PbO2 ¯ +4H++ SO42- | +2e | PbSO4 ¯ + 2H2O | +1, 68 | |
| Pb4+ | +2e | Pb2+ | +1, 69 | |
| Pt | Pt2+ | +2e | Pt ¯ | ~+1, 2 |
| Rb | Rb+ | +e | Rb ¯ | -2, 93 |
| S | SO42- + H2O | +2e | SO32- + 2OH- | -0, 93 |
| SO42- + 4H2O | +6e | S ¯ + 8OH- | -0, 75 | |
| S ¯ | +2e | S2- | -0, 48 | |
| S4O62- | +2e | 2S2O32- | +0, 09 | |
| SO42- + 4H+ | +2e | H2SO3 + H2O | +0, 17 | |
| S ¯ +2H+ | +2e | H2S | +0, 17 | |
| SO42- + 8H+ | +6e | S ¯ + 4H2O | +0, 36 | |
| S2O32- + 6H+ | +4e | 2S ¯ + 3H2O | +0, 50 | |
|
Si | SiO32- + 3H2O | +4e | Si ¯ + 6OH- | -1, 70 |
| SiO2 ¯ + 4H+ | +4e | Si ¯ + 2H2O | -0, 86 | |
| Si ¯ + 4H+ | +4e | SiH4 | +0, 10 | |
| Sr | Sr2+ | +2e | Sr ¯ | -2, 89 |
| Zn | Zn(OH)2 ¯ | +2e | Zn ¯ + 2OH- | -1, 25 |
| ZnO22- + 2H2O | +2e | Zn ¯ + 4OH- | -1, 22 | |
| Zn2+ | +2e | Zn ¯ | -0, 76 |
Последнее изменение этой страницы: 2019-06-19; Просмотров: 64; Нарушение авторского права страницы