
|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |

|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |
Классификация циклических соединенийСтр 1 из 5Следующая ⇒
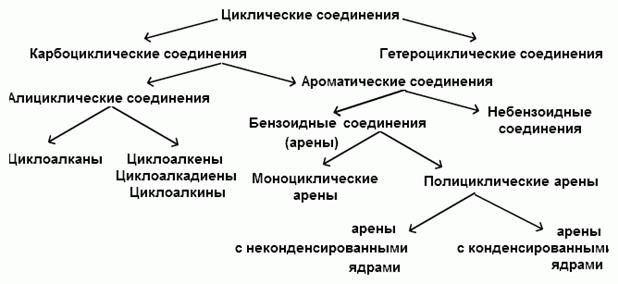
ЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ Классификация циклических соединений Циклические соединения делятся на карбоциклические и гетероциклические соединения. Карбоциклические соединения содержат в своих циклах только атомы углерода, в то время как в циклах гетероциклических соединений имеются атомы других элементов (кислорода, азота, серы и т.д.). Карбоциклические соединения подразделяются на алициклические и ароматические соединения.
АЛИЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ Алициклические соединения – это соединения, молекулы которых содержат один или несколько циклов неароматического характера. Термин «алициклические» означает алифатические циклические соединения, так как по своим свойствам они похожи на соответствующие соединения алифатического ряда. Однако, несмотря на большое сходство между алифатическими и алициклическими соединениями, имеются некоторые особенности в поведении последних, что обусловлено наличием в них циклической структуры. Классификация алициклических соединений Алициклические соединения подразделяются в зависимости от величины цикла, числа циклов и способа соединения циклов. Простейший алициклический цикл – трехчленный. Но известны алициклы с числом атомов углерода до 30 и более. Алициклические соединения, содержащие в молекуле два, три, четыре и более циклов, соединенных между собой различным способами, называются полиалициклическими соединениями. В зависимости от способа соединения циклов они могут иметь один, два, три или более общих углеродных атомов. В соответствии с этим бициклические соединения классифицируют: 1) спираны имеют один общий для двух циклов атом углерода; 2) в соединениях с конденсированными циклами общими для двух циклов являются два соседних атома углерода; 3) если общих атомов углерода больше двух, то алициклы называются мостиковыми.
По характеру связей в циклах различают: 1) насыщенные алициклические соединения (циклоалканы); 2) ненасыщенные алициклические соединения с одной двойной связью (циклоалкены), с двумя – циклоалкадиены, с тремя – циклоалкатриены, с одной тройной связью – циклоалкины.
ЦИКЛОАЛКАНЫ (ЦИКЛОПАРАФИНЫ) Циклоалканами называют предельные алициклические углеводороды, в молекулах которых все углеродные атомы цикла соединены между собой простыми одинарными ϭ – связями. По своим свойствам они напоминают обычные предельные углеводороды – алканы (парафины), откуда и происходит их название – циклоалканы (циклопарафины). Циклоалканы иногда называют полиметиленовыми углеводородами (т.е. состоящими из связанных между собой в кольцо метиленовых групп СН2), или нафтенами, так как некоторые циклоалканы (циклопентаны, циклогексаны и их производные) содержатся в некоторых сортах нефти (например, кавказская или калифорнийская). Состав циклоалканов выражают общей формулой С n H 2 n, т.е. они изомерны этиленовым углеводородам (алкенам). Номенклатура циклоалканов По современной международной заместительной номенклатуре названия циклоалканов образуют прибавлением приставки «цикло» к названиям соответствующих углеводородов алифатического ряда (циклопропан, циклобутан, циклопентан, циклогексан и т.д.) По рациональной номенклатуре циклоалканы рассматриваются как замкнутые цепочки, состоящие из метиленовых групп СН2 (триметилен, тетраметилен, пентаметилен, гексаметилен и т.д.).
При наличии в молекуле циклоалкана двух и более заместителей, их положение нумеруют таким образом, чтобы сумма номеров была наименьшей. При этом наименьший номер получает младший заместитель.
1, 3-диметилциклогексан 1-метил-2-этилциклопентан
Изомерия циклоалканов Структурная изомерия 1) Изомерия, связанная с числом углеродных атомов в цикле:
Пространственная изомерия Геометрическая изомерия (цис-, транс-изомерия) наблюдается также в циклических насыщенных соединениях, где кольцо играет роль жесткой двойной связи. В циклических системах геометрической изомерии часто сопутствует оптическая изомерия. Кроме того, в случае неплоских колец возникает возможность конформационной изомерии. Для двухзамещенных циклопропанов цис-изомерами называют соединения, у которых оба заместителя расположены по одну сторону плоскости кольца, а трансизомерами – соединения с заместителями, расположенными по разные стороны кольца:
В случае одинаковых заместителей только транс-форма имеет оптические изомеры, так как оптическая изомерия проявляется только в том случае, если молекула не имеет плоскости симметрии. В случае различных заместителей каждый из геометрических изомеров является оптически активным
Для циклов, имеющих большее число атомов углерода в кольце, число возможных цис-транс-изомеров возрастает, поскольку здесь имеются изомеры положения. В циклогексановом ряду наряду с геометрической изомерией наблюдается оптическая изомерия при 1, 2 и 1, 3-транс-положении заместителей:
1, 1-изомер 1, 2-транс 1, 2-цис 1, 3-транс 1, 4-цис
1, 4-цис 1, 4-транс Физические свойства Циклоалканы имеют более высокие температуры плавления, кипения и большую плотность, чем соответствующие алканы. При одинаковом составе температура кипения циклопарафина тем выше, чем больше размер цикла. Циклоалканы в воде практически не растворимы, однако растворимы в органических растворителях. Общие способы получения Циклизация дигалогеналканов Этим способом могут быть получены трех- и четырехчленные циклы при действии Zn, Na, Mg на соответствующие дигалогенопроизводные алканов:
n = 1, 2 (3-4-членные циклы) Пяти- и шестичленные циклические соединения этим методом образуются с трудом, вследствие преобладания конформаций, строение которых неблагоприятно для циклизации. Эти конформации в результате свободного вращения по С-С-связи имеют такое строение углеродной цепи, при котором концевые группы взаимно удалены и вероятность образования конформации со сближенными концевыми группами невелика. Получение циклопропанов Получение циклобутанов Получение циклопентанов Получение циклогексанов Дегидроциклизация алканов
Получение циклооктанов Тетрамеризация ацетилена Реакцией тетрамеризации ацетилена получают циклооктатетраен, который затем восстанавливают до циклооктана:
Циклы |
Отклонения валентных углов | Разница между теплотой сгорания на группу СН2 данного цикла и ненапряженного циклогексана (кДж/моль) | |||
| вычисленные по Байеру | фактические | ||||
| Циклопропан (С3) | +24044 | +24044 | 38, 50 | ||
| Циклобутан (С4) | +9044 | +9044 | 27, 40 | ||
| Циклопентан (С5) | +0044 | +0044 | 5, 40 | ||
| Циклогексан (С6) | - 5016 | 00 | 0 (как у гексана) | ||
| Циклогептан (С7) | - 9033 | 00 | 3, 78 | ||
| Циклооктан (С8) | - 12046 | 00 | 5, 46 | ||
| Циклононан (С9) | - 15016 | 00 | 5, 50 | ||
| Циклодекан (С10) | - 17016 | 00 | 4, 60 | ||
| Циклы с С12 и более | 0 – 1, 70 | ||||
Согласно полученным расчетам по Байеру, напряжение циклов уменьшается от трехчленного (наиболее напряженного и менее устойчивого) к пятичленному, а затем вновь возрастает. Исходя из этого Байер сделал вывод, что наиболее устойчивым должен быть циклопентан, затем циклогексан, а остальные циклы должны быть значительно менее устойчивыми.
Однако теория Байера оказалась в противоречии со многими экспериментальными данными.
Было установлено, что шестичленный цикл прочнее пятичленного; не наблюдается увеличения напряжения и в циклах с большим числом атомов углерода.
Несостоятельность теории Байера заключалась в том, что он считал все циклы плоскими, а угловое напряжение рассматривал как единственный фактор, определяющий устойчивость циклов.
В настоящее время установлено, что:
1) все циклы, за исключением трехчленного, не имеют плоскостного строения;
2) в циклических соединениях существуют следующие типы напряжений, повышающие внутреннюю энергию циклов:
Напряжение Ван-дер-Ваальса.
Этот тип напряжения возникает в результате взаимного отталкивания атомов или групп атомов, находящихся у соседних атомов углерода, связанных σ -связью.
4. Напряжение трансаннулярное (напряжение Прелога).
Этот тип напряжения возникает в результате взаимодействия атомов или групп атомов, расположенных не у соседних, а у отдаленных друг от друга атомов углерода цикла. Например, в циклах, содержащих 8-12 атомов углерода.
Естественно, что все указанные типы напряжений приводят к увеличению внутренней энергии системы. Поэтому любое алициклическое соединение стремится принять такую пространственную конфигурацию, при которой число всех этих типов напряжений было бы наименьшим, т.е. чтобы внутренняя энергия системы была минимальной.
Экспериментальная количественная оценка степени напряженности (устойчивости) циклических систем была сделана на основе исследований теплот сгорания, являющихся мерой внутренней энергии соответствующих циклоалканов.
Результаты этих исследований показали, что теплота сгорания в расчете на одну группу СН2 является наименьшей для циклогексана и не отличается от таковой в углеводородах нормального строения. Это свидетельствует об отсутствии напряжения в шестичленном цикле.
Если напряжение в этом цикле принять за нуль, то наибольший избыток энергии в расчете на одну группу СН2 по сравнению с циклогексаном имеют циклопропан (38, 5 кДж/моль) и циклобутан (27, 4 кДж/моль), что свидетельствует о наличии в этих циклах больших напряжений.
Небольшое напряжение имеется в циклопентане (5, 4 кДж/моль), циклогептане (3, 7 кДж/моль) и в циклах, содержащих С8 – С11 (4, 2-5, 8 кДж/моль).
Макроциклы с числом атомов углерода С12 и более приближаются по своей устойчивости к циклогексану (0-1, 7 кДж/моль).
Строение циклопропана



Рис.1. Строение циклопропана
В молекуле циклопропана все атомы углерода расположены в одной плоскости.
При таком расположении атомов углерода в цикле валентные углы должны быть равны 600, а величина их отклонения от нормального валентного угла (109028) должна составлять: α = (109028 – 600): 2 = 24044. Это наиболее напряженная циклическая система.
Однако в действительности, валентные углы между атомами углерода в циклопропановом цикле составляет 1060. Это объясняется тем, что σ -связи между атомами углерода в циклопропане отличаются от обычных σ -связей, образующихся при перекрывании sp3-гибридных орбиталей в алканах.
При образовании углерод-углеродных связей в циклопропановом цикле происходит только частичное перекрывание sp3-гибридных орбиталей, направленное не вдоль прямой, соединяющей центры связанных углеродных атомов, а за пределами плоскости циклопропана, что приводит к образованию изогнутых орбиталей или так называемых банановых или τ - (греч.«тау») связей.
Образование банановых (или τ -) связей в циклопропане приводит к уменьшению углового напряжения в цикле, так как угол между осями двух электронных облаков увеличивается от 600 до 1060, а сами τ -связи приобретают частично ненасыщенный характер и по прочности они занимают промежуточное положение между σ - и π -связями.
Этим объясняется склонность циклопропана к реакциям присоединения. О частичном ненасыщенном характере атомов углерода в молекуле циклопропана свидетельствует также повышенная протонная подвижность атомов водорода.
Конформации циклогексана
Если молекула циклогексана будет иметь плоское строение, то валентные углы между атомами углерода будут отличаться от нормального на 5016, а следовательно, в молекуле будет иметь место угловое напряжения. Атомы водорода при этом будут находиться в невыгодном заслоненном положении, что будет приводить к значительному торсионному напряжению.
Очевидно, что молекула циклогексана стремится принять такую конфигурацию, в которой бы эти напряжения отсутствовали и молекула была бы более устойчивой.
Для циклогексана существует две конформации без углового напряжения. Валентные углы в них равны 109028. Эти конформации получили название «кресла» и «ванны».


Кресло Ванна Кресло Ванна
В конформации «ванна» четыре атома углерода (2, 3, 5, 6) лежат в одной плоскости, а два атома (1, 4) возвышаются над ней.
Конформация «ванны» приблизительно на 28, 9 кДж/моль менее устойчива, чем конформация «кресла». Это объясняется тем, что водородные атомы в положении 1 и 4 оказываются в «заслоненном» положении, что резко повышает энергию конформации «ванна».
В конформации «кресла» практически отсутствуют все типы напряжений: углы С-С-С все равны 109028, отсутствуют торсионное, ван-дер-ваальское и трансаннулярное напряжения.
В более выгодной конформации «кресла» атомы углерода расположены по три (1, 3, 5) и (2, 4, 6) в двух параллельных плоскостях, перпендикулярно к которым проходит ось симметрии третьего порядка. Расстояние между плоскостями равно 0, 05 нм.
В этой конформации циклогексан имеет 12 С-Н-связей, которые можно разделить на две группы.
Шесть С-Н-связей параллельны оси симметрии третьего порядка и друг другу и чередуются «вверх-вниз» от плоскости кольца. Они называются аксиальными связями и обозначаются (а).
Шесть других С-Н-связей, направленные под углом 109028 к аксиальным связям, называются экваториальными связями и обозначаются (е).
Кроме того, циклогексан существует в двух конформациях «кресло», которые настолько быстро превращаются одна в другую, что их нельзя разделить. При этом один из концов «кресла» поднимается, а другой опускается и все атомы водорода, находящиеся в аксиальном положении, становятся экваториальными, и наоборот:


ось симметрии II III
I
Это явление получило название инверсии цикла, а его скорость – частоты инверсии.
Для циклогексана частота инверсии составляет 106 превращений в секунду.
Если в молекуле циклогексана имеется один заместитель, то его пространственное (аксиальное или экваториальное) расположение будет влиять на энергетическое состояние молекулы.
Энергетически более выгодной, а значит, и более устойчивой должна быть конформация, в которой заместитель располагается в экваториальном положении, так как в этом случае он будет наиболее удален от соседних атомов водорода.
Так, например, метилциклогексан в равновесной смеси аксиальных и экваториальных конформеров находится преимущественно в экваториальной форме (95%), так как в этом случае меньше пространственные затруднения:

е-конформер (96%) а-конформер
При наличии в молекуле циклогексана нескольких заместителей наиболее устойчивой должна быть такая конформация, в которой заместители располагаются в экваториальном положении, так как в этом случае они будут максимальны удалены друг от друга.
Так, например, в ряду 1, 2- и 1, 4-дизамещенных циклогексанов транс-изомеры будут устойчивее цис-изомеров, а в ряду 1, 3-дизамещенных более стабильной является цис-форма.
Это объясняется тем, что в наиболее устойчивых конформациях 1, 2- и 1, 4- транс-изомеров оба заместителя находятся в экваториальном положении, тогда как в менее устойчивых конформациях 1, 2- и 1, 4-цис-изомеров один из заместителей всегда находится в аксиальном положении.
В ряду 1, 3- дизамещенных циклогексанов наблюдается обратная закономерность.

1, 2-транс-изомер (устойчивее) 1, 4-транс-изомер (устойчивее)

1, 2-цис-изомер 1, 4-цис-изомер

1, 3-цис-изомер (устойчивее) 1, 3-транс-изомер
Реакции галогенирования
Реакции циклоалканов с галогенами происходят в различных направлениях в зависимости от величины цикла и природы галогена.
Галогенирование циклобутана
Большая устойчивость циклобутана по сравнению с циклопропаном проявляется в том, что он присоединяет бром труднее – лишь при повышенных температурах:
 + Br2 → BrCH2-CH2-CH2-CH2Br
+ Br2 → BrCH2-CH2-CH2-CH2Br
Хлор при взаимодействии с циклобутаном вступает в реакцию замещения:
CH2 – CH2 CH2 – CH-Cl CH2 - CH
| | + Cl2 → | | → | ||
CH2 – CH2 CH2 – CH2 - HCl CH2 - CH
Взаимодействие с кислотами
Окисление циклоалканов
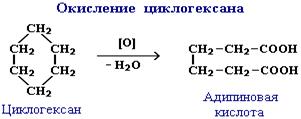
Циклоалканы довольно стойки к действию окислителей. Однако, при повышенных температурах, под действием сильных окислителей (KMnO4, K2Cr2O7) происходит разрыв цикла с образованием двухосновных кислот с тем же числом атомов углерода в молекуле:
ЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ
Классификация циклических соединений
Циклические соединения делятся на карбоциклические и гетероциклические соединения.
Карбоциклические соединения содержат в своих циклах только атомы углерода, в то время как в циклах гетероциклических соединений имеются атомы других элементов (кислорода, азота, серы и т.д.).
Карбоциклические соединения подразделяются на алициклические и ароматические соединения.
Последнее изменение этой страницы: 2019-06-19; Просмотров: 84; Нарушение авторского права страницы