
|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |

|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |
МЕТАЛЛОВЕДЕНИЕ УГЛЕРОДИСТЫХ СПЛАВОВСтр 1 из 12Следующая ⇒
МЕТАЛЛОВЕДЕНИЕ УГЛЕРОДИСТЫХ СПЛАВОВ Лабораторный практикум
Содержание
Лабораторная работа № 1 Термический анализ сплавов
Лабораторная работа № 2 Микроскопический анализ металлов и сплавов. Структура углеродистой стали
Лабораторная работа № 3 Диаграмма состояния железо-углерод. Структура, свойства и применение чугунов
Лабораторная работа № 4 Влияние холодной пластической деформации и температуры рекристаллизации на структуру и свойства металлов
Лабораторная работа № 5 Закалка углеродистых сталей
Лабораторная работа № 6 Отпуск стали
Лабораторная работа № 7 Отжиг и нормализация стали
Лабораторная работа № 8 Химико-термическая обработка стали Лабораторная работа № 1 Термический анализ сплавов
Цель работы
1. Освоить метод термического анализа и принцип построения диаграмм состояния. 2. Приобрести навыки анализа диаграмм состояния двойных сплавов.
Приборы, материалы, учебные пособия
1) Термическая печь. 2) Гальванометр. 3) Термопары хромель-алюмель. 4) Сплавы Zn-Sn: 4% Zn + 96% Sn; 8% Zn + 92% Sn; 40% Zn + 60% Sn; 60% Zn + 40% Sn. 5) Альбом микроструктур, справочные материалы.
Построение и анализ диаграмм состояния
Структурные составляющие системы Диаграмма состояния или диаграмма равновесия – графическое изображение равновесных состояний сплава в виде точек в n-мерном пространстве, по осям координат которого отложены n независимых параметров состояния рассматриваемого сплава. Параметр состояния – физическая величина, служащая в термодинамике для характеристики состояния рассматриваемой системы, например, давление, температура, концентрация элементов и т. д. В данной работе будут рассматриваться диаграммы состояния в координатах: концентрация компонентов – температура. Компонентами называются простейшие вещества, которые определяют состав сплава, и концентрация которых является независимой от остальных параметров. Чистый металл представляет собою однокомпонентную систему, сплавы из двух компонентов – двухкомпонентную и т. д. Однородная часть неоднородной системы, имеющая границы раздела с другими частями системы и взаимодействующая с ними, называется фазой. Фазами могут быть сами компоненты, их химические соединения, жидкие и твердые растворы. Химическое соединение – химически индивидуальное вещество, в котором атомы одного (как, например, О2) или различных (как, например, КСl) элементов соединены между собою тем или иным видом химической связи. Химическое соединение описывается определенной химической формулой, образует кристаллическую решетку, которая отличается от кристаллических решеток элементов образующих это химическое соединение. Твердые растворы – однородные кристаллические вещества, состоящие из двух или большего числа компонентов и сохраняющие однородность при изменении соотношений между компонентами в определенном интервале концентраций. В твердых растворах атомы одного или нескольких компонентов находятся в кристаллической решетке одного из компонентов, который называется растворителем. Различают твердые растворы замещения, внедрения, вычитания. В твердых растворах замещения, образованных двумя или несколькими металлами (например, медью и никелем), атомы одного металла (Ni) размещаются в узлах кристаллической решетки другого (Cu) вместо атомов Сu. В твердых растворах внедрения атомы неметалла (обычно) располагаются в промежутках между атомами металла, которые находятся в узлах кристаллической решетке. Твердые растворы вычитания образуются только на основе химических соединений. При растворении компонента А в химическом соединении А и В, часть узлов решетки, принадлежащих компоненту В, делается вакантной (вычитается из решетки). Твердые растворы обозначаются греческими буквами: a, b, g, d и т. д. В сплавах имеются структурные составляющие: эвтектика и эвтектоид. Эвтектика – тонкая смесь кристаллов различных компонентов или фаз, одновременно закристаллизовавшихся из жидкости определенного (эвтектического) состава при температуре ниже температуры плавления отдельных компонентов. Эвтектоид – аналогичная эвтектике структурная составляющая металлических сплавов, но в отличие от нее образующаяся не из жидкой, а из твердой фазы.
Анализ диаграмм состояния По диаграмме состояния можно определить критические точки сплава при нагревании и охлаждении и установить его структуру, выбрать сплав, обладающий наилучшими литейными свойствами, правильно назначить режим термической обработки. Диаграмма состояния сплавов, компоненты которой неограниченно растворимы в жидком состоянии, нерастворимы в твердом и при кристаллизации образуют эвтектику (рис. 4): АЕС – ликвидус, начало кристаллизации сплавов. ВЕF – солидус, конец кристаллизации сплавов; на этой линии происходит одновременная эвтектическая кристаллизация компонентов А и В при постоянной температуре. Линия называется эвтектической. АЕ – начало кристаллизации компонента А. ЕС – начало кристаллизации компонента В. Точка Е называется эвтектической, в ней происходит одновре-
Кристаллизация и структурообразование сплавов (I–III) Сплав I – доэвтектический. Критическая точка 1 – начало кристаллизации компонента А, две фазы: жидкость и зародыши зерен компонента А. Критическая точка 2 – кристаллизация эвтектики, т. е. из оставшейся к этой температуре жидкости одновременно кристаллизуютсякомпоненты А и В:
На кривой охлаждения образуется площадка 2-2. Структура сплавапосле охлаждения состоит из зерен компонента А и эвтектики. По мере охлаждения сплава между точками I и 2 жидкость меняет свою концентрацию по линии AЕ. Чтобы определить состав твердой и жидкой фаз при заданной температуре t1 сплава I (рис.4), необходимо через точку t1провести коноду, т. е. прямую линию, параллельную оси концентрации, до пересечения с линиями диаграммы и точки пересечения спроектировать на ось концентрации. Точка пересечения l c линией ликвидус покажет концентрацию компонентов А и В в жидкой фазе, точка S – в твердой (чистый компонент А). Соотношение масс фаз при заданной температуре можно определить по правилу отрезков. Правило отрезков. Массы фаз относятся между собой как обратная пропорция отрезков коноды. Например, при температуре t1 сплав I имеет 2 фазы: жидкую и твердую с количеством масс QЖ и QТВ, соотношение фаз определится выражением (I), а количество жидкой и твердой фаз – соотношениями (2) и (3):
где Р – общая масса сплава. Сплав II – эвтектический. Критическая точка Е - компоненты А и В кристаллизуются одновременно при постоянной температуре:
Присутствуют 3 фазы: жидкость эвтектического состава, компоненты А и В. На кривой охлаждения образуется площадка 1-1. Структура сплава после охлаждения состоит из эвтектики (смеси кристаллов компонентов А и В). Сплав III – заэвтектический. Критическая точка 1 – начало кристаллизации компонента В. Фазы две: жидкость, кристаллы компонента В. По мере охлаждения сплава жидкость меняет концентрацию по линии ликвидус ЕС. Например, при t2 состав жидкости определится точкой n, спроектированной на ось концентраций, а состав твердой фазы – проекцией точки m. Критическая точка 2 – кристаллизация эвтектики, т. е. из оставшейся к этой температуре жидкости при постоянной температуре кристаллизуются оба компонента:
Структура сплава после охлаждения состоит из зерен компонента В и эвтектики. Правило фаз Гиббса устанавливает зависимость между числами фаз системы, ее компонентов и степеней свободы:
где С – число степеней свободы, или вариантность системы; К – число компонентов системы; Ф – число фаз, находящихся в равновесии в данной критической точке. Под числом степеней свободы понимается число независимых параметров системы, которые можно изменить, не изменяя равновесия, например, температуру без изменения числа фаз. Так как степень свободы не может быть меньше нуля и дробным числом, то
Следовательно, в двойной системе в равновесии может находиться не более трех фаз, в тройной – не более четырех и т. д. Например, определим число степеней свободы у сплава I в 1-й критической точке (рис.4):
т. е. с изменением температуры между точками 1-2 число фаз не изменяется, а происходит переход одной фазы (жидкости) в другую (компонент А). Во второй точке
т. е. процесс кристаллизации эвтектики идет при постоянной температуре, система нонвариантна. Изменение температуры ведет к изменению количества фаз. Диаграмма состояния сплавов, компоненты которой растворимы
Рис. 5. Диаграмма состояний сплавов, компоненты которой неограниченно растворимы в жидком состоянии, нерастворимы в твердом и при кристаллизации образуют устойчивое химическое соединение
Диаграмма рассматривается как совокупность двух диаграмм состояния, где в роли компонента выступает химическое соединение: I часть диаграммы – компоненты А и АтВn; II часть диаграммы – компоненты В и АтВn. Обе части диаграммы характеризуются неограниченной растворимостью в жидком состоянии. В твердом состоянии они нерастворимы, при кристаллизации образуется эвтектическая смесь, состоящая из кристаллов компонента и химического соединения. Диаграмма состояний сплавов, компоненты которой неограниченно растворимы друг в друге в жидком и твердом состояниях (рис.6):
Рис. 6. Диаграмма состояния сплавов, компоненты которой неограниченно растворимы друг в друге в жидком и твердом состояниях
АnВ – ликвидус, начало кристаллизации твердого раствора; АтВ – солидус, конец кристаллизации твердого раствора.
Кристаллизация и структурообразование сплавов (I) Критическая точка 1 – начало кристаллизации твердого раствора α:
Критическая точка 2 – конец кристаллизации твердого раствора α. При кристаллизации в интервале температур между точками 1-2 жидкая и твердая фазы изменяют состав. Изменение концентрации жидкости определяется линией ликвидус АnВ, а концентрации твердого раствора – линией солидус АmВ. Например, в сплаве I при температуре t1 состав жидкой фазы соответствует точке c, твердой – точке d, спроектированными на ось концентраций. По правилу отрезков количество твердой фазы
Структура сплава: зерна однородного твердого раствора α. Диаграмма состояния сплавов, компоненты которой неограничен
Рис. 7. Диаграмма состояния сплавов, компоненты которой неограниченно растворимы в жидком состоянии, ограниченно в твердом и при кристаллизации образуют смесь (эвтектику)
АЕС – ликвидус; АВЕFС – солидус; АЕ – начало кристаллизации твердого раствора α; АВ – конец кристаллизации твердого раствора α; ЕС – начало кристаллизации твердого раствора β; СF – конец кристаллизации твердого раствора β; ВМ – ограничение растворимости компонента В в кристаллической решетке компонента А. FN – ограничение растворимости компонента А в кристаллической решетке компонента В. Точки В, F – максимальная растворимость компонентов друг в друге. Диаграмма отличается от диаграммы (рис.4) наличием двух областей граничных твердых растворов α и β. Компоненты в чистом виде в сплавах этой системы макроскопически не присутствуют, а находятся только в виде твердых растворов α и β. Кристаллизация и структурообразование в сплавах, состав которых находится в интервале проекций точек В и F диаграммы (рис.7) на ось концентраций, происходят аналогично ранее рассмотренным примерам диаграммы с нерастворимыми в твердом состоянии компонентами, только вместо компонентов А и В присутствуют твердые растворы α и β.
Кристаллизация и структурообразование сплавов IV (V) Критическая точка 1 – начало кристаллизации твердого раствора. α (β ), две фазы: жидкость и α (β ). В интервале температур между точками 1 и 2 идет кристаллизация:
Критическая точка 2 – конец кристаллизации α (β ), в структуре сплава осталась одна фаза – α (β ). В интервале температур между точками 2 и 3 – охлаждение твердого раствора α (β ). За счет снижения растворимости твердый раствор становится насыщенным. Критическая точка 3 – начало выделения вторичного твердого раствора β II(α II) из пересыщенного твердого раствора α (β ) вследствие уменьшения растворимости компонентов при снижении температуры. В интервале температур между точкой 3 и комнатной выделяется вторичный твердый раствор β II(α II). В структуре сплава две фазы: IV –
Порядок выполнения работы
Работа выполняется звеньями (по два-три студента в каждом звене). 1. Изучить учебное пособие. 2. Получить жидкий сплав одного из составов (разд.2), установить термопару в кварцевый наконечник, погруженный в сплав, записать показания температуры через 30 с. Замер прекратить при температуре 140°С. 3. Построить по полученным данным кривую охлаждения сплава в координатах температура-время (рис.1). 4. Определить критические точки по перегибам кривой охлаждения, т. е. температуру начала и конца кристаллизации, отметить их на графике. 5. Указать в таблице критические точки сплавов, определенные другими звеньями студентов. 6. Построить диаграмму состояния олово-цинк (рис.2): а) отложить на левой вертикали температуру кристаллизации олова – 232°С; б) отложить на правой вертикали температуру кристаллизации цинка – 419°С; в) найти положение сплава эвтектического состава и отметить температуру его кристаллизации; г) найти положение сплавов доэвтектического и заэвтектического составов и отметить точки начала и конца кристаллизации; д) соединить плавной кривой все точки начала кристаллизации и прямой линией – точки конца кристаллизации. 7. Выполнить индивидуальное задание.
Содержание отчета
1. Цель работы. 2. Кривая охлаждения заданного сплава. 3. Диаграмма состояния олово-цинк, на которой указаны: а) линии ликвидус и солидус данной системы; б) линия начала кристаллизации олова и цинка; в) линия кристаллизации эвтектики; г) эвтектическая точка. 4. Структура сплавов доэвтектического, заэвтектического и эвтектического составов (рис. 3). 5. Индивидуальное задание: а) зарисовать данную преподавателем диаграмму состояния; б) установить тип данной диаграммы; в) определить структурный и фазовый состав различных ее областей; г) определить положение сплава, данного преподавателем, на диаграмме состояния; д) определить его критические точки, число степеней свободы в каждой критической точке по правилу фаз Гиббса и построить кривую охлаждения в координатах температура-время; е) определить концентрацию компонентов в твердой и жидкой фазах по правилу отрезков, а также весовое количество фаз при заданной температуре; ж) определить структуру заданного сплава.
6. Контрольные вопросы
1. Что такое диаграмма состояния? 2. Какой метод положен в основу построения диаграммы олово-цинк? 3. Что называется компонентом, фазой? 4. Как определяется концентрация фаз? 5. Как определяется соотношение масс фаз? 6. Каковы особенности эвтектического сплава? 7. Нарисовать диаграмму состояния с ограниченной и неограниченной растворимостью компонентов в твердом состоянии и проставить все фазы. 8. Нарисовать диаграмму состояния, когда компоненты не растворяются друг в друге, когда образуется устойчивое химическое соединение, проставить все фазы. 9. Как определяется число степеней свободы в критических точках?
Лабораторная работа № 2 Цель работы 1. Ознакомиться с микроанализом, устройством и работой металлографического микроскопа. 2. Приобрести навыки анализа структуры и свойств железоуглеродистых сплавов в равновесном состоянии.
Приготовление микрошлифов Вырезка. Вырезка образца из детали обычно производится механическим способом в необходимом для исследования месте, не допуская разогрева и пластической деформации, которые могут изменить структуру металла. Шлифование. Исследуемая плоскость образца шлифуется сначала на шлифовальном круге, затем шлифовальной бумагой разных номеров с последовательно уменьшающимися размером абразивных зерен вручную или на вращающихся плоских дисках. При переходе на более мелкозернистую бумагу шлиф каждый раз поворачивают 90° вокруг оси и шлифуют до исчезновения поперечных рисок. От остатков абразива шлиф очищают промывкой водой. Полировка. До зеркального блеска шлиф полируется на бархате или сукне, на которые наносят окись хрома или алюминия, поддерживая достаточную влажность. После полировки шлиф промывают в воде, а затем в этиловом спирте, чтобы предупредить окисление поверхности. Более совершенным методом является электролитическое полирование. Под действием электрического тока выступы на шлифуемой поверхности растворяются, и она постепенно становится зеркальной. Травление. Травление шлифов производится для выявления структуры, т.к. на нетравленом шлифе видны только поры, трещины и неметаллические включения. Для травления стали и чугуна наиболее часто применяется 3…5%-ный раствор азотной кислоты в этиловом спирте. Продолжительность травления 10...20с. Затем шлиф тщательно промывается спиртом и сушится фильтровальной бумагой. При травлении границы зерен и сами зерна, имеющие различную кристаллографическую ориентировку или фазовый состав, растворяются под действием реактива неодинаково. Сильнее протравившиеся зерна имеют шероховатую поверхность и при отражении в большей степени рассеивают световые лучи. Поэтому под микроскопом одни зерна выглядят более темными, другие - более светлыми. Границы зерен обладают повышенной энергией, так как являются дефектами кристалла с неправильной упаковкой атомов, растравливаются сильнее самих зерен, и поэтому под микроскопом кажутся темными линиями. После травления поверхность шлифа имеет сложный микрорельеф, который характеризует строение металла.
Определение величины зерна Размер кристаллических зерен определяется на протравленным микрошлифе. Величина зерна – один из факторов, влияющих на свойство сплавов. С укрупнением зерна понижаются ударная вязкость и прочность металлов и сплавов. Величина зерен под микроскопом определяется двумя методами: визуальной оценкой и непосредственным подсчетам числа зерен на единице площади шлифа. Размер зерна оценивается соответствующим номером при общем увеличении микроскопа х100 (ГОСТ 5630-69).
Определение балла неметаллических включений Неметаллические включения изучают на зеркальной непротравленной поверхности при увеличении х100. Тип неметаллических включений, их балл, площадь, занимаемая включениями, определяется по шкале ГОСТ 1778-57.
Двухфазные составляющие В системе железо-углерода имеются две двухфазных структурных составляющих: перлит и ледебурит. Перлит – эвтектоидная смесь феррита и цементита пластинчатого строения с содержанием углерода 0, 8%, образуется из аустенита при постоянной температуре на линии эвтектоидного превращения РSК по реакции Аs®Фр + Цк и находится при этой температуре в равновесии с аустенитом состава точки S. Ледебурит – эвтектическая смесь образуется из жидкости при постоянной температуре на линии эвтектического превращения ЕСF по реакции Жс® АE+ЦF, содержит 4, 3% С и состоит в интервале температур от линии ЕСF до линии РSК из смеси аустенита и цементита, а при температуре ниже линии РSК из перлита и цементита. На линии ЕСF ледебурит находится в равновесии с жидкостью состава точки С. При комнатной температуре ледебурит состоит из пластин цементита, в которых расположены столбики перлита.
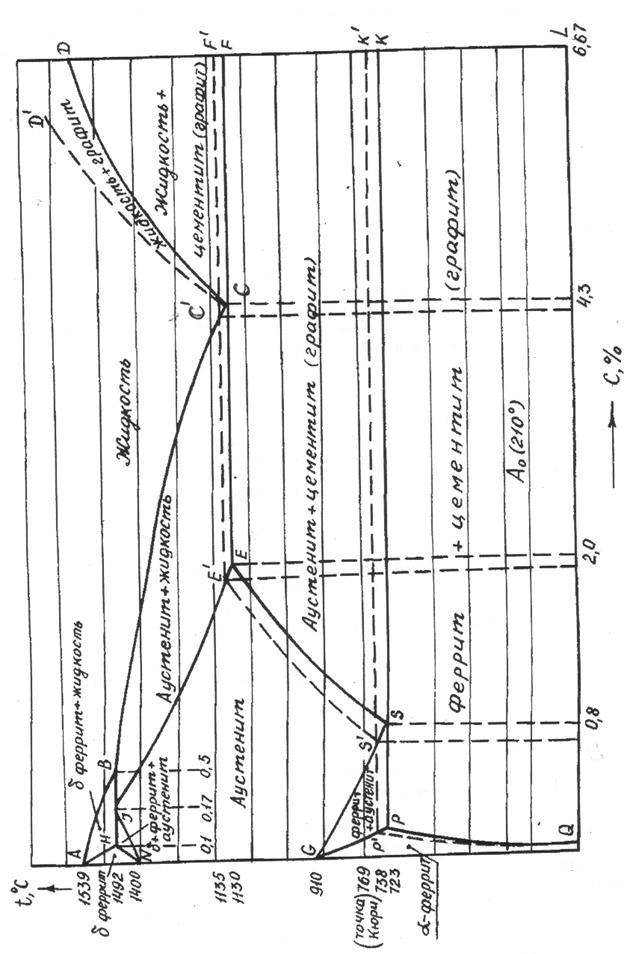
Рис. 2. Структура железо-углеродистых сплавов в равновесном состоянии: а, б, в) доэвтектоидные сплавы; г) эвтектоидный сплав; д)заэвтектоидный сплав Диаграмма железо-углерод Диаграмма железо – углерод (рис.3), изображаемая сплошными линиями, является метастабильной диаграммой железо-цементит, а диаграмма, изображаемая пунктирными линиями, является стабильной диаграммой железо-графит. АВСД (АВС¢ Д¢ ) – линия ликвидус в метастабильной (стабильной) диаграмме. АНJЕСF (АНJЕ¢ С¢ F¢ ) – линия солидус в метастабильной (стабильной) диаграмме. АВ и АН – линии начала и конца кристаллизации феррите. ВС (ВС¢ ) и JE (JЕ¢ ) – линии начала и конца кристаллизации аустенита в метастабильной (стабильной) диаграмме. HJB – линия перитектического превращения. Точка Jявляется перитектической точкой. ECF(E¢ C¢ F¢ ) – линия эвтектического превращения в метастабильной (стабильной) диаграмме. NH и NJ – линии начала и конца полиморфного превращения d-феррита в аустенит. СД (С¢ Д¢ ) – линии начала кристаллизации цементита (графита) в метастабильной (стабильной) диаграмме. С (С¢ ) – эвтектическая точка в метастабильной (стабильной) диаграмме. ЕS (E¢ S¢ ) – линии ограниченной растворимости углерода в аустените в метастабильной (стабильной) диаграмме. РQ (Р¢ Q¢ ) – линия ограниченной растворимости углерода в феррите в метастабильной (стабильной) диаграмме.
Порядок выполнения работы 1. Изучить учебное пособие. 2. Ознакомиться с устройством микроскопа и установить увеличение х80 или х130. 3. Определить величину зерна в образце 1 методом визуального сравнения (ГОСТ 5630-65) и зарисовать его в квадратах 25х25 мм. 4. Определить тип неметаллических включений на образце 4 (ГОСТ 1778-57) и зарисовать. 5. Вычертить диаграмму состояния железо-углерод на развернутом листе бумаги. 6. Зарисовать условно структуру доэвтектоидных сплавов с различным количеством углерода (3 шт.), эвтектоидного и заэвтектоидного сплавов. 7. Определить количество углерода в образцах доэвтектоидной стали (ГОСТ 1050-74). 8. Установить взаимосвязь между углеродом и свойствами сплавов, построить графики по данным табл. 1 (справочные материалы). 9. Выполнить индивидуальное задание.
Содержание отчета 1. Цель работы. 2. Диаграмма железо-углерод. 3. Схематическая зарисовка изучаемых структур стали. 4. Графики зависимости прочности, твердости, пластичности от количества углерода. 5. Выполнение индивидуального задания. Образец выполнения приведен в приложении.
8. Контрольные вопросы 1. Что изучается с помощью микроанализа? 2. Как определяется увеличение микроскопа МИМ-7. 3. Перечислить основные операции при подготовке микрошлифа. 4. Для чего используются протравленные и непротравленные шлифы? 5. Что понимается под равновесным состоянием сплава? 6. Перечислить и дать характеристику твердых растворов системы железо-углерод. 7. Дать характеристику эвтектоидной и эвтектической смесей в системе железо-углерод. 8. Что такое перлит и ледебурит? При каких условиях они образуются? 9. Какие фазы наблюдаются при температуре, соответствующей линиям РSК, ЕСF, PQ, ЕS? 10. Сколько углерода содержит каждая из фаз, присутствующая при температуре 723°С (линии РSК) и 1130°С (линия ЕСF)? 11. Применить правило отрезков в двухфазных областях диаграммы железо-углерод и построить кривую охлаждения для одного сплава. 12. Применить правило фаз Гиббса в критических точках диаграммы железо-углерод. 13. Зарисовать структуру стали 40, У10, У8 и технически чистого железа. 14. Как определить марку доэвтектоидной стали по структуре? 15. Как зависит твердость, прочность и пластичность стали от содержания углерода? Лабораторная работа № 3 И применение чугунов
Цель работы
1. Изучить превращения в области чугунов диаграммы железо-углерод. 2. Приобрести навыки изучения микроструктур белых и серых чугунов. 3. Изучить зависимость свойств чугунов от их структуры.
Белые чугуны Белые чугуны образуются при быстром охлаждении и их структура описывается метастабильной диаграммой. Структура белых чугунов зависит от содержания углерода и они классифицируются по структуре и содержанию углерода следующим образом: чугуны с содержанием углерода до 4, 3% (левее точки С) называются доэвтектическими, с содержанием углерода 4, 3% (точка С) – эвтектическими, с содержанием углерода более 4, 3% (правее точки С) – заэвтектическими.
Эвтектический белый чугун. Сплав 2. В точке С при постоянной температуре 1130°С происходит кристаллизация жидкости по реакции Жс®АЕ +ЦF. Образующаяся смесь аустенита и цементита называется ледебуритом и представляет собою пластины цементита со столбиками аустенита в них. После окончания кристаллизации сплав будет охлаждаться далее. Содержание углерода в столбиках аустенита при охлаждении будет уменьшаться по линии SЕ. На линии PSK аустенит будет содержать 0, 8% (т.S) и распадается на перлит. Ниже линии РSК ледебурит будет состоять из пластин цементита и столбиков перлита в них. Пример структуры ледебурита изображен на рис. 2.
Рис. 2. Микроструктура ледебурита (а) и ее схематическое изображение (б)
Доэвтектический белый чугун. Сплав 1. Чуть ниже линии АС (рис. 2) в жидкости возникают и растут зародыши аустенита. При произвольной температуре t состав аустенита определяется проекцией точки m, а жидкости – точки n на ось концентраций, то есть состав аустенита в процессе кристаллизации изменяется по линии солидус АЕ, а состав жидкости – по линии ликвидус АС. Количество аустенита и жидкости при температуре t определяется, как

Рис. 3. Микроструктура белого доэвтектического чугуна и ее схематическое изображение
Заэвтектический белый чугун. Сплав 3. Ниже линии СД (рис. 1) в сплаве будет происходить кристаллизация цементита первичного в виде пластин. При произвольной температуре t состав жидкости определяется проекцией точки k на ось концентрации, то есть состав жидкости изменяется по линии ликвидус СД. Количество жидкости и цементита первичного при температуре
Рис. 4. Микроструктура белого заэвтектического чугуна и ее схематическое изображение Применение белых чугунов В своей структуре белые чугуны содержат большое количество цементита, обладающего высокой твердостью, прочностью, хрупкостью и имеющего белый цвет, чем и обусловлен цвет и название белых чугунов. Так, например, в сплаве 3 при комнатной температуре количество цементита в структуре равно Белый доэвтектический чугун также используется в виде заготовок среднего литья, отжигаемых впоследствии на ковкий чугун. Серые чугуны В серых чугунах часть углерода находится в свободном состоянии в виде стабильной фазы-графита и поэтому в серых чугунах кристаллизация и структурообразование происходят при медленном охлаждении по стабильной диаграмме железо-углерод. (рис. 5).
Рис. 5. Часть стабильной диаграммы сплавов Fе–С, отражающая процессы кристаллизации и структурообразования в серых чугунах Ниже линии АС¢ в жидкости происходит кристаллизация аустенита, причем содержание углерода в жидкости изменяется по линии АС¢, а в аустените – по линии АЕ¢. И когда сплав 1 охладится до линии Е¢ С¢ F¢ оставшаяся жидкость будет иметь состав С¢. В сплаве 3 при медленном охлаждении ниже линии С¢ Д¢ в жидкости будет происходить кристаллизация графита в виде столбиков. Из-за различной плотности графита и жидкости столбики графита будут всплывать в верхнюю часть отливки и поэтому в структуре не наблюдается. Содержание углерода в жидкости будет изменятся по линии С¢ Д¢ и когда сплав 3 охладится до линии Е¢ С¢ F¢ жидкость будет иметь состав точки С¢. Таким образом, независимо от содержания углерода, жидкость на линии Е¢ С¢ F¢ будет иметь состав точки С¢. При медленном охлаждении, немного ниже линии Е¢ С¢ F¢ при постоянной температуре в жидкости происходит совместная кристаллизация аустенита и графита по реакции Графитовые включения кристаллизуются в виде розеток с тремя, четырьмя искривленными лепестками. После окончания процесса кристаллизации АЕ¢ и Г сплав будет охлаждаться далее, растворимость углерода в аустените уменьшается по линии Е¢ S¢, лишний углерод уходит из аустенита на ранее образовавшиеся графитные включения, наслаиваясь на них и увеличивая их размеры. При охлаждении сплава до линии Р¢ S¢ К¢ содержание углерода уменьшится до 0, 7% (т. S¢ ).
Рис. 6. Микроструктура серого чугуна с крупнопластинчатым графитом и ее условная зарисовка: а – на ферритной основе; б – на феррито-перлитной основе; в – на перлитной основе
При очень малой скорости охлаждения или даже выдержки в интервале температур 738…723°С произойдет полное превращение аустенита в феррит и получится ферритная металлическая основа с графитными включениями, то есть структура феррит+графит (рис. 6а) – серый чугун на ферритной основе, имеющий низкие механические свойства – малую выносливость и хрупкость. При большей, промежуточной, скорости охлаждения часть аустенита, находящегося около графитных включений при охлаждении в интервале температур между линиями Р¢ S¢ К¢ и РSК, превратится в феррит, а оставшаяся часть аустенита, находящаяся дальше от графитовых включений, переохладится ниже линии РSК и распадется на перлит. Получится серый чугун на феррито-перлитной основе с графитовыми включениями (рис. 6б), имеющий небольшие, но более высокие, чем предыдущий сплав, механические свойства. При большой скорости охлаждения превращение аустенита в феррит в интервале температур между линиями Р¢ S¢ К¢ и РSК произойти не успеет, аустенит переохладится ниже линии РSК, распадется на перлит и получится перлитная металлическая основа с графитными включениями, то есть структура перлит+графит (рис. 6в). Это наилучший вид литейного серого чугуна, который может быть использован также как антифрикционный сплав для подшипников скольжения. Таким образом, при кристаллизации и структурообразовании серых чугунов независимо от содержания углерода в сером чугуне получаются структуры, изображенные на рис. 6, из анализа которых можно сделать вывод о том, что металлическая основа серых чугунов похожа на структуру технического железа, доэвтектоидной и эвтектоидной стали и, следовательно, серые чугуны можно рассматривать, как стали с графитными включениями. Популярное:
|
Последнее изменение этой страницы: 2016-03-15; Просмотров: 1984; Нарушение авторского права страницы