
|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |

|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |
Для описания свойств реальных газов
Удивительно, что при всей простоте уравнения Ван-дер-Ваальса, оно дает ясное, качественно правильное описание превращений в системе жидкость-газ. Однако в количественном отношении предсказания на его основе отклоняются от экспериментальных результатов:
• Исходное положение о том, что параметры a и b являются константами для каждого вещества, не оправдалось. Установлено, что они зависят от температуры. • Полученное значение критического параметра меньше чем экспериментальное значение • Соотношение • В области сильно сжатых газов и жидкостей, включая область двухфазных состояний, уравнение Ван-дер-Ваальса не имеет теоретического обоснования и приводит к значительным количественным расхождениям с опытом.
14.3. Внутренняя энергия газа Ван-дер-Ваальса Внутренняя энергия газа может быть представлена суммой кинетической энергии молекул, зависящей от температуры, и потенциальной энергии взаимного притяжения частиц. Если предположить, что теплоемкость Мерой потенциальной энергии притяжения является работа (с противоположным знаком), которую надо затратить для того, чтобы развести молекулы на бесконечно большое расстояние друг от друга. Молярную работу против сил внутреннего давления газа рассчитаем как макроскопическую работу
соответственно
Таким образом, внутренняя энергия одного моля газа Ван-дер-Ваальса определяется формулой
где Выражение для энергии (14.11) можно получить и чисто термодинамическим методом согласно (12.25) на основе термического уравнения состояния газа (14.1). Для
Отметим, что полученные выражения для энергии газа Ван-дер-Ваальса справедливы только для физически однородного вещества. Для двухфазных состояний они не применимы. Хотя иногда используются для количественных оценок некоторых параметров. Анализ формул (14.11) и (14.12) показывает, что при расширении газа в вакуум в условиях адиабатической изоляции, он охлаждается. Подобное явление не может произойти в идеальном газе. В реальном газе это происходит потому, что хотя газ и не совершает работу против внешних сил. Он совершает работу против внутренних сил молекулярного притяжения за счет уменьшения средней кинетической энергии частиц. Вследствие этого температура газа понижается.
14.4. Эффект Джоуля-Томсона
Основные определения
Многолетние совместные исследования Джоуля и В.Томсона (с 1852 по 1862 гг.) позволили им не только экспериментально подтвердить зависимость внутренней энергии реального газа от его объема. Было открыто важное физическое явление, получившее название эффекта Джоуля-Томсона. Явление заключается в изменении температуры реального газа при его медленном протекании через пористую перегородку (пробку) в условиях адиабатической изоляции. Стационарное течение газа через пробку называется процессом Джоуля-Томсона, а изменение температуры газа при таком течении дифференциальным эффектом Джоуля-Томсона. Наряду с дифференциальным эффектом существует также интегральный эффект Джоуля-Томсона. Интегральный эффект наблюдается в процессе дросселирования газа, т.е. протекания его через вентиль (малое отверстие), по разные стороны которого давление отличается на несколько порядков, т.е. в сотни или тысячи раз. Если газ при расширении охлаждается Описание процесса Джоуля-Томсона
В опыте используется теплоизолированная трубка, разделенная посередине пористой перегородкой, например, пробкой из ваты. По обе стороны пробки находится реальный газ (рис. 14.2). Под действием разности давлений, создаваемой с помощью поршней П1 и П2, исследуемый газ медленно протекает через пробку из одной части трубки в другую. Давление газа
 , а по другую – постоянная температура , а по другую – постоянная температура 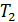 . Для измерения . Для измерения  и и 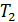 обычно используют термопары. обычно используют термопары.Несмотря на медленность течения, этот процесс необратим, так как система в целом не является равновесной. Энтропия в изолированной системе возрастает. Попробуем разобраться, какая функция состояния в этом процессе остается неизменной. Пусть один моль газа при давлении Запишем уравнение первого начала термодинамики применительно к рассматриваемому процессу с учетом наличия теплоизолирующей оболочки
или, что, то же самое,
Посмотрите внимательно на выражение (14.14). Узнаёте? Конечно, здесь написано, что энтальпия «до того» равно энтальпии «после того». Таким образом, в процессе Джоуля-Томсона
Полученное условие постоянства энтальпии является принципиально важным для вычисления эффекта Джоуля-Томсона.
Сущность эффекта Джоуля-Томсона Природу этого эффекта можно понять на основе анализа зависимости потенциала межмолекулярного взаимодействия от расстояния между частицами (рис. 13.2). Наличие минимума на кривой Леннарда-Джонса указывает на то, что слева от Поскольку сумма потенциальной энергии взаимодействия и кинетической энергии величина постоянная, то получаем простое соотношение
Теперь рассмотрим два случая. 1. Пусть температура газа
2. Пусть температура газа
Следовательно, один и тот же газ при одних условиях (
Расчет дифференциального эффекта Джоуля-Томсона
Получим формулу эффекта Джоуля-Томсона методом термодинамических потенциалов. Выберем в качестве независимых переменных
Сделаем замену
Последнее равенство получается из (12.10) и соотношения Максвелла, имеющего вид
Окончательно из (14.16) получаем
Это и есть искомая формула для дифференциального эффекта Джоуля-Томсона. Температура, при которой Вычисление величины эффекта по формуле (14.17) неизбежно связано с вычислением производной
Приравняв к нулю правую часть (14.18), получим температуру инверсии газа Ван-дер-Ваальса:
Температура инверсии определяется индивидуальными параметрами исследуемого газа. Если температура газа больше чем Для большинства газов Для таких газов как водород и гелий
Расчет интегрального эффекта Джоуля-Томсона Процесс дросселирования газа не является равновесным процессом. Однако начальное и конечное состояния газа являются равновесными и полностью определяются заданием энтальпии и давления. При вычислении изменения температуры реального процесса его заменяют идеальным квазистатическим процессом, происходящим при постоянной энтальпии. Другими словами, интегральный эффект Джоуля-Томсона представляют непрерывной последовательностью дифференциальных эффектов. При таком подходе получаем выражение
Это и есть формула интегрального эффекта. В ряде случаев интегральный эффект можно рассчитать непосредственно на основе условия (14.15). Запишем энтальпию газа Ван-дер-Ваальса до дросселирования и после него и приравняем эти величины:
Формула (14.21) описывает интегральный эффект для газа Ван-дер-Ваальса. Из условия
Кривая инверсии изображена на рис. 14.3. Как видно с увеличением плотности газа
Рис. 14.3.
У достаточно разреженного газа температура инверсии равна Величина интегрального эффекта может достигать десятков и сотен Интегральный эффект Джоуля-Томсона имеет очень важное практическое значение: наряду с адиабатическим расширением этот эффект используется для получения низких температур.
14.5. Методы получения низких температур
Формирование представлений о низких температурах, их получение и измерение относится к началу XVIII века. Однако прошло почти два века прежде чем низкие температуры стали мощным инструментом исследования вещества. Началом физики низких температур как раздела физики, изучающего свойства вещества и процессы при температурах вблизи абсолютного нуля, следует считать 1908 год. Именно в этом году в Лейденской криогенной лаборатории под руководством Х.Камерлинг-Оннеса было осуществлено сжижение гелия и началось исследование свойств различных веществ при гелиевых температурах (4, 2 ÷ 1 К настоящему времени в физике сложилась следующее подразделение основных температурных диапазонов: 1. Криогенные температуры – Т < 80 2. Низкие температуры – Т < 0, 3 3. Сверхнизкие температуры – 10-3 ÷ 10-6 На схеме 14.5.1. представлены методы получения криогенных температур в различных интервалах. Схема14.5.1.
Широкий спектр проблем получения криогенных температур и способы их решения представлены в книге Петра Леонидовича Капицы [7] в главе «Криогенная техника». Остановимся более подробно на обсуждении двух наиболее распространенных методах получения криогенных температур.
Популярное:
|
Последнее изменение этой страницы: 2016-03-17; Просмотров: 1436; Нарушение авторского права страницы