Характеристика простых и кратных связей
| Молекула
| Связь
| Длина связи нм.
| Энергия связи кДж/моль
|
| C2H6
|  C C C C
| 0, 154
|
|
| C2H4
| C == C
| 0, 135
|
|
| C2H2
| C  C C
| 0, 120
|
|
ВОПРОС 4. Донорно-акцепторный механизм образования связи.
В методе валентных связей различают обменный и донорно-акцепторный механизмы образования химической связи. По обменному механизму в образовании электронной пары участвуют по одному электрону от различных атомов. По донорно-акцепторному механизму химическая связь возникает за счет двухэлектронного облака одного атома и свободной орбитали другого, соответственно атом, предоставляющий для связи пару электронов является донором, а предоставляющий свободную орбиталь – акцептором.
Рассмотрим механизм образования иона аммония NH4+
NH3 + H+ = NН+4
Н - е = Н 
У иона водорода Н+. вакантна (свободна) 1s орбиталь. В молекуле аммиака азот имеет неподеленную пару электронов. При сближении аммиака с ионом водорода, двухэлектронное облако атома азота становится общим, т.е. превращается в молекулярное электронное облако. Возникает 4-я ковалентная связь. Заряд иона водорода при этом делокализуется между всеми атомами.
Схематично это можно представить:

 Атом азота, представляющий для связи двухэлектронное облако (неподеленную пару) является донором, а ион водорода, предоставляющий вакантную орбиталь - акцептором. Все четыре связи равноценны, однако, часто выделяют в формуле связь по донорно-акцепторному механизму стрелкой, направленной от донора к акцептору [Н← NH3]+.
Атом азота, представляющий для связи двухэлектронное облако (неподеленную пару) является донором, а ион водорода, предоставляющий вакантную орбиталь - акцептором. Все четыре связи равноценны, однако, часто выделяют в формуле связь по донорно-акцепторному механизму стрелкой, направленной от донора к акцептору [Н← NH3]+.
Аналогично осуществляется взаимодействие аммиака с трифторидом бора, неподеленная электронная пара аммиака занимает вакантную орбиталь фторида бора (а точнее бора) BF3*NH3.
Разновидностью донорно – акцепторной связи является дативная связь, при которой и донором и акцептором электронной пары являются атомы одного итого же элемента, что приводит к упрочнению молекулы. 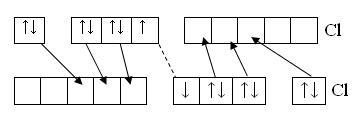
Например, в молекуле F2 энергия связи –148 кДж/моль, а в молекуле Сl2 – 240кДж/моль. Объяснение повышенной энергии связи в молекуле хлора состоит в том, что неподеленные электронные пары одного атома заполняют свободные 3d орбитали другого атома. В результате чего образуется донорно – акцепторная связь:
Cl ® Cl
5.Определение валентности по методу валентных связей (МВС).
В соответствии с методом ВС валентность атома равна числу его неспаренных электронов плюс число связей, образованных по донорно – акцепторному механизму. С этой позиции валентности атомов элементов 2-го периода системы элементов Д.И.Менделеева объясняют следующим образом. Первый энергетический уровень заполнен (1s) и не может внести вклад в валентность атома. Ответственными за образование хим. связей являются электроны второго (внешнего) уровня:
По числу одиночных электронов делаем вывод о том, что литий одновалентен Li (1), а бериллий нульвалентен Ве (0), только при возбуждении атома бериллия, связанного с затратой энергии (Ве + 324 кДж/моль® Ве*), происходит разделение его электронной пары, бериллий становится способным проявлять валентность равную двум Ве*(2). При этом у электронов, ставших одиночными, спины сохраняют свое направление.
В результате из одного двухэлектронного облака образуется два одноэлектронных валентных облака. При этом энергия затрачивается и атом переходит в возбужденное состояние.
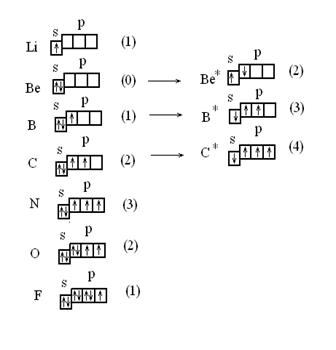
Однако, эти затраты затем с избытком компенсируются за счет образования атомом двух дополнительных химических связей.
В нормальном состоянии бор - одновалентен, при возбуждении
( В + 531кДж/моль → В*) трехвалентен.
Атом азота может иметь 5 электронов, но не может быть 5-ти валентным. Для этого потребовалось бы перевести один из электронов на следующий. - третий энергетический уровень, что связано с большими затратами энергии, которые не смогут быть компенсированы энергией, выделяющейся при образовании связей. Теперь должны быть понятны структурные формулы НNO3.

Вопрос 6. Гибридизация атомных орбиталей (АО). Делокализованная π - связь. Американский ученый Линус Полинг предложил понятие о гибридизации атомных орбиталей. В 1954 г. Линусу Полингу присуждена Нобелевская премия " За исследования природы химической связи и ее применения для определения структуры сложных соединений".
В результате комбинации различных орбиталей ( s, p, d и т.д), смешивания их и выравнивания по форме и энергии, возникают новые атомные орбитали промежуточной формы, которые называются гибридными.
Гибридная орбиталь имеет грушевидную форму и сильно вытянута по одну сторону от ядра.
Химическая связь гибридными орбиталями более прочная, чем не гибридной, т.к. происходит большее перекрывание.
sp-гибридизация возникает при образовании атомом двух связей за счет электронов, находящихся на s и p орбиталях, и обладающих близкой энергией.
Рассмотрим на примере возбужденного атома Ве, имеющего валентные электроны 2s¹ 2p¹
Получающиеся гибридные sp - орбитали расположены на одной прямой линии под углом 180 градусов.
Отсюда легко объяснить прямолинейность молекулы BeCl2. Атом Ве подвергается sp-гибридизации и образует две гибридные связи с двумя атомами хлора, у каждого из которых по одному неспаренному р-электрону, которые являются валентными.


Такой направленностью двух АО объясняют угол между связями, образуемыми атомами Ве, Mg, Ca, Zn, Cd, Hg, C, в CO2 и C2H2.
В молекуле ацетилена в гибридизации участвуют только s и p
орбитали углерода, образующие с атомами водорода σ - связи, углы между которыми составляют 180 градусов.
sp² -гибридизация наблюдается, тогда когда в гибридизации участвуют
одна s и 2p орбитали. Комбинируясь друг с другом три различные АО
образуют 3 гибридные орбитали. В результате получается три равноценных гибрида, расположенных под углом 120 градусов, относительно центра координат.

s +2p 3sp2
Такой тип гибридизации объясняет расположение всех трех связей в молекуле ВCl3.У атома бора электронная структура 1s² 2s² 2p¹ .В возбужденном состоянии 1s² 2s¹ 2p². В гибридизации участвуют орбитали одного s и двух p электронов, что приводит к образованию трех гибридных орбиталей, расположенных под углом 120 градусов.
Молекула BCl3 имеет форму плоского равностороннего треугольника с атомом B в центре. Угол между осями гибридных орбиталей составляет 120 градусов. Все 4 атома лежат в одной плоскости.
Плоская треугольная формула молекулы BCl3.
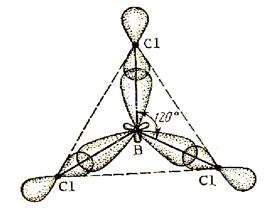
sp2- гибридизация наблюдается в алкенах.
s p3-гибридизация возникает, если в химических связях участвуют четыре атомные орбитали (s + 3p) одного атома и в результате их гибридизации образуются четыре эквивалентные sp3-орбитали. От центра атома они расходятся под углом 109˚ 28´.

Подобный тип гибридизации имеется в атомах углерода, входящих в молекулы предельных углеводородов. В результате перекрывания 4-х гибридных sp3-орбиталей атома углерода и s-орбиталей 4-х атомов водорода образуется прочная молекула метана с четырьмя одинаковыми связями.
В молекулах алканов наблюдается sp3-гибридизация.

В молекуле метана все четыре валентные АО у каждого атома углерода находятся в sp3-гибридизованном состоянии и участвуют в образовании 4-х s - связей располагающимися под углом 109˚ 28´.
Чтобы выяснить тип гибридизации необходимо :
1) Из бутлеровской формулы молекулы выяснить число валентных связей рассматриваемого атома
(нарисовать графическую формулу).
2) Выяснить состояние валентных электронов в центральном атоме, которое отвечает числу связей.
3)Выяснить, сколько электронов данного атома участвуют в p - связях и сколько в s - связях.
Состояние электронов, участвующих только в  -связях данного атома определяет вид гибридизации.
-связях данного атома определяет вид гибридизации.
Вид гибридизации валентных АО данного атома
| Молекула
| Атом
| Кол-во валентных связей центр. атома
| Кол-во
π -связей
| Состояние валентных электронов в атоме в процессе образования связи
| Вид гибридизации
|

|
C
|
|
| 
|
sp3
|

|
C
|
|
| 
|
sp
|
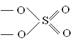
|
S
|
|
| 
|
sp3
|
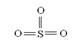
|
S
|
|
|
|
sp2
|

|
N
|
|
| 
|
sp3
|
Углы между связями в молекулах водородных соединениях
| VI A
| Угол между связями
| V A
| Угол между связями
| IV A
| Угол между связями
|
| H2O
| 104, 5
| NH3
| 107, 3
| CH4
| 109, 5
|
| H2S
| 92, 2
| PH3
| 93, 3
| SiH4
| 109, 5
|
| H2Se
| 91, 0
| AsH3
| 91, 5
| GeH4
| 109, 5
|
| H2Te
| 88, 5
| SbH3
| 91, 3
| SnH4
| 109, 5
|
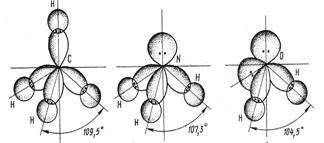
МВС - объясняет геометрию многих молекул.
p-облака атомов элементов VI А группы перекрываются с s- облаками.
водорода, аналогично молекуле воды. Близки к 90˚ градусам углы в молекулах водородных соединений V A группы. Во всех рассмотренных примерах гибридные орбитали были заселены неспаренными электронами. Однако есть примеры когда гибридная орбиталь занята несвязывающей электронной парой, это оказывает влияние на геометрию молекул. Несвязывающая пара находится ближе к ядру, чем связывающая так как испытывает воздействие ядра только своего атома, а связывающая пара испытывает воздействие двух ядер. Поэтому несвязывающая пара сильнее отталкивает связывающие электронные пары, чем те отталкивают друг друга. В результате взаимодействия несвязывающих электронных пар атома азота, связывающие парные углы между связями H-N-H сокращаются до 107, 3 градусов по сравнению со 109, 5 у правильного тетраэдра. Еще большее отталкивание испытывают связывающие электронные пары в молекуле воды, где у атома кислорода две несвязывающие электронные пары.
Делокализованая p-связь.
В некоторых молекулах и ионах, содержащих двойные связи, π -связи являются делокализованными, т.е. охватывающими не 2атома, а несколько атомов или целые молекулы или ионы. Примерами соединений с делокализованными π -связями являются молекула озона, а также ионы СО32-, SO42- и др. (пунктирной линией обозначается делокализованая p-связь).
Делокализованая p-связь присутствует в карбонат-ионе
СО32-

Ион имеет треугольное строение. За счет sp² -гибридных орбиталей, атом углерода образует 3 s -связи, лежащие в плоскости под углом 120 градусов. 4-й электрон углерода образует π -связь. Валентное насыщение одного атома кислорода достигается за счет образования π -связи, двух других - за счет присоединения электрона.
Строение такого иона изображают следующей формулой:
недостатком которой является локализация π -связи и обусловленная этим кажущаяся неравноценность связей
С¾ О, что противоречит эксперименту. Поэтому в теории валентных связей строение аниона СО3-2 изображается не одной схемой, а набором из 3-х равноценных:
Равноценность всех связей свидетельствует о делокализации π -связи (π -электронного облака) и отрицательного заряда на все атомы кислорода. Тогда можно обойтись одной схемой с изображением делокализованного π -электронного облака в виде пунктира:
Вследствии делокализации π -электронного облака, порядок связи С=О составляет примерно 1 1/3. Длина связи dсо в ионе 0, 129 нм и является промежуточной между длиной одинарной dc-o =0, 143 нм и двойной dс=о =0, 122 нм связей.
Примеры структур с многоцентровыми (делокализованными) π -связями могут служить HNO3, С6Н6, SO2.
Гибридные орбитали вследствие особой симметрии в образовании π -связей участия не принимают.
 ВОПРОС 7. Полярность ковалентной связи.
ВОПРОС 7. Полярность ковалентной связи.
Ковалентная связь, кроме направленности и насыщаемости характеризуется поляризуемостью. Поляризуемость рассматривается на основе представлений, что ковалентная связь может быть неполярной или полярной. Полярная связь образуется, когда межъядерная электронная плотность смещается к атому с большей электроотрицательностью, тогда центры тяжести (+) и (-) не совпадают и возникает электрический диполь.
Вследствие смещения электронной пары к одному из ядер увеличивается плотность отрицательного заряда у данного атома, и соответственно атом получает заряд, называемый эффективным зарядом атома - d-. Например в молекуле НСl электронная пара смещена к Сl, т.к. ОЭО (Сl) = 2, 83 больше ОЭО (Н) = 2, 1, в результате чего атомы приобретают эффективные заряды Н → Сl, + d у атома Н и - d у атома Сl. Благодаря двухполюсности, диполь имеет два равных, но противоположных по знаку заряда, расстояние между которыми называется длиной диполя l . Длина диполя - расстояние между полюсами.
Степень (мера) полярности связи - электрический момент диполя (ЭМД) - m равный произведению абсолютного заряда электрона на длину диполя.
q=1, 6 10-19 Кл.
Моменты диполей - векторные величины, т.е. характеризуются направленностью (условно от положительного к отрицательному).
ЭМД линейной молекулы СО2 равен m СО2 = m (СО) + m (СО) = 0, молекула неполярна, а для H2О, имеющей угловое строение m = 6, 13 10-30 Кл* м
Примеры соединений с полярной ковалентной связью НСl, H2О, Н2S, NH3 и др.
Полярность молекул оказывает влияние на свойства образуемых ими веществ. Полярные молекулы ориентируются друг к другу равноименно заряженными концами. Следствием такого диполь-дипольного взаимодействия является взаимное притяжение полярных молекул и упрочнение (связи) между ними. Поэтому, вещества, образованные полярными молекулами, обладают, как правило, более высокими температурами плавления и кипения, чем вещества, молекулы которых неполярны.
Поляризуемость ковалентных связей объясняется разной электроотрицательностью образующих молекулу атомов. Электронное облако (пара) сдвигается к более электроотрицательному атому, и в молекуле образуется электрический момент диполя.
Ионная связь.
При полном смещении межъядерной электронной плотности к атому с большей электроотрицательностью длина диполя становится равной длине связи (l = r0), а атомы превращаются в положительно и отрицательно заряженные ионы, между которыми действуют силы электростатического притяжения.
Такая связь называется ионной.
Степень полярности или ионности связи ί определяется отношением l к r0 если отношение = 0, то связь ковалентная, если < или = 1, то ионная.
В остальных случаях ί = 0-1 имеет промежуточные значения, например для молекулы НСl ί = 0, 0225/0, 1280 = 0, 18. Т.о. ионность связи НСl состявляет 18%, а эффективные заряды δ = +0, 18 и -0, 18 заряда электрона.
Чем больше разность ОЭО, для данной пары, тем больше длина диполя и величина эффективных зарядов, а следовательно, больше ионность связи.
| Соединения
| NaF
| LiF
| NaCl
| HF
| HI
|
| ЭО
| 3, 1
| 3, 0
| 2, 1
| 1, 9
| 0, 3
|
| Ионность%
| 95
| 92
| 75
| 45
| 5
|
| Кова-сть%
| 5
| 8
| 25
| 55
| 95
|
Чисто ионной связи нет, т.к. как нет полного смещения.
Ионная связь характеризуется ненаправленностью и ненасыщаемостью.
Популярное:

