
|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |

|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |
Номенклатура неорганических соединений. Графические формулы
По единым номенклатурным правилам, разработанным в комиссиях Международного союза теоретической и прикладной химии (ИЮПАК) в 1979 г., рекомендуется называть неорганические соединения слева направо в именительном падеже, хотя в традициях русской номенклатуры принято называть сначала электроотрицательную составляющую соединения (анион), а затем – электроположительную (катион) в родительском падеже. Стехиометрические отношения элементов в соединениях можно выражать тремя способами: 1. С помощью приставок из греческих числительных. Для обозначения числа атомов одинаковых элементов в молекулах простых и сложных веществ употребляют приставки из греческих числительных:
Для обозначения количества сложных групп атомов (кислотные остатки кислородсодержащих кислот) употребляют латинское «бис», греческие «трис», «тетракис», а группу атомов, к которой они относятся, заключают в круглые скобки. Примеры: Н2 – диводород, О3 – трикислород, Р2О5 – дифосфор пентаоксид, FeCl2 – железо дихлорид, Ca(NO3)2 – кальций бис(нитрат), Fe2(CO3)3 – дижелезо трис(карбонат). 2. По системе Штока После названия элемента в круглых скобках римской цифрой указывают его степень окисления. Примеры: FeCl3 – железо (III) хлорид, Mn2O7 – марганец (VII) оксид. 3. По системе Эвенса-Бассета. После названия иона в круглых скобках пишут его заряд арабской цифрой и знак заряда. Примеры: Cu(NO3)2 – медь (2+) нитрат, FeCl3 – железо (3+) хлорид. Систему Эвенса-Бассета используют чаще всего в названиях комплексных соединений. Графические формулы При написании графических (структурных) формул соединений необходимо соблюдать 2 правила: 1. Каждая связующая электронная пара (связь) между атомами обозначается черточкой (штрихом). Число черточек соответствует степени окисления элемента, взятой по абсолютной величине. 2. «Электроположительные» атомы могут соединяться только с «электроотрицательными» (имеющими отрицательную степень окисления). Оксиды
Основания
Кислоты Основные правила названий кислот и их анионов приведены в теоретическом разделе, посвященном классам неорганических соединений. Ниже приведены названия некоторых, не вошедших в список ранее названных, кислот и их анионов, а также графические формулы наиболее распространенных кислот
угольная серная сернистая азотная
фосфорная хромовая дихромовая пирофосфорная
тетраборная
перхлорная пермарганцовая метесурьмяная
Соли Сначала называется электроположительная составляющая солей (катион) в именительном падеже, а затем – электроотрицательная (анион). Средние соли Примеры (номенклатура с приставками из греческих числительных и по системе Штока):
Кислые соли В названии солей, содержащих не полностью замещенный в кислоте водород, перед названием кислотного остатка без пробела называется слово «водород» с указанием, в случае необходимости, числа его атомов. Примеры:
Основные и оксидные соли В названиях солей, содержащих одну или несколько групп ОН, после названия металла употребляется слово «гидроксид» с указанием числа гидроксидных групп, принадлежащих одному атому металла, а затем следует название аниона. Примеры:
Примеры выполнения контрольных заданий № 3 и № 4
  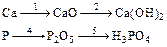 Ca3(PO4)2 Ca3(PO4)2
Ответ: 1. 2Ca + O2 ® 2CaO 2. CaO + H2O ® Ca(OH)2 3. 3Ca(OH)2 + 2H3PO4 ® Ca3(PO4)2¯ + 6H2O 4. 4P + 5O2 (изб) 5. P2O5 + 3H2O ® 2H3PO4 6. 2H3PO4 + 3Ca(OH)2 ® Ca3(PO4)2¯ + 6H2O Пример 2. Покажите взаимную связь между соединениями с помощью химических уравнений. а)
Ответ:
б) Ответ:
в)
Ответ:
Примечание: ОВР уравняйте одним из методов – МЭБ или МПР. Пример 3. К растворам каждого из веществ Zn(NO3)2, NaOH, H2CO3, Be(OH)2 добавили избыток калий гидроксида. Напишите молекулярные и ионные уравнения возможных реакций. Ответ:
Zn2+ + 2NO3– + 4K+ + 4OH– ® 2K+ + 2NO3– + 2K+ + ZnO22– + 2H2O Zn2+ + 4OH– ® ZnO22– + 2H2O
H2CO3 + 2K+ + 2OH– ® 2K+ + CO32– +2H2O H2CO3 + 2OH– ® CO32– +2H2O
Be(OH)2 + 2K+ + 2OH– ® 2K+ + BeO22– +2H2O Be(OH)2 + 2OH– ® BeO22– +2H2O или Be(OH)2 + 2KOH (изб.) Be(OH)2 + 2K+ + 2OH– ® 2K+ + [Be(OH)4]2– Be(OH)2 + 2OH– ® [Be(OH)4]2– Пример 4. Подберите по 2 молекулярных уравнения для реакций, которые выражаются следующими ионно-молекулярными уравнениями: а) Ba2+ + CO32– ® BaCO3 б) Ca2+ + SiO32– ® CaSiO3 Ответ: а)
Ba2+ + 2OH– + 2Na+ + CO32– ® BaCO3 + 2Na+ + 2OH– Ba2+ + CO32– ® BaCO3¯
Ba2+ + 2NO3– + 2K+ + CO32– ® BaCO3 + 2K+ + 2NO3– Ba2+ + CO32– ® BaCO3¯ б)
Ca2+ + 2OH– + 2Na+ + SiO32– ® CaSiO3 + 2Na+ + 2OH– Ca2+ + SiO32– ® CaSiO3¯
Ca2+ + 2Cl– + 2K+ + SiO32– ® CaSiO3¯ + 2K+ + 2Cl– Ca2+ + SiO32– ® CaSiO3¯ Пример 5. Смесь CaO и CaSO3 массой 80 г обработали раствором соляной кислоты. При этом выделилось 7, 84 л газа (н.у.). Определите массовую долю в % CaO в смеси. Решение: Оба компонента смеси взаимодействуют с кислотой:
но т.к. газ (SO2) выделяется во второй реакции, то можно составить пропорцию
Тогда
Ответ: массовая доля CaO в смеси составляет 47, 5%. Пример 6. Через раствор, содержащий 10 г NaOH попустили H2S массой 20г. Какая соль образовалась при этом? Определите ее массу. Решение: При взаимодействии NaOH с H2S возможны две реакции:
Для выбора идущей реакции необходимо выяснить количества реагирующих веществ NaOH и H2S и определить, какое из них находится в недостатке.
Из сравнения n(NaOH) и n(H2S) следует, что NaOH находится в недостатке, поэтому пойдет первая реакция, для которой нужно меньше вещества NaOH. I способ: Для нахождения массы соли NaHS составим пропорцию:
II способ: Исходя из того, что по уравнению реакции 1 n(NaOH) = n(NaHS), можно вычислить m(NaHS) по формуле:
Ответ: образуется кислая соль NaHS, ее масса равна 14 г. Пример 7. Какая соль образуется при пропускании всего углерод (IV) оксида, получившегося при сжигании метана объемом 2, 24 л. (н.у.) через раствор объемом 19, 1 мл с массовой долей натрий гидроксида 32% (ρ =1, 35 г/мл)? Определите массовую долю (в %) соли в полученном растворе. Решение: Уравнение реакции горения метана: CH4 + 2O2 ® CO2 + 2H2O (1) При пропускании углекислого газа через раствор щелочи можно предположить образование средней соли: CO2 + 2NaOH ® Na2CO3 + H2O (2) Расчет количества вещества реагентов:
Из уравнения (1) следует, что n(CH4) = n(CO2) = 0, 1 моль. Для нахождения n(NaOH) необходимо рассчитать массы раствора и вещества NaOH.
Из уравнения (2) следует, что n(CO2): n(NaOH) = 1: 2. Рассчитанные количества CO2 и NaOH находятся в эквивалентных количествах, т.е. 1: 2, поэтому образуется средняя соль Na2CO3. Количество Na2CO3 равно n(Na2CO3) = n(CO2) = 0, 1 моль, тогда:
В результате пропускания углекислого газа через раствор щелочи масса раствора увеличилась на массу CO2:
Массовая доля Na2CO3 равна:
Ответ: образуется средняя соль Na2CO3, ее массовая доля равна 35, 1%. Пример 8. Rp.: Ag. Plumbi 50, 0 Acidi borici 2, 0 Ag. Destill. аd. 100, 0 M.D.S. Примочка. Рассчитать массовую долю борной кислоты в примочке. Решение: В данном рецепте в 100 г раствора содержится 2 г H3BO3, следовательно, ее массовая доля составляет 0, 02 или 2%. Ответ: массовая доля 2%.
Контрольное задание № 3 1. Классификация сложных веществ. Основания. Сравнительная характеристика щелочей и амфотерных гидроксидов. Их получение и свойства. 2. К растворам каждого из веществ: Mn(NO3)2, Cr(OH)3, H2CO3, CaCl2, NH4OH добавили избыток натрий гидроксида. Напишите молекулярные и ионные уравнения возможных реакций. 3. Подберите по 2 молекулярных уравнения для реакций, которые выражаются следующими ионно-молекулярными уравнениями: Fe3+ + 3OH- ® Fe(OH)3 CrO42- + Ba2+ ® BaCrO4 Ag+ + Cl- ® AgCl 4. В растворах данных солей укажите реакцию среды: NaSCN, ZnSO4, Na2CuO2. Для гидролизующихся солей приведите молекулярные и ионные уравнения. 5. Допишите реакции образования К.С., назовите продукты, составьте выражения для Кнест. комплексных ионов: а) б) 6. Уравняйте ОВР, пользуясь ионно-электронным методом: а) MnSO4+NaBiO3+HNO3®HMnO4+Bi(NO3)3+NaNO3+Na2SO4+H2O б) KCrO2 + Br2 + KOH ® K2CrO4 + KBr + H2O 7. Покажите взаимную связь между соединениями с помощью химических уравнений: а) K ® KOH ® K2S ® KHS ® K2S ® KCl ® K б) Zn ® ZnO ® Zn(OH)2 ® Na2ZnO2 ® Zn(NO3)2 ® Na2[Zn(OH)4] 8. Смесь железа и цинка в количестве 15 г обработали раствором калий гидроксида. При этом выделилось 3, 2 л газа (при н.у.). Определите процентный состав смеси. 9. Биороль элементов подгруппы цинка. Токсические свойства соединений кадмия и ртути. Применение в медицине и фармации. 10. Напишите эмпирические и графические формулы солей, дайте вторые названия с приставками из греческих числительных: а) медь (II) гидроксид сульфат б) стронций (II) водород(орто)арсенит. Контрольное задание № 4 1. Укажите степени окисления (С.О.) элементов IVA-группы. Как изменяются К.О. и О.В. свойства с ростом величины С.О. Приведите примеры реакций. Укажите токсичные соединения и применение в медицине соединений углерода, кремния, олова и свинца. 2. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: а) HCl ® Cl2 ® KClO ® KCl ® AgCl ® [Ag(NH3)2]Cl ® AgCl б) NH4NO2 ® N2 ® NH3 ® NH4NO3 ® N2O ® NO ® NO2 ® HNO3 3. Допишите и уравняйте ОВР, пользуясь МПР; укажите окислитель и восстановитель: а) K2Cr2O7 + K2S + H2SO4 ® б) NH3 + KMnO4 + KOH ® 4. Напишите уравнения всех возможных реакций между веществами, взятыми попарно: K2O, P2O5, Ba(OH)2, H2SO4, KI, Pb(NO3)2. Уравнения реакций, протекающих в растворах, изобразите в сокращенной ионной форме. 5. Напишите уравнения реакций гидролиза солей Na2B4O7 и Sn(NO3)4 в молекулярной и ионной формах. Укажите реакцию среды. 6. Допишите реакции образования К.С., назовите продукты реакций: а) 7. Какую массу раствора с массовой долей фосфорной кислоты 40% можно получить из фосфорита массой 100 кг с массовой долей Ca3(PO4)2 93%? 8. Остаток, полученный после термического разложения хлората калия в присутствии оксида марганца (IV), растворили в воде. К раствору добавили избыток раствора AgNO3, получив осадок массой 57, 4 г. Какой объем кислорода выделился при разложении хлората (н.у.)? 9. Rp: Sol. Natrii thiosulfatus 10% - 200, 0. D.S. По 2 столовые ложки через каждые 5-10 минут. Рассчитайте дозу тиосульфата натрия на прием (масса раствора в столовой ложке 15 г). 10. Напишите эмпирические и графические формулы, дайте названия по номенклатуре с приставками из греческих числительных: а) цинк (II) водородсульфид б) алюминий (III) дигидроксид фосфат.
Студент должен уметь:
2. Владеть основными приемами и техникой выполнения экспериментов по общей и неорганической химии. 3. Пользоваться основными неорганическими реактивами, растворителями и химической посудой. 4. Правильно использовать номенклатуру неорганических соединений.
Студент должен знать:
4. Основные этапы развития общей и неорганической химии, ее современное состояние. 5. Связь свойств соединений с положением составляющих их элементов в Периодической системе химических элементов Д.И. Менделеева. 7. Основу теории строения неорганических веществ, теории химической связи. 9. Основные типы неорганических соединений. 10. Современную номенклатуру неорганических соединений. 11. Основные литературные источники и справочную литературу по общей и неорганической химии. 12. Основные правила охраны труда и техники безопасности при работе в химической лаборатории.
Вопросы к экзамену по неорганической химии (1 курс фарм.ф-та СибГМУ, заочная форма обучения).
1. Строение атома; строение ядра; элементарные частицы. Изотопы. 2. Электронное строение атома. Главное и орбитальное квантовые числа. 3. Магнитное и спиновое квантовые числа. 4. Электронные формулы атомов. Валентные электроны. Принцип Паули. 5. Электронно-графические схемы атомов. Правило Гунда. 6. Периодический закон Д.И. Менделеева. Периодическая система и ее структура: периоды (большие и малые); группы, подгруппы. 7. Изменение металлических и неметаллических свойств элементов по периодам и группам. Деление элементов на семейства: s-, p-, d-, f-. 8. Механизм образования ковалентной связи (метод ВС). Насыщаемость и направленность; характер перекрывания орбиталей. 9. Ионная связь, ее свойства. Металлическая связь. 10. Характеристики химических связей: энергия, длина, валентный угол, полярность. Водородная связь. 11. Понятие скорости химической реакции. Химическое равновесие. 12. Основные положения теории строения комплексных соединений. Понятия: центральный ион, лиганды, комплексный ион, внешняя сфера. 13. Классификация комплексных соединений, номенклатура. Химические свойства комплексных соединений. 14. Диссоциация комплексных соединений. Константа нестойкости. Способы получения комплексных соединений. 15. Электронная теория окислительно-восстановительных реакций Л.В.Писаржевского. Типичные окислители и восстановители. Окислительно-восстановительная двойственность. 16. Понятие растворов; их классификация по различным признакам. Растворимость газообразных, жидких и твердых веществ. 17. Механизм растворения электролитов. Диссоциация кислот, оснований и солей. 18. Степень диссоциации, факторы, влияющие на ее величину; сильные и слабые электролиты. 19. Ионное произведение воды. Водородный и гидроксильный показатель, рН растворов сильных и слабых кислот и оснований. 20. Гидролиз солей. Степень гидролиза; факторы, влияющие на ее величину. 21. Водород. Водород пероксид. Их химические свойства. 22. Щелочные и щелочно-земельные металлы, их химические свойства. 23.Основные химические свойства d-элементов. 24.Азот, его соединения. Азотная кислота, ее химические свойства. 25.Сера, ее соединения. Серная кислота, ее химические свойства.
Популярное:
|
Последнее изменение этой страницы: 2016-08-31; Просмотров: 8253; Нарушение авторского права страницы