
|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |

|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |
Введение. Цели и задачи курса защиты металлов от коррозииСтр 1 из 20Следующая ⇒
Введение. Цели и задачи курса защиты металлов от коррозии Металлы и сплавы являются одними из основных конструкционных материалов ещё со времен «бронзового века». В последние 40-50 лет все шире применяются пластмассы, полимерные материалы, керамики, бетоны и т.д. Тем не менее, металлические материалы останутся в обозримом будущем основными материалами, применяемыми в самых различных отраслях промышленности. Это обусловлено совокупностью уникальных свойств металлов: высокой прочностью и пластичностью, тепло- и электропроводностью, свариваемостью, способностью к обработке давлением и штамповке, литью, возможностью многократного повторного использования. Важной особенностью большинства практически используемых металлических материалов является экологическая безвредность (в т.ч. продуктов коррозии) для человека и окружающей среды. 1.1 Определение термина “коррозия металлов” и значение защиты металлов Производство и эксплуатация металлических изделий происходят в конкретных средах, где присутствуют вещества, которые, взаимодействуя с металлом, приводят к снижению его работоспособности, ухудшению функциональных свойств и постепенному разрушению вследствие превращения в продукты коррозии. Коррозия металлов - разрушение металлов вследствие химического или электрохимического взаимодействия их с коррозионной средой.* Согласно международному определению ISO 8044: 1999, коррозия – физико-химическое взаимодействие между металлом и средой, в результате которого изменяются свойства металла и часто происходит ухудшение функциональных характеристик металла, среды или включающей их технической системы. Коррозия - самопроизвольный процесс, в отличие от целенаправленного растворения металлов при получении солей, электрохимическом осаждении или растворении металлов, работе гальванических элементов и т.д. Взаимодействие неметаллических материалов с окружающей средой также приводит со временем к снижению эксплуатационных свойств и их разрушению (“коррозии”), которое называется старением полимерных материалов вследствие деструкции, деполимеризации, сорбции, десорбции и т.д.). Коррозия металлических материалов наносит существенный ущерб промышленности, вследствие потери функциональных свойств металлоконструкций и нередко приводит к катастрофическим разрушениям. В настоящее время общий металлофонд Земли, состоящий из металлоконструкций, машин, оборудования и т.д., составляет около 6, 5 млрд. т, что составляет примерно 30% от всего объема произведенного человечеством металла. Остальное исчезло из обращения вследствие коррозии. Общемировое производство стали в 2009 г. составило ~95 млн.т (в т.ч. в Китае ~45 млн.т). В Российской Федерации в период 2007 - 2009 г.г. выпускалось проката черных металлов ~ 5, 2 – 4, 5 млн. т, нержавеющих сталей ~ 80 тыс.т. Общие потери от коррозии составляют примерно 10 – 12 % ежегодно выплавляемого металла, т.е. каждая 8-я домна “работает” на коррозию. В денежном эквиваленте потери оцениваются от 1, 2 % (Япония) до 4, 5 - 6 % (США, Европа) валового национального продукта. За счет рационального применения противокоррозионных мер потери от коррозии могут быть уменьшены на 10 - 30 %. Основоположником коррозии как науки считается Эванс Ю.Р. (Evans U.R. 1889 – 1980). В нашей стране исследования по химическому сопротивлению материалов были начаты еще М.В. Ломоносовым. В современном виде отечественная коррозия сформировалась благодаря работам Акимова Г.В., Кистяковского В.А., Изгарышева Н.А., Томашова Н.Д., Фрумкина А.Н., Сухотина А.М., Розенфельда Н.Л., Жука Н.П., Колотыркина Я.М. и др. Среди зарубежных ученых большой вклад внесли работы Улига Г.Г., Спеллера Ф., Шрайера Л.Л., Хора Ф., Кешэ К., Пурбэ М., Окамото Г. и др. Стандартизация в коррозии С целью унификации и обобщения опыта работ по коррозионным испытаниям, методам исследования и защите от коррозии была разработана уникальная межгосударственная общетехническая система стандартов «Единая система защиты от коррозии и старения» (ЕСЗКС). ЕСЗКС принятая в странах СНГ, является основой многих стандартов таких общетехнических систем как ЕСКД, в которой регламентируются методы коррозионных испытаний, скорости коррозии, толщины покрытий и т.д., ЕСТПП, в которой регламентируются типовые технологические процессы, и др., и состоит более чем из 114 межгосударственных стандартов. Основу ЕСЗКС составляют: - термины и определения (7 стандартов), - методы испытаний металлических и неметаллических материалов (52), - характеристики агрессивности природных условий (3), - металлические и неметаллические неорганические покрытия с типовыми технологическими процессами (16), - лакокрасочные и другие полимерные покрытия (19), - средства и методы временной защиты (5), - средства и методы защиты от воздействия биологических факторов (12), - требования к электрохимической защите (1), и т.д. Для группы стандартов ЕСЗКС зарезервирована нумерация: ГОСТ 9.ххх. ЕСЗКС есть: комплекс взаимоувязанных межгосударственных стандартов, устанавливающих общие требования, правила, нормы и методы защиты изделий, конструкций и материалов от коррозии, старения и биоповреждений на всех стадиях жизненного цикла изделий и конструкций (исследование и обоснование разработки, разработка, производство и эксплуатация (хранение), капитальный ремонт), включая работы по сертификации. Стандарты ЕСЗКС разрабатываются на базе национальных стандартов РФ, других стран, стандартов ISO с учетом требований стандартов международных и региональных организаций по стандартизации (IEC – международной электротехнической комиссии, СЕN – европейского комитета по стандартизации и др.). Кроме стандартов ЕСЗКС имеются другие национальные стандарты РФ по коррозии, не входящие в систему, межотраслевые и отраслевые нормы и правила. Весьма авторитетными национальными стандартами по коррозии являются американские стандарты ASM (информационное общество по материалам), ASTM (общество по материалам и испытаниям), API (институт нефти и газа), NACE (ассоциация инженеров - коррозионистов), немецкие (DIN), британские (BS), французские, и др. Такое обилие стандартов и нормативов обусловлено большими потерями от коррозии, которые составляют до 6 % валового национального продукта. Ущерб от коррозии состоит из: 1) прямых потерь - безвозвратных потерь в виде продуктов коррозии, 2) стоимости изготовления металлических конструкций, требующих замены из-за коррозии, 3) косвенных потерь. Прямые, или безвозвратные потери в виде продуктов коррозии - окалины, ржавчины, составляют незначительную часть от общих потерь, поскольку основная часть подвергшихся коррозии металлических изделий подвергается вторичной переплавке. Основной вклад составляют косвенные потери: 1) ликвидация аварий и их экологических последствий, 2) стоимость изготовления прокорродировавших изделий, 3) убытки от простоев, ненадежности оборудования, утечки энергии, понижения производительности труда, 4) связанные с этим потери продукции, 5) потери мощности (из – за отложения продуктов коррозии на стенках теплообменной аппаратуры), 6) снижение качества выпускаемой продукции (из-за попадания продуктов коррозии), 7) преждевременный выход из строя металлоконструкций, 8) увеличение толщины металлоконструкций из – за допуска “на коррозию”, 9) затраты на профилактическое обслуживание, ремонт и замену деталей, 10) затраты на противокоррозионные мероприятия. Экономический эффект затрат на мероприятия по защите от коррозии состоит из: 1) уменьшении загрязнения окружающей среды (поскольку основная часть используемых в промышленности металлов – экологически безвредны); 2) увеличения срока службы оборудования и сохранения материальных ресурсов; 3) улучшению качества продукции; 4) снижения стоимости защитных средств; 5) уменьшения количества и стоимости текущих и капитальных ремонтов и простоев оборудования. Условие сплошности Условие сплошности заключается в том, что молекулярный объем оксида, образующегося при взаимодействии металла и кислорода, Vок, должен быть больше объема металла, израсходованного при образовании оксида, VМ. Если это не соблюдается, оксидной пленки не хватит для покрытия сплошным слоем металла, в результате чего она получается несплошной или пористой. Условие сплошности пленок по Пиллингу и Бедворту: если
где М – молекулярная масса оксида, А – атомная масса металла, dM и dок – плотность металла и оксида соответственно. Условию сплошности не удовлетворяют все щелочные и щелочноземельные металлы, за исключением бериллия. На основании экспериментальных данных установлено, что высокими защитными свойствами обладают пленки при условии 2, 5 > Рост пленок по толщине приводит к образованию внутренних напряжений в оксидных пленках. Источником этих напряжений является увеличение объема оксида относительно основного металла (при Однако применение условия сплошности для большинства широко используемых металлов в свете современных представлений о механизме высокотемпературного окисления нельзя считать достаточно обоснованным. При формулировке критерия защитной способности оксидных пленок Пиллинг и Бедворт полагали, что рост окалины может происходить только за счет диффузии ионов окислителя через слой продуктов реакции в направлении к внутренней границе раздела фаз «металл-оксидная пленка» и рост окалины происходит именно на внутренней границе. Если это так, то когда объем образующегося продукта коррозии меньше объема прореагировавшего металла, пустое пространство, образующееся между первичным слоем окалины и расходуемой поверхностью металла (зона превращения металла в оксид) не полностью заполняется продуктами реакции и окалина имеет пористую структуру. Если же объем образующегося продукта реакции равен или несколько больше эквивалентного объема металла, то зона превращения металла полностью заполнена продуктами коррозии и образовавшая пленка плотная и обладает защитной способностью. По Пиллингу и Бедворту, сплошность окалины может быть нарушена, если отношение мольных объемов оксида и металла (уравнение 2.13) значительно превысит 1, поскольку образующийся продукт не будет в состоянии разместиться между металлической фазой и первичной пленкой. При достижении предела упругости окалины наступит ее разрушение и процесс окисления будет развиваться так же, как и при формировании на поверхности пористой окалины. Вместе с тем экспериментально не было подтверждено, что появление трещин и отслоений от подложки окалины, растущей в результате диффузии окислителя к металлу, связано с высокими значениями критерия условия сплошности. Таким образом, Пиллинг и Бедворс обосновали случай роста окалины на внутренней границе раздела фаз за счет диффузии ионов окислителя через решетку оксида. Позднее было показано, что в большинстве случаев решающую роль в процессе образования окалины играет диффузия ионов металла через оксидный слой. При этом образование окалины происходит не на внутренней, а на внешней границе, т.е. на границе раздела «оксид-окислительная среда». Здесь пространство, которое занимает образующийся продукт, ничем не ограничено и никак не связано с объемом прореагировавшего металла. Критерий условия сплошности широко применяется при изучении окисления тугоплавких металлов (титана, циркония, ниобия, вольфрама), т.е. в тех случаях, когда рост оксидных пленок происходит в основном и исключительно в результате диффузии ионов кислорода через оксидный слой в сторону матрицы. Если рост окалины происходит в результате диффузии ионов металла через оксидный слой к внешней границе часто (и особенно в неизотермических условиях процесса) в пленках продуктов коррозии возникают сжимающие и (или) растягивающие напряжения, обусловленные различием коэффициентов термического расширения металла и оксида, вызывающие разрушение пленок. Однако эти разрушения никак не связаны с механизмом возникновения напряжений по Пиллингу и Бедворту. Разрушение защитных пленок Толщина сплошной оксидной пленки не может расти до бесконечности. Металл при образовании оксида занимает больший объем, а металл и оксид имеют разные коэффициенты термического расширения, это приводит к возникновению внутренних напряжений, являющихся причиной нарушения сплошности и растрескивания пленок. Основными причинами растрескивания защитных пленок являются: 1) колебания температуры, вызывающие возникновение внутренних напряжений из-за разных коэффициентов термического расширения плёнки и металла (рис. 2.8, 1а); 2) неравномерности металлической поверхности, приводящие к образованию отрывающего усилия из-за внутренних напряжений сжатия (рис. 2.8, 1 б); 3) образование пустот на границе раздела металлическая основа – защитная пленка из-за коагуляции вакансий, образующихся при росте пленки за счет преимущественной диффузии катионов металла; 4) механические напряжения при эксплуатации конструкции (при постоянных или переменных нагрузках, ударах и др.); 5) возникновение внутренних напряжений вследствие образования новых фаз или фазового перехода оксидной пленки, сопровождающееся изменением ее объема и различием: а) коэффициентов термического расширения различных фаз; б) межатомного взаимодействия между фазами.
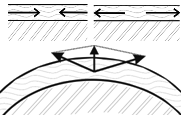 
1 2 Рис.2.8. Внутренние напряжения при росте пленки (1), окисление Cu при 5000С с характерными изломами параболической кривой вследствие периодических разрушений оксидной пленки (2).
Возникающие напряжения могут вызвать механические разрушения защитных пленок и привести к изменению закона окисления материала от степенного или логарифмического до линейного (рис.2.8, 2). На разрушение оксидных пленок влияет: 1) величина и характер внутренних напряжений и внешних механических нагрузок; 2) механические свойства защитной пленки (прочность и пластичность); 3) адгезия защитной пленки к металлу; 4) разность коэффициентов линейного и объемного расширения металла и пленки. На рис. 2.9 приведены основные виды разрушений при росте пленок.
Рис.2.9. Разрушения оксидных пленок при их росте. Образование пузырей (рис. 2.9, а) происходит при большой прочности пленки на разрыв и невысокой адгезии. При небольшой прочности пленки образуются пузыри с разрывом (рис. 2.9, 6), что делает пленку газопроницаемой и незащитной, под пузырем образуется новая оксидная пленка. Этот вид разрушения снижает защитные свойства оксидной пленки и может привести к изменению закона роста пленки (рис. 2.8, 2). Иногда в оксидной пленке образуются газонепроницаемые микропузыри (рис. 2.9, в), препятствующие диффузии ионов металла и тормозящие процесс окисления металла, что может привести к изменению закона роста пленки от параболического закона к степенному с показателем n> 2 или логарифмическому закону. Разрушение пленки отслаиванием (рис. 2.9, г) может происходить на неровностях поверхности металла и приводит к ускорению окисления металла аналогично изломам кривой окисления на рис. 2.8, 2. Растрескивание при сдвиге (рис. 2.9, д) происходит в пленках, имеющих высокую адгезию и набольшую прочность. При этом отрыва пленки не происходит, что не вызывает резкого увеличения скорости окисления металла, Контроль процесса изменяется от чисто диффузионного с параболическим законом роста к диффузионно-кинетическому контролю с ростом пленки по закону квадратичного уравнения Эванса (уравнение 2.25). Растрескивание на углах поверхности (рис. 2, 9, е) приводит к более быстрому окислению острых выступов и часто служит началом отслаивания оксидной пленки. Следовательно, наибольшую устойчивость имеют защитные пленки средней толщины, при которой не создается больших внутренних напряжений, но с толщиной, способной затормозить диффузию. Эти пленки, возникающие на гладкой поверхности металла, должны иметь высокую прочность, пластичность, адгезию с металлом и минимальную разницу в коэффициентах термического расширения с основой. Влияние температуры Температура существенно влияет на процесс окисления металлов. С повышением температуры скорость окисления возрастает, несмотря на уменьшение термодинамической возможности процесса. Влияние температуры на скорость окисления металлов приведена на рис. 2.10, а. Влияние температуры на скорость окисления определяется зависимостью константы скорости химической реакции (Кс) при кинетическом контроле процесса, или коэффициента диффузии реагентов окисления (D) при диффузионном контроле процесса, которое определяется экспоненциальным законом, – уравнением Аррениуса: Кс=К0с D=D0 где К0с и D0 – константы, формально равные скорости химической реакции и коэффициенту диффузии при Т→ Для определения энергии активации уравнение (2.40) логарифмируют: lnKc= lnK0c - и по построенному в координатах lgKc = f(1/T) графику (рис.2.10, б) определяют энергию активации Величина кажущейся энергии активации Qc, определенная выше, для гетерогенных химических реакций меньше истинной энергии активации, Q, на величину теплоты адсорбции реагирующего вещества, λ: Qc=Q - λ .
а б Рис.2.10. Зависимость скорости окисления металлов в кислороде (а), и константы скорости окисления железа от температуры в логарифмических координатах (б).
Если при изменении температуры изменяется структура металла или механизм процесса окисления, константа скорости окисления описывается ломаной линией (рис.2.10, б) и имеет разные величины при различных температурах. С учетом этого, расчет энергии активации и коэффициентов К0с и D0 дает возможность расчета глубины коррозионных поражений подстановкой этих значений в уравнения 2.16, 2.23, 2.25, 2.28, 2.37, 2.38. Влияние давления Уменьшение парциального давления окислителя ниже равновесного давления диссоциации образующегося оксида (для кислорода У металлов, на поверхности которых растет окисная полупроводниковая пленка n-типа, повышение Если с изменением парциального давления окислителя контролирующая стадия процесса изменяется, например, механизм процесса окисления определяется не диффузией окислителя, а миграцией ионов под действием электрического поля, или при росте пленки на поверхности твердого раствора в металлической основе (металлы подгруппы титана), то, независимо от типа проводимости пленки, повышение парциального давления окислителя увеличивает скорость окисления (рис. 2.11, а).
Рис.2.11. Влияние давления кислорода на константу скорости окисления Тi при 10000С (а), и толщину оксидной пленки на Cu при различных температурах, 0С (б).
Неоднозначное влияние парциального давления кислорода на скорость газовой коррозии проявляется в проявлении высокотемпературной пассивации, при которой скорость окисления в определенном интервале давлений остается очень низкой, что обусловлено образованием более совершенной оксидной пленки. Высокотемпературная пассивация наблюдается на Cu (рис. 2.11, б), Ti, Zr, нержавеющих хромистых и хромоникелевых сталях и может быть использована для “выращивания” высокозащитной пленки с целью повышения жаропрочности. Окисление сплавов При окислении двухкомпонентного сплава хМ1+уМ2, состоящего из менее благородного (менее термодинамически устойчивого по величине Δ GT) металла М1, и более благородного, М2, с соответствующими концентрациями х и у, более склонен к окислению менее термодинамически устойчивый компонент М1. Окисление сплава может протекать по механизму избирательного окисления, когда окислитель взаимодействует только с одним компонентом сплава (например Ni в сплаве Ni – Pt), и по механизму предпочтительного окисления, когда скорость окисления компонентов различна. Состав образующихся оксидов зависит от концентрации исходных компонентов: 1) при у»х на поверхности сплава образуется оксид более благородного металла М2О, в котором может находиться в растворе соединения металла М1; 2) при х»у на поверхности образуется соединение более благородного М2, твердый раствор которого может содержать менее благородный металл М1; 3) при х≈ у на поверхности сплава могут образовываться как отдельные слои соединений компонентов сплава, так и слои смеси оксидов компонентов сплава, или же оксиды типа шпинели (М1М2)2О4. При окислении сплавов наряду с образованием поверхностного окисного слоя (окалины) возможно образование “подокалины” – слоя, обогащенного более термодинамически устойчивым металлом М2, содержащего вкрапления оксидов менее стойкого металла М1. Это - внутреннее окисление, заключающееся в избирательном окислении наименее термодинамически стойкого легирующего компонента (М1), которое происходит в сплаве вблизи границы раздела сплав – окислитель. Оно обусловлено превышением диффузионного потока окислителя вглубь сплава над встречным потоком легирующего компонента, в результате чего частицы оксидов образуются внутри сплава, под слоем недостаточно защитной оксидной пленки. Внутреннее окисление развивается в подокалинном слое при достаточной растворимости окислителя (кислород, азот, углерод, водород) в основном металле. Оно наблюдается в Cu, Ag при “низком” легировании (до 1 – 3 %) Al, Si, Ti; в Ni при легировании Al, Cr, Fe, и др. сплавах. Образование тонких дисперсных частиц оксидов в сплаве обуславливает упрочнение сплавов при азотировании, цементации и т.д., а также дает возможность получения дисперсно-упрочненных сплавов. Катастрофическое окисление - неожиданно быстрое окисление металлов. Может быть вызвано: 1) потерей изотермичности условий в зоне окисления, вследствие чего температура в зоне реакции непрерывно возрастает и металл начинает окисляться с возрастающей скоростью. Металлы, окисляющиеся по линейному закону, имеют тенденцию к катастрофическому окислению, если выделяющееся тепло экзотермической реакции окисления металла не успевает рассеиваться, и температура поверхности металла возрастает, непрерывно ускоряя окисление. При достаточной скорости подвода кислорода это будет приводить к воспламенению (Мg, в экстремальных условиях - Nb, Ti и некоторые другие металлы; 2) образованием летучих, легко сублимирующихся оксидов на Mo, W, V, Re, Os (и некоторых сплавах с их высоким содержанием), не дающих защитной окалины. При достаточной скорости подвода кислорода и температурах, обеспечивающих большую скорость сублимации оксида, эти металлы подвержены катастрофическому окислению; 3)образованием на поверхности легкоплавких оксидов (эвтектик). На сталях, в т.ч. нержавеющих, наблюдаются высокие скорости окисления при сжигании мазута или нефти с высоким содержанием соединений V - “ванадиевая коррозия”. Причиной катастрофического окисления является осаждение на поверхности золы, содержащей V2О5, которая образует легкоплавкую эвтектику (tпл.V2O5=6900C) и может растворять оксидные пленки Fe, Ni и Сr с образованием ванадатов: Fe2O3 + V2O5 = 2FeVO4, и далее окисляет железо: 4Fe + 3V2O5= 2Fe2O3+3V2O3. Рост чугунов Рост чугунов - увеличение размеров чугунных изделий до десятков процентов с значительным уменьшением прочности, наблюдаемое при попеременном нагреве и охлаждении в области температур превращения α -Fe Росту чугунов способствуют примеси Si, А1 и Ni, являющихся графитизаторами. Легирование Si (до 10%) и Ni (до 20%) понижает склонность чугунов к росту вследствие повышения температуры превращения α -Fe Высоколегированные чугуны (силаль 5-10% Si, нихросилаль < 1, 8%C, 18%Ni, 2%Cr, 6%Si, Mn, нирезист 2, 7-3, 1%C, 12-15%Ni, 1, 5-4%Cr, 5-7%Cu, 1, 0-1, 5%Mn, 1, 2-2, 0%Si) не подвержены росту, поскольку имеют стабильноаустенитную структуру.
Защита от газовой коррозии Окисление сильно сокращает срок эксплуатации стальных конструкций и наносит значительный ущерб, который включает в себя: 1) “угар” металла при термомеханической обработке, потери от которого составляют около 3 - 3, 5% массы нагреваемого металла; 2) разрушение окалиной огнеупорных материалов нагревательных печей с образованием сварочного шлака; 3) усиление износа инструмента окалиной при штамповке, прошивке и т.д.; 4) брак из-за закатывания окалины в металл; 5) изменение (уменьшение) размеров нагреваемых деталей вследствие окисления и т.д. Все это указывает на необходимость борьбы с окислением металлов, в т.ч. железа, стали и чугуна при их нагреве. Защита от газовой коррозии осуществляется 4 основными группами методов воздействия на гетерогенную систему металл – агрессивная среда (рис.3.1).
Рис.3.1. Методы защиты металлов от газовой коррозии. Методы защиты от газовой коррозии включают: 1 - воздействие на металл (жаростойкое легирование, изменение фазового состава и структуры металла); 2 - воздействие на межфазную границу (нанесение защитных покрытий и обработка поверхности); 3 - воздействие на среду (защитные атмосферы); 4 – прочие (технологические) методы уменьшения окисления металлов. Жаростойкое легирование Наиболее общим и эффективным методом повышения устойчивости к газовой коррозии является жаростойкое легирование. Существуют 3 наиболее обоснованные теории жаростойкого легирования в зависимости от механизма действия легирующих элементов. 1. Теория уменьшения дефектности оксида основного металла (Вагнер, Хауффе и др.), основана на диффузионной модели окисления, где скорости диффузии и передвижения ионов зависят от уровня дефектности кристаллической решетки оксидной пленки. Поскольку скорость окисления при диффузионном контроле процесса определяется скоростью диффузии ионов металла и окислителя, зависящей от концентрации точечных дефектов, то уменьшение дефектности оксидной пленки снижает скорость окисления. Дефектами ионной решетки оксида являются: 1) - междоузельные катионы и избыточные электроны (в оксидах с избытком металла), 2) - свободные катионные и электронные вакансии (оксиды с недостатком металла). Изменение концентрации дефектов в решетке оксидов может быть вызвано только введением ионов другой валентности. 1) В оксидах с избытком металла (n – полупроводники) повышение жаростойкости достигается, если n*> n, где n* и n - валентности ионов легирующего и основного элемента. В этом случае замена части катионных узлов на катионы высшей валентности понизит концентрацию точечных дефектов и, соответственно, уменьшит скорость окисления. Например, при легировании цинка алюминием в оксиде ZnO три иона Zn2+ в узлах решетки оксида заменяются двумя ионами Al3+ для сохранения электронейтральности. Два иона Al3+ займут места двух ионов Zn2+, а место третьего иона Zn2+ займет тот же ион из междоузельного пространства. Это уменьшит концентрацию междоузельных катионов и приведет к снижению скорости диффузии катионов и, соответственно, контролируемой ей скорости окисления сплава. Чем больше избыток металла в оксиде, тем больше должна быть добавка металла большей валентности для уменьшения скорости окисления основного металла. Легирование небольшой добавкой металла, образующего ионы низшей валентности, (например Li+), повысит скорость окисления основного металла. Так легирование Zn 1, 0% Аl уменьшает константу скорости окисления этого сплава при 390°С в 800 раз, а добавление 0, 4% Li увеличивает скорость окисления на 4.103. 2) В полупроводниковых оксидах р – типа с недостатком металла (или избытком кислорода) повышение жаростойкости обеспечивается при n*< n. Для оксидов этого типа (NiO, FeO, Cu2O) - наоборот, легирование решетки ионов низшей валентности уменьшит концентрацию ионных вакансий и скорость окисления будет снижаться. Так, при легировании никеля литием в NiO один ионNi2+ в узлах решетки оксида заменяется двумя ионамиLi+. Из двух ионов Li+ только один может занять место Ni2+, а другой занимает вакансию. Число катионных вакансий уменьшится, снизится скорость диффузии катионов сквозь оксидную пленку, и, соответственно, уменьшится скорость окисления. Введение небольшой добавки металла, образующего ионы высшей валентности, чем основной металл, повышает его скорость окисления. При легировании металла той же валентности n*=n, должно соблюдаться условие r*i < ri, где ri – радиусы ионов. Замена в оксиде катионов основного металла катионами добавки той же валентности уменьшает концентрацию катионных дефектов, и, соответственно, скорость окисления, если радиус легирующего иона меньше радиуса иона основного металла. Кроме этого, оксид легирующего элемента (M*) должен иметь большее сродство к кислороду: Данная теория позволяет прогнозировать влияние низкого легирования на жаростойкость основного металла. Если диффузия ионов не является контролирующей стадией окисления металлов, а определяется другими процессами, легирование приводит к образованию в оксидной пленке новой фазы, данная теория неприменима. 2. Теория образования высокозащитного оксида легирующего элемента (А.А. Смирнов, Н. Д. Томашов и др.) связывает механизм повышения жаростойкости с образованием на поверхности сплава более защитного оксида легирующего элемента, который затрудняет диффузию и окисление основного металла. По этой теории легирующий компонент (M*) должен: 1) удовлетворять условию сплошности Данная теория жаростойкого легирования подтверждается образованием защитного оксида Аl2О3 на Fe, легированном 8 - 10% А1; ZnO на Сu, содержащей > 20%Zn; А12O3 на Сu при легировании > 3% А1; ВеО на Сu, легированной > 1% Be, и др. Теория позволяет на основе свойств элементов и их оксидов, качественно оценить пригодность различных элементов для среднего и высокого жаростойкого легирования. 3. Теория образования высокозащитных двойных оксидов связывает повышение жаростойкости при легировании образованием смешанных двойных оксидов основного и легирующего компонента, защитные свойства которых выше оксида любого компонента. Это оксиды с кристаллической решеткой типа шпинели и составом M1М*2O4, обладающие более высокими защитными свойствами по сравнению с оксидами компонентов сплава. Повышение жаростойкости железных сплавов по этой теории обеспечивается: 1) снижением возможности образования наименее защитного вюстита (FeO, c г.ц.к.), что определяется диаграммой состояния, 2) преимущественным образованием оксидов типа шпинели с меньшими параметрами кристаллической решетки в окалине. Низкое легирование Al, Cr, Si, повышая температуру появления вюстита в окалине, уменьшает возможность образования вюститной фазы, и благоприятствует образованию шпинелей с малым параметром решетки (FeAl2О4, FeCr2O4, NiFe2O4, NiCr2O4 и др.), что повышает жаростойкость железных сплавов. Теория позволяет прогнозировать влияние легирования на жаростойкость сталей. Популярное:
|
Последнее изменение этой страницы: 2017-03-09; Просмотров: 1516; Нарушение авторского права страницы