
|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |

|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |
ПОДГОТОВИТЕЛЬНОЕ ОТДЕЛЕНИЕСтр 1 из 20Следующая ⇒
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ ФЕДЕРАЛЬНО ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ «МОСКОВСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИКО-СТОМАТОЛОГИЧЕСКИЙ УНИВЕРСИТЕТ ИМЕНИ А.И. ЕВДОКИМОВА» Moscow State University of Medicine and Dentistry named after A. I. Evdokimov
ПОДГОТОВИТЕЛЬНОЕ ОТДЕЛЕНИЕ
Л. И. Пашкова, А. М. Жидкова, А. Я. Фирсова
ОСНОВЫ ОРГАНИЧЕСКОЙ ХИМИИ УЧЕБНО-МЕТОДИЧЕСКОЕ ПОСОБИЕ
МОСКВА 2017 УДК: 547(075.32) ББК: 24.2я727. П22
Авторы: Л. И. Пашкова, А. М. Жидкова
Основы органической химии: учебно-методическое пособие / Л. И. Пашкова, А. М. Жидкова – М. 2017 г.
Пособие разработано на основе рабочей программы по химии для иностранных обучающихся на Подготовительном отделении МГМСУ им. А.И. Евдокимова. В пособии изложены следующие темы курса органической химии: «Теория химического строения органических соединений А. М. Бутлерова», «Предельные углеводороды», «Непредельные углеводороды», «Ароматические углеводороды», «Спирты», «Карбонильные соединения», «Карбоновые кислоты и сложные эфиры», «Углеводы», «Амины», «Аминокислоты. Белки». Издание также может быть рекомендовано для учащихся старших классов средней школы, абитуриентов, проходящих довузовскую подготовку.
ТЕОРИЯ ХИМИЧЕСКОГО СТРОЕНИЯ ОРГАНИЧЕСКИХ ВЕЩЕСТВ. Таблица простейших радикалов
Например:
2-метилпентен-2 (суффикс -ен указывает на наличие кратной связи) 3-метилбутаналь
Здесь альдегидная группа старшая, следовательно, с нее начинается нумерация цепи, и она обозначается суффиксом –аль. 3-гидрокси-6-метил-4-этилгептен-5-овая кислота Изомерия. Изомеры – это вещества, имеющие одинаковый элементный состав (общая молекулярная формула), но различное химическое строение и поэтому обладающие различными свойствами. Все виды изомерии можно отнести к двум типам: структурная изомерия и пространственная изомерия. Структурная изомерия:
Скелетная изомерия обусловлена различным строением углеродного скелета:
Например: С5Н12 2-метилбутан 2, 2-диметилпропан Изомерия положения функциональной группы или кратной связи:
2-метилбутен-1 3-метилбутен-1 2-метилбутен-2
3. Метамерия, зависящая от различного распределения углеродных атомов между несколькими углеводородными радикалами, входящими в состав молекулы: этилацетат метилпропионат диметиламин этиламин 4. Межклассовая изомерия – изомеры относятся к разным классам органических соединений:
(класс непредельных спиртов)
этоксиэтен (винилэтиловый эфир) (класс простых эфиров) Пространственная, или стереоизомерия, обусловлена различным пространственным расположением атомов при одинаковом порядке из связывания. 1. Геометрическая, или цис-, транс-, изомерия, характерна для алкенов и циклоалканов
цис-пентен-1 транс-пентен-1 цис-1, 2-диметилциклопропан транс-1, 2-диметилциклопропан (tкип = 370С) (tкип = 290С)
2. Оптическая (зеркальная), изомерия (энантиомерия), обусловлена наличием асимметрического (хирального) атома углерода (С*), т.е. атома углерода, связанного с четырьмя различными заместителями.
1-хлорэтанол 2-гидроксипропановая кислота (молочная кислота)
D - глицериновый альдегид L - глицериновый альдегид эталон D-ряда эталон L -ряда Взаимное влияние атомов в молекуле. Атомы и группы атомов, входящие в молекулу органического соединения, оказывают взаимное влияние на химическое поведение друг друга, при этом связанные атомы могут различаться по величине электроотрицательности, что определяет полярность и прочность химических связей в молекуле. Все составляющие молекулы атомы находятся во взаимосвязи и испытывают взаимное влияние. CH3− COO− H+ CCl3← COO← H+ Типичные органические вещества в отличие от неорганических являются неэлектролитами, они имеют неполярные или слабополярные связи. Являются газами (низшие), жидкостями или твердыми веществами с низкой температурой плавления, разрушаются при нагревании, окисляются на воздухе, горючи, нерастворимы или плохо растворимы в воде, но часто хорошо растворимы в органических растворителях.
Пример 1. Четвертичный атом углерода соединен с четырьмя… 1) атомами углерода 2) атомами водорода 3) углеводородными радикалами 4) гидроксильными группами 5) аминогруппами Решение. Четвертичный атом углерода – это атом углерода, который соединен с четырьмя атомами углерода или с четырьмя углеводородными радикалами Ответ: 1, 3
Пример 2. Назовите соединение по международной номенклатуре и укажите количество вторичных атомов углерода в его молекуле. 1) 4-гидрокси-3-метил-6-изопропилгептен-6-он-2, 3 вторичных атома углерода 2) 4-гидрокси-3-метил-6-изопропилпентен-6-он-2, 2 вторичных атома углерода 3) 4-гидрокси-6-изопропил-3-метилгептен-6-он-2, 4 вторичных атома углерода 4) 4-гидрокси-6-изопропил-3-метилпентен-6-он-2, 2 вторичных атома углерода 5) 4-гидрокси-7-диметил-6-метилиденоктанон-2, 4 вторичных атома углерода
Решение. Выбираем главную, самую длинную цепь углеродных атомов, содержащую функциональные группы. Самая длинная цепь содержит 8 атомов углерода, но не включает в себя кратную связь. Цепь атомов углерода, в составе которой находятся все функциональные группы (кето-, гидрокси- и кратная связь), состоит из 7 атомов. Т.к. старшей группой является карбонильная группа, то нумерация цепи начинается справа. При наименовании вещества названия заместителей располагают в алфавитном порядке, следовательно, по м.н. данное вещество называется 4-гидрокси-6-изопропил-3-метилгептен-6-он-2 и имеет в молекуле 4 вторичных атома углерода С2, С4, С5 и С7, т.к. связаны с соседними атомами углерода двумя связями. Ответ: 3
Пример 3. Сколько σ - и π -связей содержится в молекуле изопрена? 1) 10σ - и 2π - 2) 11σ - и 2π - 3) 12σ - и 2π - 4) 13σ - и 2π - 5) 14σ - и 2π - Решение. Изопрен, или 2-метилбутадиен-1, 3, имеет формулу:
Каждая черточка означает одну s-связь, а двойная связь состоит из одной s-связи и одной p-связи, следовательно, в молекуле изопрена 12 s- и 2 p-связи. Ответ: 3
Пример 4. В каком из перечисленных соединений все атомы углерода находятся в одинаковом гибридном состоянии? 1) изопрен 2) гексатриен-1, 3, 5 3) толуол 4) пентадиин-1, 4 5) метилциклобутан
Решение. Гибридизация атома углерода определяется по числу s-связей, которыми данный атом связан с другими: атом углерода в sp3-гибридизации имеет 4 s-связи, в sp2-гибридизации - 3 s-связи, в sp-гибридизации - 2 s-связи. Рассмотрим каждое из соединений.
изопрен (2-метилбутадиен-1, 3) 2) гексатриен-1, 3, 5
3) толуол 4) пентадиин-1, 4 5) метилциклобутан
Только в молекулах гексатриена 1, 3, 5 и метилциклобутана атомы углерода имеют одинаковую гибридизацию (sp2 и sp3 соответственно). Ответ: 2, 5
Пример 5. Напишите формулу 3, 3-диэтилгексана. Приведите формулу гомолога, имеющего на один атом углерода больше и не содержащего вторичных атомов углерода.
Решение. 3, 3-диэтилгексан (С10Н22). Гомолог имеет общую формулу С11Н24. Соединение, соответствующее этой формуле и не имеющее вторичных атомов углерода, - это 2, 2, 3, 3, 4, 4-гексаметилпентан.
Пример 6. Среди приведенных соединений выберите изомеры:
Решение. Изомеры – вещества, имеющие одинаковую молекулярную формулу, но разное строение. Здесь представлены только алканы, для которых возможна скелетная изомерия. 1) С8Н18 2) С9Н20 3) С7Н16 4) С8Н18 5) С8Н18 Изомерами являются 1-ое, 4-ое и 5-ое соединения. Ответ: 1, 4, 5
Пример 7. В молекуле алкана имеются только первичные и третичные атомы углерода, причем первичных атомов в 2 раза больше, чем третичных. Напишите формулу алкана.
Решение. В молекуле 2, 3-диметилбутана имеется четыре первичных и два третичных углеродных атома.
Пример 8. Приведите формулу нециклического углеводорода, в молекуле которого: а) атомы углерода находятся в состоянии sp3-, sp2- и sp-гибридизации; б) все четыре атома углерода находятся в состоянии sp-гибридизации; в) все четыре атома углерода находятся в состоянии sp2-гибридизации.
Решение. а) В молекуле углеводорода атомы углерода находятся в состоянии sp3-, sp2- и sp-гибридизации, т.е. в молекуле содержится тройная, двойная связи и углеводородный радикал, например, пентен-3-ин-1 или 2-метилбутен-3-ин-1. б) В молекуле углеводорода все четыре атома углерода находятся в состоянии sp-гибридизации, т.е. в молекуле имеются две тройные связи (бутадиин).
в) Все четыре атома углерода в молекуле углеводорода находятся в состоянии sp2-гибридизации, значит, в молекуле содержатся две двойные связи (бутадиен-1, 3).
УГЛЕВОДОРОДЫ АЛКАНЫ Алканы – это углеводороды нециклического строения, в молекулах которых все атомы водорода находятся в состоянии sp3-гибридизации и связаны друг с другом только s-связями. Общая формула алканов С n H2 n+2. Угол между s-связями составляет 109028¢, длина С-С-связи равна 0, 154 нм. Вокруг С-С-связей возможно свободное вращение. Номенклатура алканов. Первые четыре члена гомологического ряда имеют тривиальные названия: метан, этан, пропан, бутан. Названия последующих членов ряда образуют от греческих числительных с добавлением окончания –ан: пентан, гексан и т.д. При составлении названия по международной (заместительной) номенклатуре выбирают самую длинную нормальную цепь атомов углерода и нумеруют с того конца, к которому ближе заместитель. В названии соединения цифрой указывают номер, под которым находится радикал, далее – его название и затем название главной цепи. Если радикалы повторяются, то перечисляют цифры, указывающие их положение, а число одинаковых радикалов указывают приставками ди-, три-, тетра-. При наличии
нескольких алкильных групп, их перечисляют в алфавитном порядке, например: 5-изопропил-2, 2, 6-триметил-4-этилгептан.
Изомерия алканов. Для алканов характерна только структурная изомерия – изомерия углеродного скелета, начиная с n = 4. Так, алкану состава С5Н12 соответствуют соединения строения: Физические свойства. Четыре первых гомолога метана – газообразные вещества, начиная от пентана (С5) до пентадекана (С15) – жидкости, с С16- твердые вещества. Все алканы легче воды. Алканы практически нерастворимы в воде, но хорошо растворимы в органических растворителях. Метан, этан и высшие гомологи не имеют запаха, средние - обладают запахом бензина. Химические свойства . В обычных условиях алканы обладают низкой реакционной способностью, что связано с прочностью и малой полярностью s-связей. При температуре и на свету (hn) создаются возможности для гомолитического разрыва С-С и С-Н-связей с образованием радикалов. В этих условиях алканы вступают в реакции радикального замещения (SR). I. Реакции замещения.
При хлорировании углеводородов обычно образуется смесь хлорпроизводных. Реакции бромирования, нитрования и сульфирования протекают избирательно: легче всего происходит замещение атома водорода у третичного атома углерода, затем – у вторичного и в последнюю очередь у первичного. При вторичном галогенировании замещается преимущественно атом водорода у того атома углерода, который уже подвергался воздействию галогена (для брома избирательность выше, чем для хлора). II. Реакции окисления 1) горение
2) каталитическое окисление
При каталитическом окислении метана в зависимости от условий могут быть получены различные продукты окисления (метанол, формальдегид, муравьиная кислота): В промышленности окислением бутана получают уксусную кислоту: 2С4Н10 + 5О2 Алканы устойчивы к воздействию перманганата и дихромата калия. III. Изомеризация.
Нормальные алканы при определенных условиях легко изомеризуются, образуя алканы с разветвленной углеродной цепью. IV. Крекинг – процесс расщепления углеводородов, содержащихся в нефти, сопровождающийся гомолитическим разрывом С-С-связей при сравнительно высокой температуре (4600 – 5600). В результате крекинга образуются алканы и алкены с меньшей молекулярной массой:
Одновременно протекают реакции изомеризации, циклизации, полимеризации. В результате образуется смесь разнообразных продуктов, состав которой зависит от условий крекинга. Крекинг при более высоких температурах (7000-8000С) называют пиролизом. Пиролиз приводит к более глубоким изменениям (образованию непредельных газообразных углеводородов, например, этилена, ацетилена и др.) и частичному образованию углерода: 2СН4 С2Н6 СН4
ЦИКЛОАЛКАНЫ Циклоалканы (циклопарафины) являются насыщенными углеводородами, содержащими цикл из трех и более атомов углерода. Они относятся к алициклическим углеводородам. Все атомы углерода цикла находятся в sp3-гибридизации. В простейших циклах (С3, С4) углы между С-С-связями сильно отличаются от тетраэдрического угла (109028¢ ), что создает в молекулах напряжение, вследствие этого молекулы циклопропана и циклобутана обладают высокой реакционной способностью. Свободное вращение вокруг С-С-связей, образующих цикл, отсутствует. С увеличением числа атомов углерода (циклы С5-С6) угловое напряжение уменьшается и наблюдается ограничеснная возможность вращательного движения, например, циклогексан существует в двух конформациях («кресло» и «ванна»). Общая формула циклоалканов С n H2 n ( n ³ 3). Простейшие представители:
циклопропан циклобутан Номенклатура циклоалканов. Названия циклоалканов образуют прибавлением приставки “ цикло” к названиям соответствущих ациклических углеводородов. Заместители нумеруют таким образом, чтобы цифры были минимальные.
1, 2-диметилциклопропан 1, 1-диметилциклопропан Изомерия циклоалканов. Структурная изомерия. а) изомерия углеродного скелета связана с различной величиной циклов, видом и строением заместителей и их расположением; б) межклассовая изомерия (изомерны алкенам). Пространственная (геометрическая) изомерия. Возникает при наличии в цикле (С3-С6) двух заместителей, расположенных у соседних атомов углерода. Например, в молекуле 1, 2-диметилциклопропана две метильные группы могут находиться по одну сторону от плоскости цикла (цис-изомер) или по разные стороны (транс-изомер):
цис-циклопропан транс-циклопропан Физические свойства. Циклопропан и циклобутан – газы, циклопентан и циклогексан – жидкости, высшие циклоалканы – твердые вещества. Циклоалканы легче воды и практически в ней нерастворимы. Химические свойства. Циклоалканы, содержащие циклы различного размера, неодинаково ведут себя в химических реакциях. Соединения с трех- и четырехчленными циклами отличаются повышенной реакционной способностью, для них характерны реакции присоединения (подобно алкенам). Углеводороды, содержащие циклы с пятью и более атомами углерода, более устойчивы, для них характерны реакции замещения (подобно алканам). I. Реакции присоединения
Гидрирование (образование алканов): Галогенирование (образование дигалогеналканов):
Гидрогалогенирование (образование моногалогеналканов):
II. Реакции замещения Галогенирование (образование моногалогенциклоалканов):
циклогексан хлорциклогексан III. Реакции дегидрирования (образование ароматических углеводородов):
циклогексан бензол IV. Реакции окисления 1) горение: CnH2n +
2) окисление циклогексана и его производных под действием сильных окислителей: гександиовая (адипиновая) кислота Получение циклоалканов.
1. Циклизация дигалогеналканов под действием активных металлов Na, Zn, Mg (применяется для получения трех- и четырехчленных циклов): 1, 4-дихлорбутан циклобутан
2. Циклизация алканов: циклогексан Гидрирование циклоалкенов или ароматических углеводородов:
циклопентен циклопентан
бензол циклогексан
НЕПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ Изомерия алкенов 1. Структурная изомерия. а) изомерия углеродного скелета; б) изомерия положения двойной связи; в) межклассовая изомерия (изомерны циклоалканам). 2. Пространственная (геометрическая) изомерия ( цис-, транс- изомерия). Пространственная (цис-, транс-) изомерия наблюдается в том случае, когда каждый из атомов углерода при двойной связи связан с двумя различными заместителями. Расположение пары одинаковых заместителей у ненасыщенных атомов углерода по одну сторону плоскости двойной связи образует цис-изомер, по разные стороны - транс-изомер (рис. 2).
цис-бутен-2 транс-бутен-2 (т.пл. -139, 30 С) (т.пл. -105, 80 С) Рис.2. Цис-, транс-изомерия для бутена-2 Физические свойства. Молекулы алкенов малополярны. Соединения состава С2 – С4 – газы, С5 – С16 – жидкости, начиная с С17 – твердые вещества. Алкены плохо растворимы в воде. Химические свойства алкенов определяются наличием в их молекуле двойной связи. Для алкенов характерны реакции электрофильного присоединения (АЕ), полимеризации и окисления. Реакции электрофильного присоединения протекают по схеме:
Электронная плотность p-связи достаточно подвижна и легко вступает во взаимодействие с электрофильными частицами - катионами (чаще всего 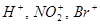 ), у которых есть свободная валентная орбиталь. Реагент ХY – это Br2, H2O, HCI, HBr, НOCI, H2SO4 и др. ), у которых есть свободная валентная орбиталь. Реагент ХY – это Br2, H2O, HCI, HBr, НOCI, H2SO4 и др.
Поскольку реакции электрофильного присоединения – это ионные процессы, полярность связи в реагенте ( I. Реакции присоединения
1. Гидрирование (образование алканов): пропен пропан
2. Галогенирование (образование дигалогеналканов): Обесцвечивание бромной воды – качественная реакция на двойную связь. 3. Гидрогалогенирование (образование моногалогеналканов) . У несимметричных алкенов присоединение полярных молекул типа Н-Х (Х = CI, Br, OH, CN и т.п.) протекает по правилу Марковникова: водород присоединяется к наиболее гидрогенизированному атому углерода.
Стадией, определяющей процесс, является электрофильная атака по двойной связи, следовательно, катион водорода  будет преимущественно присоединяться к тому из атомов углерода, на котором больше отрицательный заряд. Распределение зарядов определяется смещением p-электронной плотности под влиянием заместителей. будет преимущественно присоединяться к тому из атомов углерода, на котором больше отрицательный заряд. Распределение зарядов определяется смещением p-электронной плотности под влиянием заместителей.
Электродонорные заместители, например, алкильные радикалы, обладающие положительным индуктивным эффектом (+I-эффект), смещают p-электронную плотность к наиболее гидрогенизированному атому углерода и создают на нем частичный отрицательный заряд. Присоединение протекает по правилу Марковникова.
Электроотрицательные заместители, например, группы –СООН, -NO2, -CCI3 и др. вызывают обратные электронные эффекты. Присоединение протекает против правила Марковникова: акриловая кислота 3-бромпропановая кислота (пропеновая кислота)
В присутствии пероксидов полярные молекулы НХ реагируют с алкенами также против правила Марковникова: пропен 1-бромпропан Этот эффект носит название «пероксидного эффекта», реакция протекает по радикальному механизму.
4. Гидратация . При гидратации этилена образуется первичный спирт, при гидратации гомологов в соответствии с правилом Марковникова - вторичные и третичные спирты: 5. Алкилирование бензола и его производных (реакция Фриделя-Крафтса). Это реакция – реакция присоединения для алкенов, но для аренов – это реакция замещения:
бензол этилбензол II. Реакция полимеризации алкенов и их производных в присутствии кислот протекает по механизму АЕ:
где R = H, CH3, CI, C6H5 и т.д. Молекула СН2=СН-R называется мономером, полученное соединение – полимером, число n – степенью полимеризации. Полимеризацией производных алкенов получают полиэтилен, полипропилен, поливинилхлорид, полистирол и другие полимеры. III. Реакции окисления алкенов.
а) горение:
б) мягкое окисление (гидроксилирование) водным раствором перманганата калия (реакция Вагнера): пропандиол-1, 2 в) жесткое окисление (в кислой среде или в водном растворе перманганата калия при нагревании протекает с разрывом двойной связи) Если в молекуле алкена двойная связь между атомами углерода располагается в начале молекулы (ен-1, 2), то при окислении образуется углекислый газ и соответствующая кислота (или кетон), например,

Если двойная связь в молекуле алкена находится не в начале молекулы, то при окислении образуются соответствующие кислоты (или кетоны): 5CH3CH=CHCH3 + 4KMnO4 + 6H2SO4 = 10CH3COOH + 4MnSO4 + 2K2SO4 + 6H2O При действии водного раствора перманганата калия при нагревании необходимо учитывать щелочной характер среды, например:
3CH3CH2CH=CH2 + 10KMnO4  3CH3CH2COOK + 3K2CO3 +10MnO2¯ +KOH + 4Н2О 3CH3CH2COOK + 3K2CO3 +10MnO2¯ +KOH + 4Н2О 
IV. Галогенирование в алкильное положение. Гомологи этилена могут вступать в реакции радикального замещения с галогенами (CI2, Br2) при нагревании. Легче замещается атом водорода a-положении к двойной связи.
пропен 3-хлорпропен Получение алкенов. 1. Дегидрирование алканов: CnH2n+2
2. Гидрирование алкинов: CnH2n-2 + H2
3. Крекинг алканов (см. «Алканы») 4. Дегидратация спиртов. Реакция протекает в соответствии с правилом Зайцева: при отщеплении молекулы типа НХ атом водорода отщепляется от наименее гидрогенизированного атома углерода. Легче всего дегидратируются третичные спирты, труднее – вторичные, еще труднее – первичные:
пропанол-1 пропен 5. Дегидрогалогенирование моногалогеналканов спиртовым раствором щелочи. (по правилу Зайцева):
6. Дегалогенирование вицинальных дигалогеналканов под действием магния или цинка (атомы галогена находятся у соседних атомов углерода):
Пример 1. Какие соединения имеют цис- и транс-изомеры? 1) 2, 3-дихлорпентен-2 2) 1, 2-диметилциклопентан 3) 3-метилпентен-1 4) 2-метилбутен-2
Решение. Напишем графические формулы предложенных соединений:
В молекуле соединения (1) каждый из атомов углерода при двойной связи связан с двумя различными заместителями и оба атома имеют одинаковые заместители (CI). Данное соединение может существовать в виде цис- и транс-изомеров. Соединение (2) – представитель углеводородов ряда циклоалканов. Одинаковые заместители (СН3-) у соседних углеродных атомов могут по разному располагаться относительно плоскости кольца, образуя цис- и транс-изомеры. В соединениях (3) и (4) один из атомов углерода при двойной связи имеет два одинаковых заместителя (Н- или СН3-), следовательно, у этих соединений не существуют цис- и транс-изомеры. Ответ: 1, 2
АЛКИНЫ
Алкины – непредельные углеводороды, в молекулах которых ненасыщенные атомы углерода находятся в sp-гибридизации и связаны тройной связью (одна σ -связь и две π -связи). В таком состоянии гибридизации атомы углерода образуют линейные молекулы. Угол между гибридными орбиталями составляет 1800. Длина тройной связи между атомами углерода равна 0, 120 нм. Энергия тройной связи составляет 826 кДж/моль.
Рис. 4 Строение молекулы этина (ацетилена)
Общая формула алкинов С n H2 n-2 (n ≥ 2). Номенклатура. Названия алкинов строят подобно названиям алканов с заменой окончания –ан на –ин. В качестве основы выбирают самую длинную цепь, содержащую тройную углерод-углеродную связь, и нумеруют ее с того конца, к которому ближе тройная связь. Положение тройной связи указывают в конце названия номером атома, у которого она начинается, например,
4-метилгексин-2 Изомерия. Для алкинов характерна структурная изомерия: а) изомерия углеродного скелета; б) изомерия положения тройной связи;
в) межклассовая изомерия. Алкины изомерны циклоалкенам и алкадиенам.
Например, алкин состава С5Н8 имеет структурные изомеры: плюс 7 изомерных алкадиенов и 8 изомерных циклоалкенов. Геометрическая изомерия для алкинов не существует, т.к. атомы углерода, связанные тройной связью, и соседние углеродные атомы лежат на одной прямой и имеют линейное строение.
Физические свойства алкинов схожи со свойствами алканов и алкенов. С2 – С4 – газы, С5 – С16 – жидкости, начиная с С17 – твердые вещества. Алкины нерастворимы в воде и хорошо растворимы в неполярных органических растворителях. Химические свойства алкинов обусловлены наличием в их молекуле тройной связи. Алкины вступают в большинство реакций электрофильного присоединения (АЕ), характерных для двойной связи алкенов, причем направление присоединения подчиняется правилу Марковникова. Реакции присоединения для алкинов протекают в две стадии и медленнее, чем для алкенов, поскольку тройная связь обладает меньшей поляризуемостью, короче двойной, т.е. является более прочной.
I. Реакции присоединения 1. Гидрирование: НСº СН 2.
Галогенирование: Обесцвечивание бромной воды Br2(aq) – качественная реакция на кратную связь.
3.
Гидратация (реакция Кучерова). Реакция катализируется кислотой и солями двухвалентной ртути (Hg+2). Присоединение воды происходит легче, чем у алкенов. На первой стадии идет образование енола – неустойчивого соединения, который затем перегруппировывается (кето-енольная перегруппировка) в более стабильные карбонильные соединения. При гидратации ацетилена получается уксусный альдегид (этаналь), гомологи ацетилена в этих условиях образуют кетоны.
4. Гидрогалогенирование. Присоединение галогеноводорода протекает в две стадии, но менее активно, чем у алкенов.
5. Присоединение синильной кислоты (HCN): НСº СН + HCN акрилонитрил
6. Присоединение спиртов (реакция Фаворского-Шостаковского): HСº СН + СН3OH винилметиловый эфир
7. Присоединение карбоновых кислот: HСº СН + СН3COOH винилацетат II. Реакции полимеризации. В присутствии катализаторов алкины способны реагировать друг с другом. В зависимости от условий проведения реакции могут образовываться димеры, циклические тримеры или линейные полимеры.
2HСº СН ацетилен винилацетилен (бутен-3-ин-1) В промышленности винилацетилен – исходное сырье для получения хлоропрена, который является мономером хлоропренового каучука.
хлоропрен 2.
Тримеризация ацетилена и его гомологов. Образуются ароматические углеводороды.
III. Реакции окисления
СnН2n-2 + 2. Окисление. Алкины легко обесцвечивают водный раствор перманганата калия (качественная реакция на кратную связь). Состав продуктов реакции зависит как от строения исходного алкина, так и от условий проведения процесса. Водным раствором перманганата калия без разрыва s-связей в молекуле окисляется только ацетилен, образуя оксалат калия. 3HСº СН + 8KMnO4 ® 3КООС-СООК + 8MnO2 + 2KOH + 2Н2О оксалат калия Гомологи ацетилена окисляются перманганатом калия, как в нейтральной, так и в кислой среде, c разрывом тройной связи, образуя соответствующие кислоты. 3CH3Cº CH + 8KMnO4 5CH3Cº CH + 8KMnO4 + 12H2SO4 ® 5CH3COOH + 5CO2 + 8MnSO4 + 4K2SO4 + 12H2O IV. Реакции замещения 1) Алкины с концевой тройной связью (терминальные алкины). Соединения, содержащие этинильную группу (− Сº СН), обладают специфическими свойствами, которые обусловлены кислотным характером атома водорода. Кислотность терминальных алкинов можно объяснить тем, что в образовании связи − Сº С− Н участвует sp-орбиталь атома углерода, обуславливающая более сильную поляризацию s-связи. Атом водорода при тройной связи способен замещаться на металл. При взаимодействии терминальных алкинов с солями ртути(II), меди(I) или серебра образуются комплексные нерастворимые соединения (ацетилениды), например:
HСº СН + 2[Ag(NH3)2]OH ® AgСº СAg ¯ + 4NH3 + 2H2O СН3-Сº СН + [Cu(NH3)2]Cl ® СН3-Сº C-Cu ¯ + NH4Cl + NH3 СН3-Сº СН + CH3MgI ® СН3-Сº C-MgI ¯ + CH4
Образование темно-красного осадка соли меди служит качественной реакцией на этинильную группу. Ацетилениды, как и соли очень слабых кислот, легко разлагаются при действии сильных кислот с выделением исходного алкина, поэтому эти свойства можно использовать для выделения ацетилена и алкинов с концевой тройной связью из смеси углеводородов. СН3-Сº C-Ag + HCl ® СН3-Сº СН + AgCl ¯
Ионные соединения образуются при взаимодействии терминальных алкинов с сильными основаниями (например, NaNH2, KNH2):
2R-Cº CH + 2NaNH2 ® 2R-Cº C-Na + H2
Синтезированные таким образом карбанионы можно алкилировать алкингалогенидами. Эта реакция представляет собой один из основных методов получения алкинов с более длинной углеродной цепью.
2) Галогенирование в алкильное положение. Гомологи ацетилена могут вступать в реакции радикального замещения с галогенами (CI2, Br2) при нагревании. Легче замещается атом водорода a-положении к тройной связи:
пропин 3-хлорпропин Получение алкинов
1.
Дегидрогалогенирование вицинальных и геминальных дигалогеналканов под действием спиртового раствора щелочи. Отщепление Н-GaI протекает по правилу Зайцева.
2.
Дегидрирование алкенов: 3. Взаимодействие ацетиленидов с первичными алкилгалогенидами (метод увеличения углеродной цепи): CH3-Cº C-Ag + CH3I ® CH3-Cº C-CH3 + AgI CH3-Cº C-MgBr + CH3Br ® CH3-Cº C-CH3 + MgBr2
4. Получение ацетилена из карбида кальция: CaC2 + 2H2O ® Ca(OH)2 + C2H2
5. Получение ацетилена пиролизом метана: 2CH4
Пример 1. Изомерами являются: 1) 3-метилциклогексен 2) 3-этилгексадиен-1, 4 3) 2-изопропилбутадиен-1, 3 4) 4, 4-диметипентин-2
Решение. Изомеры – это вещества, имеющие одинаковый молекулярный состав, но различное химическое строение. Напишем структурные формулы предложенных соединений и определим их молекулярный состав.
Как видно, углеводороды (1), (3) и (4) имеют одинаковый молекулярный состав, но разное строение, следовательно, они являются изомерами. Ответ: 1, 3, 4
Пример 2. Какие из перечисленных соединений имеют пространственную (геометрическую) изомерию: 1) 2, 3-диметилбутен-2 2) 1, 4-дихлорциклогексан 3) 1-хлорпропен 4) 2-бромбутин-3
Решение. Геометрическая изомерия в ряду алкенов наблюдается в том случае, если у каждого атома углерода при двойной связи находятся два разных заместителя. В молекуле 2, 3-диметилбутена-2 атомы углерода С2 и С3 содержат одинаковые заместители (метильные группы). Это соединение не имеет пространственных изомеров.
В молекуле 1, 2-дихлорциклогексана из-за отсутствия свободного вращения вокруг С-С-связей цикла одинаковые заместители могут находиться по одну сторону от плоскости цикла или по разные. Таким образом, геометрическая изомерия возможна. В молекуле 1-хлорпропена каждый атом углерода при двойной связи (С1 и С2) имеет два разных заместителя (СН3- и CI) и два одинаковых заместителя (атомы водорода); это соединение может существовать в виде цис- и транс-изомеров.
Углеводород 2-бромбутин-3 принадлежит ряду алкинов, у которых отсутствует пространственная изомерия. Ответ: 2, 3
Пример 3. Определите вещества «A», «B», «C», «D» в предложенной схеме превращений: Решение. Ключевым веществом для решения данного примера является соединение «С». Стрелки (6) и (7) означают, что исходное веществ пропен и соединение («С») связаны возможностью взаимопревращения. Предположим, что реакция 6 – гидрирование пропена, а реакция 7 – дегидрирования пропана. Согласно схеме «Пропен
дегидрогалогенированием (реакция 5). Ответ: «А» - 1, 2-дибромпропан; «В» – пропин; «С» – пропан; «D» – 2-бромпропан.
Пример 4. Газообразный углеводород объемом 10 мл смешали с 70 мл кислорода. После сгорания, конденсации воды и приведения конечной смеси к н.у. объем газовой смеси составил 65 мл. Продукты сгорания пропустили через раствор гидроксида натрия, при этом объем уменьшился до 45 мл. Определите молекулярную формулу исходного углеводорода, считая, что все объемы измерены при н.у. Решение. Пусть исходный газообразный углеводород имеет формулу СхНy. Образовавшиеся 65 мл газовой смеси содержат углекислый газ, который поглощается при пропускании смеси через раствор щелочи. Поглотилось 20 мл СО2 (65 – 45 = 20 мл) и осталось 45 мл непрореагировавшего кислорода. Следовательно, израсходовалось 25 мл кислорода (70 – 45 = 25 мл). Запишем уравнение реакции горения углеводорода СхНy:
Отсюда находим: х = 2 ( Ответ: С2Н2 (этин)
БЕНЗОЛ. ПРАВИЛА ОРИЕНТАЦИИ
Ароматические углеводороды – это соединения, содержащие в молекуле одно или несколько бензольных ядер. Родоначальником класса ароматических углеводородов является бензол. Общая формула гомологического ряда бензола С n H2 n-6 (n ≥ 6). Строение молекулы бензола. Согласно квантово-механической теории химических связей все шесть атомов углерода в молекуле бензола находятся в sp2-гибридизации. Каждый атом углерода образует три σ -связи, которые лежат в одной плоскости под углом 1200. Каждый из шести негибридизованных р-электронных облаков атомов углерода располагаются перпендикулярно плоскости σ -связи, образуя единое π -электронное облако. В молекуле бензола осуществляется круговое сопряжение, в результате чего в молекуле бензола нет ни двойных, ни одинарных связей. Длина всех С-С-связей в цикле равна 0, 139 нм.
Рис. 5 Строение молекулы бензола
Номенклатура производных бензола. Ароматические углеводороды - производные ряда бензола - можно рассматривать как продукт замещения атомов водорода в бензоле одновалентными радикалами. Названия составляют из названий
радикалов боковых цепей с добавлением окончания - бензол. Некоторые производные бензола имеют тривиальные названия (например, толуол, кумол).
Простейшие одновалентные арильные радикалы имеют общую формулу С n H2 n-7. Бензол образует радикал фенил (С6Н5-), толуол – радикал бензил (С6Н5СН2− ). Изомерия. Структурная изомерия в гомологическом ряду бензола обусловлена взаимным расположением заместителей в ядре. Однозамещенные производные бензола не имеют изомеров. Физические свойства. Первые члены гомологического ряда бензола – бесцветные жидкости со специфическим запахом. Они легче воды и плохо в ней растворяются. Хорошо растворяются в органических растворителях и сами являются хорошими растворителями для многих органических веществ. Бензол – сильно токсичное вещество. Химические свойства. Характерной особенностью ароматических соединений бензольного ряда является их склонность вступать в реакции, не приводящие к нарушению ароматической системы, - это реакции замещения, которые протекают легче, чем у алканов. При явной ненасыщенности состава (-8е по сравнению с С6Н14) бензол проявляет насыщенный характер. Реакции присоединения и окисления проходят с трудом. Чаще всего протекают реакции электрофильного замещения SЕ. Ароматическое ядро является удобным объектом для электрофильных реагентов.
I. Реакции электрофильного замещения ( SE).
1. Галогенирование (CI2, Br2 в присутствии катализаторов AICI3, FeCI3, AIBr3. I2 в данную реакцию не вступает): хлорбензол
При действии избытка галогена можно получить ди- и полигалогензамещенные. Реакционная способность галогенов убывает в ряду: F2 > Cl2 > Br2 3.
Нитрование (проводят смесью концентрированных азотной и серной кислот). Действующий агент – нитроний-катион 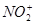 : : 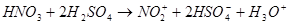
нитробензол
3. Сульфирование (проводят концентрированной серной кислотой или олеумом при нагревании):
Сульфобензол (бензолсульфокислота)
4. Алкилирование (получение гомологов бензола) проводят: а) галогеналканами в присутствии катализаторов (AlCl3, FeBr3) – реакция Фриделя-Крафтса
метилбензол (толуол) б) алкенами
этилбензол
кумол (изопропилбензол) 5. Ацилирование (введение группы ацил R-C(O)-):
ацетилхлорид ацетофенон (хлорангидрид уксусной кислоты) (метилфенилкетон) Введение второго заместителя. Правила ориентации. Место введения второго электрофильного заместителя в бензольное кольцо определяется природой уже имеющегося заместителя в ядре. Электронное взаимодействие радикала и бензольного ядра реализуется через индуктивный и мезомерный эффекты. Индуктивный эффект (J-эффект) передается по σ -углерод-углеродной связи, а мезомерный (М-эффект) – по системе сопряженных π -связей (см. тема 1, модуль 1.1). Наиболее сильно электронное влияние заместителя проявляется в о- и п-положениях бензольного кольца по сравнению с м-положением, нарушая симметрию π -сопряженного электронного облака молекулы. В зависимости от проявляемого заместителями суммарного эффекта (индуктивного и мезомерного) их можно разделить на две группы: 1) электронодонорные (ориентанты I-го рода) и 2) электроноакцепторные (ориентанты II-го рода). Заместители I-го рода, обладающие +М и (или) + J-эффектом, повышают электронную плотность бензольного кольца в о- и п-положениях, тем самым облегчая вступление второго заместителя в эти положения. -ОН; -OR; -NH2; -СI (- Br, -I); алкилы
+ М > -J + М > -J + М > -J -J > +M + J При нитровании гомологов бензола избытком азотной кислоты образуются тризамещенные продукты. Аналогично протекает реакция галогенирования с избытком галогена:
2, 4, 6-трибромтолуол толуол 2, 4, 6-тринитротолуол
Заместители II-го рода, обладающие –М или –J-эффектами, понижают электронную плотность бензольного кольца, тем самым затрудняют введение второго заместителя и направляют его преимущественно в м-положение:
бензойная кислота м-нитробензойная кислота
Если в бензольном кольце уже находятся два заместителя (ориентанты I-го и II-го рода) и действия их не согласованы, то преимущество при ориентировании имеет ориентант I-го рода.
согласованное действие заместителей несогласованное действие заместителей (*) I-го рода (·) II-го рода (*) I-го рода (·) II-го рода II. Реакции присоединения. Эти реакции протекают в жестких условиях и приводят к нарушению ароматической системы.
1. Гидрирование. Реакция идет при нагревании и давлении в присутствии катализаторов (Ni, Pt, Pd): циклогексан
2. Галогенирование парами хлора при ультрафиолетовом облучении. Реакция протекает по радикальному механизму: гексахлорциклогексан (гексахлоран) III. Окисление. Окисление бензола в отсутствие активирующих добавок протекает чрезвычайно трудно. Щелочной раствор перманганата калия реагирует с бензолом очень медленно и только при нагревании. При каталитическом окислении воздухом (4000С, катализатор V2O5) или хлоратом калия (при нагревании в присутствии кислых катализаторов) происходит разрыв циклической системы с образованием малеинового ангидрида:
малеиновый ангидрид
Окисление гомологов бензола протекает достаточно легко (окислители: перманганат калия в водном или в сернокислом растворе, дихромат калия, разбавленная азотная кислота и др.). При этом окислению подвергается алкильные радикалы по α -углеродному атому. бензоат калия п-этилтолуол терефталевая кислота IV. Реакция замещения гомологов бензола в алкильном радикале. Реакция галогенирования протекает по радикальному механизму (SR) на свету или при нагревании:
толуол бензилхлорид фенилдихлорметан фенилтрихлорметан
этилбензол 1-фенил-1-хлорэтан Классификация спиртов
Многоатомные спирт ы
Многоатомные спирты – это производные углеводородов, содержащие в молекуле две и более гидроксильные группы. Многоатомные спирты в зависимости от числа гидроксильных групп в молекуле делятся на двухатомные (две гидроксильные группы), или диолы, трехатомные (три гидроксильные группы), или триолы и т.д. Представителем диолов является этиленгликоль, а триолов - глицерин. Они обладают несколько более кислым характером, чем предельные одноатомные спирты, но растворы их имеют нейтральную реакцию среды.
Общая формула многоатомных спиртов С n H2 n+2Ох, где х = 2, 3, ….. Физические свойства. Этиленгликоль и глицерин – вязкие бесцветные жидкости, сладкие на вкус, хорошо растворимые в воде и плохо растворимые в органических растворителях. Химические свойства. Химические свойства многоатомных спиртов повторяют свойства одноатомных спиртов. 1. Образование гликолятов и глицератов:
а) взаимодействие с натрием или калием б) взаимодействие с гидроксидами тяжелых металлов (качественная реакция на многоатомные спирты)
хелатное соединение ярко-синего цвета
2. Взаимодействие с галогеноводородами: этиленхлоргидрин Вторая гидроксильная группа замещается труднее - только под действием PCl5 или SOCl2.
3. Образование сложных эфиров: а) с азотной кислотой глицерин глицеринтринитрат (тринитроглицерин) Тринитроглицерин способен разлагаться с выделением теплоты и большого количества газов:
б) с карбоновыми кислотами
4. Отношение к нагреванию: а) межмолекулярная дегидратация
б) внутримолекулярная дегидратация
5. Окисление: глиоксаль щавелевая кислота (этандиаль)
2-оксопропандиовая кислота (кетомалоновая кислота) Получение. Получают многоатомные спирты теми же способами, что и одноатомные. Отдельные представители этих спиртов получают специальными методами. 1. Из синтез-газа при нагревании, высоком давлении и катализаторе: 2СО + 3Н2 → СН2(ОН)− СН2(ОН) 3СО + 4Н2 → СН2(ОН)− СН(ОН) − СН2(ОН)
2. Гидролиз дигалогеналканов водным раствором щелочи: ClCH2-CH2Cl + 2NaOH 3. Окисление алкенов (окисление по Вагнеру).
ФЕНОЛЫ Фенолы – это органические соединения, в молекулах которых одна или несколько гидроксильных групп непосредственно связаны с ароматическим ядром. Общая формула фенолов С n H2 n-6Ох, где х = 1, 2, 3, ….. По числу гидроксильных групп различают одно-, двух- и многоатомные фенолы:
фенол о-крезол пирокатехин пирогаллол (карболовая кислота) (2-метилфенол) (1, 2-дигидроксибензол) (1, 2, 3-тригидроксибензол) Строение фенола. Особенности химических свойств фенола определяются взаимным влиянием гидроксильной группы и бензольного кольца.
1.Влияние бензольного кольца на гидроксильную группу. Неподеленная пара электронов атома кислорода вступает в сопряжение с p-электронным облаком бензольного кольца, это приводит к уменьшению электронной плотности атома кислорода, что в свою очередь вызывает повышение полярности связи -О-Н. Водород становится более подвижным: фенолы в отличие от предельных спиртов обладают слабыми кислотными свойствами. 2. Влияние гидроксильной группы на бензольное кольцо. В результате сопряжения неподеленной пары электронов атома кислорода гидроксильной группы с p-электронами бензольного кольца происходит перераспределение электронной плотности внутри кольца и увеличение ее в орто- и пара-положениях (-ОН-группа – ориентант I-го рода). Изомерия. Изомерия фенолов обусловлена положением гидроксильной группы. Для двухатомных фенолов известны три изомера - орто-, мета- и пара -изомеры. Например,
Физические свойства Фенолы - кристаллические вещества (м-крезол – жидкость), обладающие сильным характерным запахом, плохо растворимы в холодной воде и хорошо в горячей воде, а также в водных растворах щелочей. Важнейшим представителем этого класса является фенол С6Н5ОН. Химические свойства. Фенол – очень слабая кислота. I. Реакции гидроксильной группы 1. Образование фенолятов: а) со щелочными металлами
фенолят натрия
б) с оксидами щелочных металлов
в) со щелочами, т.к. кислотность фенола выше, чем у предельных спиртов
Под действием сильных кислот (HCl, H2SO4) гидролиз фенолятов протекает необратимо: Фенол значительно слабее угольной кислоты (» 3000 раз), поэтому при действии углекислого газа на раствор фенолята образуется свободный фенол.
Кислотные свойства фенолов ослабевают при введении в бензольное кольцо заместителей I-го рода и усиливаются при введении заместителей II-го рода. 2. Образование эфиров: а) сложных эфиров. В отличие от спиртов фенолы не образуют эфиры при непосредственном взаимодействии кислот и спиртов, их получают только через феноляты:
фенилацетат (фениловый эфир уксусной кислоты)
б) простых эфиров этоксибензол (фенилэтиловый эфир)
3. Восстановление: 4. Качественной реакцией на фенолы является сиреневое окрашивание раствора FeCI3. II. Реакции бензольного кольца. Реакции электрофильного замещения (SЕ) в феноле протекают легче, чем в бензоле.
1. Галогенирование. В отличие от бензола фенол реагирует с бромной водой, образуя осадок 2, 4, 6-трибромфенола:
2. Нитрование:
3. Сульфирование:
о-фенолсульфокислота
п-фенолсульфокислота
4. Алкилирование: 4-трет-бутилфенол
5. Конденсация с альдегидами:
2-гидроксиметилфенол
Эта реакция лежит в основе получения в промышленности фенолформальдегидных смол.
6. Гидрирование: циклогексанол 7. Окисление. Фенолы окисляются легко, причем образуется смесь различных продуктов окисления. Получение фенола
1. Большое количество фенолов содержится в каменноугольной смоле и древесном дегте. 2. Кумольный синтез (1949 г., Сергеев): 3. Сплавление натриевых солей бензолсульфокислот со щелочами:
4. Гидролиз моногалогенпроизводных (проходит с трудом в жестких условиях: 40%-ный раствор NaOH, температура и давление):
Ароматические спирты Ароматические спирты – это производные ароматических углеводородов, содержащие гидроксильную группу в боковой цепи.
фенилметанол 3-фенилпропанол-2 (бензиловый спирт) По способам получения и химическим свойствам ароматические спирты сходны с предельными одноатомными спиртами.
АЛЬДЕГИДЫ И КЕТОНЫ
Органические соединения, в молекулах которых содержится карбонильная группа (> С=O), называются карбонильными соединениями (оксосоединениями). Карбонилсодержащие соединения делятся на альдегиды - карбонильная группа соединена с атомом водорода и углеводородным радикалом и на кетоны – карбонильная группа соединена с двумя углеводородными радикалами. В зависимости от строения углеводородных радикалов альдегиды и кетоны бывают алифатическими, алициклическими и ароматическими. Общая формула предельных (алифатических) альдегидов и кетонов С n H2 n O.
Номенклатура. По международной номенклатуре названия альдегидов и кетонов производятся от названия соответствующих углеводородов с прибавлением окончания - аль для альдегидов и -он для кетонов. Нумерация для альдегидов начинается с карбонильного атома углерода, для кетонов - с того края, к которому ближе расположена карбонильная группа. Для альдегидов часто употребляют названия, произведенные от тривиальных названий соответствующих карбоновых кислот. Для кетонов также распространена рациональная номенклатура, по которой названия строятся из названий радикалов, связанных с карбонильной группой, и слова кетон.
Строение карбонильной группы. Атом углерода карбонильной группы находится в состоянии sp2-гибридизации. Три гибридные орбитали располагаются на плоскости под углом 120 ° и образуют σ -связи с атомами водорода и углерода в молекуле альдегида или с атомами углерода в молекуле кетона. Негибридизованные р-орбитали атомов углерода и кислорода при боковом перекрывании образуют π -связь. Электронная плотность π -связи смещена к более электроотрицательному атому кислорода, в результате чего на атоме кислорода возникает частичный отрицательный заряд (δ -), а на атоме углерода – частичный положительный заряд (δ +)/ Полярность карбонильной группы оказывает существенное влияние на физические и химические свойства оксосоединений (чем сильнее поляризация связи, тем соединение более реакционноспособно).
Изомерия. Для предельных оксосоединений характерна структурная изомерия. 1. Изомерия углеродного скелета радикалов; 2. Изомерия положения карбонильной группы (для кетонов); 3. Межклассовая изомерия: альдегиды изомерны кетонам, непредельным одноатомным и циклическим спиртам. Физические свойства альдегидов. При нормальных условиях только формальдегид является газом, оксосоединения (С2 – С5) – жидкости, С6 – Сn − твердые вещества, нерастворимые в воде. Ацетальдегид и ацетон - бесцветные жидкости, хорошо растворимые в воде. Химические свойства альдегидов. Химические свойства альдегидов обусловлены наличием поляризованной карбонильной группы. Химические свойства делят на три группы: 1) реакции с участием карбонильной группы; 2) реакции по углеродному скелету; 3) реакции окисления. I. Реакции по карбонильной группе . Реакции нуклеофильного присоединения (А N) Эти реакции протекают за счёт разрыва связи С=О. 1) Восстановление – присоединение водорода. Реакция идет при нагревании и с использованием катализатора никеля Ni или платины Pt. При взаимодействии альдегидов с водородом образуются первичные спирты, кетонов – вторичные спирты.
2. Присоединение синильной кислоты (образование гидроксинитрилов, или циангидринов).
Продукты реакции являются исходными веществами для получения соответствующих α -гидрокси- и α -аминокислот. 3. Присоединение спиртов (образование ацеталей). Альдегиды реагируют со спиртами в мягких условиях, кетоны - только в присутствии катализаторов (AlCl3, FeBr3).
полуацеталь ацеталь 4. Присоединение воды. Реакция гидратации формальдегида легко протекает с образованием гидрата:
гидрат формальдегида
5. Присоединение гидросульфита натрия ( NaHSO3). В реакцию вступают все альдегиды алициклического ряда. Качественная реакция.
6. Реакции полимеризации (линейная и циклическая полимеризации): а) линейная полимеризация. Под действием света происходит линейная полимеризация 40%-ного водного раствора формальдегида с образованием параформа.
б) циклическая полимеризация. Альдегиды самопроизвольно или под действием кислот могут вступать в реакции тримеризации или тетрамеризации, при этом образуются шести- и восьмичленные циклы с чередующимися атомами углерода и кислорода в молекуле. триоксиметилен
паральдегид
Ароматические альдегиды и кетоны в реакции полимеризации не вступают. 7. Реакции поликонденсации. Реакция поликонденсации – это реакция образования высокомолекулярного соединения (полимера) с выделением побочного низкомолекулярного вещества (H2O). Альдегиды вступают в реакцию поликонденсации с фенолом (анилином и т.д.) с образованием соответствующих полимерных смол. Реакции протекают ступенчато: сначала образуется димер, затем тример и т.д.
2-гидроксиметилфенол
II. Реакции окисления являются качественными на альдегиды 1. Реакция серебряного зеркала – реакция взаимодействия альдегидов с аммиачным раствором оксида серебра (Ag2O/NH3 или [Ag(NH3)2]OH). Реакция идет при нагревании.
Исключение для формальдегида
2) Реакция «медного зеркала» - со свежеосаждённым гидроксидом меди(II). Реакция идет при нагревании.
2. Горение: CnH2nO2 + III. Реакции замещения. 1. Замещение атома кислорода карбонильной группы:
2. Замещение атома водорода в радикале в α -положении к карбонильной группе. Сильно поляризованная карбонильная группа в молекулах альдегидов и кетонов вызывает понижение электронной плотности (δ +) на атомах углерода в α -положении, поэтому атомы водорода приобретают повышенную реакционную способность и способны отщепляться в виде протона: Галогенирование:
2-бромбутаналь (a-броммасляный альдегид) КЕТОНЫ Кетоны – это органические соединения, в молекулах которых карбонильная группа соединена с двумя углеводородными радикалами.
Номенклатура кетонов: к названию соответствующего углеводорода добавляют суффикс –он, или указывают названия радикалов от меньшего к большему с добавлением слова кетон.
Изомерия кетонов 1) изомерия углеродного скелета; 2) изомерия положения карбонильной группы; 3) межклассовая изомерия. Например: изомеры кетона с общей формулой С6Н12О
Получение альдегидов
1. Окисление первичных спиртов:
2. Гидроформилирование алкенов (оксосинтез):
3. Гидролиз 1, 1-дигалогенпроизводных: 4. Гидратация ацетилена по реакции Кучерова:
5. Через виниловые эфиры:
6. Восстановление хлорангидридов карбоновых кислот: 7.
Окисление алкенов ряда этилена кислородом воздуха в присутствии PdCl2 и CuCl2.
Получение кетонов 1. Окисление вторичных спиртов:
2. Гидратация алкинов (реакция Кучерова)
3. Гидролиз геминальных дигалогенпроизводных:
4. Декарбоксилирование Са- и Ва-солей карбоновых кислот при нагревании:
5. Синтез ароматических кетонов по методу Фриделя-Крафтса:
6. Кумольный способ. Промышленный способ получения простейшего из фенолов, который экономически выгоден, т.к. одновременно с фенолом получается и другой важный продукт – ацетон: 7. Окисление разветвленных алкенов:
КАРБОНОВЫЕ КИСЛОТЫ
Карбоновые кислоты – это органические соединения, содержащие в молекуле одну или несколько карбоксильных групп, соединённых с углеводородным радикалом.
Общая формула карбоновых кислот: R(COOH)n, где n ≥ 1. Классификация карбоновых кислот.
1) По числу карбоксильных групп (по основности)
- одноосновные (монокарбоновые), содержащие одну карбоксильную группу. Например: СН3СООН – уксусная кислота, С15Н31СООН – пальмитиновая кислота;
- двухосновные (дикарбоновые), содержащие две карбоксильные группы. Например: НООС− СООН щавелевая кислота,
2) По строению углеводородного радикала карбоновые кислоты делятся на:
- предельные, в углеводородном радикале все связи одинарные. Например: С3Н7СООН – масляная кислота;
- непредельные, в углеводородном радикале содержится кратная связь. Например СН2=СН− СООН – акриловая кислота;
- ароматические, углеводородный радикал содержит бензольное кольцо. Например:
Номенклатура К названию соответствующего углеводорода добавляется окончание –овая и слово кислота. Существуют еще тривиальные (исторические) названия.
IV. Дикарбоновые кислоты | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| НООС-СООН | этандиовая | щавелевая | оксалаты | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| НООС-СН2-СООН | пропандиовая | малоновая | малонаты | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| НООС-(СН2)2-СООН | бутандиовая | янтарная | сукцинаты | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| НООС-(СН2)3-СООН | пентандиовая | глутаровая | глутараты | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| НООС-(СН2)4-СООН | гександиовая | адипиновая | адипинаты | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| НООС-СН=СН-СООН | цис-бутен-2-овая | малеиновая | малеаты | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| транс-бутен-2-овая | фумаровая | фумараты | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
V. Ароматические кислоты | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| C6H5COOH | фенилкарбоновая | бензойная | бензоаты | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| C6H4(OH)COOH | о-гидроксибензойная | салициловая | салицилаты | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| C6H4(NH2)COOH | о-аминобензойная | антраниловая |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| C6H4(COOH)2 | о-карбоксибензойная | фталевая | фталаты | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| м-карбоксибензойная | изофталевая | изофталаты | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| п-карбоксибензойная | терефталевая | терефталаты | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Оксикислоты | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| НО-СН2-СООН | гидроксиэтановая | гликолевая |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| СН3-СН(ОН)-СООН | 2-гидроксипропановая | молочная | лактаты | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| НООС-СН(ОН)-СООН | гидроксипропандиовая | тартроновая (оксималоновая) |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| НООС-СН2СН(ОН)-СООН | гидроксибутандиовая | яблочная (оксиянтарная) | малаты | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| НООС-СН2С(ОН)(СООН)СН2-СООН | 3-гидрокси-3-карбоксипен-тандиовая | лимонная | цитраты | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| НООС-СН(ОН)-СН(ОН)-СООН | 2, 3-дигидроксибутандиовая | виннокаменная | тартраты | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Изомерия . Для карбоновых кислот возможны различные виды изомерии в зависимости от типа кислоты:
I. Структурная изомерия
1) изомерия углеродной цепи
 |
 |
3) изомерия положения функциональных групп (для гетерофункциональных кислот)
 |
а) сложные эфиры (n ≥ 2);
б) альдегидо- (n ≥ 2) и кетоспирты (n ≥ 3);
в) ненасыщенные (n ≥ 4) и циклические (n ≥ 3) двухатомные спирты.
II. Пространственная изомерия
1) цис-, транс-изомерия (для ненасыщенных кислот), например,
 |
2) оптическая изомерия (для гетерофункциональных кислот). (см. тему 4, модуль 4.1).
Физические свойства. Низшие монокарбоновые кислоты (С1-С9) − бесцветные жидкости с резким запахом, высшие – твердые вещества. Все дикарбоновые и ароматические кислоты – кристаллические вещества. Низшие кислоты хорошо растворимы в воде и смешиваются с ней в любых отношениях. С увеличением углеводородного радикала растворимость кислот в воде уменьшается. Органические кислоты являются слабыми электролитами. Уменьшение силы кислот наблюдается в ряду:
Cl3CCOOH > HOOC-COOH > Cl2CHCOOH > ClCH2COOH > C6H5COOH > HCOOH > > CH2=CH-COOH > CH3-CH=CH-COOH > CH3COOH > C2H5COOH
 |
линейная ассоциация кислот димерная ассоциация
Строение карбоновых кислот
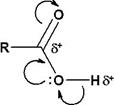
| Вследствии большей электроотрицательности атома кислорода происходит оттягивание электронной плотности от атома углерода к атому кислорода. В результате этого происходит сильная поляризация связи кислород – водород в группе –ОН. Следовательно, водород легко отщеплятся в виде протона Н+, поэтому эти соединения проявляют свойства слабых кислот. |
Химические свойства предельных одноосновных кислот. Химические свойства предельных одноосновных кислот разделяют на две группы: 1) свойства, общие с неорганическими кислотами; 2) особые свойства, характерные для органических кислот.
I. Общие кислотные свойства
1. Диссоциация.. В водных растворах карбоновые кислоты обратимо диссоциируют:
СН3СООН « СН3СОО- + Н+
или СН3СООН + Н2О « СН3СОО- + Н3О+
карбоксилат-анион
2. Образование солей:
а) с активными металлами
2RCOOH + Zn ® (RCOO)2Zn + H2↑
б) с основными оксидами
2RCOOH + СаО ® (RCOO)2Са + H2O
в) с гидроксидами
RCOOH + NaOH ® RCOONа + H2O
г) с солями более слабых кислот
2СН3COOH + К2СO3 ® 2СН3COOК + СО2 + H2O
СН3COOH + С17Н35СООNa ® СН3COONa + С17Н35СООН¯
д) взаимодействие с аммиаком
СН3COOH + NH3 ® СН3COONH4
СН3COONH4  СН3CONH2
СН3CONH2
амид
II. Особые свойства органических кислот. Замещение группы − ОН
1. Образование сложных эфиров (реакция этерификации). Протекает в присутствии сильных неорганичсеких кислот.
 |
этилацетат
Сложные эфиры простейших карбоновых кислот обладают ярко выраженным фруктовым запахом.
2. Образование хлорангидридов:
СН3 -СООН + PCl5 ® СН3 -СОСl + POCl3 + HCl
СН3 -СООН + SOCl2 ® СН3 -СОСl + SO2 + HCl
хлорангидрид
уксусной кислоты
 |
 |
4. Образование амидов:
 |
 |

 RCOOH
RCOOH 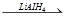 RCH2OH + H2O
RCH2OH + H2O

 RCOOCl
RCOOCl 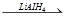 RCH2OH + HCl
RCH2OH + HCl
(восстановление протекает легче)
CH3COOH + 6HI ® CH3-CH3 + 3I2 + 2H2O
9. Окисление (горение): 
 CnH2nO2 + (1, 5n-1)O2 ® nCO2 + nH2O
CnH2nO2 + (1, 5n-1)O2 ® nCO2 + nH2O
III. Реакции замещения атомов водороа у α -углеродного атома.
7. Галогенирование:
СН3СООН + 3Cl2 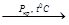 Сl3C-СООН + 3HCl
Сl3C-СООН + 3HCl
 |
кислота
2-хлорпропановая кислота
Введение хлора (электроноакцепторного заместителя) резко увеличивает силу кислоты.


10. Свойства солей карбоновых кислот:
а) декарбоксилирование солей щелочных металлов (синтез Дюма)

 CH3CH2COONa + NaOH
CH3CH2COONa + NaOH 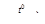 CH3-CH3 + Na2CO3
CH3-CH3 + Na2CO3
б) термическое разложение кальциевых (бариевых) солей

 (CH3CH2COO)2Ca
(CH3CH2COO)2Ca 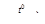 CH3CH2C(O)CH2CH3 + CaCO3
CH3CH2C(O)CH2CH3 + CaCO3
пентанон-3
в) электролиз солей одноосновных карбоновых кислот (реакция Кольбе):

 2CH3CH2COONa + 2H2O
2CH3CH2COONa + 2H2O  2NaOH + H2 + CH3CH2CH2CH3 + 2CO2
2NaOH + H2 + CH3CH2CH2CH3 + 2CO2
Общие способы получения
 |
 |
 |
Дикарбоновые кислоты
Общая формула СnН2n(СООН)2
В свободном состоянии дикарбоновые кислоты – бесцветные, кристаллические вещества, растворимые в воде, растворимость уменьшается с увеличением молекулярной массы.
Химические свойства. По химическим свойствам дикарбоновые кислоты напоминают монокарбоновые кислоты: образуют соли (кислые и средние), сложные эфиры, хлорангидриды. В реакциях может участвовать одна или обе карбоксильные группы.
Кислотность дикарбоновых кислот в водном растворе обычно несколько выше, чем у монокарбоновых кислот. По силе они превосходят одноосновные кислоты; так, например, щавелевая кислота в 2000 раз сильнее уксусной.
Дикарбоновые кислоты образуют два ряда производных, например, кислые и средние соли
HOOC-COONa NaOOC-COONa
гидрооксалат натрия оксалат натрия
неполные и полные сложные эфиры
НООС-СН2-СООС2Н5 С2Н5ООС-СН2-СООС2Н5
моноэтилмалонат диэтилмалонат
Получение.
1)
 |
толуол бензойная кислота этилбензол
2) Окисление бензилового спирта:
 |
3) Гидролиз бензотрихлорида, содержащего три атома галогена у одного атома углерода, приводит к образованию кислоты:
 |
Примерами ароматических дикарбоновых кислот являются фталевые кислоты:
 |
При поликонденсации терефталевой кислоты с этиленгликолем при повышенной температуре образуется полиэтилентерефталат, который используют в виде штапельного волокна (лавсан, дакрон) в производстве верхней одежды, тюля, ковров и т.д:

полиэтилентерефталат
(лавсан, дакрон)
 |
Решение. В соответствии с правилами международной номенклатуры в главную цепь углеродных атомов включают функциональные группы, а также двойную углерод-углеродную связь и нумерацию цепи начинают с углеродного атома карбоксильной группы. Заместители в названии кислоты располагают по алфавиту.
1) 2-изопропил-2-метил-3-этилбутен-3-овая кислота
2) 4-метилгептадиен-2, 5-овая кислота
3) 3-оксобутановая кислота
4) 2-гидрокси-5-метилгексен-3-овая кислота
Пример 2. Число изомеров, отвечающей формуле вещества С3Н6О2, равно:
1) 1 2) 4 3) 7 4) 9
Решение. Брутто формуле С3Н6О2 отвечают:
1) пропановая кислота 2) метилацетат 3) этилформиат
4) циклопропандиол-1, 2 5) 2-гидроксипропаналь 6) 3-гидроксипропаналь
7) гидроксипропанон
Ответ: 3
Пример 3. Укажите вещества, для которых возможна оптическая изомерия:
1) акриловая кислота 2) глицериновый альдегид
3) молочная кислота 4) щавелевая кислота
Решение. Оптическая, или зеркальная, изомерия обусловлена наличием в молекуле асимметрического атома углерода ( 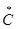 ). В молекулах глицеринового альдегида (
). В молекулах глицеринового альдегида ( 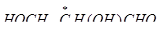 ) и молочной кислоты (
) и молочной кислоты ( 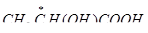 ) присутствуют асимметрические атомы углерода, в молекулах акриловой
) присутствуют асимметрические атомы углерода, в молекулах акриловой 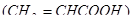 и щавелевой кислоты
и щавелевой кислоты 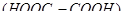 они отсутствуют.
они отсутствуют.
Ответ: 2, 3
СЛОЖНЫЕ ЭФИРЫ
Сложные эфиры являются наиболее важными функциональными производными карбоновых кислот, у которых в молекуле кислоты атом водорода карбоксильной группы заменен на углеводородный радикал.
 |
Общая формула для алифатических (предельных) эфиров CnH2nO2
 |
Изомерия. Для сложных алифатических (предельных и непредельных) эфиров характерна структурная изомерия:
1) изомерия углеродного скелета радикалов спирта и кислоты
 |
 |
 |
4) изомерия положения кратной связи возможна для кислот, содержащих кратные связи в радикале спирта или кислоты
 |
 |
цис-метилбутен-2-ат транс-метилбутен-2-ат
6) оптическая изомерия (для эфиров, содержащих в молекуле асимметрический атом углерода)
 |
Химические свойства.
1) Гидролиз сложных эфиров. Эта реакция является обратной реакции этерификации и может протекать как в кислой, так и в щелочной средах.
 |
 |
2) Реакция переэтерификации. В результате переэтерификации происходит замена спиртового остатка в молекуле сложного эфира.
 |
3) Аммонолиз (взаимодействие сложных эфиров с аммиаком с образованием амидов):
 |
4) Восстановление сложных эфиров.
 |
6) Горение:
СnH2nO2 + 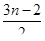 O2 ® nCO2 + nH2O
O2 ® nCO2 + nH2O
Получение.
1) Реакция этерификации.
 |
Так как данная реакция обратима, то для смещения равновесия в сторону образования продукта необходимо удалять воду.
2) Алкоголиз - взаимодействие спиртов или фенолов с галогенангидридами и ангидридами карбоновых кислот:
 |
ЖИРЫ
Жиры – это продукты этерификации глицерина и карбоновых кислот - глицериды.. Жиры и жироподобные вещества объединяют под общим названием липиды.
 |
Физические свойства. Бывают твердые и жидкие жиры. В твердых жирах преобладают остатки насыщенных кислот, в жидких – ненасыщенных (олеиновой, линолевой, линоленовой). Животные жиры, как правило, твердые, а растительные – жилкие. Жиры легче воды и в ней нерастворимы. Хорошо растворимы в бензоле, бензине, дихлорэтане. Природные жиры не имеют резкой температуры плавления, они предварительно размягчаются и плавятся в определенном интервале температур. Температура затвердевания жира тем выше, чем больше в нем содержание предельных кислот.
Изомерия.
Структурная изомерия глицеридов связана с различным (1, 2 или 3) положением кислот и их строением; стереоизомерия обусловлена наличием асимметрического атома углерода в положении 2, если в положении 1 и 3 находятся различные остатки кислот (оптическая изомерия), и наличием двойных связей в кислотных остатках (геометрическая изомерия).
Химические свойства.
1) Гидролиз триацилглицеридов:
 |
б) щелочной (омыление жиров) гидролиз приводит к образованию щелочных солей жирных кислот (мыла).
 |
 |
3) Окисление. Жиры и масла, особенно содержащие радикалы ненасыщенных жирных кислот, окисляются кислородом воздуха. Первыми продуктами окисления являются разнообразные пероксиды и гидропероксиды (первичные продукты окисления), вторичные продукты окисления: спирты, альдегиды, кетоны, кислоты и их производные с углеродной цепочкой различной длины. Образовавшиеся продукты способны к дальнейшим превращениям, например, к полимеризации. Направление и глубина окисления зависит от состава жиров и масел: с увеличением степени непредельности кислот, входящих в состав глицеридов, скорость их окисления возрастает. С этим связан процесс «прогоркания» жиров; неприятный запах и вкус обусловлены появлением в жирах продуктов их превращений, например, масляной кислоты.
 |
глицерин стеариновая кислота тристеарин (жир)
Жиры служат одним из источников энергии организма. При окислении жиров выделяется в два раза больше энергии, чем при окислении таких же количеств белков и углеводов. Жиры в организме служат резервным питательным веществом, а также выполняют защитную и теплоизоляционную функции.
МЫЛА
Мыла – растворимые в воде натриевые и калиевые соли высших карбоновых кислот: пальмитиновой С15Н31СООН, стеариновой С17Н35СООН, олеиновой С17Н33СООН. Образуются при щелочном гидролизе жиров. В жёсткой воде мыла теряют свои свойства из-за образования нерастворимых солей Са 2+ и Mg2+.
2 С15Н35СООNa + Ca(HCO3)2 = (С15Н35СОО)2Ca↓ + 2NaHCO3
мыло
МОНОСАХАРИДЫ
Моносахаридами (простыми углеводами) называются такие углеводы, которые не способны гидролизоваться с образованием более простых углеводов.
Важнейшими моносахаридами являются альдегидоспирты – глюкоза С6Н12О6, рибоза С5Н10О5, дезоксирибоза С5Н10О4; кетоноспирт – фруктоза С6Н12О6.
Изомерия. Для углеводов очень важна оптическая, или зеркальная, изомерия, обусловленная наличием в молекуле асимметрического атома углерода.

Оптическая (зеркальная) изомерия. Асимметрический, или хиральный, атом углерода (*С) связан с четырьмя различными заместителями (у него отсутствуют элементы симметрии).
D-ряд L-ряд
Стереоизомерами (стереомерами) называются изомеры, различающиеся только расположением атомов и групп атомов в пространстве у асимметрического атома углерода. Кроме вращения плоскости поляризованного света, оптические изомеры похожи друг на друга, как предмет и его отражение в зеркале, как правая рука на левую, и являются оптическими антиподами.
Альдопентозы содержат три асимметрических атома углерода и имеют 8 стереоизомеров (23 = 8). D-ряд альдопентоз (4 изомера):
 |
 |
D-фруктоза L-фруктоза
Моносахариды проявляют свойства альдегидной группы и многоатомного спирта. Однако глюкоза не дает некоторых альдегидных реакций (например, не взаимодействует с гидросульфитом натрия (NaHSO3), не дает реакции с фуксинсернистой кислотой. Было установлено, что одна из гидроксильных групп в молекуле глюкозы более реакционноспособна, чем остальные.
В растворах моносахаридов наряду с альдегидными и кетонными формами всегда содержатся циклические таутомерные формы. Как известно, альдегиды легко присоединяют спирты, превращаясь в полуацетали:
 |
(ациклическая форма) (циклическая форма)
формула Фишера формула Хеурзса
 |
D-глюкоза b-D-глюкофураноза
(ациклическая форма) (циклическая форма)
формула Фишера формула Хеуорзса
Сахара были одними из первых веществ, для которых наблюдалось явление таутомерии. Таутомерия сахаров - так называемая кольчато-цепная или оксо-окси-таутомерия. В кристаллическом виде моносахариды существуют только в циклической форме и являются устойчивыми соединениями. Однако в растворе быстро образуется равновесная смесь нескольких форм моносахаридов - таутомерное равновесие.
Отдельные представители
Глюкоза (виноградный сахар) очень широко распространена в природе, содержится в соке винограда и других сладких плодах и в небольших количествах в организмах животных и человека.
 |
(a-D-глюкопираноза) (b-D-глюкопираноза)
В медицине чистая глюкоза применяется в виде растворов (для введения в кровь при ряде заболеваний) и в виде таблеток. Из глюкозы получают витамин С. Она также применяется в текстильном производстве и в некоторых других производствах в качестве восстановителя.
 |
a-D-галактоза (a-D-галактопираноза)
Получают галактозу гидролизом молочного сахара.
 |
a-D-фруктоза b-D-фруктоза
(a-D-фруктофураноза) (b-D-фруктофураноза)
Входит в состав многих сложных сахаров, например, тростникового сахара, из которого может быть получена гидролизом. Она хорошо усваивается организмом.
При восстановлении фруктозы образуется сорбит и маннит. Сорбит применяют как заменитель сахара в питании больных диабетом, а также его используют для производства аскорбиновой кислоты (витамин С).
Рибоза. В природе встречается D-рибоза. Она играет важную биологическую роль: является структурным компонентом рибонуклеиновых кислот и некоторых других биологически важных соединений.
 |
(a-D-рибофураноза) (b-D-рибофураноза)
ДИСАХАРИДЫ
Дисахариды состоят из двух остатков моносахаридов. К дисахаридам относятся сахаоза (α -глюкоза + β -фруктоза), лактоза (молочный сахар), мальтоза (два остатка α -глюкозы), целлобиоза (два остатка β -глюкозы) и др.
ПОЛИСАХАРИДЫ
Полисахариды – это природные полимеры, которые образуются при полконденсации моносахаридов. К полисахаридам относятся рахмал, целлюлоза, гликоген, хитин и др.
Крахмал. Молекулы крахмала состоят из остатков a-глюкозы. Крахмал имеет разветвленное строение.
Качественной реакцией на крахмал является взаимодействие с иодом. Образуется комплекс темно-синего цвета.
Целлюлоза (клетчатка). Молекулы клетчатки имеют линейное строение: они представляют собой очень длинные цепи остатков b-глюкозы.
Большое практическое значение имеют эфирные производные целлюлозы: ацетаты (искусственный шелк), ксантогенаты (вискозные волокна), нитраты (взрывчатые вещества) и другие.
 |
(колоксилин)
 |
(пироксилин) (основа вискозного волокна)
Гликоген, или животный крахмал, в животных организмах является структурным и функциональным аналогом растительного крахмала, по строению он подобен амилопектину, но молекулы его еще более разветвлены.
АМИНЫ
Амины – органические производные аммиака, в молекуле которого атомы водорода замещены на углеводородные радикалы. В зависимости от числа углеводородных радикалов, содержащихся в молекуле амина, они подразделяются на первичные (замещен один атом водорода), вторичные (замещены два атома водорода) и третичные (замещены все атомы водорода).
 |
 |
Номенклатура. Названия первичных аминов производят от названий соответствующих углеводородов с добавлением окончания амин; названия вторичных и третичных аминов чаще образуют по принципам международной номенклатуры(м.н.) и рациональной номенклатуры(р.н.).
 |
 |
 |
Получение
1. Реакция Гофмана (алкилирование аммиака и аминов):
NН3 + CH3I ® [CН3NH3]+ 
 CН3NH2 +
CН3NH2 + 
первичный амин
CН3NH2  (CН3)2NH
(CН3)2NH  (CН3)3N
(CН3)3N  [(CН3)4N]+
[(CН3)4N]+ 
вторичный амин третичный амин четвертичная соль
2. Восстановление нитропроизводных:
 |
4. Восстановление нитрилов и амидов карбоновых кислот:
 |
Химические свойства
Амины являются сильными основаниями, то есть способны присоединять протон из воды и кислот.
 |
гидроксид диметиламмония
2. Образование солей:
 |
Соли аминов – твердые вещества, хорошо растворимые в воде.
Качественная реакция - взаимодействие со щелочами (аналогично солям аммония):
 |
3. Взаимодействие с азотистой кислотой:
 |
б) вторичные амины (качественная реакция – выпадение осадка)
 |
 |
4. Алкилирование (реакция Гофмана):
 |
 |
 |
Ароматические амины
Анилин (фениламин) С6Н5NН2 – родоначальник класса ароматических аминов, в молекулах которых аминогруппа непосредственно связана с бензольным кольцом. Анилин – это бесцветная, темнеющая на свету и воздухе, малорастворимая в воде маслянистая жидкость.
Аминогруппа (NH2-) является электродонорным заместителем (ориентант I-го рода, имеет положительный мезомерный эффект), т.е. неподеленная пара электронов атома азота вступает в сопряжение с p-электронами бензольного кольца, вследствие этого основные свойства аминогруппы уменьшаются, а электронная плотность бензольного кольца увеличивается на атомах углерода в положениях 2, 4, 6, что отличает протекание реакции электрофильного замещения в ароматических углеводородах.
 |
Химические свойства
I. Реакции по аминогруппе
1. Взаимодействие с сильными кислотами. Анилин – гораздо более слабое основание, чем алифатические амины. Он не взаимодействует с водой, т.е. не образует основание; образует соли только с сильными кислотами.
 |
Соли фениламмония хорошо растворимы в воде, при действии на них растворов щелочей происходит выделение анилина.
 |
фенилдиазонийхлорид
3. Алкилирование:
 |
 |
N-фенилацетамид
II. Реакции бензольного кольца
1. Взаимодействие с бромной водой. Реакция протекает без нагревания и катализаторов.
 |
 |
2, 4, 6-тринитроанилин
 |
сульфаниловые кислоты
 |
5. Окисление. Анилин легко окисляется различными окислителями с образованием ряда соединений, поэтому он темнеет при хранении на воздухе. При действии хлорной извести CaOCl2 на водный раствор анилина появляется интенсивное фиолетовое окрашивание – качественная реакция на анилин.
Получение аминов
 |
2. Восстановление монохлорбензола:
 |
3. Аммонолиз фенола:
 |
АМИНОКИСЛОТЫ
Аминокислотами называются соединения, в молекулах которых содержатся одновременно амино- и карбоксильная группы. В зависимости от положения аминогруппы по отношению к карбоксильной группе различают a-, b-, g- и т.д. аминокислоты.
 |
кислота кислота кислота
В зависимости от числа функциональных групп различают: моноаминомонокарбоновые, диаминомонокарбоновые, моноаминодикарбоновые кислоты и т.д.
 |
2-амино-3-метилбутановая кислота 2-аминопентандиовая кислота
(валин) (глутаминовая кислота)
Изомерия. Для аминокислот характерны три типа изомерии: углеродного скелета, положения аминогруппы по отношению к карбоксильной группе, от наличия асимметрических атомов углерода, а также межклассовая изомерия - аминокислоты изомерны нитросоединениям. Все природные аминокислоты, кроме глицина, содержат один или несколько асимметрических атомов углерода и, следовательно, могут существовать в виде нескольких стереоизомеров
 |
Получение аминокислот
1. Гидролиз белков. Гидролиз пептидной связи (-С(О)-NH-) протекает при длительном нагревании пептидов с растворами кислот или щелочей с образованием соответствующих солей образующихся аминокислот.

 |
3. Нитрильный синтез:
 |
4. Восстановление нитрокислот:
 |
5. Присоединение аммиака к a- и b-непредельным кислотам:
 |
БЕЛКИ
Белки - это природные высокомолекулярные органические соединения (биополимеры), молекулы которых построены из остатков a-аминокислот, соединенных между собой пептидными связями (-С(О)-NH-).
 |
Все природные белки содержат пять химических элементов: C, H, O, N, S. Встречается P, реже Fe. По химическому составу белки делятся на а) протеины (простые), при гидролизе которых образуются только α -аминокислоты, и б) протеиды (сложные), при гидролизе которых образуются α -аминокислоты и другие компоненты (остатки полисахаридов, H3PO4, катионы металлов, и др.)
Белки обладают сложной структурой. Различают несколько степеней организации молекулы белка: первичную, вторичную, третичную и четвертичную структуры белковых молекул.
Первичная структура – это последовательность аминокислотных остатков в полипептидной цепи. Условно считают, что к белкам относятся полипептиды, содержащие в цепи более 100 аминокислотных остатков и имеющие массу от 10000 до нескольких миллионов. Соединения с меньшим числом аминокислотных остатков называются пептидами, которые делятся на олигопептиды (от 2 до 10 остатков) и полипептиды (от 10 до 100 остатков). Подсчитано, что из 20 различных аминокислот, которые чаще всего встречаются в составе белков, можно построить примерно 1018 белковых молекул. Свойства белковой молекулы зависят от первичной структуры и от конфигурации полипептидной цепи.
Вторичная структура – это упорядочное расположение в пространстве атомов основной полипептидной цепи. В результате образования внутримолекулярных водородных связей между атомами кислорода кето- или оксигруппы и атомом водорода окси- или аминогруппы цепи многих белков скручиваются в спираль.
 |
В b-структуре (складчатом слое) полипептидная цепь растянута, ее участки располагаются параллельно друг другу и удерживаются также за счет водородных связей.
Третичная структура характеризует пространственное распределение всех атомов белковой молекулы, это трехмерная конфигурация закрепленной a-спирали или b-структуры в пространстве. Она стабилизируется связями различного типа между отдельными участками полипептидных цепей.
Такими связями являются:
| Дисульфидные Возникают между серусодержащими звеньями аминокислотных остатков | − S− S− |
| Сложноэфирные Образуются в результате взаимодействия карбоксильной группы в радикалах и дикарбоновых кислот и гидроксильной группы в радикалах гидрокси аминокислот | 
|
| Солевые мостики Образуются между протонированной аминогруппой и ионизированной карбоксильной группой, которые содержатся в радикалах диамино- и дикарбоновых кислот | NH3+…..⁻ OOC− |
Спирали могут свиваться в клубок, образовывать глобулы или располагаться рядом, образуя нитевидные структуры. Несколько молекул могут складываться с образованием более крупных агрегатов.
Четвертичная структура. Для некоторых белков характерно образование ассоциатов из нескольких полипептидных цепей, каждая из которых имеет определенную вторичную и третичную структуру. Ассоциация обусловлена межмолекулярным взаимодействием между боковыми группами аминокислот. Четвертичную структуру имеют не все белки. Именно третичная и четвертичная структура белка определяют его биологические свойства.
Физические свойства. Природные белки выполняют в организме различные функции и в соответствии с этим обладают разными свойствами. Существуют жидкие и твердые белки, растворимые и нерастворимые в воде. Белки не имеют температуры плавления и кипения, так как большинство из них при нагревании сворачиваются. При высокой температуре все белки сгорают.
Физико-химические свойства. Как и аминокислоты белки являются амфотерными соединениями, так как молекула любого белка содержит на одном конце аминоруппу, а на другом – карбоксильную группу. Поэтому свойства белков во многом похожи на свойства аминокислот. Однако, белки обладают рядом специфических свойств.
1. Гидролиз белков. Переваривание белков в организме по своей сути представляет ферментативный гидролиз белковых молекул. В лабораторных условиях и в промышленности проводят кислотный гидролиз. При гидролизе происходит разрушение пептидных связей. Гидролиз протеакет ступенчато.
Белок  полипептиды
полипептиды  олигопептиды
олигопептиды  дипептиды
дипептиды  α -аминокислоты
α -аминокислоты
2. Обратимое осаждение (высаливание). Белки способны осаждаться из растовров под действием таких веществ, как этиловый спирт, ацетон, соли натрия, калия, аммония и др. свойства белков при таком осаждении не меняются, поэтому при добавлении воды белки снова могут переходить в раствор.
3. Необратимое осаждение (денатурация, свертывание). При действии таких реагентов, как соли тяжёлых металлов (Hg2+, Pb2+, Cu2+, и др.) концентрированные кислоты и щелочи, а также в результате нагревания, облучения ультафиолетом и γ -лучами происходит разрушение (полное или частичное) вторичной и третичной структуры белка и изменение его природных (нативных) свойств.
Цветные реакции белков.
А) Биуретовая реакция – появление сине-фиолетового окрашивания при обработке белка концентрированным раствором щелочи и насыщенным раствором CuSO4. Реакция связана с наличием в молекуле пептидных связей.
Б) Ксантопротеиновая реакция – появление желтой окраски в результате действия на белки концентрированной азотной кислоты. Реакция связана с наличием в белке ароматических колец.
В) Сульфгидрильная реакция – выпадение черного осадка сернистого свинца при нагревании белка с раствором плюмбита. Реакция связана с наличием в белке сульфгидрильных групп.
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
ФЕДЕРАЛЬНО ГОСУДАРСТВЕННОЕ БЮДЖЕТНОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
ВЫСШЕГО ОБРАЗОВАНИЯ
«МОСКОВСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИКО-СТОМАТОЛОГИЧЕСКИЙ УНИВЕРСИТЕТ ИМЕНИ А.И. ЕВДОКИМОВА»
Moscow State University of Medicine and Dentistry named after A. I. Evdokimov
ПОДГОТОВИТЕЛЬНОЕ ОТДЕЛЕНИЕ

Последнее изменение этой страницы: 2019-04-09; Просмотров: 481; Нарушение авторского права страницы