
|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |

|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |
БЕНЗОЛ. ПРАВИЛА ОРИЕНТАЦИИ
Ароматические углеводороды – это соединения, содержащие в молекуле одно или несколько бензольных ядер. Родоначальником класса ароматических углеводородов является бензол. Общая формула гомологического ряда бензола С n H2 n-6 (n ≥ 6). Строение молекулы бензола. Согласно квантово-механической теории химических связей все шесть атомов углерода в молекуле бензола находятся в sp2-гибридизации. Каждый атом углерода образует три σ -связи, которые лежат в одной плоскости под углом 1200. Каждый из шести негибридизованных р-электронных облаков атомов углерода располагаются перпендикулярно плоскости σ -связи, образуя единое π -электронное облако. В молекуле бензола осуществляется круговое сопряжение, в результате чего в молекуле бензола нет ни двойных, ни одинарных связей. Длина всех С-С-связей в цикле равна 0, 139 нм.
Рис. 5 Строение молекулы бензола
Номенклатура производных бензола. Ароматические углеводороды - производные ряда бензола - можно рассматривать как продукт замещения атомов водорода в бензоле одновалентными радикалами. Названия составляют из названий
радикалов боковых цепей с добавлением окончания - бензол. Некоторые производные бензола имеют тривиальные названия (например, толуол, кумол).
Простейшие одновалентные арильные радикалы имеют общую формулу С n H2 n-7. Бензол образует радикал фенил (С6Н5-), толуол – радикал бензил (С6Н5СН2− ). Изомерия. Структурная изомерия в гомологическом ряду бензола обусловлена взаимным расположением заместителей в ядре. Однозамещенные производные бензола не имеют изомеров. Физические свойства. Первые члены гомологического ряда бензола – бесцветные жидкости со специфическим запахом. Они легче воды и плохо в ней растворяются. Хорошо растворяются в органических растворителях и сами являются хорошими растворителями для многих органических веществ. Бензол – сильно токсичное вещество. Химические свойства. Характерной особенностью ароматических соединений бензольного ряда является их склонность вступать в реакции, не приводящие к нарушению ароматической системы, - это реакции замещения, которые протекают легче, чем у алканов. При явной ненасыщенности состава (-8е по сравнению с С6Н14) бензол проявляет насыщенный характер. Реакции присоединения и окисления проходят с трудом. Чаще всего протекают реакции электрофильного замещения SЕ. Ароматическое ядро является удобным объектом для электрофильных реагентов.
I. Реакции электрофильного замещения ( SE).
1. Галогенирование (CI2, Br2 в присутствии катализаторов AICI3, FeCI3, AIBr3. I2 в данную реакцию не вступает): хлорбензол
При действии избытка галогена можно получить ди- и полигалогензамещенные. Реакционная способность галогенов убывает в ряду: F2 > Cl2 > Br2 3.
Нитрование (проводят смесью концентрированных азотной и серной кислот). Действующий агент – нитроний-катион 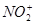 : : 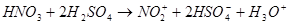 нитробензол
3. Сульфирование (проводят концентрированной серной кислотой или олеумом при нагревании):
Сульфобензол (бензолсульфокислота)
4. Алкилирование (получение гомологов бензола) проводят: а) галогеналканами в присутствии катализаторов (AlCl3, FeBr3) – реакция Фриделя-Крафтса
метилбензол (толуол) б) алкенами
этилбензол
кумол (изопропилбензол) 5. Ацилирование (введение группы ацил R-C(O)-):
ацетилхлорид ацетофенон (хлорангидрид уксусной кислоты) (метилфенилкетон) Введение второго заместителя. Правила ориентации. Место введения второго электрофильного заместителя в бензольное кольцо определяется природой уже имеющегося заместителя в ядре. Электронное взаимодействие радикала и бензольного ядра реализуется через индуктивный и мезомерный эффекты. Индуктивный эффект (J-эффект) передается по σ -углерод-углеродной связи, а мезомерный (М-эффект) – по системе сопряженных π -связей (см. тема 1, модуль 1.1). Наиболее сильно электронное влияние заместителя проявляется в о- и п-положениях бензольного кольца по сравнению с м-положением, нарушая симметрию π -сопряженного электронного облака молекулы. В зависимости от проявляемого заместителями суммарного эффекта (индуктивного и мезомерного) их можно разделить на две группы: 1) электронодонорные (ориентанты I-го рода) и 2) электроноакцепторные (ориентанты II-го рода). Заместители I-го рода, обладающие +М и (или) + J-эффектом, повышают электронную плотность бензольного кольца в о- и п-положениях, тем самым облегчая вступление второго заместителя в эти положения. -ОН; -OR; -NH2; -СI (- Br, -I); алкилы
+ М > -J + М > -J + М > -J -J > +M + J При нитровании гомологов бензола избытком азотной кислоты образуются тризамещенные продукты. Аналогично протекает реакция галогенирования с избытком галогена:
2, 4, 6-трибромтолуол толуол 2, 4, 6-тринитротолуол
Заместители II-го рода, обладающие –М или –J-эффектами, понижают электронную плотность бензольного кольца, тем самым затрудняют введение второго заместителя и направляют его преимущественно в м-положение:
бензойная кислота м-нитробензойная кислота
Если в бензольном кольце уже находятся два заместителя (ориентанты I-го и II-го рода) и действия их не согласованы, то преимущество при ориентировании имеет ориентант I-го рода.
согласованное действие заместителей несогласованное действие заместителей (*) I-го рода (·) II-го рода (*) I-го рода (·) II-го рода II. Реакции присоединения. Эти реакции протекают в жестких условиях и приводят к нарушению ароматической системы.
1. Гидрирование. Реакция идет при нагревании и давлении в присутствии катализаторов (Ni, Pt, Pd): циклогексан
2. Галогенирование парами хлора при ультрафиолетовом облучении. Реакция протекает по радикальному механизму: гексахлорциклогексан (гексахлоран) III. Окисление. Окисление бензола в отсутствие активирующих добавок протекает чрезвычайно трудно. Щелочной раствор перманганата калия реагирует с бензолом очень медленно и только при нагревании. При каталитическом окислении воздухом (4000С, катализатор V2O5) или хлоратом калия (при нагревании в присутствии кислых катализаторов) происходит разрыв циклической системы с образованием малеинового ангидрида:
малеиновый ангидрид
Окисление гомологов бензола протекает достаточно легко (окислители: перманганат калия в водном или в сернокислом растворе, дихромат калия, разбавленная азотная кислота и др.). При этом окислению подвергается алкильные радикалы по α -углеродному атому. бензоат калия п-этилтолуол терефталевая кислота IV. Реакция замещения гомологов бензола в алкильном радикале. Реакция галогенирования протекает по радикальному механизму (SR) на свету или при нагревании:
толуол бензилхлорид фенилдихлорметан фенилтрихлорметан
этилбензол 1-фенил-1-хлорэтан |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Последнее изменение этой страницы: 2019-04-09; Просмотров: 567; Нарушение авторского права страницы