
|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |

|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |
НЕПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ
АЛКЕНЫ (ЭТИЛЕНОВЫЕ УГЛЕВОДОРОДЫ) Алкены – алифатические углеводороды, содержащие в молекуле одну двойную связь. Они относятся к непредельным углеводородам. Общая формула алкенов С n H2 n Первый представитель класса алкенов – этен (или этилен) СН2=СН2. Ближайшие гомологи этена: СН3СН=СН2 СН3СН2СН=СН2 СН3СН=СНСН3 пропен бутен-1 бутен-2
Рис. 1. Строение молекулы этилена а) s-связи и р-электронные облака; б) s- и p-связи; в) геометрия молекулы
Простейший алкен с разветвленным углеродным скелетом:
2-метилпропен Простейшие радикалы общей формулы С n H2 n-1: СН2=СН- винил (этенил), СН2=СН-СН2- аллил (пропенил) Атомы углерода, связанные двойной связью, находятся в sp2-гибридизации: три гибридные орбитали располагаются на плоскости (плоскость s-связи) под углом 1200 относительно друг друга, а негибридизованная р-орбиталь ориентирована перпендикулярно плоскости s-связи. При перекрывании гибридизованных орбиталей образуются s-связи, а перекрывание негибридизованных р-орбиталей приводит к образованию p-связи. Длина двойной связи равна 0, 134 нм. p-Связь менее прочная, чем s-связь: для разрыва s-связи требуется 341, 9 кДж/моль, а для разрыва двойной связи – 611, 7 кДж/моль, т.е. меньше, чем для разрыва двух s-связей.
Номенклатура алкенов. Названия алкенов строят подобно названиям алканов с заменой окончания - ан на - ен. В качестве основы выбирают самую длинную цепь, содержащую двойную углерод-углеродную связь, и нумеруют ее с того конца, к которому ближе двойная связь. Положение двойной связи указывают в конце названия номером атома, у которого начинается двойная связь. 2-изопропил-3-метилбутен-1 Изомерия алкенов 1. Структурная изомерия. а) изомерия углеродного скелета; б) изомерия положения двойной связи; в) межклассовая изомерия (изомерны циклоалканам). 2. Пространственная (геометрическая) изомерия ( цис-, транс- изомерия). Пространственная (цис-, транс-) изомерия наблюдается в том случае, когда каждый из атомов углерода при двойной связи связан с двумя различными заместителями. Расположение пары одинаковых заместителей у ненасыщенных атомов углерода по одну сторону плоскости двойной связи образует цис-изомер, по разные стороны - транс-изомер (рис. 2).
цис-бутен-2 транс-бутен-2 (т.пл. -139, 30 С) (т.пл. -105, 80 С) Рис.2. Цис-, транс-изомерия для бутена-2 Физические свойства. Молекулы алкенов малополярны. Соединения состава С2 – С4 – газы, С5 – С16 – жидкости, начиная с С17 – твердые вещества. Алкены плохо растворимы в воде. Химические свойства алкенов определяются наличием в их молекуле двойной связи. Для алкенов характерны реакции электрофильного присоединения (АЕ), полимеризации и окисления. Реакции электрофильного присоединения протекают по схеме:
Электронная плотность p-связи достаточно подвижна и легко вступает во взаимодействие с электрофильными частицами - катионами (чаще всего 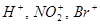 ), у которых есть свободная валентная орбиталь. Реагент ХY – это Br2, H2O, HCI, HBr, НOCI, H2SO4 и др. ), у которых есть свободная валентная орбиталь. Реагент ХY – это Br2, H2O, HCI, HBr, НOCI, H2SO4 и др.
Поскольку реакции электрофильного присоединения – это ионные процессы, полярность связи в реагенте ( I. Реакции присоединения
1. Гидрирование (образование алканов): пропен пропан
2. Галогенирование (образование дигалогеналканов): Обесцвечивание бромной воды – качественная реакция на двойную связь. 3. Гидрогалогенирование (образование моногалогеналканов) . У несимметричных алкенов присоединение полярных молекул типа Н-Х (Х = CI, Br, OH, CN и т.п.) протекает по правилу Марковникова: водород присоединяется к наиболее гидрогенизированному атому углерода.
Стадией, определяющей процесс, является электрофильная атака по двойной связи, следовательно, катион водорода  будет преимущественно присоединяться к тому из атомов углерода, на котором больше отрицательный заряд. Распределение зарядов определяется смещением p-электронной плотности под влиянием заместителей. будет преимущественно присоединяться к тому из атомов углерода, на котором больше отрицательный заряд. Распределение зарядов определяется смещением p-электронной плотности под влиянием заместителей.Электродонорные заместители, например, алкильные радикалы, обладающие положительным индуктивным эффектом (+I-эффект), смещают p-электронную плотность к наиболее гидрогенизированному атому углерода и создают на нем частичный отрицательный заряд. Присоединение протекает по правилу Марковникова.
Электроотрицательные заместители, например, группы –СООН, -NO2, -CCI3 и др. вызывают обратные электронные эффекты. Присоединение протекает против правила Марковникова: акриловая кислота 3-бромпропановая кислота (пропеновая кислота)
В присутствии пероксидов полярные молекулы НХ реагируют с алкенами также против правила Марковникова: пропен 1-бромпропан Этот эффект носит название «пероксидного эффекта», реакция протекает по радикальному механизму.
4. Гидратация . При гидратации этилена образуется первичный спирт, при гидратации гомологов в соответствии с правилом Марковникова - вторичные и третичные спирты: 5. Алкилирование бензола и его производных (реакция Фриделя-Крафтса). Это реакция – реакция присоединения для алкенов, но для аренов – это реакция замещения:
бензол этилбензол II. Реакция полимеризации алкенов и их производных в присутствии кислот протекает по механизму АЕ:
где R = H, CH3, CI, C6H5 и т.д. Молекула СН2=СН-R называется мономером, полученное соединение – полимером, число n – степенью полимеризации. Полимеризацией производных алкенов получают полиэтилен, полипропилен, поливинилхлорид, полистирол и другие полимеры. III. Реакции окисления алкенов.
а) горение:
б) мягкое окисление (гидроксилирование) водным раствором перманганата калия (реакция Вагнера): пропандиол-1, 2 в) жесткое окисление (в кислой среде или в водном растворе перманганата калия при нагревании протекает с разрывом двойной связи) Если в молекуле алкена двойная связь между атомами углерода располагается в начале молекулы (ен-1, 2), то при окислении образуется углекислый газ и соответствующая кислота (или кетон), например,

Если двойная связь в молекуле алкена находится не в начале молекулы, то при окислении образуются соответствующие кислоты (или кетоны): 5CH3CH=CHCH3 + 4KMnO4 + 6H2SO4 = 10CH3COOH + 4MnSO4 + 2K2SO4 + 6H2O При действии водного раствора перманганата калия при нагревании необходимо учитывать щелочной характер среды, например:
3CH3CH2CH=CH2 + 10KMnO4  3CH3CH2COOK + 3K2CO3 +10MnO2¯ +KOH + 4Н2О 3CH3CH2COOK + 3K2CO3 +10MnO2¯ +KOH + 4Н2О 
IV. Галогенирование в алкильное положение. Гомологи этилена могут вступать в реакции радикального замещения с галогенами (CI2, Br2) при нагревании. Легче замещается атом водорода a-положении к двойной связи.
пропен 3-хлорпропен Получение алкенов. 1. Дегидрирование алканов: CnH2n+2
2. Гидрирование алкинов: CnH2n-2 + H2
3. Крекинг алканов (см. «Алканы») 4. Дегидратация спиртов. Реакция протекает в соответствии с правилом Зайцева: при отщеплении молекулы типа НХ атом водорода отщепляется от наименее гидрогенизированного атома углерода. Легче всего дегидратируются третичные спирты, труднее – вторичные, еще труднее – первичные:
пропанол-1 пропен 5. Дегидрогалогенирование моногалогеналканов спиртовым раствором щелочи. (по правилу Зайцева):
6. Дегалогенирование вицинальных дигалогеналканов под действием магния или цинка (атомы галогена находятся у соседних атомов углерода):
Пример 1. Какие соединения имеют цис- и транс-изомеры? 1) 2, 3-дихлорпентен-2 2) 1, 2-диметилциклопентан 3) 3-метилпентен-1 4) 2-метилбутен-2
Решение. Напишем графические формулы предложенных соединений:
В молекуле соединения (1) каждый из атомов углерода при двойной связи связан с двумя различными заместителями и оба атома имеют одинаковые заместители (CI). Данное соединение может существовать в виде цис- и транс-изомеров. Соединение (2) – представитель углеводородов ряда циклоалканов. Одинаковые заместители (СН3-) у соседних углеродных атомов могут по разному располагаться относительно плоскости кольца, образуя цис- и транс-изомеры. В соединениях (3) и (4) один из атомов углерода при двойной связи имеет два одинаковых заместителя (Н- или СН3-), следовательно, у этих соединений не существуют цис- и транс-изомеры. Ответ: 1, 2
|
Последнее изменение этой страницы: 2019-04-09; Просмотров: 342; Нарушение авторского права страницы