
|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |

|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |
II. Реакции, идущие с отщеплением ОН-группы.
1. Замещение гидроксильной группы на галоген (нуклеофильное замещение; реакция достаточно легко протекает с пентахлоридом фосфора и тионилхлоридом; проявление слабых основных свойств в реакции с галогеноводородными кислотами):
2. Дегидратация спиртов:
а) межмолекулярная дегидратация (образование простых эфиров) б) внутримолекулярная дегидратация (образование алкенов идет в соответствии с правилом Зайцева):
3. Окисление спиртов. В качестве окислителей используют перманганат калия, смесь бихромата калия и серной кислоты, кислород в присутствии катализатора – меди или платины. а) окисление
- первичных спиртов
- вторичных спиртов
б) горение СnН2n+2О+ Третичные спирты более устойчивы к окислению.
4. Каталитическое дегидрирование спиртов: СН3-СН2-ОН этаналь Непредельные спирты проявляют как свойства спиртов, так и свойства непредельных соединений (алкенов), т.е. вступают в реакции присоединения, окисления и т.д.
Получение спиртов 1. Гидролиз моногалогеналканов: СН3СН2-Br + NaOH(p-p) ® СН3СН2-ОН + NaBr 2. Гидратация алкенов (по правилу Марковникова):
3. Восстановление альдегидов, кетонов, карбоновых кислот и сложных эфиров:
RСОOН + 4[H·] 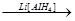 RСН2ОН + H2О RСН2ОН + H2О
RСОOR + 4[H·] 4. Гидролиз сложных эфиров:
5. Взаимодействие первичных аминов с азотистой кислотой: СН3СН2-NH2 + HNO2 ® СН3СН2-ОН + N2 + H2O
6. Этанол получают ферментативным брожением глюкозы: С6Н12О6 → 2С2Н5ОН + 2СО2↑ 7. Метанол получают из синтез-газа. Эта реакция идет при нагревании и высоком давлении. В качестве катализатора используется медь, оксид цинка, оксид алюминия. СО + H2 = СН3ОН
Многоатомные спирт ы
Многоатомные спирты – это производные углеводородов, содержащие в молекуле две и более гидроксильные группы. Многоатомные спирты в зависимости от числа гидроксильных групп в молекуле делятся на двухатомные (две гидроксильные группы), или диолы, трехатомные (три гидроксильные группы), или триолы и т.д. Представителем диолов является этиленгликоль, а триолов - глицерин. Они обладают несколько более кислым характером, чем предельные одноатомные спирты, но растворы их имеют нейтральную реакцию среды.
Общая формула многоатомных спиртов С n H2 n+2Ох, где х = 2, 3, ….. Физические свойства. Этиленгликоль и глицерин – вязкие бесцветные жидкости, сладкие на вкус, хорошо растворимые в воде и плохо растворимые в органических растворителях. Химические свойства. Химические свойства многоатомных спиртов повторяют свойства одноатомных спиртов. 1. Образование гликолятов и глицератов:
а) взаимодействие с натрием или калием б) взаимодействие с гидроксидами тяжелых металлов (качественная реакция на многоатомные спирты)
хелатное соединение ярко-синего цвета
2. Взаимодействие с галогеноводородами: этиленхлоргидрин Вторая гидроксильная группа замещается труднее - только под действием PCl5 или SOCl2.
3. Образование сложных эфиров: а) с азотной кислотой глицерин глицеринтринитрат (тринитроглицерин) Тринитроглицерин способен разлагаться с выделением теплоты и большого количества газов:
б) с карбоновыми кислотами
4. Отношение к нагреванию: а) межмолекулярная дегидратация
б) внутримолекулярная дегидратация
5. Окисление: глиоксаль щавелевая кислота (этандиаль)
2-оксопропандиовая кислота (кетомалоновая кислота) Получение. Получают многоатомные спирты теми же способами, что и одноатомные. Отдельные представители этих спиртов получают специальными методами. 1. Из синтез-газа при нагревании, высоком давлении и катализаторе: 2СО + 3Н2 → СН2(ОН)− СН2(ОН) 3СО + 4Н2 → СН2(ОН)− СН(ОН) − СН2(ОН)
2. Гидролиз дигалогеналканов водным раствором щелочи: ClCH2-CH2Cl + 2NaOH 3. Окисление алкенов (окисление по Вагнеру).
ФЕНОЛЫ Фенолы – это органические соединения, в молекулах которых одна или несколько гидроксильных групп непосредственно связаны с ароматическим ядром. Общая формула фенолов С n H2 n-6Ох, где х = 1, 2, 3, ….. По числу гидроксильных групп различают одно-, двух- и многоатомные фенолы:
фенол о-крезол пирокатехин пирогаллол (карболовая кислота) (2-метилфенол) (1, 2-дигидроксибензол) (1, 2, 3-тригидроксибензол) Строение фенола. Особенности химических свойств фенола определяются взаимным влиянием гидроксильной группы и бензольного кольца.
1.Влияние бензольного кольца на гидроксильную группу. Неподеленная пара электронов атома кислорода вступает в сопряжение с p-электронным облаком бензольного кольца, это приводит к уменьшению электронной плотности атома кислорода, что в свою очередь вызывает повышение полярности связи -О-Н. Водород становится более подвижным: фенолы в отличие от предельных спиртов обладают слабыми кислотными свойствами. 2. Влияние гидроксильной группы на бензольное кольцо. В результате сопряжения неподеленной пары электронов атома кислорода гидроксильной группы с p-электронами бензольного кольца происходит перераспределение электронной плотности внутри кольца и увеличение ее в орто- и пара-положениях (-ОН-группа – ориентант I-го рода). Изомерия. Изомерия фенолов обусловлена положением гидроксильной группы. Для двухатомных фенолов известны три изомера - орто-, мета- и пара -изомеры. Например,
Физические свойства Фенолы - кристаллические вещества (м-крезол – жидкость), обладающие сильным характерным запахом, плохо растворимы в холодной воде и хорошо в горячей воде, а также в водных растворах щелочей. Важнейшим представителем этого класса является фенол С6Н5ОН. Химические свойства. Фенол – очень слабая кислота. I. Реакции гидроксильной группы 1. Образование фенолятов: а) со щелочными металлами
фенолят натрия
б) с оксидами щелочных металлов
в) со щелочами, т.к. кислотность фенола выше, чем у предельных спиртов
Под действием сильных кислот (HCl, H2SO4) гидролиз фенолятов протекает необратимо: Фенол значительно слабее угольной кислоты (» 3000 раз), поэтому при действии углекислого газа на раствор фенолята образуется свободный фенол.
Кислотные свойства фенолов ослабевают при введении в бензольное кольцо заместителей I-го рода и усиливаются при введении заместителей II-го рода. 2. Образование эфиров: а) сложных эфиров. В отличие от спиртов фенолы не образуют эфиры при непосредственном взаимодействии кислот и спиртов, их получают только через феноляты:
фенилацетат (фениловый эфир уксусной кислоты)
б) простых эфиров этоксибензол (фенилэтиловый эфир)
3. Восстановление: 4. Качественной реакцией на фенолы является сиреневое окрашивание раствора FeCI3. II. Реакции бензольного кольца. Реакции электрофильного замещения (SЕ) в феноле протекают легче, чем в бензоле.
1. Галогенирование. В отличие от бензола фенол реагирует с бромной водой, образуя осадок 2, 4, 6-трибромфенола:
2. Нитрование:
3. Сульфирование:
о-фенолсульфокислота
п-фенолсульфокислота
4. Алкилирование: 4-трет-бутилфенол
5. Конденсация с альдегидами:
2-гидроксиметилфенол
Эта реакция лежит в основе получения в промышленности фенолформальдегидных смол.
6. Гидрирование: циклогексанол 7. Окисление. Фенолы окисляются легко, причем образуется смесь различных продуктов окисления. Получение фенола
1. Большое количество фенолов содержится в каменноугольной смоле и древесном дегте. 2. Кумольный синтез (1949 г., Сергеев): 3. Сплавление натриевых солей бензолсульфокислот со щелочами:
4. Гидролиз моногалогенпроизводных (проходит с трудом в жестких условиях: 40%-ный раствор NaOH, температура и давление):
Ароматические спирты Ароматические спирты – это производные ароматических углеводородов, содержащие гидроксильную группу в боковой цепи.
фенилметанол 3-фенилпропанол-2 (бензиловый спирт) По способам получения и химическим свойствам ароматические спирты сходны с предельными одноатомными спиртами.
|
Последнее изменение этой страницы: 2019-04-09; Просмотров: 322; Нарушение авторского права страницы