Структура и свойства молекулы воды
Уникальные свойства воды объясняются структурой ее молекул и определяют ее биологические функции.
Химические свойства Н2О:
1. Малые размеры молекулы Н2О;
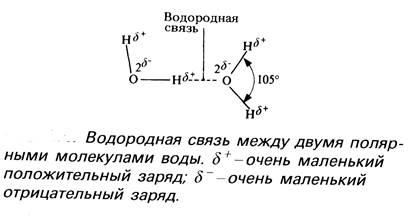
2. Полярность молекулы Н2О. Полярность – неравномерное распределение зарядов в молекуле. Молекула Н2О – диполь – один конец молекулы несет слабый + заряд, другой слабый – заряд. Связь в молекуле Н2О – ковалентная полярная т.к. кислород более электроотрицательный. Угол связи 104, 5º;
3. Между молекулами Н2О возникают водородные связи:
Физические свойства воды и их значение для биологических процессов .
| Физическое свойство
| Значение
| Примеры
| | 1. Хороший растворитель (благодаря полярности молекул и способности образовывать водородные связи)
| Самый распространенный в природе растворитель, среда для протекания химических реакций.
Н2О растворитель для полярных (с ионной и ковалентной полярной связью) веществ – Гидрофильных веществ (с греч. «hidros» - Н2О, «phileo» - люблю). Гидрофильные в-ва - ионные соединения – соли, которые диссоциируют в Н2О при растворении, а также кислоты, щелочи; хорошо растворяются неионные полярные соединения - сахара, простые спирты, белки, аминокислоты. При переходе вещества в раствор, его молекулы или ионы двигаются более свободно, реакционная способность вещества возрастает.
Гидрофобные вещества ( с греч. «phobos» - боязнь) – это практически не растворимые в Н2О неполярные в-ва – липиды, клетчатка, нуклеиновые кислоты, жирорастворимые витамины А, Е, D, К, каучук. Такие в-ва образуют с водой поверхности раздела, на которых протекают многие химические реакции.
| кровь, тканевая жидкость, лимфа, желудочный сок, слюна – у животных;
клеточный сок – у растений;
организмы, живущие в водной среде используют кислород и углекислый газ, растворенный в воде.
| | 2. Высокая теплоемкость (благодаря наличию водородных связей между молекулами, для разрыва которых требуется значительная энергия) и высокая теплопроводность (из-за небольших размеров молекул)
| Способность поглощать тепловую энергию при минимальном повышении собственной температуры.
Обеспечивает поддержание теплового равновесия организма – Н2О в клетках придает организму термостабильность и дает возможность значительно охладится при минимальной потере Н2О.
| большая теплоемкость защищает ткани от сильного повышения температуры, многие организмы охлаждаются, испаряя воду - транспирация у растений, потоотделение у млекопитающих, тепловая одышка у собак, крокодилов.
Высокая теплопроводность воды способствует быстрому охлаждению тела в холодный день. В жидкостях молекулы расположены почти вплотную друг к другу. Теплопроводность прижатых молекул, разумеется, выше.
| | 3. Большая теплота плавления
| Для плавления (таянья) нужно много энергии.
| при замерзании Н2О отдает много тепла, что уменьшает замерзание содержимого клеток.
| | 4. Плотность и поведение Н2О вблизи точки замерзания. Расширение при замерзании (благодаря образованию молекулой максимального числа – четырех водородных связей)
| Лед легче Н2О, он образует на поверхности водоема и выполняет функцию теплоизоляции – защищает от холода находящиеся в Н2О организмы.

| сохранение зимой биоценозов замерзающих озер, пруда, рек
| | 5. Большое поверхностное натяжение и когезия - сцепление молекул Н2О друг с другом под действием сил притяжения. И адгезия – способность слипаться с другими веществами.
| Водные растворы – средство передвижения веществ в организме
| капиллярный кровоток; восходящий и нисходящий токи растворов в растении; скольжение насекомых по поверхности Н2О
| | 6. Н2О как реагент.
| Участвует в метаболических реакциях в клетке:
| реакции гидролиза б.ж.у. (ферментативное расщепление в-в при взаимодействии их с Н2О), источник водорода и кислорода в фотосинтезе.
| | 7. Н2О практически не сжимается
| Поддержание формы организмов
| создает тургорное давление, определяя V и упругость клеток и тканей; гидростатический скелет круглых червей, медуз
| | 8. Вязкость
| Смазывающие свойства
| синовиальная жидкость – «смазка» в суставах позвоночных; плевральная жидкость уменьшает трение между грудной клеткой и легкими во время дыхания.
| | 9. Прозрачность
| Возможность фотосинтеза на небольшой глубине
| высокопродуктивные биоценозы прудов, озер, рек, морского шельфа.
|
Минеральные соли.
Минеральные соли клетки в виде ионов или в твердом состоянии.
Из катионов важны K +, Na +, C а2+, Mg 2+, NH 3 +. Из анионов H2 PO4-, H PO42 - Cl-, HCO3-, NO3-, PO43-, CO32 -.
Концентрация ионов K+ внутри клетки выше, а Na+ низкая. В окружающей клетку среде (крови, морской воде) все наоборот.
От концентрации солей зависит БУФЕРНОСТЬ – способность клетки сохранять определенную концентрацию водородных ионов (pH). В клетке поддерживается слабощелочная реакция (pH 7, 2).
Буферными называют растворы, содержащие смесь слабой кислоты и ее растворимой соли. Внутри клетки буферность обеспечивают анионы – H2 PO4- , HPO42 - - это фосфатная буферная система . Вне клетки бикарбонатная система HCO3- , H2CO3.
Нерастворимые в организме соли – фосфат кальция входит в состав межклеточного вещества костной ткани, в раковины моллюсков; панцири губок, диатомовых, красных водорослей - известковые или кремниевые.
|

