| Уровень организации
| Признаки
| Связи, участвующие в образовании структуры
|
| 1. Первичная структура (линейная)
Она уникальна для любого белка и определяет его свойства, форму и функции.
| Линейная последовательность аминокислот в полипептидной цепи. Она определяется генами организма.
В первичной структуре белка можно различить N-конец цепочки, содержащий свободную NH2-группу, и С-конец, содержащий свободную СООН-группу.
Первым белком, у которого выявлена аминокислотная последовательность - гормон инсулин.
| Ковалентные (пептидные) связи между остатком карбоксильной группы одной аминокислоты и остатком аминогруппы другой аминокислоты.


|
| 2. Вторичная структура (спиральная)
| α – спираль
 β – структура
β – структура
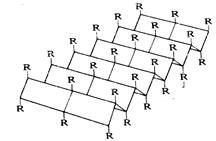
| α – спираль – полипептидная цепь закрученная в форме спирали и стабилизированная водородными связями между СО одной аминокислоты и NH группами другой аминокислоты (удаленной от первой на 4 аминокислотных остатка) соседних витков спирали.
Все ферменты имеют такую структуру.
β – структура – слоистая, из нескольких параллельно расположенных полипептидных цепей, связанных водородными связями.
Например: фибриллярные белки – фиброин шелка, кератин волос.
Все они гиброфобны.
|
| 3. Третичная структура (глобулярная или клубковая)
| Трехмерная пространственная упаковка α - спиралей и β – слоев. Эта структура устанавливается за счет взаимодействия радикалов аминокислот, между которыми могут возникнуть связи нескольких типов.

| 1. Ионные связи – возникают за счет электростатического взаимодействия между отрицательно и положительно заряженными боковыми группами;
2. Гидрофобные («не любящие воду») – устанавливаются за счет стремления неполярных радикалов объединятся друг с другом, а не смешиваться с окружающей их водной средой;
3. Дисульфидные мостики - образуются между атомами серы SH – группы двух остатков аминокислоты цистеина. Эти S-S связи по своей природе являются ковалентными;
4. Водородные – возникают за счет взаимодействия между атомами радикалов. Например: ферменты и антитела.
|
| 4. Четвертичная структура (супер структура из нескольких глобул - субъединиц)
| Представлена ассоциантом из нескольких глобул – субъединиц. Свойственна лишь белкам с особо сложной структурой.
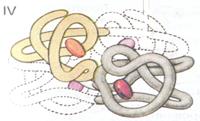
 IV структура гемоглобина
IV структура гемоглобина
| В основном силы межмолекулярного притяжения, в меньшей степени - водородные, ионные и ковалентные.
Например: гемоглобин состоит из 4-х субъединиц белка (2-х α – спиралей + 2-х β - структур). Каждая субъединица связана с молекулой железосодержащего гемма.
Например: инсулин состоит из 2-х субъединиц.
|

