
|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |

|
Архитектура Аудит Военная наука Иностранные языки Медицина Металлургия Метрология Образование Политология Производство Психология Стандартизация Технологии |
Равновесия в растворах гидролизующихся солей
Гидролизом солей называют реакции ионного обмена между водой и компонентами растворенных в ней солей, сопровождающиеся образованием малодиссоциированных соединений, газообразных или твердых продуктов. В результате гидролиза в растворе соли может появиться некоторое избыточное количество ионов Н+ или ОН-, т.е. раствор приобретает кислые или основные свойства. Поэтому процесс гидролиза в определенной степени является обратным процессу нейтрализации - взаимодействию кислоты и основания.
Классической реакцией получения солей является взаимодействие основания и кислоты:
 . .
Соль сохраняет “наследственность” по катиону от основания и по аниону от кислоты. Все соли – сильные электролиты, т.е. при растворении в воде (aq) соли полностью диссоциируют на гидратированные катионы и анионы. Этот процесс необратим вплоть до насыщенного состояния:
Любую соль можно представить как продукт взаимодействия основания и кислоты. Исходя из этого, различают 4 типа солей.
1. Соли, образованные сильным основанием и сильной кислотой, например: KCl, NaNO3, BaCl2. Соли этого типа гидролизу не подвергаются.
2. Соли, образованные слабым основанием и сильной кислотой, например: Zn(NO3)2, FeSO4, NH4Cl. Подвергаются гидролизу по катиону.
3. Coли, образованные слабой кислотой и сильным основанием, например: Na3BO3, KNO2, Na2S. Подвергаются гидролизу по аниону.
4. Соли, образованные слабой кислотой и слабым основанием, например, (NH4)2CO3, Cd(CN)2. Подвергаются полному гидролизу – по катиону и аниону одновременно.
Показателем глубины протекания гидролиза является степень гидролиза (β ) – отношение концентрации гидролизованных частиц Сгидр. к исходной концентрации растворенных частиц соли - С:
β = Сгидр./С. (59)
Показателем глубины, а также и направления гидролиза является и рН раствора соли. Поэтому расчет рН раствора соли представляет как практический, так и теоретический интерес. Механизм гидролиза каждого типа солей имеет свои особенности. Гидролиз соли по катиону Рассмотрим гидролиз соли, образованнойслабым основанием и сильной кислотой, например NH4NO3. В растворе соль полностью диссоциирована на ионы:
NH4 NO3 = NH4 + + NO3-.
Вода как, слабый электролит, диссоциирована частично: Н2О ⇄ Н+ + ОН-. ОН- - ионы взаимодействуя с катионом NH4+, образуют слабое основание NH4OH: NH4+ + OH- ⇄ NH4OH. Суммарная реакция гидролиза в ионном NH4+ + H2О ⇄ NH4OH + Н+, и молекулярном виде: NH4NO3 + H2O⇄ NH4OH + НNO3,
из которой следует, что в результате гидролиза появилось избыточное количество ионов Н+, т.е. среда стала кислой и рН системы понизился (рН < 7). Как правило, равновесие гидролиза сильно сдвинуто влево, т.е. концентрация негидролизованных частиц в растворе существенно выше концентрации частиц, подвергшихся гидролизу. Степень гидролиза β, как правило, невелика. Это объясняется тем, что продукты гидролиза вступают в обратную реакцию - реакцию нейтрализации с образованием очень слабого электролита – воды. Согласно закону действующих масс, константа равновесия для уравнения гидролиза имеет вид:
или в общем виде для гидролиза катиона слабого основания: Kt+ + H2O ⇄ KtOH + H+
Так как
КГ = КР∙
Выразим равновесную концентрацию ионов водорода
и подставим в выражение для константы гидролиза КГ:
где Кдис – константа диссоциации слабого основания KtOH, равная:
Чем меньше константа диссоциации слабого основания, тем больше константа гидролиза, тем полнее протекает гидролиз
Для расчета рН раствора соли необходимо рассчитать концентрацию ионов водорода [Н+]. Согласно ионному уравнению гидролиза соли NH4+ + H2О ⇄ NH4OH + Н+.
Концентрация [Н+] = [NН4+], т.е. концентрации гидролизованных частиц Сгидр.. Ее можно выразить через степень гидролиза β:
[Н+] = [NН4+] = β ∙ CKt,
где CKt. – исходная концентрация катионов NH4 +. Путем несложных преобразований можно убедиться, что степень гидролиза β и константа гидролиза КГ для разбавленных растворов связаны между собой выражением, аналогичным выражению закона разбавления Оствальда:
Тогда CH+ = β ∙ CKt = а рН раствора равно:
Следовательно, гидролиз соли, образованной слабым основанием и сильной кислотой, идет по катиону и приводит к подкислению раствора, а рН раствора вычисляется по формуле:
Пример 6.1 0, 05 г соли Al2(SO4)3 растворили в 100 см3 воды. Чему равна величина pH полученного раствора?
Решение. Уравнение электролитической диссоциации соли:
 ⇄ ⇄ 
Al3+ “наследует” свойства слабого основания Al(OH)3 (KIдисс.< 10− 2); (SO4)2− “наследует” свойства сильной кислоты H2SO4 (КIдисс.> 10− 2).
Если гидролизу подвергается многозарядный катион, то гидролиз может протекать по стадиям, а число стадий гидролиза равно заряду катиона. Для катиона Al3+ возможны 3 стадии гидролиза.
Ионное уравнение гидролиза по 1-ой стадии:
 ⇄ ⇄  . .
KIдисс.= 1, 8∙ 10− 16, KIIIдисс.= 1, 4∙ 10− 9 - это последняя константа диссоциации слабого основания Al(OH)3.
Равновесие реакции сдвинуто влево, в сторону более слабого электролита - воды:
(
Ионы (SO4)2− в реакции не участвуют.
Молекулярное уравнение 1-ой стадии гидролиза:
Так как в результате реакции гидролиза в растворе появляются свободные ионы Н+, то pH < 7 (среда кислая).
Расчет pH 1-ой стадии гидролиза в растворе Al2(SO4)3.
Необходимо перевести заданную концентрацию соли в мольную:
Мольная масса Al2(SO4)3
Ответ: рН раствора соли Al2(SO4)3 заданной концентрации равен 3, 83.
Так как гидролиз соли – реакция эндотермическая, в соответствии с принципом Ле-Шателье о сдвиге равновесия, повышение температуры приводит к увеличению степени гидролиза β. Нагревание способствует гидролизу (сдвигу равновесия вправо). Добавление воды (разбавление раствора) приводит к усилению гидролиза. Усиление ступенчатого гидролиза солей многокислотного слабого основания и сильной кислоты может привести к образованию малорастворимых основных солей, тогда равновесие гидролиза сильно сдвигается вправо. Гидролиз соли по катиону можно предотвратить, если растворять соль в заранее подкисленном растворе. В данном случае перед растворением соли Al2(SO4)3 необходимо в воду добавить кислоту H2SO4 в таком количестве, чтобы величина pH стала меньше 3, 83. Добавление щелочи в таком количестве, чтобы величина pH стала больше 3, 83 вызовет сдвиг равновесия вправо, т.е. будет способствовать гидролизу. Поэтому при нагревании, разбавлении и добавлении щелочи могут протекать последующие стадии гидролиза.
Как правило, гидролиз идет лишь по первой стадии в силу выше описанных причин. Но если существуют условия для сдвига равновесия реакции гидролиза, то возможно протекание последующих стадий. 2-ая стадия гидролиза
Ионное уравнение 2-ой стадии гидролиза:
Расчет рН, β, КГ гидролиза можно провести, руководствуясь теми же представлениями, что и для 1-ой стадии гидролиза.
3-я стадия гидролиза:

  ; ;
  . .
В данном случае 3-я стадия гидролиза идет до конца, так как образуется малорастворимое соединение Al(OH)3. 6.2. Гидролиз соли по аниону Рассмотрим гидролиз соли, образованной сильным основанием и слабой кислотой, например, КF. Реакция полной диссоциации соли: КF ⇄ K+ + F-.
Гидролизу подвергается анион слабой кислоты F-: F- + H2O ⇄ HF + OH-.
Суммарная реакция гидролиза в молекулярном виде: КF + H2O⇄ HF + КОН.
Из уравнения реакции гидролиза следует, что в растворе появляется некоторое избыточное количество гидроксил-ионов, т.е. раствор подщелачивается. Степень гидролиза β и константа гидролиза КГ в данном случае описываются теми же уравнениями, как и в предыдущих примерах (п. 6.1. ), но вместо константы диссоциации слабого основания входит константа диссоциации слабой кислоты. Равновесную концентрацию ионов ОН- вычисляем из уравнения:
Соответственно, водородный показатель среды рассчитывается по уравнению:
Следовательно, гидролиз соли, образованной сильным основанием и слабой кислотой, идет по аниону и приводит к подщелачиванию раствора. рН среды вычисляется по формуле: где Пример 6.2 10 г соли Na3PO4 растворили в 1000 см3 воды. Чему равна величина pH раствора?
Na+ “наследует” свойства сильного основания NaOH (Кдисс. > 10− 2), (PO4)3− “наследует” свойства слабой кислоты H3PO4 (Кдисс.< 10− 2).
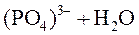 ⇄ ⇄  . .
Kдисс.= 1, 8∙ 10− 16 KIIIдисс.= 1, 3∙ 10− 12.
Устанавливается положение равновесия влево (в сторону более слабого электролита – воды):
(
Ионы Na+ в реакции не участвуют.
Молекулярное уравнение реакции 1-ой стадии гидролиза:
(равновесие сдвинуто влево).
Так как в результате реакции гидролиза в растворе появляются свободные ионы (OH)− , то pH > 7 (среда щелочная).
Расчет pH 1-ой стадии гидролиза:
Сг/л = 10 г/л, М = 164 – мольная масса соли Na3PO4.
Ответ. рН раствора Na3PO4 заданной концентрации равен 12, 35.
Гидролиз соли по аниону можно предотвратить, если растворить соль в заранее подщелоченном растворе. В данном случае, перед растворением соли Na3PO4 в воде, необходимо в воду добавить щелочь NaOH в таком количестве, чтобы величина pH стала больше 12, 35. Добавление кислоты в таком количестве, чтобы величина pH стала меньше 12, 35, вызывает сдвиг равновесия вправо, т. е. будет способствовать гидролизу. При нагревании и добавлении кислоты могут протекать последующие стадии гидролиза. Общее число стадий гидролиза численно равно заряду аниона ( для аниона РО43- возможны 3 стадии гидролиза).
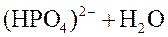  . .
3-я стадия гидролиза:
  ⇄ ⇄  . .
В данном случае 3-я стадия гидролиза находится в состоянии равновесия, так как образуется хорошо растворимая кислота H3PO4. Популярное:
|
Последнее изменение этой страницы: 2016-03-16; Просмотров: 4744; Нарушение авторского права страницы